AsSod基因调控茄链格孢致病性及对胁迫的响应
2022-02-10赵冬梅侯晓丹东曼白家琪范莎莎杨志辉朱杰华
赵冬梅 侯晓丹 东曼 白家琪 范莎莎 杨志辉 朱杰华



摘要
由茄链格孢Alternaria solani引起的马铃薯早疫病是马铃薯生产上的重要病害之一,可导致马铃薯大面积减产,进而造成巨大的经济损失。本研究在获得缺失AsSod基因的茄链格孢突变株(ΔAsSod)的基础上,对ΔAsSod进行了不同的胁迫处理。结果表明,相比于野生型菌株和回复株,突变株ΔAsSod对细胞壁胁迫因子SDS以及渗透胁迫因子KCl、NaCl、山梨醇的耐受性均减弱。进一步分析发现,ΔAsSod对外源过氧化物胁迫更敏感,胞内过氧化物酶和漆酶活性均显著降低。在对突变株孢子萌发和致病力的研究中发现,突变株ΔAsSod的孢子萌发率显著低于野生型菌株和回复株。同时,突变株ΔAsSod的致病力也显著降低,表明AsSod基因在茄链格孢对外界胁迫的耐受性、孢子萌发和致病性方面发挥重要的作用。
关键词
马铃薯早疫病;茄链格孢;超氧化物歧化酶(SOD);致病性
中图分类号:
S435.32
文献标识码:A
DOI:10.16688/j.zwbh.2020564
AsSod gene regulates the pathogenicity of Alternaria solani and its response to stress
ZHAO Dongmei,HOU Xiaodan,DONG Man,BAI Jiaqi,FAN Shasha,YANG Zhihui,ZHU Jiehua*
(College of Plant Protection, Hebei Agricultural University, Baoding071000, China)
Abstract
Potato early blight caused by Alternaria solani is one of the most important diseases in potato production, which can greatly reduce the yield of potato. In the previous study, we obtained an AsSod deletion mutant of A.solani (ΔAsSod), and different stress treatments were carried out on ΔAsSod. It was found that the tolerance of ΔAsSod to cell wall stress factors SDS and osmotic stress factors KCl, NaCl and sorbitol was weaker than that of wild and complementation strains. Furthermore, it was found that ΔAsSod was more sensitive to exogenous peroxide stress, and the activities of intracellular peroxidase and laccase in ΔAsSod decreased significantly. The spore germination rate of ΔAsSod was significantly lower than that of wild and complementation strains. At the same time, the pathogenicity of the ΔAsSod also decreased significantly, indicating that the AsSod plays an important role in the tolerance to external stress, spore germination and pathogenicity of A.solani.
Key words
potato early blight;Alternaria solani;superoxide dismutase (SOD);pathogenicity
茄链格孢Alternaria solani是引起马铃薯早疫病的主要病原菌,其寄主范围广,除马铃薯外还可侵染番茄、烟草等多种作物。马铃薯早疫病在马铃薯整个生育期都会发生,对马铃薯的生产造成很大的危害,严重时会导致大面积的减产,是世界范圍内一种常见的马铃薯病害[1]。近年来早疫病在我国马铃薯产区频繁发生,发生严重地块减产约30%[2]。分泌蛋白(secreted proteins)是指在细胞内合成后分泌到细胞外起作用的蛋白质,参与生物体的发育及防御、细胞分化和凋亡的调控、细胞信号传导等重要的生命活动[3]。许多研究表明,分泌蛋白在病原菌入侵、定殖和扩展过程中均发挥重要作用。 何佳昱[4]在茄链格孢全基因组测序的基础上,应用BLASTp和病原菌 寄主互作蛋白数据库(PHI database),从茄链格孢全基因组中预测得到138个潜在的病原菌寄主互作蛋白,其中含有一个编码超氧化物歧化酶(superoxide dismutase, SOD)的基因。
超氧化物歧化酶是生物体内重要的抗氧化酶,广泛存在于各种生物体内,能够清除机体内的氧自由基,有助于提升微生物的抗逆性,延缓老化。SOD作为生物体抗氧化体系中最主要的成员,在真菌的生理过程中发挥着重要的作用。目前,随着真菌全基因组数据的不断丰富以及功能基因组学研究技术的不断发展,真菌SOD的生物学功能也不断被解析[5]。研究表明,真菌SOD基因缺失的突变株对氧自由基产生、高温、高渗等胁迫条件的敏感性增强[6 -10]。Hwang等[6]发现白色念珠菌Candida albicans 线粒体MnSOD(Sod2)缺失会导致其对氧化胁迫、热胁迫、乙醇胁迫及高渗胁迫的耐受性降低,同时该基因的回复互补能恢复菌株的抗逆性。2007年,Li等[7]在毕赤酵母Pichia pastoris中过表达酿酒 酵母Saccharomyces cerevisiae Cu,ZnSod (Sod1)基因增强了重组菌株对氧化胁迫的抗性。Giles等[8]发现新生隐球菌Cryptococcus neoformans中的Sod2基因是其应对高温及氧化胁迫下所必需的,同时,Sod2基因的缺失会使新生隐球菌丧失毒力。Cortez[9]在研究荚膜红细菌Rhodobacter capsulatus时发现sodB基因的表达量与氧气含量呈正相关,含氧环境下的表达量比缺氧条件下提高了10倍。2007年,李森[10]将Sod基因转化到哈茨木霉Trichoderma harzianum中,发现Sod基因的表达使哈茨木霉对高温和高盐环境的抗性增强。
真菌中抵抗寄主生物体内高温、高渗、高氧自由基等逆境相关的基因在一定程度上可影响真菌的侵染力,是潜在毒力影响因子。Rolke等[11]发现BCSod1基因的缺失会导致灰葡萄孢Botrytis cinerea对大豆的致病力减弱。Moore等[12]研究麦角菌Claviceps purpurea时发现,与野生型菌株相比,缺失Sod1基因的突变株在侵染初期致病性减弱,表明Sod1基因在病原菌的侵染前期发挥一定的作用。高士刚[13]利用qRTPCR研究玉米弯孢叶斑菌Curvularia lunata致病性分化相关基因时发现Sod基因在强、中等致病力菌株中表达量较高,在弱、特殊致病类型菌株中表达量相对较低,同时发现缺失Sod基因的突变株不仅影响黑色素的形成,在侵染初期致病力减弱。Zhang等[14]研究发现茄链格孢缺失AsSod基因的突变株产孢量下降,菌丝分支减少,与野生型菌株HWC168和回复株相比,SOD含量明显下降。
本研究前期通过同源重组和原生质体转化技术获得了茄链格孢AsSod基因缺失突变株,在此基础上,为了探明基因缺失是否对早疫病菌应答胁迫产生影响,测定了不同胁迫因子下突变株生长的抑制率,胞外酶活性以及突变株的孢子萌发率与致病性,为进一步明确AsSod基因在茄链格孢中的功能提供理论依据。
1材料与方法
1.1供试菌株
茄链格孢A.solani野生型菌株HWC168,AsSod基因缺失突变株ΔAsSod,回补AsSod基因的回复株ΔAsSodC,均由河北农业大学马铃薯病害研究室分离、构建和保存。所有菌株在PDA培养基上25℃黑暗培养备用。
1.2AsSod基因对茄链格孢氧化应激性的影响
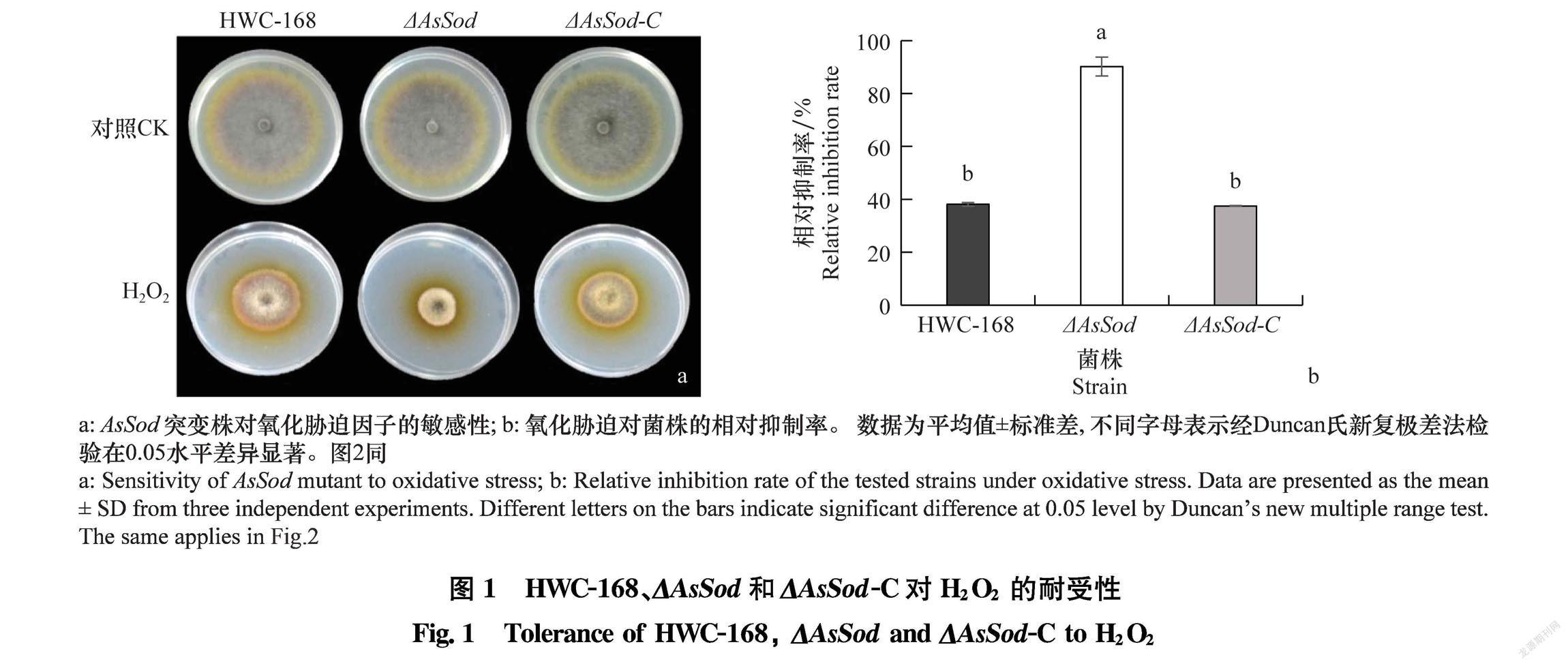
将野生型菌株HWC168、突变株ΔAsSod、回复株ΔAsSodC接種在含30 mmol/L H2O2的PDA平板上,25℃培养7 d,测量菌落直径,计算野生型菌株、突变株ΔAsSod、回复株ΔAsSodC的相对生长抑制率。相对生长抑制率[15]=(对照菌落直径 处理菌落直径)/(处理菌落直径 菌饼直径)×100%。每个处理设置3个重复,共进行3次生物学重复。
1.3ΔAsSod对细胞壁胁迫因子的敏感性测定
将野生型菌株HWC168、突变株ΔAsSod、回复株ΔAsSodC接种在含0.2 mg/mL SDS的PDA平板上,25℃培养7 d,测量菌落直径,计算野生型菌株、突变株ΔAsSod、回复株ΔAsSodC的相对生长抑制率。每个处理设置3个重复,共进行3次生物学重复。
1.4ΔAsSod对渗透胁迫因子的敏感性测定
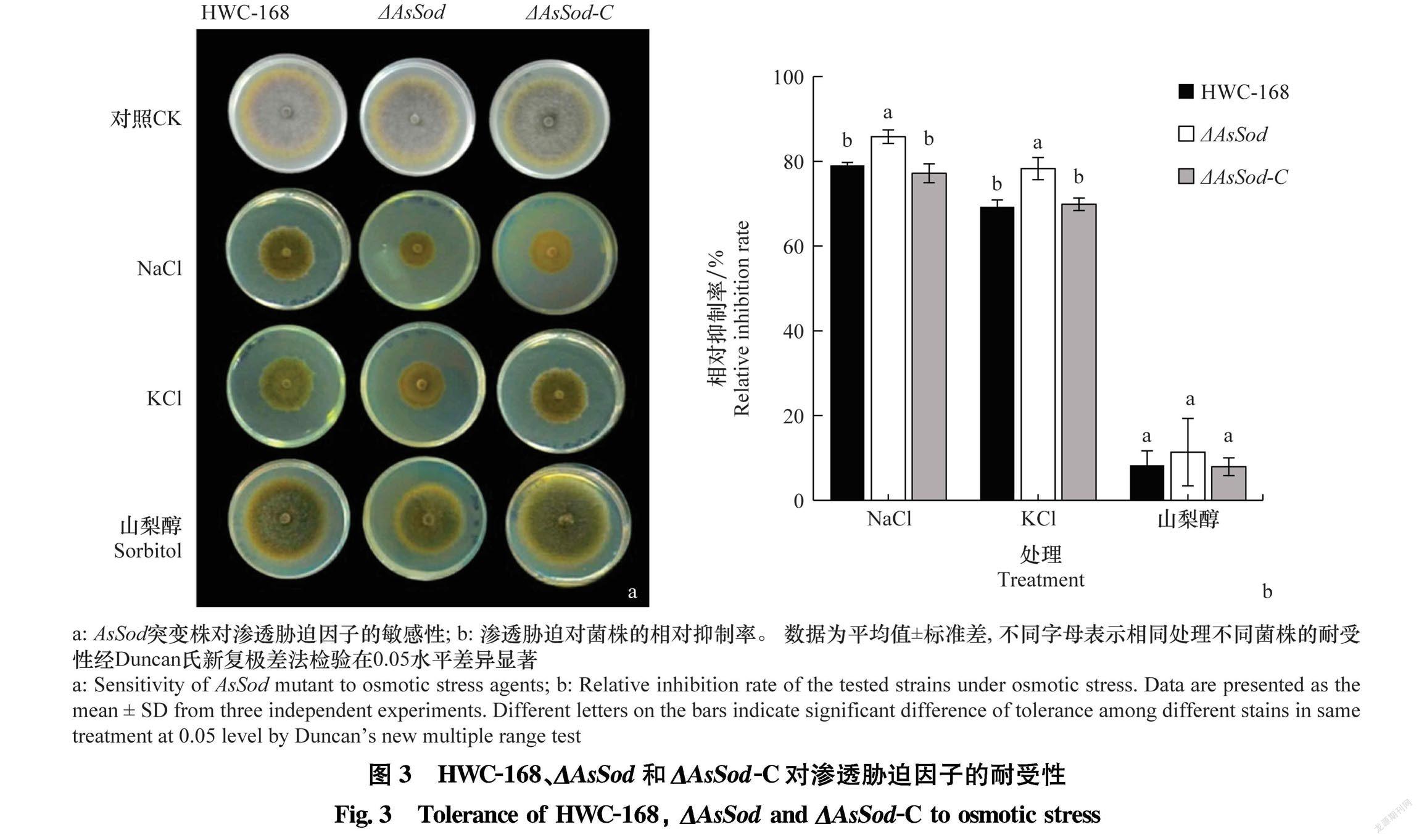
将野生型菌株HWC168、突变株ΔAsSod、回复株ΔAsSodC接种在含0.5 mol/L NaCl、0.5 mol/L KCl和0.3 mol/L山梨醇的PDA平板上,25℃培养7 d,测量菌落直径,计算野生型菌株、突变株ΔAsSod、回复株ΔAsSodC的相对生长抑制率。每个处理设置3个重复,共进行3次生物学重复。
1.5AsSod基因对茄链格孢胞外酶活性的影响
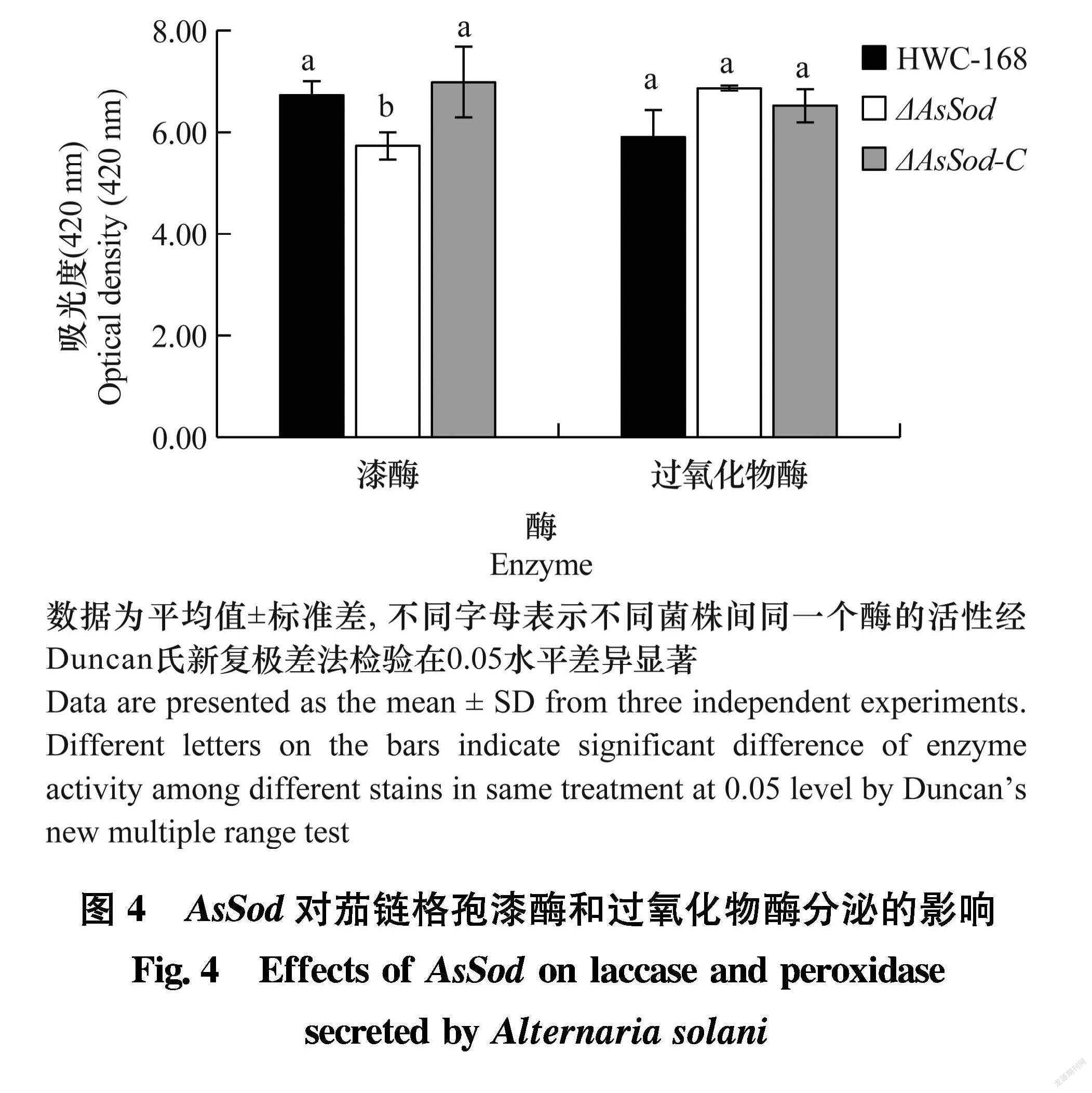
漆酶活性的测定:将野生型菌株HWC168、突变株ΔAsSod及回复株ΔAsSodC接种到80 mL PD培养液中,25℃,120 r/min,培养48 h;过滤收集菌丝,并用吸水纸除去多余水分,置于 80℃,冷冻24 h,冷冻抽干24 h,称量干重。取1 mL滤液,4℃, 3 500 r/min,离心10 min;在2 mL EP管中加入100 μL 500 mmol/L的醋酸、100 μL 10 mg/mL的ABTS、200 μL离心后的滤液、600 μL ddH2O,室温放置5 min,立即插入冰上终止反应,用分光光度计测定其在420 nm的吸光值,将最终单位换算为吸光值/g,用以表示漆酶活性。共进行3次生物学重复。
过氧化物酶活性测定:在上述步骤2 mL EP管中再加入3.4 μL 30% H2O2(m/m),测定其在420 nm处的吸光值,再将最终单位换算成吸光值/g,用以表示过氧化物酶的活性。共进行3次生物学重复。
1.6AsSod基因对茄链格孢分生孢子萌发的影响
茄链格孢在人工培养条件下不易产孢,本研究参考刘丽丽[16]的方法对HWC168、ΔAsSod及ΔAsSodC进行诱导产孢。将得到的孢子配制成1×103个/mL的孢子悬浮液,取500 μL均匀地涂抹在1%的水琼脂培养基上,放置在25℃恒温培养箱中黑暗培养2 h后观察分生孢子萌发情况,若1个孢子产生多个芽管或芽管与孢子等长时认为分生孢子萌发。同时对孢子悬浮液进行热胁迫处理,42℃水浴15 min,再将孢子悬浮液均匀地涂抹在1%的水琼脂平板上,2 h后观察热胁迫后HWC168、ΔAsSod及ΔAsSodC分生孢子的萌发情况。每个处理统计的孢子数为50个,每个菌株设置3个重复,共进行3次生物学重复,计算分生孢子的萌发率。萌发率=萌发孢子数/统计孢子数×100%。
1.7AsSod基因对茄链格孢致病力的影响
采用离体叶片接种法测定茄链格孢野生型菌株HWC168、突变株ΔAsSod及回复株ΔAsSodC的致病力。取叶龄、叶位、大小一致的马铃薯健康叶片, 使叶片正面向上,将叶柄插入含有10.7 μmol/L萘乙酸(NAA)和10 μg/mL盐酸四环素的1%水琼脂平板中。将野生型菌株HWC168、突变株ΔAsSod和回复株ΔAsSodC分生孢子悬浮液的浓度均调整至1×104个/mL,用移液枪吸取25 μL孢子悬浮液,接种在叶片正面中部的主脉附近,盖上皿盖,在25℃光照培养箱中L∥D=12 h∥12 h条件下培养5 d,用十字交叉法测量病斑的长度和宽度,并观察病斑特征。共进行3次生物学重复,每个重复接种5~8个叶片。
1.8数据统计
本研究中,所有试验均进行3次生物学重复,每次重复设置3个平行处理(致病力测定试验中每个重复接种5~8片叶片)。本试验所有数据均使用DPS数据处理软件中的Duncan氏新复极差法进行统计分析,显著水平设置为0.05。用Excel对统计结果绘制柱状图。
2结果与分析
2.1AsSod基因对茄链格孢氧化应激性的影响
25℃下,野生型菌株HWC168、突变株ΔAsSod、 回复株ΔAsSodC在含30 mmol/L H2O2的PDA平板上的生长均受到抑制。 培养7 d后,野生型菌株HWC168、突变株ΔAsSod、回复株ΔAsSodC的相对生长抑制率分别为38.11%,90.21%和37.49%, 突变株ΔAsSod的相对生长抑制率显著大于野生型菌株和回复株(图1),由此推测, AsSod基因的缺失导致突变株对过氧化物的耐受力降低。
2.2 AsSod参与调控茄链格孢对细胞壁胁迫的应答
野生型菌株HWC168、突变株ΔAsSod、回复株ΔAsSodC在含0.2 mg/mL SDS的PDA平板上生长受到抑制,25℃,培养7 d,其相对生长抑制率分别为25.54%、33.06%和26.68%,SDS对突变株ΔAsSod的生长较野生型菌株和回复株具有更显著的抑制效果(图2)。由此推测:AsSod参与调控茄链格孢对细胞壁胁迫的应答。
2.3AsSod参与调控茄链格孢对渗透胁迫的应答
野生型菌株HWC168、突变株ΔAsSod、回复株 ΔAsSodC在含NaCl(0.5 mol/L)、KCl(0.5 mol/L) 和山梨醇(0.3 mol/L)的PDA平板上生长均受到了抑制。25℃,培养7 d,NaCl和KCl對突变株ΔAsSod的抑制明显高于野生型菌株和回复株(图3)。与NaCl和KCl相比,山梨醇对野生型菌株、突变株和回复株的相对生长抑制率差异较小,野生型菌株HWC168、突变株ΔAsSod、回复株ΔAsSodC的相对生长抑制率分别为8.29%、11.34%和7.94%。
2.4AsSod调控茄链格孢漆酶的分泌
为了进一步验证AsSod是否参与调控马铃薯早疫病菌过氧化物酶和漆酶的分泌,检测液体培养ΔAsSod滤液中过氧化物酶及漆酶活性的变化情况,发现ΔAsSod滤液中漆酶的活性低于HWC168及ΔAsSodC(图4),但ΔAsSod滤液中过氧化物酶的活性与HWC168及ΔAsSodC没有显著差异,表明AsSod可能参与调控茄链格孢漆酶的分泌。
2.5AsSod参与调控早疫病菌孢子萌发
孢子悬浮液25℃培养2 h后,野生型菌株HWC168、突变株ΔAsSod、回复株ΔAsSodC的孢子萌发率分别为53.33%、31.56%和52.22%(表1)。突变株ΔAsSod的孢子萌发数量显著低于野生型菌株和回复株,表明AsSod基因的缺失对茄链格孢分生孢子的萌发有显著的抑制作用。分生孢子在热胁迫处理后培养2 h,野生型菌株HWC168、突变株ΔAsSod、回复株ΔAsSodC的分生孢子萌发率相对于正常情况下的孢子萌发率分别下降了22.66、14、20百分点。
2.6AsSod参与调控茄链格孢的致病力
为了阐明AsSod是否参与茄链格孢的致病过程,对ΔAsSod进行了致病性测定。利用茄链格孢孢子悬浮液离体接种马铃薯叶片,结果显示,接种HWC168和ΔAsSodC的叶片病斑平均直径分别约为1.77 cm和1.62 cm,接种突变株ΔAsSod的叶片病斑平均直径约为1.32 cm,比接种HWC168和ΔAsSodC叶片发病减弱,且病斑直径具有显著性差异(图5),表明AsSod基因缺失的茄链格孢致病力减弱。
3讨论
病原菌在生长和侵染寄主植物过程中会受到环境及寄主细胞防卫反应产生的过氧化物等因素的胁迫,而病原菌对于胁迫的应答与其生长发育及致病力有着重要的联系。为了探明AsSod基因缺失是否影响茄链格孢对外界胁迫的应答,本研究测定了不同胁迫因子对突变株的生长抑制率。结果表明,AsSod基因缺失后茄链格孢对渗透胁迫、氧化胁迫及细胞壁胁迫更加敏感,表明AsSod参与茄链格孢对外界胁迫的应答。
细胞壁在维持病原菌细胞形态、信号传递及生长分化中起重要作用[17]。本研究发现,在细胞壁胁迫因子SDS的作用下,茄链格孢菌落生长受到了抑制,而且对突变株的抑制大于野生型菌株和回复株,这可能是由于AsSod的缺失影响了茄链格孢细胞壁的完整性,进而影响了菌株对胁迫因子的耐受能力。张小华等[18]研究表明,Sod1基因编码的铜锌超氧化物歧化酶是酵母细胞中最重要的抗氧化酶,Sod1基因缺失导致酵母细胞对真菌细胞壁抑制剂刚果红的敏感性增加,表明Sod1基因的缺失影响了酵母细胞壁的稳定性。同时本研究中也发现,突变株ΔAsSod相比野生型菌株和回复株对于渗透胁迫因子的敏感性增强,这可能也是由于AsSod的缺失影响了细胞壁的完整性所导致的。
Sod基因除了调控病原菌对外界胁迫的应答外,对病原菌的致病力也有一定的影响。缺失Sod基因对病原菌致病力的影响在灰葡萄孢和麦角菌中均有报道[11-12]。本研究中,突变株ΔAsSod在马铃薯叶片上引起的病斑面积显著小于野生型菌株和回复株。在玉米大斑病菌Setosphaeria turcica[19]和稻瘟病菌Magnaporthe oryzae [20]侵染寄主植物的研究中发现,病原菌在寄主表面萌发后形成附着孢,附着孢再形成侵染钉,然后侵染钉利用附着孢内部的膨压穿透表皮角质层,完成侵染过程。在本研究中发现,突变株ΔAsSod的分生孢子萌发率较野生型菌株和回复株显著下降,这可能是导致ΔAsSod突变株致病力减弱的原因之一。
植物在受到病原菌的侵染時,表面会产生大量的活性氧来抵抗病原菌的侵染,而此时病原菌通过产生大量的过氧化物酶降解植物表面的活性氧,进而达到成功侵染的目的[21-23]。在本试验中,突变株ΔAsSod中胞外漆酶活性降低,我们推测AsAod影响了胞外漆酶的分泌,进而干扰了突变株降解寄主木质素的能力,导致突变株致病性降低。具体如何调控还需要进一步的研究。
参考文献
[1]高玉林, 徐进, 刘宁, 等. 我国马铃薯病虫害发生现状与防控策略[J]. 植物保护, 2019, 45(5): 106-111.
[2]刘玉华,王文桥.河北省 季作区马铃薯病虫害发生及综合防控[J]. 中国马铃薯, 2010, 24(3): 159-164.
[3]KRAUSE C, RICHTER S, KNLL C, et al. Plant secretome—from cellular process to biological activity [J]. Biochimica et Biophysica Acta, 2013, 1834(11): 2429-2441.
[4]何佳昱. 茄链格孢全基因组测序及SSR分子标记的开发[D]. 保定: 河北农业大学, 2015.
[5]MILER A. Superoxide dismutases: Ancient enzymes and new insights [J]. FEBS Letters, 2012, 586(5): 585-595.
[6]HWANG C S, BAEK Y U, YIM H S, et al. Protective roles of mitochondrial manganesecontaining superoxide dismutase against various stresses in Candida albicans [J]. Yeast, 2003, 20(11): 929-941.
[7]LI Jianrong, YU Ping. Expression of Cu, Znsuperoxide dismutase gene from Saccharomyces cerevisiae in Pichia pastoris and its resistance to oxidative stress [J]. Applied Biochemistry & Biotechnology, 2007, 136(1): 127-139.
[8]GILES S S, BATINICHABERLE I, PERFECT J R, et al. Cryptococcus neoformans mitochondrial superoxide dismutase: an essential link between antioxidant function and hightemperature growth [J]. Eukaryotic Cell, 2005, 4(1): 46-54.
[9]CORTEZ N, CARRILLO N, PASTERNAK C, et al. Molecular cloning and expression analysis of the Rhodobacter capsulatus sodB gene, encoding an iron superoxide dismutase [J]. Journal of Bacteriology, 1998, 180(20): 5413.
[10] 李森. 哈茨木霉SOD基因的克隆及功能研究[D]. 哈尔滨: 哈尔滨工业大学, 2007.
[11] ROLKE Y, LIU Songji, QUIDDE T, et al. Functional analysis of H2O2generating systems in Botrytis cinerea: the major CuZnsuperoxide dismutase (BCSOD1) contributes to virulence on French bean, whereas a glucose oxidase (BCGOD1) is dispensable [J]. Molecular Plant Pathology, 2004, 5(1):17-27.
[12] MOORE S, VRIES O M H D, TUDZYNSKI P. The major Cu, Zn SOD of the phytopathogen Claviceps purpurea is not essential for pathogenicity [J]. Molecular Plant Pathology, 2010, 3(1): 9-22.
[13] 高士刚. 玉米弯孢叶斑病菌全基因组序列分析与致病性分化相关基因的研究[D]. 上海: 上海交通大学, 2014.
[14] ZHANG Dai, YU Shuiqing, YANG Yiping, et al. Antifungal effects of volatiles produced by Bacillus subtilis against Alternaria solani in potato [J/OL]. Frontiers in Microbiology, 2020, 11: 1196. DOI: 10.3389/fmicb.2020.01196.
[15] HUANG Shuaishuai, HE Zhangjiang, ZHANG Shiwei, et al. Interplay between calcineurin and the Slt2 MAPkinase in mediating cell wall integrity, conidiation and virulence in the insect fungal pathogen Beauveria bassiana [J]. Fungal Genetics & Biology, 2015, 83: 78- 91.
[16] 刘丽丽. 马铃薯早疫病菌产孢诱导、嘧菌酯敏感性及品种抗病性的研究[D]. 保定: 河北农业大学, 2013.
[17] YIN Ziyi, TANG Wei, WANG Jingzhen, et al. Phosphodiesterase MoPdeH targets MoMck1 of the conserved mitogenactivated protein (MAP) kinase signalling pathway to regulate cell wall integrity in rice blast fungus Magnaporthe oryzae [J]. Molecular Plant Pathology, 2016, 17(5): 654 -668.
[18] 张小华, 刘向勇, 卞伟华, 等. 酵母SOD1基因缺失突变体应答刚果红胁迫的转录组学分析[J]. 中国生物化学与分子生物学报, 2015, 31(9): 960 -966.
[19] 宋文静,董金皋. 玉米大斑病菌孢子萌发和附着胞形成的影响因素研究[J]. 植物病理学报, 2008, 38(5): 536-539.
[20] TALBOT N J. On the trail of a cereal killer: Exploring the biology of Magnaporthe grisea [J]. Annual Review of Microbiology, 2003, 57(1): 177-202.
[21] CHI M H, PARK S Y, KIM S, et al. A novel pathogenicity gene is required in the rice blast fungus to suppress the basal defenses of the host [J/OL]. PLoS Pathogens, 2009, 5(4): e1000401. DOI: 10.1371/journal.ppat.1000401.
[22] LIU Guosheng, GREENSHIELDS D L, SAMMYNAIKEN R, et al. Targeted alterations in iron homeostasis underlie plant defense responses [J]. Journal of Cell Science, 2007, 120(4): 596-605.
[23] LZARO M, REGINE K. An Ustilago maydis gene involved in H2O2 detoxification is required for virulence [J]. The Plant Cell, 2007, 19(7): 2293-2309.
收稿日期:2020- 10- 27修订日期:2021- 01- 05
基金项目:
河北省教育厅青年基金(QN2019156);国家现代农业产業技术体系建设专项(CARS-09-P18)
* 通信作者
E-mail:zhujiehua356@126.com
