LINC00707靶向miR-374a-3p对LPS诱导的肺上皮细胞炎症因子释放和凋亡的影响
2022-02-10李玉磊刘莉敏武汉科技大学附属天佑医院呼吸与危重症医学科武汉430064
李玉磊 刘莉敏 熊 静 (武汉科技大学附属天佑医院呼吸与危重症医学科,武汉 430064)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是重症患者经常发生的一种急性肺损伤,以肺部广泛炎症反应和氧气吸入减少为特征,常导致呼吸衰竭和多器官功能障碍,病死率高达60%,目前仍缺乏有效降低ARDS病死率的方法[1]。ARDS进展中,严重炎症反应会诱导肺上皮细胞凋亡、坏死和纤维化,加速肺损伤[2]。因此,如何有效抑制肺上皮细胞炎症反应和凋亡对开发有效的ARDS治疗策略意义重大。长链非编码RNA(lnc-RNA)和微小RNA(miRNA)是非编码RNA的重要成员,前期研究表明lncRNA和miRNA参与细胞增殖、代谢调控、组织分化等多种过程,其表达失调可能导致一系列功能障碍和疾病[3-4]。长基因间非编码RNA 00707(LINC00707)位于10p14区,其作用已在成骨分化、结直肠癌、肝癌等疾病中得到了证实[5-7]。此外,有报道称LINC00707通过靶向miR-30a-5p缓解脂多糖(LPS)诱导的PC12细胞炎症和凋亡,是脊髓损伤的潜在治疗靶点[8]。靶基因预测显示,miR-374a-3p与LINC00707存在结合位点。miR-374a-3p在骨关节炎患者软骨组织和LPS诱导的软骨细胞中表达降低,上调其表达可减轻LPS诱导的软骨细胞损伤[9]。但LINC00707在ARDS中的作用及其是否靶向miR-374a-3p调控ARDS进展尚不清楚。本研究采用LPS刺激肺上皮细胞体外模拟ARDS炎症发病机制[10],探讨LINC00707靶向miR-374a-3p对LPS诱导的肺上皮细胞凋亡和炎症因子释放的影响,为LINC00707/miR-374a-3p轴在ARDS中的应用提供理论基础。
1 材料与方法
1.1 材料 人正常肺上皮细胞BEAS-2B购自武汉普诺赛生命科技公司;高糖DMEM培养基、胎牛血清购自美国Hyclone公司;LINC00707的小干扰RNA(si-LINC00707)、miR-374a-3p mimics、miR-374a-3p抑制剂(anti-miR-374a-3p)、LINC00707过表达质粒(pcDNA-LINC00707)及各自阴性对照(si-NC、miRNC、anti-miR-NC、pcDNA)购自上海生工生物公司;第一链cDNA合成试剂盒购自广州吉赛生物科技公司;miRNA第一链cDNA合成试剂盒购自广州复能基因公司;SYBR green master mix试剂盒购自南京诺维赞生物公司;IL-6、IL-1β ELISA试剂盒及Annexin V-FITC-PI凋亡检测试剂盒购自上海碧云天生物公司;兔源裂解的半胱氨酸天冬氨酸蛋白酶3(cleaved-caspase3)多克隆抗体(ab49822)、兔源cleaved-caspase9多克隆抗体(ab2324)、山羊抗兔IgG(ab205718)、兔源GAPDH单克隆抗体购自美国Abcam公司。
1.2 方法
1.2.1 细胞培养和分组 采用含10%胎牛血清的高糖DMEM培养基37 ℃、5%CO2培养BEAS-2B细胞,细胞融合达到80%时按1∶4传代。取2×105个对数期BEAS-2B细胞接种至6孔板,利用Lipofectamine2000将序列片段或质粒分别转染至40%融合的BEAS-2B细胞,收集转染48 h的BEAS-2B细胞进行后续实验。采用10 µg/ml LPS处理BEAS-2B细胞48 h构建细胞损伤模型,记为LPS组。正常培养的BEAS-2B细胞记为对照组;转染pcDNA、pcDNALINC00707、si-NC、si-LINC00707的BEAS-2B细胞分别记为pcDNA组、pcDNA-LINC00707组、si-NC组、si-LINC00707组。10 µg/ml LPS处理转染si-NC、si-LINC00707、miR-NC、miR-374a-3p mimics、si-LINC-00707+anti-miR-NC、转 染 si-LINC00707+anti-miR-374a-3p的BEAS-2B细胞48 h,依次记为LPS+si-NC组、LPS+si-LINC00707组、LPS+miR-NC组、LPS+miR-374a-3p组、LPS+si-LINC00707+anti-miR-NC组、LPS+si-LINC00707+anti-miR-374a-3p组。
1.2.2 RT-qPCR检测LINC00707和miR-374a-3p表达 采用Trizol试剂分离Con组、LPS组、LPS+si-NC组、LPS+si-LINC00707组、LPS+miR-NC组、LPS+miR-374a-3p组、LPS+si-LINC00707+anti-miR-NC组、LPS+si-LINC00707+anti-miR-374a-3p组细胞总RNA,微量分光光度计测量不同RNA样本纯度和浓度。采用第一链cDNA合成试剂盒、miRNA第一链cDNA合成试剂盒进行逆转录,SYBR green master mix试剂盒进行RT-qPCR反应检测LINC00707和miR-374a-3p 表达。2-ΔΔCt分析 LINC00707 和 miR-374a-3p表达。LINC00707 F:5′-TCACATCTGTGAAAAGAGTGCT-3′;LINC00707 R:5′-TGCACCAAGAAAGTTGAGGGT-3′;GAPDH F:5′-GGAGCCAAAAGGGTCATC-3′;GAPDH R:5′-CCAGTGAGTTTCCCGTTC-3′;miR-374a-3p F:5′-CUUAUCAGAUUGUAUUGUAAUU-3′;miR-374a-3p R:5′-AAUUACAAUACAAUCUGAUAAG-3′;U6 F:5′-CTCGCTTCGGCAGCACA-3′;U6 R:5′-AACGCTTCACGAATTTGCGT-3′。
1.2.3 ELISA试剂盒检测IL-6和IL-1β释放量BEAS-2B细胞按1.2.1分组处理完毕后,收集上清,参照ELISA试剂盒说明书分析细胞上清中IL-6和IL-1β水平,表示IL-6、IL-1β释放量。
1.2.4 流式细胞术检测细胞凋亡 采用预冷的PBS洗涤各组BEAS-2B细胞2次,重悬于1×结合缓冲液(1×106个/ml),将 5 µl Annexin V-FITC、5 µl PI分别添加到100 µl细胞悬液中,避光孵育20 min,补加1×结合缓冲液使总体积达到500 µl混匀,流式细胞仪检测各组BEAS-2B细胞凋亡率。
1.2.5 Wesrern blot检测cleaved-caspase3和cleavedcaspase9蛋白表达 预冷PBS洗涤各组BEAS-2B细胞2次,加入RIPA缓冲液冰上裂解30 min,于4 ℃、12 000 r/min离心10 min,收集上清,BCA试剂盒进行蛋白定量,聚丙烯酰胺凝胶电泳分离蛋白,湿法转至硝酸纤维素膜,室温下用含5%脱脂乳Tris-吐温20-缓冲盐水(TBST)封闭膜2 h,4 ℃添加cleavedcaspase3(1∶500 稀释)、cleaved-caspase9(1∶1 000 稀释)、GAPDH(1∶2 500稀释)一抗孵育过夜,TBST洗涤3次,室温下添加山羊抗兔二抗IgG抗体(1∶2 000稀释)孵育30 min,TBST洗涤3次,化学发光法检测蛋白条带,Image J软件分析目的蛋白和GAPDH条带灰度值表示目的蛋白表达。
1.2.6 双荧光素酶报告实验 starbase数据库预测LINC00707和miR-374a-3p的结合位点,将包含miR-374a-3p结合位点的LINC00707野生(wt)序列及不含结合位点的LINC00707突变(mut)序列分别克隆至pmirGLO基本载体,构建wt-LINC00707、mut-LINC00707荧光素酶报告质粒,将miR-374a-3p mimics、miR-NC分别与wt-LINC00707或mut-LINC-00707共转染BEAS-2B细胞,48 h后裂解各组细胞,以海肾荧光素酶荧光强度为内参,双荧光素酶报告基因检测试剂盒检测各组BEAS-2B细胞相对荧光素酶活性。
1.3 统计学方法 采用SPSS19.0软件进行统计学分析,每组设3个平行,实验独立重复3次,结果以±s表示。采用独立样本t检验评估两组间数据差异,采用单因素方差分析和Tukey's多重比较检验分析多组间差异。P<0.05为差异有统计学意义。
2 结果
2.1 LPS诱导的肺上皮细胞损伤中LINC00707和miR-374a-3p表达 与Con组相比,LPS组BEAS-2B细胞LINC00707表达显著升高(P<0.05),miR-374a-3p表达显著降低(P<0.05,表1)。
表1 LPS诱导的肺上皮细胞损伤中LINC00707和miR-374a-3p表达(±s,n=9)Tab.1 Expressions of LINC00707 and miR-374a-3p in LPS-induced lung epithelial cell injury (±s,n=9)
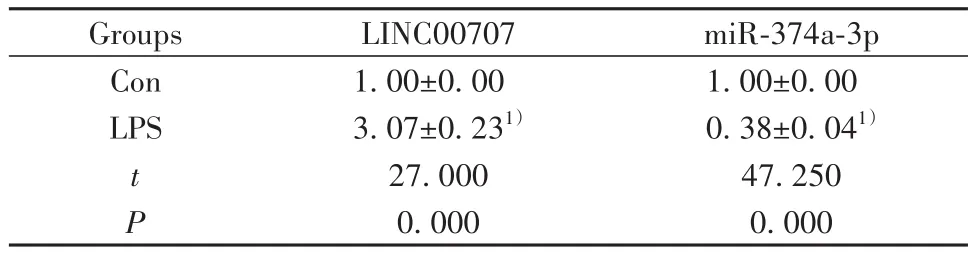
表1 LPS诱导的肺上皮细胞损伤中LINC00707和miR-374a-3p表达(±s,n=9)Tab.1 Expressions of LINC00707 and miR-374a-3p in LPS-induced lung epithelial cell injury (±s,n=9)
Note:Compared with Con group, 1)P<0.05.
Groups Con LPS t P LINC00707 1.00±0.00 3.07±0.231)27.000 0.000 miR-374a-3p 1.00±0.00 0.38±0.041)47.250 0.000
2.2 干扰LINC00707表达对LPS诱导的肺上皮细胞炎症因子释放的影响 与Con组比较,LPS组BEAS-2B细胞LINC00707表达显著升高(P<0.05),IL-6和IL-1β释放量显著增加(P<0.05);与LPS+si-NC组比较,LPS+si-LINC00707组BEAS-2B细胞LINC00707表达显著降低(P<0.05),IL-6和IL-1β释放量显著减少(P<0.05,表2)。
表2 干扰LINC00707表达对LPS诱导的肺上皮细胞炎症因子释放的影响(±s,n=9)Tab.2 Effect of interfering LINC00707 expression on release of inflammatory cytokines in LPS-induced lung epithelial cells (±s,n=9)
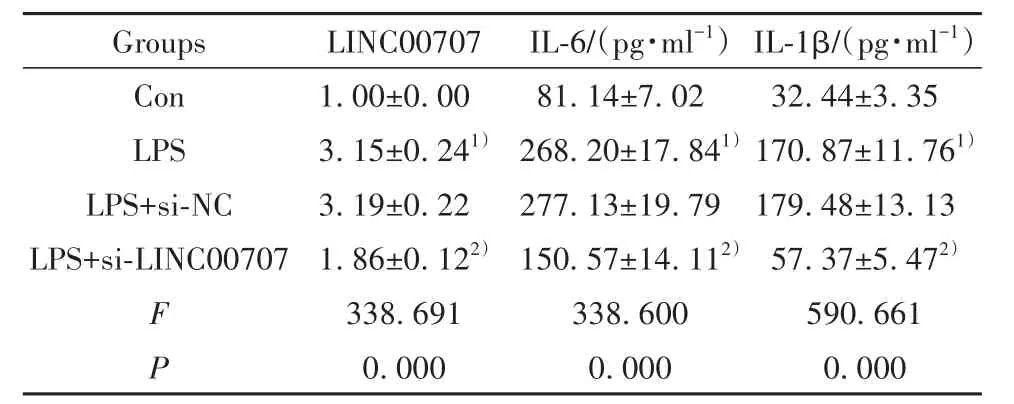
表2 干扰LINC00707表达对LPS诱导的肺上皮细胞炎症因子释放的影响(±s,n=9)Tab.2 Effect of interfering LINC00707 expression on release of inflammatory cytokines in LPS-induced lung epithelial cells (±s,n=9)
Note:Compared with Con group, 1)P<0.05; compared with LPS+si-NC group, 2)P<0.05.
Groups Con LPS LPS+si-NC LPS+si-LINC00707 F P 1.00±0.00 3.15±0.241)3.19±0.22 1.86±0.122)338.691 0.000 81.14±7.02 268.20±17.841)277.13±19.79 150.57±14.112)338.600 0.000 32.44±3.35 170.87±11.761)179.48±13.13 57.37±5.472)590.661 0.000 LINC00707IL-6/(pg·ml-1)IL-1β/(pg·ml-1)
2.3 干扰LINC00707表达对LPS诱导的肺上皮细胞凋亡的影响 与Con组比较,LPS组BEAS-2B细胞凋亡率、cleaved-caspase3和cleaved-caspase9蛋白表达显著升高(P<0.05);与 LPS+si-NC组比较,LPS+si-LINC00707组BEAS-2B细胞凋亡率、cleavedcaspase3和cleaved-caspase9蛋白表达显著降低(P<0.05,图1、表3)。
表3 干扰LINC00707表达对LPS诱导的肺上皮细胞凋亡的影响(±s,n=9)Tab.3 Influence of interference with LINC00707 expression on apoptosis of LPS-induced lung epithelial cells (±s,n=9)
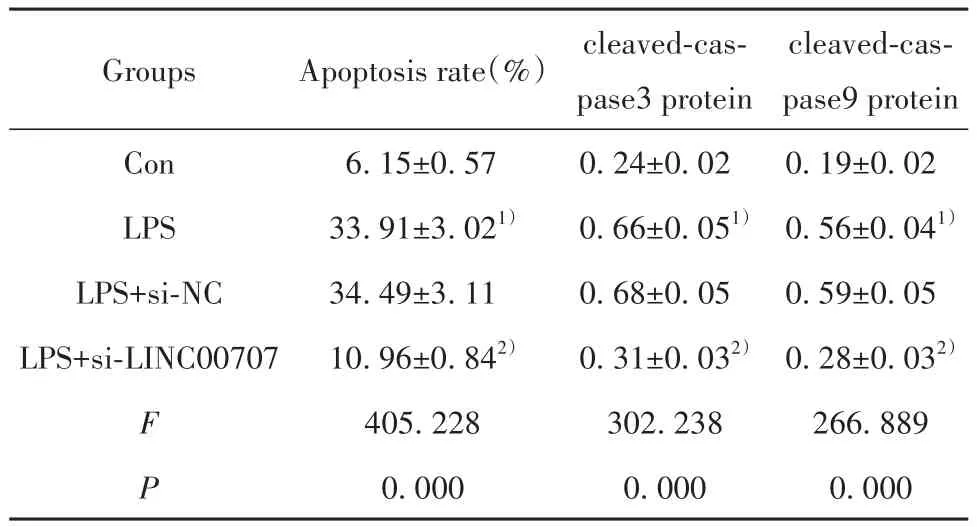
表3 干扰LINC00707表达对LPS诱导的肺上皮细胞凋亡的影响(±s,n=9)Tab.3 Influence of interference with LINC00707 expression on apoptosis of LPS-induced lung epithelial cells (±s,n=9)
Note:Compared with Con group, 1)P<0.05; compared with LPS+si-NC group, 2)P<0.05.
Groups Con LPS LPS+si-NC LPS+si-LINC00707 F P Apoptosis rate(%)6.15±0.57 33.91±3.021)34.49±3.11 10.96±0.842)405.228 0.000 cleaved-caspase3 protein 0.24±0.02 0.66±0.051)0.68±0.05 0.31±0.032)302.238 0.000 cleaved-caspase9 protein 0.19±0.02 0.56±0.041)0.59±0.05 0.28±0.032)266.889 0.000
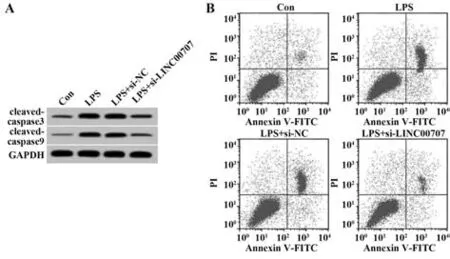
图1 干扰LINC00707表达对LPS诱导的肺上皮细胞凋亡的影响Fig.1 Effect of interference with LINC00707 expression on apoptosis of LPS-induced lung epithelial cells
2.4 LINC00707靶向调控miR-374a-3p表达 Star-Base在线软件预测显示,miR-374a-3p与LINC00707具有特异性互补的核苷酸序列(图2)。WT-LINC-00707共转染中,与转染miR-NC比较,转染miR-374a-3p后BEAS-2B细胞相对荧光素酶活性显著降低(P<0.05);MUT-LINC00707共转染中,与转染miR-NC比较,转染miR-374a-3p后BEAS-2B细胞相对荧光素酶活性差异无统计学意义(P>0.05,表4)。pcDNA-LINC00707组BEAS-2B细胞miR-374a-3p表达比pcDNA组显著降低(P<0.05);si-LINC00707组BEAS-2B细胞miR-374a-3p表达比si-NC组显著升高(P<0.05,表5)。
表4 双荧光素酶报告实验(±s,n=9)Fig.2 Complementary nucleotide sequence of LINC00707 and miR-374a-3p (±s,n=9)
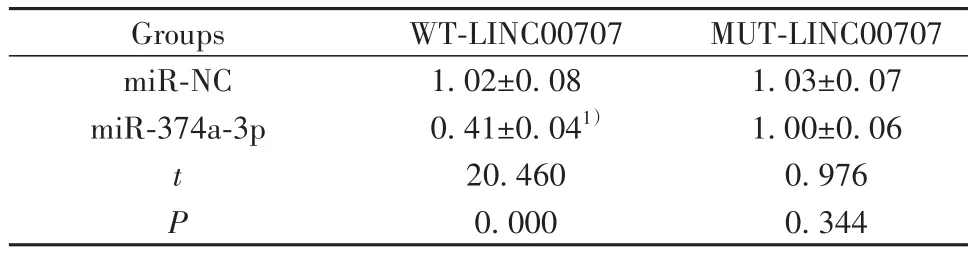
表4 双荧光素酶报告实验(±s,n=9)Fig.2 Complementary nucleotide sequence of LINC00707 and miR-374a-3p (±s,n=9)
Note:Compared with miR-NC group, 1)P<0.05.
Groups miR-NC miR-374a-3p t P WT-LINC00707 1.02±0.08 0.41±0.041)20.460 0.000 MUT-LINC00707 1.03±0.07 1.00±0.06 0.976 0.344
表5 LINC00707靶向调控miR-374a-3p表达(±s,n=9)Tab.5 LINC00707 targeted expression of miR-374a-3p(±s,n=9)
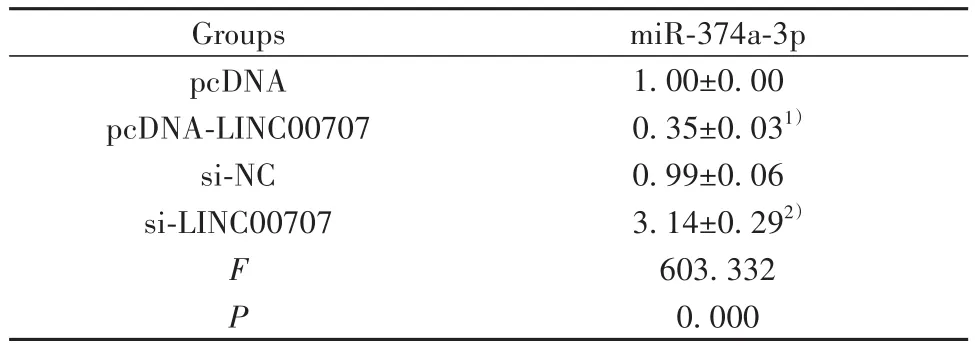
表5 LINC00707靶向调控miR-374a-3p表达(±s,n=9)Tab.5 LINC00707 targeted expression of miR-374a-3p(±s,n=9)
Note:Compared with pcDNA group, 1)P<0.05; compared with si-NC group, 2)P<0.05.
Groups pcDNA pcDNA-LINC00707 si-NC si-LINC00707 F P miR-374a-3p 1.00±0.00 0.35±0.031)0.99±0.06 3.14±0.292)603.332 0.000
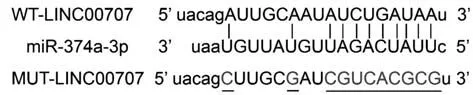
图2 LINC00707与miR-374a-3p的互补核苷酸序列Fig.2 Complementary nucleotide sequence of LINC00707 and miR-374a-3p
2.5 miR-374a-3p过表达对LPS诱导的肺上皮细胞炎症因子释放和凋亡的影响 与LPS+miR-NC组比较,LPS+miR-374a-3p组BEAS-2B细胞miR-374a-3p表达显著升高(P<0.05),IL-6和IL-1β释放量、凋亡率、cleaved-caspase3和cleaved-caspase9蛋白表达显著降低(P<0.05,图3、表6)。
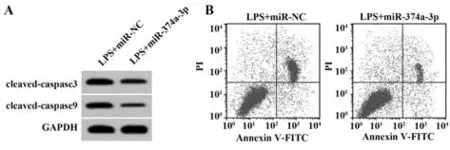
图3 miR-374a-3p过表达对LPS诱导的肺上皮细胞凋亡的影响Fig.3 Effect of miR-374a-3p overexpression on apoptosis of LPS-induced lung epithelial cells
表6 miR-374a-3p过表达对LPS诱导的肺上皮细胞炎症因子释放和凋亡的影响(±s,n=9)Tab.6 Effect of miR-374a-3p overexpression on releases of inflammatory factors and apoptosis of lung epithelial cells induced by LPS (±s,n=9)
表6 miR-374a-3p过表达对LPS诱导的肺上皮细胞炎症因子释放和凋亡的影响(±s,n=9)Tab.6 Effect of miR-374a-3p overexpression on releases of inflammatory factors and apoptosis of lung epithelial cells induced by LPS (±s,n=9)
Note:Compared with LPS+miR-NC group, 1)P<0.05.
Groups LPS+miR-NC LPS+miR-374a-3p t P miR-374a-3p 1.00±0.00 2.96±0.221)26.727 0.000 IL-6/(pg·ml-1)273.14±18.29 173.54±11.121)13.959 0.000 IL-1β/(pg·ml-1)182.08±13.06 69.17±5.911)23.630 0.000 Apoptosis rate(%)35.63±3.15 13.14±1.031)20.358 0.000 cleaved-caspase3 protein 0.67±0.05 0.39±0.031)14.406 0.000 cleaved-caspase9 protein 0.58±0.04 0.31±0.031)16.200 0.000
2.6 抑制miR-374a-3p表达逆转了干扰LINC00707表达对LPS诱导的肺上皮细胞炎症因子释放和凋亡的作用 与LPS+si-LINC00707+anti-miR-NC组比较,LPS+si-LINC00707+anti-miR-374a-3p组BEAS-2B细胞miR-374a-3p表达显著降低(P<0.05),IL-6和IL-1β释放量、凋亡率、cleaved-caspase3和cleaved-caspase9蛋白表达显著升高(P<0.05,表7、图4)。
表7 抑制miR-374a-3p表达逆转了干扰LINC00707表达对LPS诱导的肺上皮细胞炎症因子释放和凋亡的作用(±s,n=9)Tab.7 Inhibition of miR-374a-3p expression reversed effect of interfering with LINC00707 expression on inflammatory factor release and apoptosis of LPS-induced lung epithelial cells (±s,n=9)
表7 抑制miR-374a-3p表达逆转了干扰LINC00707表达对LPS诱导的肺上皮细胞炎症因子释放和凋亡的作用(±s,n=9)Tab.7 Inhibition of miR-374a-3p expression reversed effect of interfering with LINC00707 expression on inflammatory factor release and apoptosis of LPS-induced lung epithelial cells (±s,n=9)
Note:Compared with LPS+si-LINC00707+anti-miR-NC group, 1)P<0.05.
Groups LPS+si-LINC00707+anti-miR-NC LPS+si-LINC00707+anti-miR-374a-3p t P miR-374a-3p 1.00±0.00 0.36±0.041)48.000 0.000 IL-6/(pg·ml-1)146.17±11.88 224.87±18.691)10.661 0.000 IL-1β/(pg·ml-1)56.16±4.68 129.74±11.951)17.200 0.000 Apoptosis rate(%)10.02±0.93 25.24±2.181)19.265 0.000 cleaved-caspase3 protein 0.30±0.02 0.57±0.051)15.041 0.000 cleaved-caspase9 protein 0.25±0.02 0.47±0.051)12.256 0.000
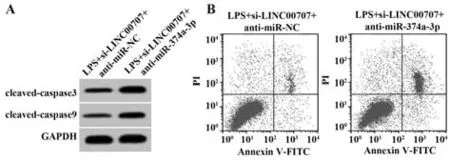
图4 抑制miR-374a-3p表达逆转了干扰LINC00707表达对LPS诱导的肺上皮细胞凋亡的作用Fig.4 Inhibition of miR-374a-3p expression reversed effect of interfering with LINC00707 expression on apoptosis of LPS-induced lung epithelial cells
3 讨论
近年多项研究揭示了lncRNA在ARDS中的作用。YAO等[11]研究发现,ARDS患者和LPS处理的人肺微血管内皮细胞(human pulmonary microvascular endothelial cells,HPMEC)中lncRNA转移相关肺腺癌转录本1(MALAT1)表达上调,敲减MALAT1可抑制HPMEC凋亡,降低HPMEC中促炎细胞因子表达,减轻ARDS患者肺损伤。WANG等[12]研究证实,lncRNA X染色体失活特异转录物(XIST)可诱导炎症细胞浸润、肺泡炎症和纤维化,加重LPS诱导的小鼠ARDS。WANG等[13]报道TNF相关和异质核蛋白相关免疫调节lncRNA(lnc-THRIL)可预测脓毒症患者ARDS风险增加,且lnc-THRIL表达水平与疾病严重程度、炎症和死亡率呈正相关。因此,lnc-RNA在ARDS中有望成为诊断或治疗靶点,本研究在LPS诱导的BEAS-2B细胞中发现LINC00707表达上调,提示LINC00707可能参与ARDS发生发展,功能分析显示,转染si-LINC00707干扰LINC00707表达后LPS诱导的BEAS-2B细胞炎症因子IL-6和IL-1β释放量降低,凋亡率下降,表明干扰LINC00707表达可抑制LPS的诱导BEAS-2B凋亡和炎症反应。此外,干扰LINC00707表达后促凋亡蛋白cleaved-caspase3、cleaved-caspase9表达显著下调,进一步证实其可逆转LPS诱导的细胞凋亡。既往研究表明,LPS可抑制人胚肺成纤维细胞MRC-5活力,促进细胞凋亡和炎症反应,而干扰LINC00707表达可减轻LPS诱导的MRC-5细胞损伤,与本研究中干扰LINC00707表达的保护作用一致[14]。表明干扰LINC00707通过抑制细胞凋亡和炎症因子分泌对LPS诱导的肺上皮细胞损伤发挥保护作用。
LINC00707富含miRNA结合位点,多项研究证实LINC00707可结合miRNA负调控其表达参与多种疾病进展[15-16]。如LINC00707通过靶向下调miR-876促进乳腺癌细胞体外增殖、迁移和侵袭和体内肿瘤生长[17]。本研究证实miR-374a-3p是LINC-00707的直接靶点。据报道,miR-374a-3p在氧化修饰低密度脂蛋白(ox-LDL)作用的内皮中表达降低,过表达miR-374a-3p可抑制内皮凋亡和炎症因子释放,保护 ox-LDL 引起的内皮损伤[18]。此外,miR-374a-3p介导敲减lncRNA小核仁RNA宿主基因5(SNHG5)还可提高LPS诱导的肾小管上皮细胞活力,降低细胞凋亡率和炎症细胞因子水平,进而抑制脓毒症诱导的急性肾损伤[19]。本研究表明,LPS诱导的BEAS-2B细胞miR-374a-3p表达降低,过表达miR-374a-3p明显下调cleaved-caspase3、cleavedcaspase9蛋白表达,抑制细胞凋亡和炎症因子分泌,逆转LPS诱导的细胞凋亡和炎症反应,与过表达miR-374a-3p对LPS诱导的BEAS-2B细胞损伤保护效果类似。由于miR-374a-3p表达受LINC00707负调控,本研究推测在BEAS-2B细胞中可能存在LINC00707/miR-374a-3p途径,恢复实验表明,抑制miR-374a-3p表达明显逆转干扰LINC00707对LPS诱导的BEAS-2B细胞凋亡和炎症因子分泌的抑制作用,进一步证实LINC00707靶向负调控miR-374a-3p参与LPS诱导的肺上皮细胞损伤。
综上,本研究证实干扰LINC00707通过靶向上调miR-374a-3p可抑制LPS诱导的肺上皮细胞炎症因子释放和凋亡,减轻LPS诱导的肺上皮细胞损伤,表明靶向抑制LINC00707/miR-374a-3p途径可能是一种潜在的ARDS治疗策略。