仙茅苷调控miR-1247-3p表达对高糖诱导的肾小管上皮细胞炎症反应的影响
2022-02-10黄建青丘水林福建医科大学附属龙岩第一医院内分泌科龙岩364000
黄建青 陈 阳 丘水林 童 艳 涂 梅 (福建医科大学附属龙岩第一医院内分泌科,龙岩 364000)
糖尿病肾病是糖尿病常见的慢性微血管并发症之一,其患病率逐年攀升,严重影响患者的生命健康及生活质量;近年来中医药治疗糖尿病肾病具有一定优势,不良反应较小[1-3]。仙茅苷是中药仙茅的有效成分,可通过调节炎症反应和氧化应激降低脂多糖诱导的急性肺损伤[4]。仙茅苷预处理可显著改善细胞活力,降低心肌细胞凋亡[5]。仙茅苷可缓解海马神经元损伤,抑制海马神经元凋亡[6]。肾小管上皮细胞炎症损伤与糖尿病肾病的发病密切相关。研究报道缺氧复氧诱导的心肌细胞中miR-1247-3p表达下调,上调miR-1247-3p可减轻缺氧复氧诱导的心肌细胞损伤[7]。miR-1247-3p能抑制氧-葡萄糖剥夺/复氧诱导的脑神经细胞凋亡[8]。说明miR-1247-3p具有减轻细胞损伤作用。本研究旨在探究仙茅苷对高糖致肾小管上皮细胞炎症损伤的影响及机制是否与miR-1247-3p有关。
1 材料与方法
1.1 材料 HK-2细胞(肾小管上皮细胞)购自美国ATCC;DMEM培养基购自美国Hyclone;D-葡萄糖购自艾美捷科技有限公司;仙茅苷购自江苏永健医药科技有限公司;IL-6、TNF-α ELISA试剂盒购自武汉伊莱瑞特生物科技股份有限公司(货号:E-ELH0102c、E-EL-H0109c);凋亡检测试剂盒(货号:QN1317)、RIPA蛋白裂解液(货号:HR0259)购自北京百奥莱博科技有限公司;Cleaved-caspase3和Cleaved-caspase9抗体购自亚科因(武汉)生物技术有限公司(货号:ABP0020、ABP50010);逆转录试剂盒(货号:D350A)、荧光定量试剂盒(货号:RR420A)购自大连宝生物工程有限公司;LipofectamineTM2000转染试剂(货号:11668019)购自美国Invitrogen公司;anti-miR-NC、anti-miR-1247-3p购自上海吉玛制药有限公司。
1.2 方法
1.2.1 细胞处理与分组 采用DMEM培养基培养肾小管上皮细胞HK-2,用含5.5、25 mmol/L葡萄糖的DMEM培养基培养HK-2细胞,分别作为正常对照组(Con)和高糖组(HG);以0.5、5、50 µmol/L仙茅苷和25 mmol/L葡萄糖分别处理HK-2细胞,作为HG+仙茅苷低、中、高剂量实验组;将miR-NC、miR-1247-3p分别转染至HK-2细胞后用25 mmol/L葡萄糖处理,为HG+miR-NC组、HG+miR-1247-3p组;将anti-miR-NC、anti-miR-1247-3p分别转染至HK-2细胞,再加25 mmol/L葡萄糖和50 µmol/L仙茅苷,设为HG+仙茅苷+anti-miR-NC组、HG+仙茅苷+anti-miR-1247-3p组。转染方法:转染前1 d培养细胞,使其转染密度为90%左右,采用50 µl无血清DMEM培养基稀释1.0 µg质粒;50 µl DMEM培养基稀释1 µl LipofectamineTM2000试剂;5 min内同稀释的质粒混合;室温静置20 min;将复合物添加至含细胞的培养板中孵育6 h,然后加入药物处理。
1.2.2 ELISA检测TNF-α、IL-6水平 收集各组细胞培养48 h后的上清液,按照试剂盒说明操作,采用酶标仪测定OD450nm值,绘制标准曲线,根据样品OD值计算相应浓度。
1.2.3 流式细胞术检测细胞凋亡 各组细胞培养48 h,PBS清洗细胞,加入300 µl结合缓冲液,Annexin V-FITC和PI避光孵育10 min,置于流式细胞仪检测细胞凋亡率。
1.2.4 Western blot检测蛋白表达 提取各组细胞总蛋白,通过SDS-PAGE电泳分离蛋白,经电转将蛋白转移至PVDF膜,5%脱脂牛奶封闭后加入Cleaved-caspase3和Cleaved-caspase9抗体,4 ℃孵育过夜,然后加入二抗孵育2 h,曝光显影,分析蛋白条带灰度值,以GAPDH为内参计算蛋白表达水平。
1.2.5 RT-qPCR检测miR-1247-3p表达水平 提取细胞总RNA,采用逆转录试剂盒将RNA逆转录为cDNA,以U6为内参,根据试剂盒说明进行PCR反应,相对表达量采用 2-ΔΔCt法计算。miR-1247-3p 正向引物:5'-CCCCGGGAACGTCGAGACTGGAGC-3',反向引物:5'-CAGTGCGTGTCGTGGAGT-3';U6正向引物:5'-CTCGCTTCGGCAGCACA-3',反向引物:5'-AACGCTTCACGAATTTGCGT-3'。引物由上海生工生物工程公司合成。
1.3 统计学分析 以SPSS20.0软件进行统计学分析,符合正态分布的计量资料用±s表示,两组独立样本比较方差齐行t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 仙茅苷对高糖诱导的肾小管上皮细胞炎症因子表达的影响 与Con组相比,HG组肾小管上皮细胞中IL-6、TNF-α水平升高(P<0.05);与HG组相比,HG+仙茅苷低、中、高剂量组肾小管上皮细胞中IL-6、TNF-α水平逐渐降低,呈剂量依赖性(P<0.05,表1)。
表1 仙茅苷对高糖诱导的肾小管上皮细胞炎症因子表达的影响(±s,n=9,pg/ml)Tab.1 Effect of curculigoside on expressions of inflammatory factors in renal tubular epithelial cells induced by high glucose (±s,n=9,pg/ml)
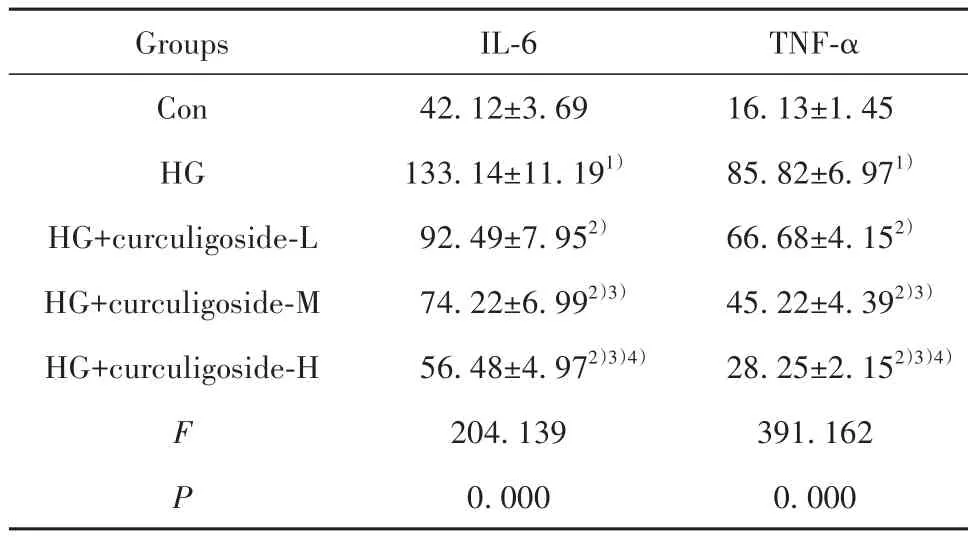
表1 仙茅苷对高糖诱导的肾小管上皮细胞炎症因子表达的影响(±s,n=9,pg/ml)Tab.1 Effect of curculigoside on expressions of inflammatory factors in renal tubular epithelial cells induced by high glucose (±s,n=9,pg/ml)
Note:Compared with Con group, 1)P<0.05; compared with HG group,2)P<0.05; compared with HG+curculigoside-L group, 3)P<0.05; compared with HG+curculigoside-M group, 4)P<0.05.
Groups Con HG HG+curculigoside-L HG+curculigoside-M HG+curculigoside-H F P IL-6 42.12±3.69 133.14±11.191)92.49±7.952)74.22±6.992)3)56.48±4.972)3)4)204.139 0.000 TNF-α 16.13±1.45 85.82±6.971)66.68±4.152)45.22±4.392)3)28.25±2.152)3)4)391.162 0.000
2.2 仙茅苷对高糖诱导的肾小管上皮细胞凋亡的影响 与Con组相比,HG组HK-2细胞的凋亡率及Cleaved-caspase3、Cleaved-caspase9蛋白表达水平均升高(P<0.05);不同浓度仙茅苷处理后,细胞凋亡率及Cleaved-caspase3、Cleaved-caspase9蛋白表达水平较HG组逐渐降低,且呈剂量依赖性(P<0.05,图1、表2)。
表2 仙茅苷对高糖诱导的肾小管上皮细胞凋亡的影响(±s,n=9)Tab.2 Effect of curculigoside on renal tubular epithelial cell apoptosis induced by high glucose (±s,n=9)
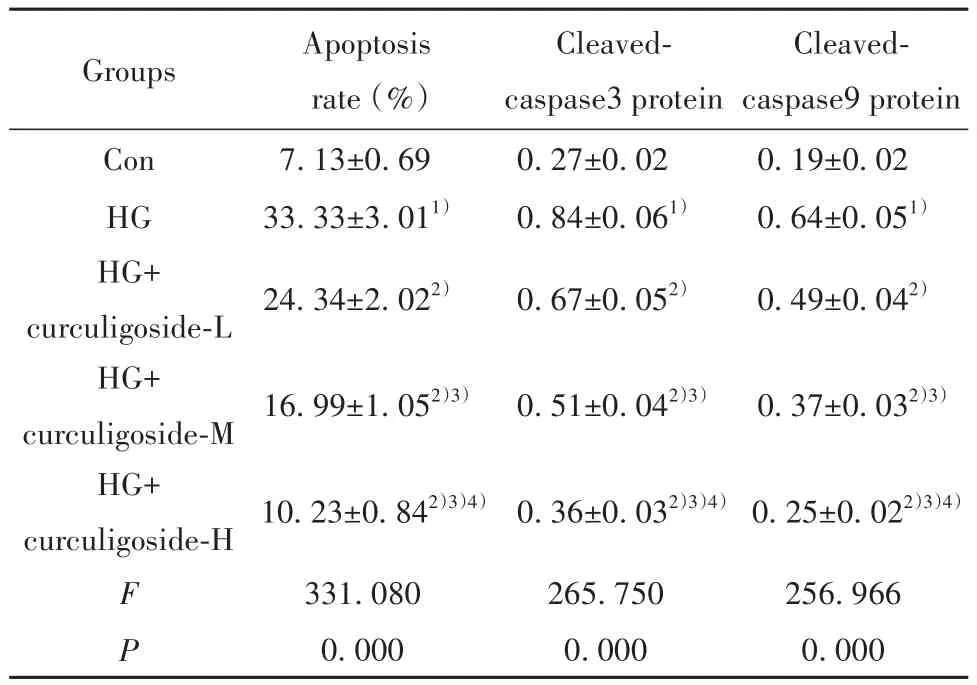
表2 仙茅苷对高糖诱导的肾小管上皮细胞凋亡的影响(±s,n=9)Tab.2 Effect of curculigoside on renal tubular epithelial cell apoptosis induced by high glucose (±s,n=9)
Note:Compared with Con group, 1)P<0.05; compared with HG group,2)P<0.05; compared with HG+curculigoside-L group, 3)P<0.05;compared with HG+curculigoside-M group, 4)P<0.05.
Groups Con HG HG+curculigoside-L HG+curculigoside-M HG+curculigoside-H F P Apoptosis rate (%)7.13±0.69 33.33±3.011)24.34±2.022)16.99±1.052)3)10.23±0.842)3)4)331.080 0.000 Cleavedcaspase3 protein 0.27±0.02 0.84±0.061)0.67±0.052)0.51±0.042)3)0.36±0.032)3)4)265.750 0.000 Cleavedcaspase9 protein 0.19±0.02 0.64±0.051)0.49±0.042)0.37±0.032)3)0.25±0.022)3)4)256.966 0.000
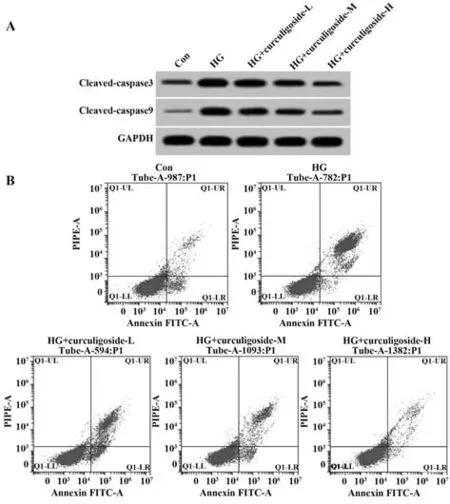
图1 仙茅苷对高糖诱导的肾小管上皮细胞凋亡的影响Fig.1 Effect of curculigoside on apoptosis of renal tubular epithelial cells induced by high glucose
2.3 仙茅苷对高糖诱导的肾小管上皮细胞miR-1247-3p表达的影响 与Con组相比,HG组HK-2细胞中miR-1247-3p表达水平降低(P<0.05);与HG组相比,仙茅苷低、中、高剂量组HK-2细胞中miR-1247-3p表达水平逐渐升高,呈剂量依赖性(P<0.05,表3)。
表3 仙茅苷对高糖诱导的肾小管上皮细胞miR-1247-3p表达的影响(±s,n=9)Tab.3 Effect of curculigoside on expression of miR-1247-3p in renal tubular epithelial cells induced by high glucose (±s,n=9)
表3 仙茅苷对高糖诱导的肾小管上皮细胞miR-1247-3p表达的影响(±s,n=9)Tab.3 Effect of curculigoside on expression of miR-1247-3p in renal tubular epithelial cells induced by high glucose (±s,n=9)
Note:Compared with Con group, 1)P<0.05; compared with HG group,2)P<0.05; compared with HG+curculigoside-L group, 3)P<0.05;compared with HG+curculigoside-M group, 4)P<0.05.
Groups Con HG HG+curculigoside-L HG+curculigoside-M HG+curculigoside-H F P miR-1247-3p 1.00±0.00 0.31±0.031)0.52±0.042)0.66±0.052)3)0.82±0.062)3)4)370.570 0.000
2.4 miR-1247-3p过表达对高糖诱导的肾小管上皮细胞炎症因子表达的影响 与HG+miR-NC组相比,HG+miR-1247-3p组miR-1247-3p表达水平升高,IL-6、TNF-α水平降低(P<0.05,表4)。
表4 miR-1247-3p过表达对高糖诱导的肾小管上皮细胞炎症因子表达的影响(±s,n=9)Tab.4 Effect of miR-1247-3p overexpression on expressions of inflammatory factors in renal tubular epithelial cells induced by high glucose (±s,n=9)
表4 miR-1247-3p过表达对高糖诱导的肾小管上皮细胞炎症因子表达的影响(±s,n=9)Tab.4 Effect of miR-1247-3p overexpression on expressions of inflammatory factors in renal tubular epithelial cells induced by high glucose (±s,n=9)
Note:Compared with HG+miR-NC group, 1)P<0.05.
Groups HG+miR-NC HG+miR-1247-3p t P miR-1247-3p 1.00±0.00 3.09±0.261)24.115 0.000 IL-6/(pg·ml-1)135.04±11.79 64.17±5.571)16.305 0.000 TNF-α/(pg·ml-1)86.59±6.65 36.69±3.241)20.237 0.000
2.5 miR-1247-3p过表达对高糖诱导的肾小管上皮细胞凋亡的影响 与HG+miR-NC组相比,HG+miR-1247-3p组肾小管上皮细胞凋亡率降低,Cleaved-caspase3和Cleaved-caspase9蛋白表达水平降低(P<0.05,图2、表5)。
表5 miR-1247-3p过表达对高糖诱导的肾小管上皮细胞凋亡的影响(±s,n=9)Tab.5 Effect of miR-1247-3p overexpression on apoptosis of renal tubular epithelial cells induced by high glucose (±s,n=9)
表5 miR-1247-3p过表达对高糖诱导的肾小管上皮细胞凋亡的影响(±s,n=9)Tab.5 Effect of miR-1247-3p overexpression on apoptosis of renal tubular epithelial cells induced by high glucose (±s,n=9)
Note:Compared with HG+miR-NC group, 1)P<0.05.
Groups HG+miR-NC HG+miR-1247-3p t P Apoptosis rate(%)33.97±3.12 13.86±1.151)18.143 0.000 Cleavedcaspase3 protein 0.86±0.05 0.45±0.041)19.209 0.000 Cleavedcaspase9 protein 0.67±0.05 0.32±0.041)16.398 0.000
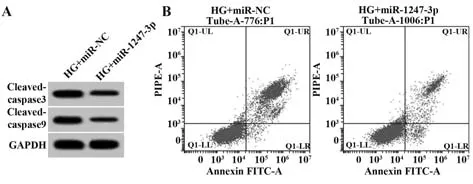
图2 miR-1247-3p过表达对高糖诱导的肾小管上皮细胞凋亡的影响Fig.2 Effect of miR-1247-3p overexpression on apoptosis of renal tubular epithelial cells induced by high glucose
2.6 下调miR-1247-3p表达和仙茅苷对高糖诱导的肾小管上皮细胞炎症损伤的作用 与HG+仙茅苷+anti-miR-NC 组相比,HG+仙茅苷(50 µmol/L)+anti-miR-1247-3p组miR-1247-3p表达水平降低,IL-6、TNF-α水平升高,细胞凋亡率升高,Cleaved-caspase3和Cleaved-caspase9蛋白表达水平升高(P<0.05,图3、表6、表7)。
表6 下调miR-1247-3p表达和仙茅苷对高糖诱导的肾小管上皮细胞miR-1247-3p表达和炎症因子的作用(±s,n=9)Tab.6 Effect of down-regulation of miR-1247-3p expression and curculigoside on miR-1247-3p expression and inflammatory factors in renal tubular epithelial cells induced by high glucose (±s,n=9)
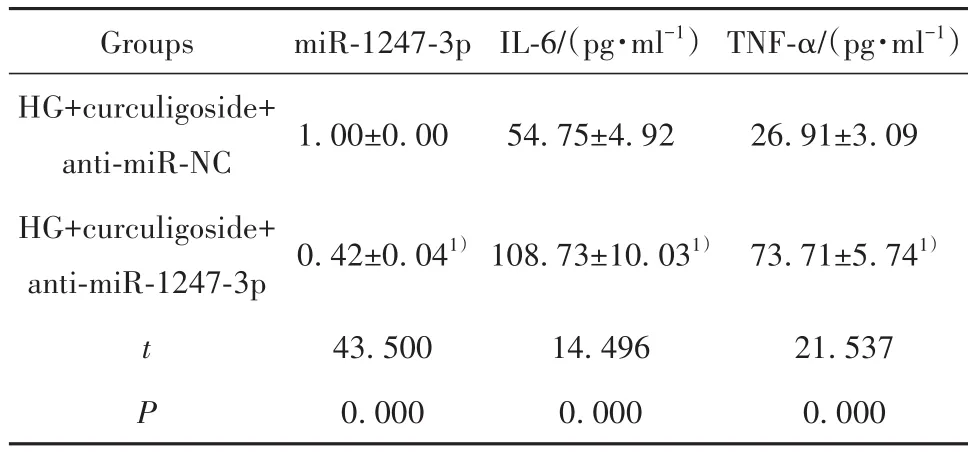
表6 下调miR-1247-3p表达和仙茅苷对高糖诱导的肾小管上皮细胞miR-1247-3p表达和炎症因子的作用(±s,n=9)Tab.6 Effect of down-regulation of miR-1247-3p expression and curculigoside on miR-1247-3p expression and inflammatory factors in renal tubular epithelial cells induced by high glucose (±s,n=9)
Note:Compared with HG+curculigoside+anti-miR-NC group, 1)P<0.05.
Groups HG+curculigoside+anti-miR-NC HG+curculigoside+anti-miR-1247-3p t P miR-1247-3p 1.00±0.00 0.42±0.041)43.500 0.000 IL-6/(pg·ml-1)54.75±4.92 108.73±10.031)14.496 0.000 TNF-α/(pg·ml-1)26.91±3.09 73.71±5.741)21.537 0.000
表7 下调miR-1247-3p表达和仙茅苷对高糖诱导的肾小管上皮细胞凋亡的作用(±s,n=9)Tab.7 Effect of down-regulation of miR-1247-3p expression and curculigoside on apoptosis of renal tubular epithelial cells induced by high glucose (±s,n=9)

表7 下调miR-1247-3p表达和仙茅苷对高糖诱导的肾小管上皮细胞凋亡的作用(±s,n=9)Tab.7 Effect of down-regulation of miR-1247-3p expression and curculigoside on apoptosis of renal tubular epithelial cells induced by high glucose (±s,n=9)
Note:Compared with HG+curculigoside+anti-miR-NC group, 1)P<0.05.
Groups HG+curculigoside+anti-miR-NC HG+curculigoside+10.03±0.93 Apoptosis rate(%)anti-miR-1247-3p t P 25.23±2.181)19.240 0.000 0.35±0.03 0.75±0.051)20.580 0.000 0.24±0.02 0.55±0.041)20.795 0.000 Cleavedcaspase3 protein Cleavedcaspase9 protein

图3 下调miR-1247-3p表达和仙茅苷对高糖诱导的肾小管上皮细胞凋亡的作用Fig.3 Effect of down-regulation of miR-1247-3p expression and curculigoside on apoptosis of renal tubular epithelial cells induced by high glucose
3 讨论
糖尿病肾病发病机制复杂,慢性炎症反应、肾小管上皮细胞凋亡、肾小管基底膜增厚、肾小管间质纤维化等均与其相关,肾小管上皮细胞损伤可促进多种炎症因子分泌,导致间质炎症[9-11]。因此,抑制肾小管上皮细胞炎症损伤是防治糖尿病肾病的重要途径。研究表明中药具有抑制肾小管上皮细胞损伤及炎症作用[12-13]。研究报道仙茅苷预处理可减少过氧化氢诱导的心肌细胞凋亡,保护心肌细胞免受氧化损伤[14]。仙茅苷可激活PI3K/Akt信号转导通路,抑制氧化应激反应、抑制炎症反应从而减轻脑组织损伤,保护脑组织的结构和功能[15]。本研究采用不同浓度仙茅苷处理高糖作用的HK-2细胞,结果显示,随着仙茅苷浓度增加,高糖损伤的肾小管上皮细胞培养液中IL-6、TNF-α水平逐渐降低,细胞凋亡率及Cleaved-caspase3、Cleaved-caspase9蛋白表达水平逐渐降低,显示出明显的量效关系,提示仙茅苷能够减轻高糖损伤肾小管上皮细胞炎症反应。
miRNA参与调控细胞损伤过程。研究报道miR-1247-3p与机体炎症反应直接相关[16]。miR-1247-3p可参与调控肺泡上皮细胞损伤过程[17]。而miR-1247-3p对损伤的肾小管上皮细胞影响作用尚不清楚。本实验结果显示:高糖诱导损伤HK-2细胞中miR-1247-3p表达水平降低,miR-1247-3p过表达后,IL-6、TNF-α水平降低,HK-2细胞凋亡率及Cleaved-caspase3、Cleaved-caspase9蛋白表达水平降低;表明miR-1247-3p过表达可抑制高糖作用的肾小管上皮细胞凋亡及炎症反应。本研究还发现仙茅苷能增加miR-1247-3p表达水平,且通过antimiR-1247-3p验证了下调miR-1247-3p表达可逆转仙茅苷对高糖诱导的肾小管上皮细胞炎症损伤。提示仙茅苷可能通过上调miR-1247-3p表达,从而减少高糖诱导的肾小管上皮细胞炎症反应与细胞凋亡。