UPLC-QTOF-MS 结合主成分分析法考察胡芦巴盐制前后的化学成分差异
2022-02-04王祎刘颖叶斌斌郑彧
王祎,刘颖,叶斌斌,郑彧
(辽宁中医药大学药学院,辽宁 大连 116600)
胡芦巴为豆科植物胡芦巴(Trigonellafoenum-graecumL.)的干燥种子,主要分布于我国宁夏、甘肃、青海、新疆、内蒙古等省区,是我国传统的药食两用植物和香料。《中国药典》中载有胡芦巴、盐胡芦巴两个品种。胡芦巴性温味苦,归肾经,温肾助阳,祛寒止痛,用于肾阳不足。在中医理论中有“入盐走肾脏仍仗软坚”,认为盐制可以引药入肾,发挥软坚散结的作用。胡芦巴经盐制后可以增强温肾阳、逐寒湿的功效[1]。我们课题组在早期研究中证明了盐胡芦巴的降脂作用优于胡芦巴[2]。胡芦巴的化学成分主要包括胡芦巴碱、皂苷类、黄酮类、膳食纤维、胡芦巴油脂、4-羟基异亮氨酸等,这些化学成分已经被报道具有降血糖、降血脂、抗肿瘤、抗氧化、抑菌、保肝等多种药理活性[3]。我们课题组早期基于响应面法优化了盐胡芦巴的炮制工艺[4],并发现胡芦巴盐制后,多糖、薯蓣皂苷元、胡芦巴碱含量升高,4-羟基异亮氨酸含量降低。
中药的炮制在中国有着悠久的历史,炮制通过促进中药中化学成分之间的转化以及药效成分的溶出,从而发挥减毒增效的作用[5]。例如,补骨脂经盐制总黄酮含量呈现上升趋势,这可能是盐制过程导致补骨脂种皮破碎,使得其成分更易溶出[6];知母中的甾体皂苷类成分在盐制过程中发生转化[7]。目前,关于胡芦巴盐制后化学成分变化的研究较少。因此,本研究使用超高效液相色谱-四极杆-飞行时间质谱法(UPLC-QTOF-MS) 分析胡芦巴与盐胡芦巴中的化学成分,采用主成分分析(PCA)以及偏最小二乘判别分析(PLS-DA)筛选胡芦巴与盐胡芦巴中的差异性成分,利用高分辨质谱提供的精确分子量、二级质谱结合文献数据鉴定这些差异性成分的结构。探究盐制对胡芦巴中化学成分的影响,为阐明胡芦巴盐制的机理提供实验依据。
1 试药
胡芦巴购自亳药千草中药饮片公司(批号:2008132,产地:安徽蒙城)经王添敏教授鉴定为豆科植物胡芦巴(Trigonellafoenum-graecumL.)的种子。参照课题组早期优化的盐制方法制备盐胡芦巴[4],即:100 g 胡芦巴, 加入含盐量 2.0 g的盐水,闷润4 h,在 160 ℃下烘箱烘制10.0 min。
2 方法
2.1 样品制备 胡芦巴和盐胡芦巴粉粹,过60目筛,精密称定后以10倍量甲醇超声提取30 min,18 000 g离心10 min取上清液(平行6份)进Agilent Technologies 6540 UHD Accurate-Mass Q-TOF LC/MS分析。取胡芦巴和盐胡芦巴各样品等量混合作为QC样品。
2.2 色谱和质谱条件
2.2.1 色谱条件 Agilent Technologies 6540 UHD Accurate-Mass Q-TOF LC/MS,离子源:electrospray ionization(ESI)。色谱柱:C18反相色谱柱(150 mm×3.0 mm,2.7 μm,YMC Co.,Ltd.)。柱温40 ℃,流速0.3 mL·min-1,进样量5 μL,流动相:0.5% 乙酸(A)-乙腈(B),梯度洗脱,0~20 min,5%~100% B;20~25 min,100% B。
2.2.2 质谱条件 离子源ESI(+),毛细管电压3.5 kV,碰撞电压75 V,锥孔电压65 V,雾化气压力35 psig,干燥气流速8 L·min-1,干燥气温度350 ℃,扫描范围m/z100~2 000。
2.3 数据统计分析 将UPLC-QTOF-MS 的结果加载到安捷伦MassHunter工作站软件上,该软件可以在分析的每个步骤中可视化原始数据,而不会丢失值。离子强度图显示了保留时间、m/z和强度的信息,以及用于进一步分析的质谱图和色谱图。将从UPLC-QTOF-MS 获得的数据转换为包含m/z、保留时间和离子强度信息的表格。从所有样品中排除质控样品中RSD值大于30%的峰,并将剩余峰用于多元统计分析。将Simca-P 12.0软件应用于PCA和PLS-DA。然后选择VIP值大于1.5、组间差异P值小于0.05的离子,通过二级质谱(MS2)进行进一步鉴定。
3 结果
3.1 胡芦巴和盐胡芦巴的PCA和PLS-DA分析 胡芦巴和盐胡芦巴在正离子模式下的总离子流图(TIC)见图1所示。在胡芦巴和盐胡芦巴TIC图中9~11 min的离子响应出现差异,提示盐制使胡芦巴中的化学成分发生变化。将各样本的UPLC-QTOF-MS 数据导入XCMS(https://xcmsonline.scripps.edu) 转换为包含m/z,保留时间和峰响应的表格,将表格导入SIMCA软件进行PCA和PLS-DA分析。PCA分析结果表明胡芦巴和盐胡芦巴样本聚集良好。进一步采用PLS-DA筛选胡芦巴和盐胡芦巴中的差异性成分,选择VIP值大于1.5、组间差异P值小于0.05的成分进行鉴定。

A.胡芦巴;B.盐胡芦巴图1 胡芦巴及盐制品正离子模式下的总离子流图
3.2 胡芦巴和盐胡芦巴差异性成分鉴定 通过质谱提供的精确分子量以及MS2数据,结合参考文献,鉴定了胡芦巴和盐胡芦巴中的25个差异性成分的结构。化合物1为胡芦巴碱[8],是胡芦巴中的主要活性成分。胡芦巴中含有大量黄酮碳苷[9],尽管本试验采用正离子模式测定胡芦巴的化学成分,对于差异性成分中黄酮的鉴定则配合了负离子模式下的靶向二级质谱。黄酮碳苷在负离子模式下易产生[M-H-90]-、[M-H-120]-、[M-H-60]-、[M-H-104]-等碎片,这些碎片信息提示黄酮碳苷中糖的类型.例如,[M-H-120]-和[M-H-90]-提示存在六碳糖苷,[M-H-90]-和[M-H-60]-提示存在五碳糖苷[10-11]。由于质谱不能鉴定糖的种类和连接位置,因此胡芦巴生、盐品差异性黄酮类化合物的鉴定参考了文献中报道的胡芦巴中含有的黄酮碳苷的名称以及其在C18柱上的保留时间,糖的结构只鉴定了其类型。基于以上分析化合物2~8被鉴定为黄酮类化合物。化合物2和4在正离子模式和负离子模式下的准分子离子峰分别为m/z595[M+H]+、593[M-H]-,提示其分子式为C27H30O15。MS2给出碎片离子峰m/z503[M-H-90]-、473[M-H-120]-、383[M-H-120-90]-、353[M-H-120-120]-。因此鉴定该两个化合物为芹菜素-6,8-C-双六碳糖苷,即vicenin 2或其异构体[9]。 化合物3,5~8在正离子模式和负离子模式下的准分子离子峰分别为m/z565[M+H]+、563[M-H]-,提示其分子式为C27H28O14。MS2给出碎片离子峰m/z503[M-H-60]-、473[M-H-90]-、443[M-H-120]-、383[M-H-120-60]-、353[M-H-120-90]-。因此鉴定该5个化合物为芹菜素-6-C-六碳糖-8-C-五碳糖苷或芹菜素-6-C-五碳糖-8-C-六碳糖苷,即vicenin 3、vicenin 1或其异构体[9]。该7个黄酮碳苷类化合物在盐胡芦巴中的响应较高,提示其盐制后含量升高。
除黄酮碳苷外,胡芦巴中还含有大量的甾体皂苷,苷元类型包括呋甾烷醇型(原diosgenin,yamogenin,neotigogenin,tigogenin,neogitogenin,gitogenin,smilagenin,sarsasapogenin)及其F环闭环的苷元即螺甾烷醇型/异螺甾烷醇型[12]。其中的呋甾烷醇型甾体皂苷在C22连有羟基,因此在质谱中的准分子离子峰为[M+Na]+同时还会观察到其C22脱水的离子峰[M+H-H2O]+。在此基础上162 Da的中性丢失生成碎片m/z[M+H-162]+提示其C26连有葡萄糖。而螺甾烷醇型/异螺甾烷醇型甾体皂苷在质谱中可形成[M+Na]+,[M+H]+的准分子离子峰,在此基础上的144 Da中性丢失为E环开裂产生[13-14]。甾体皂苷在质谱中主要产生失去糖形成的碎片峰,[M+H-162]+、[M+H-146]+、[M+H-132]+分别提示存在六碳糖、甲基五碳糖和五碳糖。m/z415、m/z271(-C8H16O2,415-144 Da)、m/z253(-H2O,271-18 Da) 的碎片峰提示苷元为原yamogenin和原diosgenin以及yamogenin和diosgenin。m/z417、m/z273(-C8H16O2,417-144 Da)、(-H2O,273-18 Da)提示苷元为原neotigogenin和原tigogenin以及neotigogenin和tigogenin。m/z431、m/z287(-C8H16O2,431-144 Da)、m/z269(-H2O,287-18 Da)、m/z251(-H2O,269-18 Da) 提示苷元为原lilagenin和原yuccagenin以及lilagenin和yuccagenin。m/z433、m/z415(-H2O,433-18 Da)、m/z289(-C8H16O2,415-144 Da)、m/z271(-H2O,289-18 Da)、m/z253(-H2O,271-18 Da) 提示苷元为原neogitogenin和原gitogenin以及neogitogenin和gitogenin。在上述苷元的碎片基础上生成142 Da中性丢失碎片提示C25和C27之间存在双键[13-14]。此外,在C18柱上25S构型的甾体皂苷先于25R构型的洗脱,中基于这个洗脱规律对甾体皂苷的C25差向异构体进行鉴定[13]。由于质谱不能鉴定糖的结构以及连接位置,因此在进行甾体皂苷的鉴定时仅对糖的类型进行了鉴定,如六碳糖、五碳糖、甲基五碳糖。基于以上分析,共鉴定胡芦巴生、盐品中的差异性皂苷15个。其中8个为呋甾烷醇型甾体皂苷,7个在盐制后响应降低;7个为螺甾烷醇/异螺甾烷醇型甾体皂苷,在盐制后响应升高。推测胡芦巴中的呋甾烷醇型甾体皂苷在盐制过程中失去C26位葡萄糖,随后发生侧链环合,生成螺甾烷醇/异螺甾烷醇型甾体皂苷。
4 讨论
对胡芦巴及其盐制品的化学成分分析结果表明,胡芦巴经盐制后化学成分的含量发生变化,但机制不同。黄酮碳苷在盐制后响应升高、但在生品、盐品中均存在、并且差异性黄酮类化合物种并无炮制后响应降低的成分,提示黄酮碳苷类成分炮制后响应升高的原因为盐制使种质疏松、溶出增加。而呋甾烷醇型甾体皂苷结构不稳定,在加热过程中容易转化为螺甾烷醇型/异螺甾烷醇型甾体皂苷[15]。因此螺甾烷醇型甾体皂苷在盐品中响应升高,而呋甾烷醇型甾体皂苷在生品中响应降低。此外,也有文献报道在胡芦巴中分离得到呋甾烷醇型甾体皂苷以及螺甾烷醇型/异螺甾烷醇型甾体皂苷[12,16],表明这一转化过程既可能发生在炮制过程中,也可能发生在对生品药材的提取过程中。本试验采用的样品为甲醇超声提取获得,采用UPLC-QTOF-MS 分析生品样品中含有多种呋甾烷醇型甾体皂苷,而这些皂苷在盐制后响应降低,提示在本试验条件下观察得到的甾体皂苷含量及种类的变化是由炮制导致的。
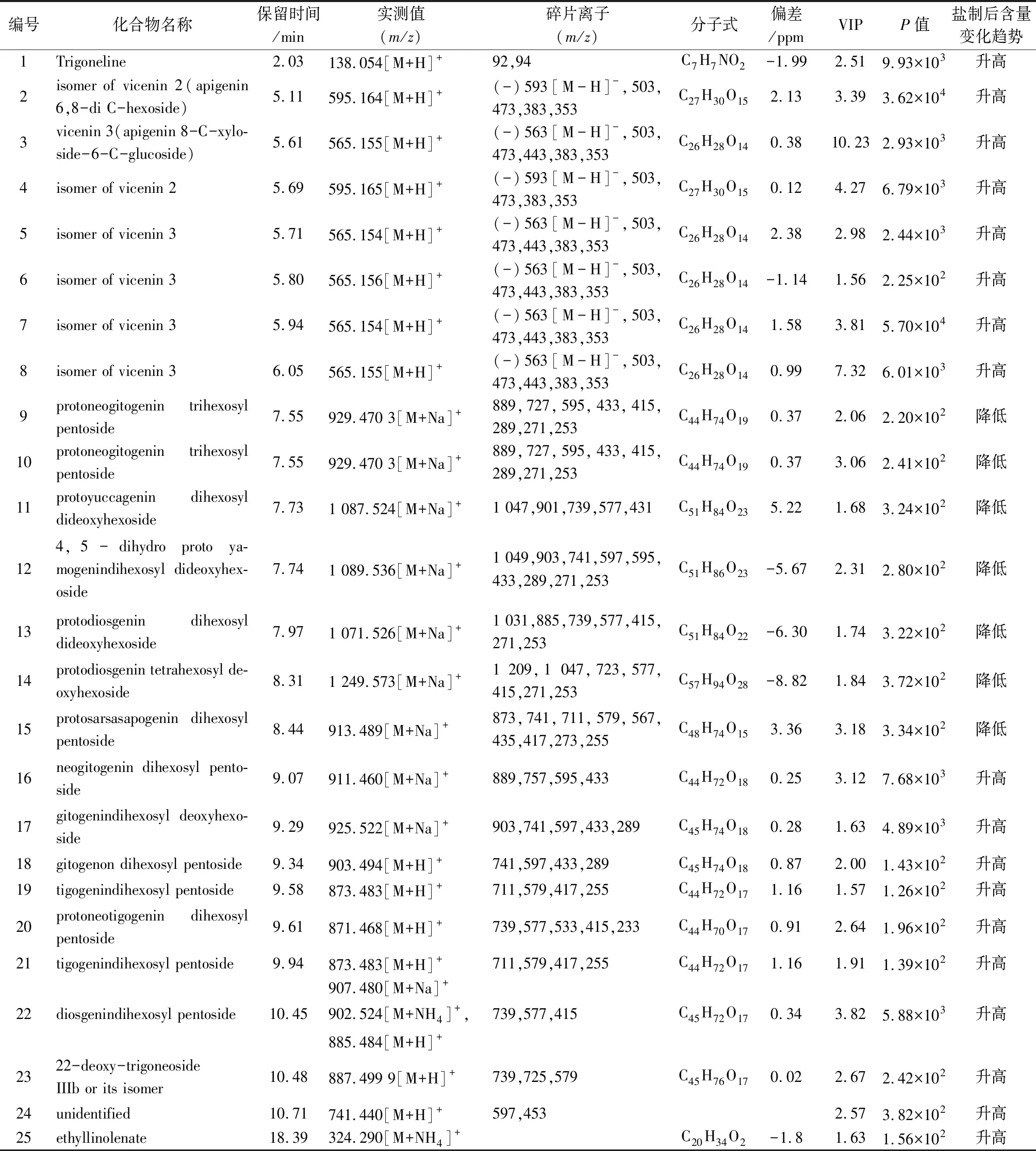
表1 胡芦巴及其盐制品之间的差异性成分
