广东省鸭疫里默氏杆菌流行病学监测及遗传进化关系
2022-01-27吴彩艳廖申权戚南山廖晓萍孙阮洋方亮星周宇峰李林林孙铭飞
吴彩艳,廖申权,戚南山,廖晓萍,孙阮洋,方亮星,周宇峰,李林林,孙铭飞
(1 华南农业大学 兽医学院,广东 广州 510642; 2 广东省农业科学院 动物卫生研究所/岭南现代农业科学与技术广东省实验室茂名分中心/广东省兽医公共卫生公共实验室/广东省畜禽疫病防治研究重点实验室/农业农村部兽用药物与诊断技术广东科学观测实验站,广东 广州 510640)
中国是世界上水禽养殖第一大国,肉鸭产量占世界总产量的70%左右,养殖量平均每年以8%~10%的速度增加。目前水禽养殖业已经成为我国解决“三农”问题的支柱产业,也是现代畜牧业的重要组成部分。虽然水禽业发展迅速,但也存在诸多制约因素,尤其是疫病多发、频发严重阻碍水禽业的健康发展。其中,由鸭疫里默氏杆菌Riemerella anatipestifer引起的鸭疫里默氏杆菌病已经成为影响水禽业经济最严重的细菌性传染病,发病率可达100%,死亡率高于75%,耐过的病鸭生长发育受阻,成为僵鸭,造成巨大的经济损失[1]。一直以来主要采用疫苗免疫与药物治疗相结合的方式防控该病,但是防控的效果并不理想。一方面,鸭疫里默氏杆菌有21个血清型且各血清型间缺乏交叉保护性,而目前市售的灭活疫苗尚未涵盖所有流行的血清型,当出现疫苗株血清型以外的鸭疫里默氏杆菌感染时,现有的灭活疫苗不能起到保护作用,导致疫苗应用受限;另一方面,虽然鸭疫里默氏杆菌对大多数抗生素或化学合成药物较敏感,但是由于长期连续使用或不规范使用药物导致耐药性普遍存在[2],并且已经成为当前养殖业面临的最严峻问题。因此,本研究拟对广东地区鸭疫里默氏杆菌分离株进行血清型和耐药性调查及遗传进化关系研究,为开展针对性疫苗免疫预防及选用敏感药物治疗提供重要依据。
1 材料与方法
1.1 材料
1.1.1 病料样本 病料于 2015—2019 年采自广东省清远、惠州、佛山等地区鸭场,采集疑似患鸭疫里默氏杆菌病病死鸭的脑、肝脏、心脏等组织,病料样本及分离鸭疫里默氏杆菌信息见表1,相同养殖场采集的样本分离的鸭疫里默氏杆菌记为1株。
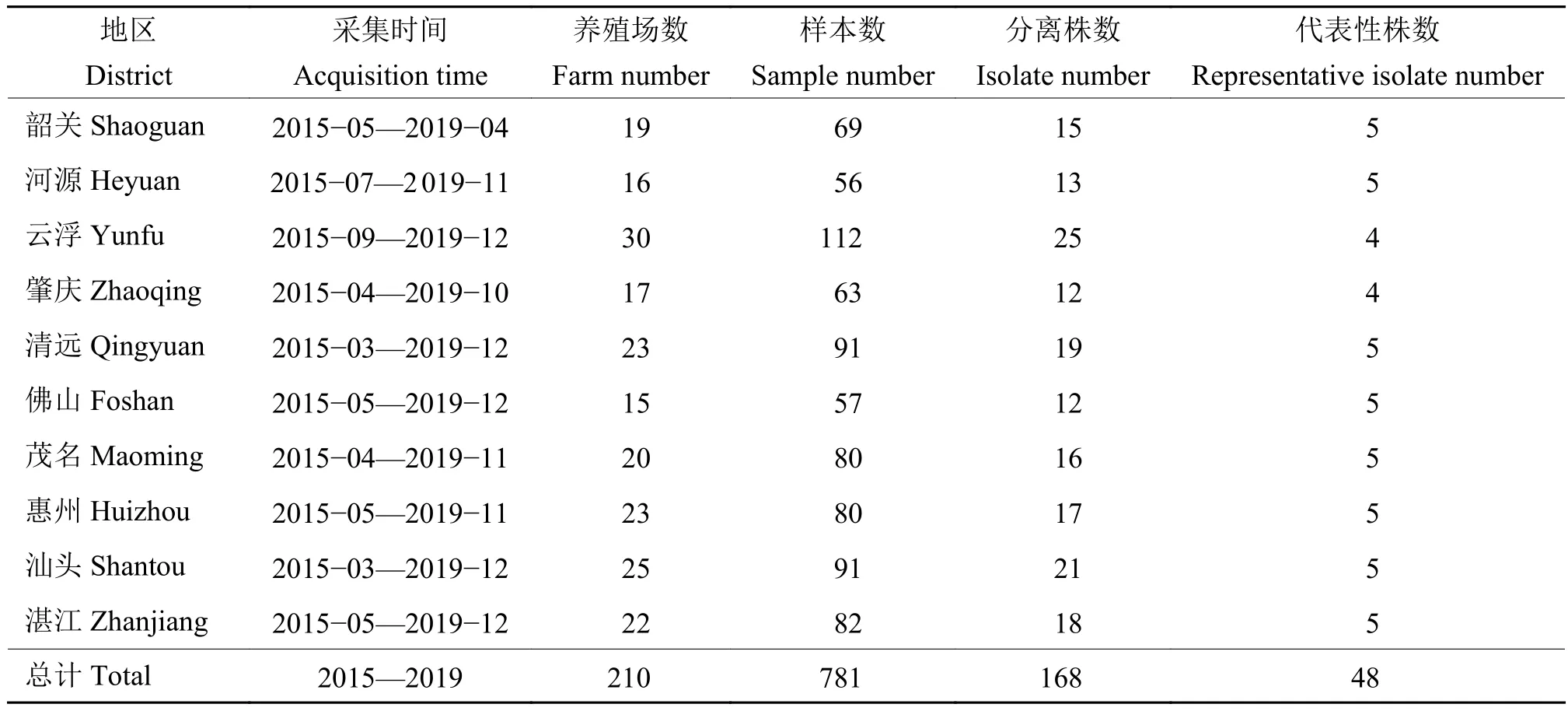
表1 采集样本与分离鸭疫里默氏杆菌信息Table 1 Collected samples and isolation information of Riemerella anatipestifer
1.1.2 试剂与药品 改良胰蛋白胨大豆肉汤(TSB)培养基,含5%(φ)新生牛血清;胰酶大豆琼脂(TSA)培养基,含5%(φ)新生牛血清;麦康凯培养基按细菌学常规方法配制;革兰染色试剂和微量生化发酵管为广东环凯微生物科技有限公司产品;DNA marker DL 2000 和 Premix Taq 为 TaKaRa 公司产品;药物标准品-氧氟沙星(Ofloxacin,OFX)、诺氟沙星 (Norfloxacin,NOR)、盐酸四环素(Tetracycline hydrochloride,TCY)、头孢噻肟(Cefotaxime,CTX)、阿莫西林 (Amoxicillin,AMX)、土霉素 (Oxytetracycline,OXY)、盐酸金霉素 (Chlortetracycline hydrochloride,CTE)、氨苄西林 (Ampicillin,AMP)、庆大霉素 (Gentamicin,GEN)、盐酸环丙沙星(Ciprofloxacin hydrochloride,CIP)、卡那霉素(Kanamycin,KAN)、大观霉素 (Spectinomycin,STP)、磺胺嘧啶 (Sulfadiazine,SDI)、磺胺二甲嘧啶(Sulfadimidine,SUL)和磺胺对甲氧嘧啶(Sulfametoxydiazine,SMD)为中国兽医药品监察所产品。
1.1.3 试验动物 1 日龄商品代樱桃谷肉鸭,大约4 000只,购自广州郊区某鸭场,未接种任何疫苗和抗血清,饲养于洁净环境中,至7~14日龄进行动物回归试验。
1.1.4 引物合成 引物参照文献 [3]合成,以 16S rRNA为扩增基因。引物 ( RA-F:5′-ACGTCATCCCACC TTCCTC-3′,RA-R:5′-GTTCAGACTAA GCGAAAG-3′ )由Invitrogen公司合成。
1.1.5 参考菌株 血清1型鸭疫里默氏杆菌参考株由广东省农科院动物卫生研究所寄生生物学研究室保存。
1.1.6 定型血清 1、2、3、4、5、6、7、8、9、10 型鸭疫里默氏杆菌参考株定型血清,由广东省农科院动物卫生研究所寄生生物学研究室自制。
1.1.7 质控菌 大肠埃希菌 ATCC25922 购自中国兽医药品监察所。
1.2 方法
1.2.1 病原分离与鉴定 病原分离:将无菌采集的病死鸭的脑、肝脏、心脏组织,划线接种于TSA培养基平板和麦康凯培养基平板,于37 ℃厌氧培养24 h,挑取单个可疑菌落进行纯化培养。
革兰染色:挑取纯培养的单菌落进行革兰染色、镜检,观察细菌的形态和染色特性。
生化试验:将分离株的纯培养物接种于微量生化发酵管中,于37 ℃温箱中培养,观察结果。
PCR鉴定:以分离株的菌液为模板进行PCR扩增,PCR 反应总体积为 20 μL:Premix Taq 10 μL、上下游引物各 1 μL、菌液 1 μL、ddH2O 7 μL;反应条件:94 ℃ 预变性 5 min,以 94 ℃ 30 s、55 ℃ 30 s、72 ℃1 min 进行 30 个循环,72 ℃ 延伸 7 min;反应结束后,将PCR产物以10 g/L琼脂糖凝胶电泳进行检测,目的条带大小为 325 bp。
动物致病性试验:将168株鸭疫里默氏杆菌分离株分别接种7~14日龄试验鸭,每株接种10只试验鸭,同时对照组设10只试验鸭,连续观察14 d;接种组腿部肌肉注射鸭疫里默氏杆菌分离株活菌 1×108CFU/mL,每只注射 1 mL,对照组接种生理盐水,每只注射1 mL。隔离饲养,观察致病力,记录试验鸭发病及死亡情况;同时根据试验鸭死亡和发病情况在接种后1~5 d采集3~4只试验鸭的心脏和肝脏,分离鸭疫里默氏杆菌,并进行革兰染色、生化试验和PCR鉴定。
血清型鉴定:取洁净的载玻片分别滴加30 μL参考株阳性血清,再滴加30 μL分离株菌液,充分混匀,观察1~2 min,以出现清晰凝集者判为阳性,否则判为阴性。
1.2.2 最低抑菌浓度的测定 从168株鸭疫里默氏杆菌分离株中选择48株作为代表性菌株,进行最低抑菌浓度 (Minimum inhibitory concentration,MIC)测定。代表性菌株选择依据:所选菌株均来自不同的规模化鸭场,每个鸭场养殖时间均在5年以上,每批肉鸭养殖规模均在20 000只以上,从韶关、河源、清远、佛山、茂名、惠州、汕头、湛江的规模化鸭场随机各选5株,从云浮和肇庆的规模化鸭场随机各选4株,总计48株。
抗菌药物贮存液的制备:将药物制成2 560 mg/L的原液,抗菌药物贮存液按照梯度稀释。
抗菌药物浓度范围:根据抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况除外。
接种物的制备:采用直接菌落悬液配制法,将培养18~24 h的鸭疫里默氏杆菌菌落调配成0.5麦氏比浊标准的悬液,再以TSB培养基按体积比1∶100稀释后备用;在15 min内接种完配制好的接种物,并取1份接种物在TSA平板上培养,以检查接种物的纯度。
抗菌药物稀释及菌液接种:以改良的试管两倍稀释法[4]测定鸭疫里默氏杆菌分离株的MIC,取14支灭菌试管为一排,除第1管加入1.6 mL TSB培养基外,其余每支试管均加入1 mL TSB培养基,于第1管中添加0.4 mL待测药物原液并混匀,吸取1 mL加入第2管,混匀后再吸取1 mL至第3管,如此连续倍比稀释至第12管,混匀后吸取1 mL弃掉,第13管为不加药物的阳性对照,第14管为不加药物和菌液、只加生理盐水的阴性对照;向第1~13管中各加入1 mL稀释菌液,此时第1~12 管药物终质量浓度分别为 256、128、64、32、16、8、4、2、1、0.5、0.25、0.125 mg/L。
培养:将接种后的试管置于37 ℃温箱中培养22~24 h。
结果判断:在阳性对照和阴性对照成立且质控菌株的MIC处于质控范围的情况下,肉眼可见澄清的最低药物浓度管即为测试菌株的MIC。
药物敏感性判定:根据标准[4-5]判断药物耐药、敏感和中介。
1.2.3 全基因组序列特征分析与核心基因组进化树的构建 基因组DNA文库的构建与序列测定:使用天根细菌基因组DNA提取试剂盒,按照操作说明,提取鸭疫里默氏杆菌分离株的基因组DNA;通过浓度测定和琼脂糖凝胶电泳,初步质检合格后,构建Illumina(250 bp)文库,利用Illumina Novaseq 6000 平台进行测序,下机数据经质控和去除接头后运用SPAdes v3.6.2对原始数据进行拼接[6],拼接后的数据使用Quast软件进行质控[7]。
序列特征分析。耐药基因分析:将拼接好的测序结果上传至CGE的ResFinder4.1数据库[8]以分析菌株所携带的耐药基因(ARGs)(https://cge.cbs.dtu.dk/services/ResFinder/);ST分型:将拼接好的测序结果上传至多位点序列分型(Multi-locus sequence typing,MLST)数据库以分析菌株所属的ST型(https://cge.cbs.dtu.dk/services/MLST/)。
构建核心基因组进化树:从NCBI Genome下载数据库中全部共计59株鸭疫里默氏杆菌的全基因组序列,以标准菌株ATCC 11845(NCBI登录号:GCA_000252855.1)作为参考菌株,利用Parsnp软件比对全基因组序列并构建核心基因组进化树[9],使用hierBAPS软件进行进化树分簇[10],再利用FigTree v1.4.2和iTOL v4软件进行美化注释[11]。
2 结果与分析
2.1 鸭疫里默氏杆菌分离与鉴定
分离株在TSA平板上长成光滑、湿润、半透明的奶油状菌落,在麦康凯平板上不生长;革兰染色呈阴性的单个或成双排列的短小杆菌;生化试验显示分离株均不发酵蔗糖、乳糖、木糖、葡萄糖、果糖、甘露糖、甘露醇、山梨醇,不产生硫化氢,不利用柠檬酸盐,甲基红试验、靛基质试验、硝酸盐还原试验阴性,氧化酶、过氧化物酶试验阳性;通过特异性PCR扩增,分离株均可扩增到约300 bp的条带,与目的条带大小一致(图1)。

图1 鸭疫里默氏杆菌分离株PCR鉴定结果Fig.1 PCR identification results of Riemerella anatipestifer isolates
2.2 动物回归试验
所有鸭疫里默氏杆菌分离株对试验鸭均有不同程度的致病力,发病率达100%,致死率介于70%~100%,其中70.24%(118/168)的分离株的毒力较强,在接种后48 h内试验鸭全部死亡,剖检未见典型的鸭疫里默氏杆菌病病理变化,其余分离株接种试验鸭后病程较长,剖检可见典型的鸭疫里默氏杆菌病病理变化。所有试验鸭接种分离株后均表现鸭疫里默氏杆菌病临床症状,主要表现精神沉郁,采食、饮水减少或废绝,排绿色或黄绿色粪便,共济失调,头颈震颤,角弓反张及转圈运动等,严重者导致死亡。从接种鸭疫里默氏杆菌分离株试验鸭的肝脏或心脏中均可分离到接种菌,革兰染色均为阴性的短小杆菌,生化试验结果符合鸭疫里默氏杆菌特性,PCR鉴定结果与分离株初次分离鉴定结果一致。因此,根据细菌分离鉴定结果和动物回归试验结果确定从广东地区的鸭场共分离到168株鸭疫里默氏杆菌菌株。
2.3 血清型鉴定
鸭疫里默氏杆菌分离株血清型鉴定结果见表2,血清 1、2、3、5、6、7、8、10 型和未定型均有流行,其中高达54.17%(91/168)的分离株为1型,其次为2型,占27.97%(47/168)。因此,广东地区鸭疫里默氏杆菌分离株以1型为优势血清型。

表2 各地区各血清型鸭疫里默氏杆菌分离株数量Table 2 Isolate number of each serotype for Riemerella anatipestifer isolates from different districts
2.4 药物敏感性试验
药物对鸭疫里默氏杆菌代表性菌株的MIC测定结果及敏感性统计结果见表3。根据MIC分析各药物抑制50%和90%鸭疫里默氏杆菌菌株生长的MIC,即 MIC50和 MIC90,MIC50介于 0.25~>256 mg/L,其中,头孢噻肟最低,仅 0.25 mg/L,阿莫西林为 1 mg/L,氨苄西林、土霉素、盐酸四环素、盐酸金霉素、氧氟沙星均为 8 mg/L,盐酸环丙沙星为 16 mg/L,诺氟沙星、大观霉素、庆大霉素分别为 32、64、128 mg/L,磺胺嘧啶为256 mg/L,卡那霉素、磺胺二甲嘧啶、磺胺对甲氧嘧啶均为>256 mg/L;MIC90值介于 8~>256 mg/L,其中,头孢噻肟最低,仅8 mg/L;土霉素和盐酸金霉素为16 mg/L;盐酸四环素、氧氟沙星、盐酸环丙沙星均为 32 mg/L;诺氟沙星为 64 mg/L;阿莫西林、氨苄西林、大观霉素均为128 mg/L;卡那霉素、庆大霉素、磺胺嘧啶、磺胺二甲嘧啶、磺胺对甲氧嘧啶较高,均为>256 mg/L。

表3 48株鸭疫里默氏杆菌代表性分离株最低抑菌浓度(MIC)测定结果1)Table 3 The minimum inhibitory concentration (MIC) of 48 representative isolates of Riemerella anatipestifer
分析鸭疫里默氏杆菌代表性菌株对受试药物的敏感性,对庆大霉素的耐药率高达91.67%(44/48);对卡那霉素和盐酸环丙沙星的耐药率分别为89.58%(43/48)和81.25%(39/48);对土霉素、盐酸四环素、盐酸金霉素、氧氟沙星、诺氟沙星、磺胺二甲嘧啶、磺胺对甲氧嘧啶的耐药率介于60%~80%;对磺胺嘧啶和氨苄西林的耐药率介于30%~60%;对阿莫西林、头孢噻肟和大观霉素的耐药水平较低(30%以下)。
根据药敏试验结果,分析鸭疫里默氏杆菌代表性菌株的多重耐药性,结果如图2所示。48株鸭疫里默氏杆菌对5~12种药物耐药,其中9耐和10耐的菌株总数最多,占54.17%(26/48),6耐和11耐、7耐与8耐的菌株数相同,分别为4株和5株,而5耐和12耐菌株数最少,各有2株。
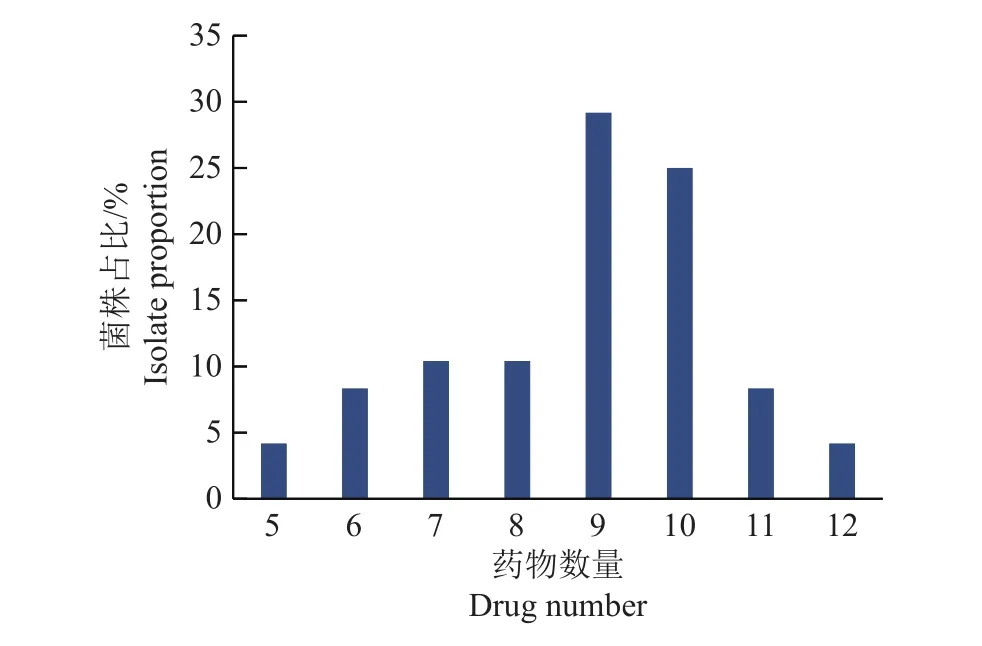
图2 48株鸭疫里默氏杆菌代表性分离株多重耐药性分布Fig.2 Results of multi-drug resistance of 48 Riemerellaanatipestifer representative isolates
统计并分析鸭疫里默氏杆菌分离株的耐药谱,48株鸭疫里默氏杆菌具有44种耐药谱型,其中40株为单一谱型,构成比为2.08%(1/48),其余4种耐药谱型分别为2株所共有,构成比为4.16%(2/48) (表4)。

表4 48株鸭疫里默氏杆菌代表性分离株耐药谱统计结果Table 4 Drug resistance spectrum of 48 representative isolates of Riemerella anatipestifer
2.5 全基因组测序分析
由北京诺禾致源科技股份有限公司对48株鸭疫里默氏杆菌代表性菌株进行全基因组测序,经过Quast软件质检后,其中2株拼接质量不高,故仅有46株进行后续分析。共检出6种耐药基因,其中携带四环素类耐药基因tet(X)的菌株最多,阳性率高达82.60%(38/46);大环内酯类耐药基因erm(F)阳性率为73.91%(34/46),而大环内酯类另一耐药基因ere(D)的阳性率仅有19.57%(9/46);β-内酰胺类耐药基因blaOXA-209的阳性率为 54.35%(25/46);氨基糖苷类耐药基因aadS和氟苯尼考耐药基因floR的阳性率相对较低,分别为34.78%(16/46)和30.43%(14/46)。耐药基因结果见表5。

表5 46株鸭疫里默氏杆菌代表性分离株耐药基因携带情况Table 5 The resistance genes carried by 46 Riemerellaanatipestifer representative isolates
基于获得的46株鸭疫里默氏杆菌全基因组序列,进一步分析其MLST,其中18株ST分型成功,分别为 ST38(4 株)、ST13(2 株)、ST24(2 株)、ST35(2株)、ST44(2株),其他ST型分别为ST2、ST16、ST21、ST34、ST42 和 ST43,均只有 1 株,其余28株为未知ST型;说明本研究测序菌株的ST型呈多样性,未出现优势ST型。
将本研究46株鸭疫里默氏杆菌菌株的全基因组测序结果与数据库中59株鸭疫里默氏杆菌菌株的全基因组数据进行比对,构建核心基因组进化树(图3),数据库59株鸭疫里默氏杆菌菌株中,39株来源于中国,9株来源于英国,2株来源于印度,德国、俄罗斯和美国各有1株,另有6株未标注来源。总计105株鸭疫里默氏杆菌菌株分布在6个分簇群系中,本研究所有测序菌株与数据库中来自中国的菌株相似度较高,且集中分布在3个簇群中,其中Clade 1群系最大,包含67株,我国菌株占50.75%(34/67),其次为 Clade 3 群系,包含 17 株,我国菌株占 47.06%(8/17),Clade 2 群系包含 5 株鸭疫里默氏杆菌,我国菌株数占60.00%(3/5)。数据库中大部分鸭疫里默氏杆菌菌株来自于中国,而欧洲来源的菌株占比较低,并且观察到来自世界各地的鸭疫里默氏杆菌菌株间存在地理分布差异。另外,数据库中我国菌株从1990年到2017年间均有收集,持续时间接近30年,时间跨度较大,但仍能与本研究测序菌株在进化树中聚集在一起,说明在我国鸭疫里默氏杆菌存在区域内长时间持续传播的特点。
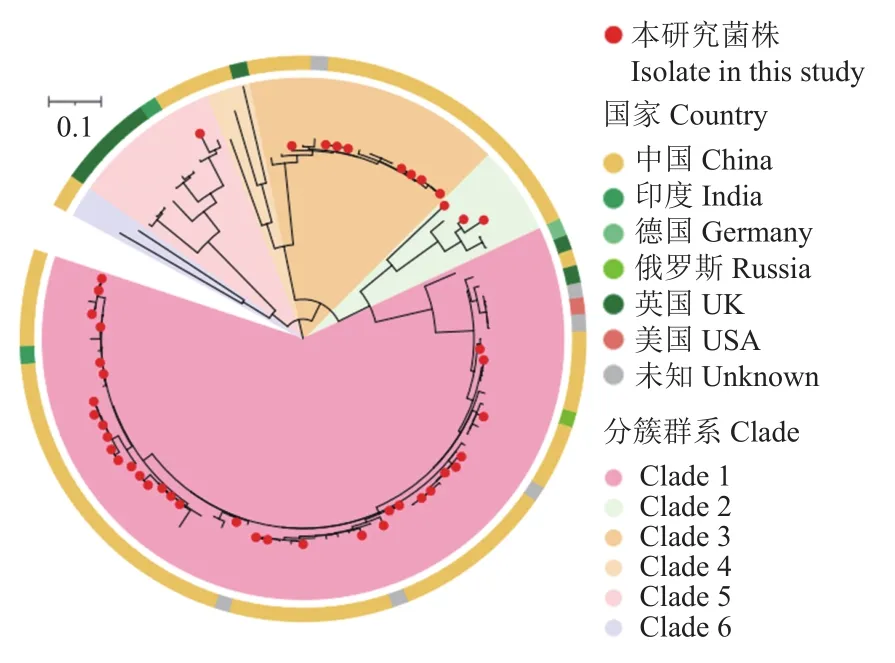
图3 105株鸭疫里默氏杆菌菌株核心基因组系统进化树Fig.3 Phylogenetic tree of core genomes for 105 isolates of Riemerella anatipestifer
3 讨论与结论
3.1 讨论
鸭疫里默氏杆菌病血清型复杂,在世界范围内流行,目前在国内多个地区均有鸭疫里默氏杆菌血清型流行情况的报道,广西百色分离株血清型比较单一,全部为1型[12];山东分离株至少存在1、2、6、10和11型5种血清型,其中以1型和2型为优势血清型[13-14];超过半数的江苏分离株为1型[15];安徽分离株则多达7种血清型,但以1型和2型发生最广泛[16];河南分离株以1型和2型多发,此外还流行 10 型和未定型[17];血清 1、2、3、4、8、10、15 型在广东地区均有流行,以1型最多发[18-20]。与国内情况类似,国外也流行多种血清型,美国以1型为主,此外还流行 1、2、5、11、13、15、19、21 型[21];1型和2型为英国多发血清型,同时5、9、13和15 型也有流行[22];泰国主要流行 1、5、6、7、10 和21型[23];新加坡以1、5和10型这3种血清型为主[24];1型和3型为丹麦的优势血清型[25];韩国只有1、4和7型这3种血清型[26];澳大利亚则流行1、6、8、9、13和14型[27]。本研究高达54.17%的分离株为血清1型,也是优势血清型。分析国内外鸭疫里默氏杆菌血清型流行情况发现多血清型流行已呈基本态势,其中1型为最普遍发生的血清型,也是重点防控的血清型。
在养殖过程中,由于长期应用抗菌药物治疗鸭疫里默氏杆菌病,导致广泛而严重的耐药性。调查显示山东分离株对氨基糖苷类药物高度耐药,并且具有多重耐药性[28];安徽分离株对恩诺沙星、新霉素、安普霉素表现不同程度的耐药性[29];贵州分离株则对氨基糖苷类和大环内酯类等药物表现高度耐药,多重耐药高达17耐[30];同样,广东地区分离株耐药状况也比较严峻,朱元军等[31]报道分离株对丁胺卡那、卡那霉素、庆大霉素和链霉素高度耐药,多数分离株表现七重以上耐药。另外,耐药性还具有随药物使用时间延长进一步加剧的现象,从同一地区采集的分离株对红霉素和多黏菌素B的耐药率呈逐年升高的趋势[32-33]。本研究采样养殖场经常采用庆大霉素、卡那霉素、磺胺嘧啶、头孢类药物、喹诺酮类药物、环丙沙星、恩诺沙星、四环素、土霉素、多黏菌素B、林可霉素等药物进行治疗,从养殖场样本中分离的鸭疫里默氏杆菌对头孢噻肟、阿莫西林、大观霉素的耐药率低于30%,对土霉素、盐酸四环素、盐酸金霉素、庆大霉素、卡那霉素等药物均表现高度耐药。因此,总体上养殖场用药与耐药表型具有一定的对应性,在临床选择药物时,最好先进行药敏试验,选用抗菌效果较好的药物,同时也要结合本养殖场的用药史合理用药。
通过分析本研究测序菌株耐药表型与耐药基因的相关性,发现携带tet(X)基因的菌株对四环素类药物全部表现耐药,因此,tet(X)基因是介导四环素耐药的最重要基因[34];氨基糖苷类耐药率高于耐药基因aadS的携带率,说明除耐药基因外还存在其他因素导致氨基糖苷类耐药,这一结果与蔡秀磊[35]研究结论一致,即氨基糖苷类耐药还与基因盒-整合子系统有关;blaOXA-209的阳性率与耐药率基本一致。由于本研究未对大环内酯类和氟苯尼考进行药物敏感性测试,因此,尚不清楚这2类药物耐药基因携带率与耐药表型的相关性。总体上,耐药表型与耐药基因具有一定的相关性,但是也要明确鸭疫里默氏杆菌分离株产生耐药性的原因比较复杂,除与耐药基因有关外,还与环境、药物等诸多因素有关。
通过系统进化树发现,来自世界各地的鸭疫里默氏杆菌菌株间存在地理分布差异,本研究的测序菌株主要分布在Clade 1簇群,且血清型全部为1型,由于数据库中其他菌株没有相关血清型信息,因此,具体血清型不明确,但可以推测,该簇群的分离株与血清1型密切相关。
鉴于本研究鸭疫里默氏杆菌血清型复杂及耐药性严重的现状,应首先针对当地或本养殖场主要流行的血清型选取相应的灭活疫苗进行免疫,当出现疫苗株以外的血清型感染时,则以当地或本养殖场的分离株制备灭活疫苗,同时选择敏感药物并合理用药辅助治疗,可以达到更有效的防治效果。
3.2 结论
本研究在对广东地区鸭疫里默氏杆菌分离株的血清型和耐药性初步了解的基础上,又结合全基因组测序数据对耐药基因、ST分型、遗传进化树做进一步分析,发现分离株的优势血清型为1型,耐药性严重,所携带的耐药基因与耐药表型具有一定的相关性,ST型呈多样性,与MLST 数据库中来自我国的菌株遗传背景相近,研究结果为鸭疫里默氏杆菌病疫苗免疫预防与药物治疗及掌握鸭疫里默氏杆菌遗传进化特征提供了依据。
