72个酿酒葡萄品种MYB调控基因的基因型和单倍型鉴定
2022-01-27肖鑫傅伟红葛孟清李腾任艳华马小河刘崇怀贾海锋房经贵
肖鑫,傅伟红,葛孟清,李腾,任艳华,马小河,刘崇怀,贾海锋,2*,房经贵
(1.南京农业大学园艺学院,江苏 南京210095;2. 中国葡萄酒产业技术研究院,宁夏 银川750000;3.山西省农业科学院,山西 晋中030600;4.中国农业科学院郑州果树研究所,河南 郑州450000)
色泽是葡萄果实外观品质的重要组成部分,对于酿酒葡萄(Vinifera)而言色泽会影响其加工用途与加工的质量。花色苷在果皮中积累的数量和其构造的差异决定了果皮的颜色[1-3]。花色苷生物合成中最重要的转录因子之一是MYB转录因子[4]。位于第2染色体上的2个相邻且非常相似的转录因子基因VvmybA1和VvmybA2可以诱导VvUFGT的转录,并参与葡萄果实着色所需的花色苷合成途径[5]。VvmybA1a、VvmybA1b、VvmybA1c、VvmybA1SUB、VlmybA1-3、VvmybA1BEN是MYBA1基因位点的主要基因型[6]。不着色葡萄表型通常是由于VvmybA1的表达在VvmybA1a等位基因中被阻断造成的,该等位基因包含一个逆转座子Gret1,而Gret1位于VvmybA1编码序列的上游,诱导VvUFGT突变无法正常表达,导致色素沉着能力丧失[7-9]。VvmybA1b和VvmybA1c都能调控UFGT合成花色苷,不同的是在VvmybA1b等位基因中,靠近VvmybA1编码序列的5′端有一个长度约5 bp的Gret1的LTR(solo LTR)拷贝并被表达,而VvmybA1c则完全缺乏Gret1,可能是Gret1插入之前VvmybA1的原始序列[10-11]。
VvmybA2与VvmybA1在染色体上位置相邻,在一个杂交后代中形成了一个用浆果颜色隔离的位点。在VvmybA2的白色果实中等位基因VvmybA2w的编码区存在2个SNP位点(CGA突变成CTA以及CA的缺失),一个导致氨基酸取代,另一个导致一种更小的蛋白质的框架移位。瞬时试验分析表明,这2种突变都使该调控系统失去了启动花青素生物合成的能力[4]。此外,在欧美杂交种的少数品种中例如‘巨峰’MYBA2位点还有VlmybA2和VlmybA1-2两个具有调控果实着色功能的等位基因,并且它们的克隆数存在较大差异[11-12]。
单倍型(haplotypes)可以定义为连锁阶段常见等位基因的组合,通常位于相邻位点(即从单亲遗传的等位基因)[8]。在具有自交系统的植物物种中,单倍型可以直接从基因型确定,而杂合子则需要在标记之间进行相位检测[13]。将具有着色功能的等位基因单倍型命名为C(HapC),将非着色功能等位基因命名为单倍型A(HapA)[14]。HapC可分为2个单倍群:N(HapC-N)和Rs(HapC-Rs)。HapC-N含有功能等位基因VvmybA1c和VvmybA2r,HapC-Rs含有功能等位基因VvmybA1c和非功能等位基因VvmybA2w[15]。此外,还有HapG(VvmybA1a和VvmybA2r)和HapH(VvmybA1b和VvmybA2r)等单倍群[14-15]。欧美杂交种葡萄中有4个与MYB相关的功能基因,分别为VlmybA1-1、VlmybA1-2、V1mybA1-3和VlmybA2[12]。VlmybA1-2和VlmybA1-3被命名为单倍型E1(HapE1),VlmybA2和VlmybA1-3被命名为单倍型E2(HapE2)。研究发现,欧美杂交种葡萄的大多数果实颜色遗传基因位点由HapE1和HapA单倍型组成,而具有2种功能单倍型的葡萄幼果果实花色苷含量高于仅具有单一功能单倍型的葡萄幼果果实[14]。但酿酒葡萄的单倍型组成与果皮着色之间关系的相关研究尚未见报道。因此,本研究分析了72个酿酒葡萄品种的着色情况,包括国内自育品种和国外引进的多个优良品种,对我国目前大量栽培的优质酿酒葡萄品种的单倍型和色泽进行系统的调查和鉴定,对优质酿酒葡萄品种的选育进行探索,为确立酿酒葡萄育种目标提供科学有效的依据和指导,并建立高效的品质性状特别是颜色性状育种体系。
1 材料与方法
1.1 材料
供试材料为72个酿酒葡萄品种,其中65个品种由中国农业科学院郑州果树研究所葡萄种质资源圃提供,7个品种由山西省农业科学院果树研究所提供。72个品种包括48个欧亚种、19个欧美杂交种以及5个欧山杂交种。采集各品种的新梢嫩叶用蒸馏水清洗干净后吸干多余水分,液氮速冻后储存于-80 ℃冰箱中。酿酒葡萄品种的编号、名称及颜色见表1,田间果穗外观见图1。
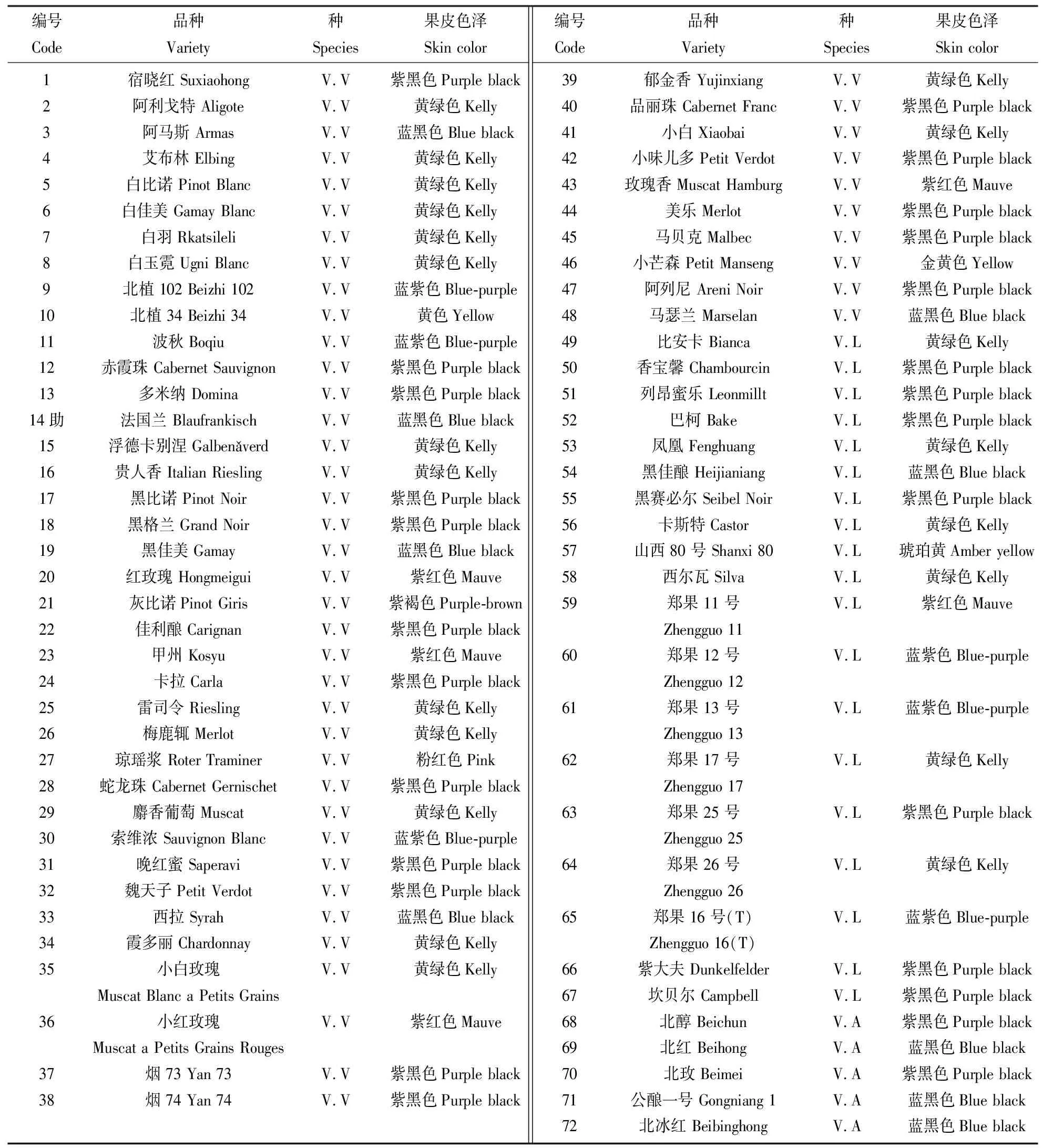
表1 供试酿酒葡萄品种及相关属性Table 1 Test wine grape varieties and related attributes

图1 72个酿酒葡萄品种的田间果穗色泽图Fig.1 Fruit color chart of 72 wine grape varieties1~72同表1。1-72 are the same as Table 1. 下同。The same as follows.
1.2 DNA提取
将酿酒葡萄叶片从-80 ℃取出,迅速研磨成粉末,采用改良版CTAB法[16]提取DNA。用12 g·L-1琼脂糖凝胶电泳检测DNA质量。用核酸蛋白测定仪检测浓度,将DNA稀释,使最终浓度为30 ng·μL-1,于-20 ℃冰箱保存备用。
1.3 PCR引物合成及反应体系
引物设计参考纠松涛[17]的方法。所需引物和测序工作由通用生物系统(安徽)有限公司负责完成。引物序列见表2。

表2 PCR扩增所用引物序列Table 2 Primer sequences used for PCR amplification
PCR反应体系25 μL:2×Hieff®PCR Master Mix(With Dye)12.5 μL,ddH2O 9.5 μL,上、下游引物各 1.0 μL,DNA 1.0 μL。3次重复。
1.4 大肠杆菌及载体选择
本试验中使用大肠杆菌(Escherichiacoli)DH5α(北京全式金)菌株,克隆载体为pMD 19-T(TaKaRa生物工程(大连)有限公司)。
1.5 回收片段的连接转化
PCR扩增按照DNA凝胶回收试剂盒(AXYGENA)说明书进行。连接反应按照pMD 19-T载体试剂盒说明书进行操作。连接反应体系(10 μL):回收片段 4.5 μL,Solution I 5.0 μL,pMD 19-T 0.5 μL,16 ℃反应过夜。
连接与转化:将10 μL连接反应体系加入至30 μL DH5α感受态细胞中,冰上放置30 min。42 ℃热激90 s后,再在冰中放置1~2 min。加入890 μL LB培养基,37 ℃振荡培养60 min。在含有Amp的LB琼脂平板培养基上培养12~15 h,形成单菌落。
每组产物挑取12个单菌落,利用LB液体培养基活化摇菌8 h后进行菌液PCR检测,并将菌液送通用生物系统(安徽)有限公司进行测序,每个菌液样品测序3次。测序后的序列使用BioXM软件去除载体部分,并根据序列的荧光吸收峰图信息进行碱基正确性的检查。利用NCBI(http://www.ncbi.nlm.nih.gov)上的BLAST和DNAMAN 6.0软件进行比对分析。
2 结果与分析
2.1 不同酿酒葡萄品种2个MYB基因位点基因型的鉴定
2.1.1 酿酒葡萄叶片DNA提取质量检验72份酿酒葡萄DNA的琼脂糖电泳胶图如图2所示。为保证72个葡萄品种MYBA1和MYBA2两个基因位点等位基因扩增结果的准确性和真实性,利用看家基因KyActin1对稀释后的DNA样品进行扩增和优化。由图3可见:72个酿酒葡萄品种的DNA都能成功扩增出相应的KyActin1基因的序列片段,并能显示出清楚、单一的琼脂糖电泳条带,表明选取的DNA样品的浓度及纯度符合PCR的要求。

图2 72个酿酒葡萄品种DNA的琼脂糖电泳胶图Fig.2 DNA agarose gel electrophoresis maps of 72 wine grape varieties
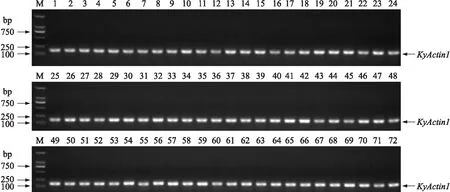
图3 72个酿酒葡萄品种内参基因KyActin1扩增条带Fig.3 Amplified bands of internal reference gene KyActin1 from 72 wine grape varietiesM. DNA Marker(2 000 bp). 下同。The same as follows.
2.1.2VvmybA1a和VvmybA1BEN鉴定结果如图4所示:在56个酿酒葡萄品种中能检测到VvmybA1a,这其中有42个品种为欧亚种,12个为欧美杂交种,2个为欧山杂交种。由于上游引物F1位于在逆转座子Gret1区域,下游引物R1位于VvmybA1保守区,所以其余16个品种中未检测到VvmybA1a说明这16个葡萄品种中VvmybA1基因的启动子区域无逆转录转座子(Gret1)的插入。同时72个葡萄品种中均未检测到长度大于2 000 bp的条带,说明均不存在VvmybA1BEN。
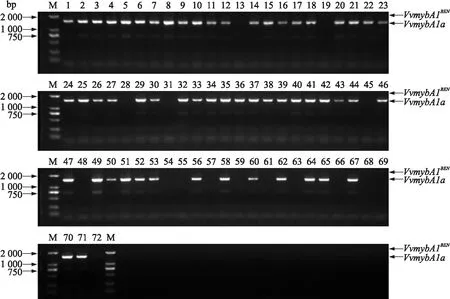
图4 72个酿酒葡萄品种中VvmybA1a和VvmybA1BEN 扩增条带Fig.4 Amplified bands of VvmybA1a and VvmybA1BEN in 72 wine grape varieties
2.1.3VvmybA1b、VvmybA1c、VvmybA1SUB和VlmybA1-3鉴定结果由图5可见:在所有的供试样品内,仅在‘小红玫瑰’(36)1个品种中检测到VvmybA1b。检测到长度约为1 000 bp条带的有14个品种。由于VvmybA1SUB和VlmybA1-3的PCR扩增条带长度分别为1 035 bp和999 bp,无法通过电泳区分VvmybA1SUB和VlmybA1-3这2个等位基因,所以需经胶回收步骤后,将1 000 bp左右的条带连接pMD19-T 载体,转化大肠杆菌感受态细胞后,对活化单菌落进行测序。测序结果显示‘甲州’(23)、‘梅鹿辄’(26)、‘晚红蜜’(31)这3个品种1 000 bp左右的条带为VvmybA1SUB。
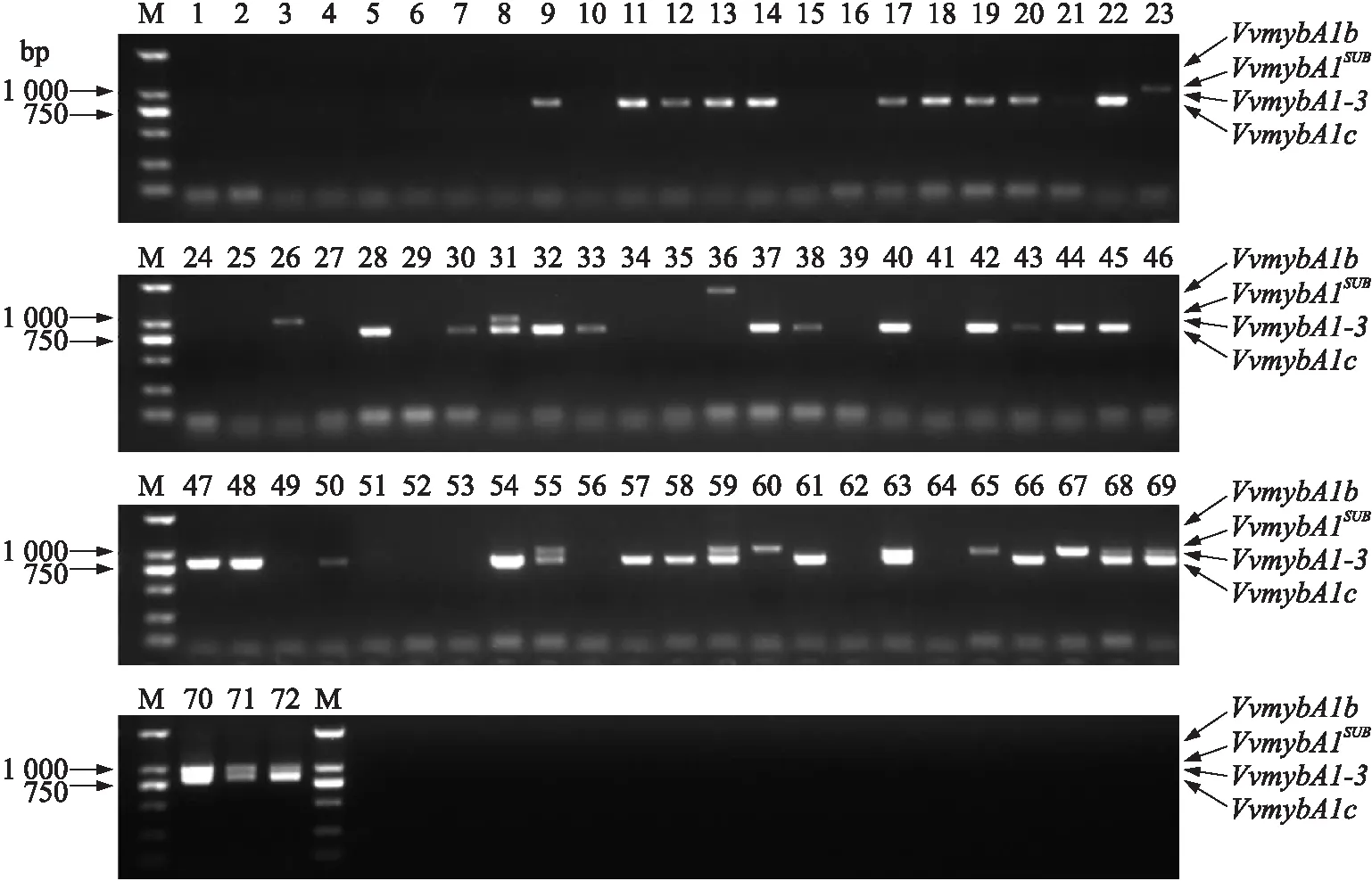
图5 72个酿酒葡萄品种中VvmybA1b、VvmybA1c、VvmybA1SUB和VlmybA1-3扩增条带Fig.5 Amplified bands of VvmybA1b,VvmybA1c,VvmybA1SUB and VlmybA1-3 in 72 wine grape varieties
2.1.4VlmybA1-2的鉴定结果如图6所示:在72个酿酒葡萄品种中,有6个品种中检测到大小为 250 bp 左右的条带,由此可直接将包含VlmybA1-2基因的品种鉴定出来。这6个品种均为欧美杂交种,这与Kobayashi等[7,12]研究结果一致。

图6 72个酿酒葡萄品种中VlmybA1-2扩增条带Fig.6 Amplified bands of VlmybA1-2 in 72 wine grape varieties
2.1.5VlmybA2的鉴定结果如图7所示:在所有的供试样品中,仅有3个葡萄品种中检测到VlmybA2,获得的 PCR 扩增条带大小是 150 bp 左右。‘列昂蜜乐’(51)、‘巴柯’(52)、‘郑果16号(T)’(65)这3个葡萄品种均来自欧美杂交种,这也与Kobayashi等[7,12]研究结果一致。

图7 72个酿酒葡萄品种中VlmybA2扩增条带Fig.7 Amplified bands of VlmybA2 in 72 wine grape varieties
2.1.6VvmybA2w和VvmybA2r的鉴定结果由于MYBA2基因位点2个等位基因VvmybA2w和VvmybA2r的编码区有2个SNP位点(CGA突变成CTA,CA的缺失),所以不能根据特异性引物序列直接区别,需要在紫外灯照射条件下将含有目的片段的琼脂糖凝胶切下后连接pMD19-T 载体,转化大肠杆菌感受态细胞后,对活化单菌落进行测序。结果(图8)显示,除了‘北醇’(68)和‘北红’(69)外,其余70个品种中都检测到了VvmybA2r或VvmybA2w,其中29份含有VvmybA2r,58份含有VvmybA2w,二者都含的有20个品种。
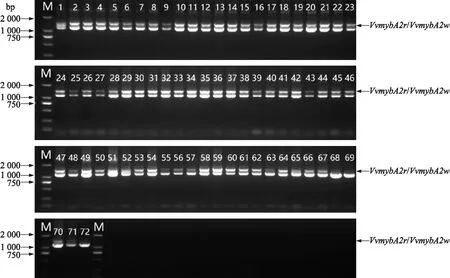
图8 72个酿酒葡萄品种中VvmybA2w和VvmybA2r扩增条带Fig.8 Amplified bands of VvmybA2w and VvmybA2r in 72 wine grape varieties
2.2 72个酿酒葡萄品种中2个MYB基因位点的单倍型分析
葡萄果皮着色的MYB基因位点的10种单倍型形式是由6个MYBA1基因位点的等位基因(VvmybA1a、VvmybA1BEN、VvmybA1b、VvmybA1c、VvmybA1SUB、VlmybA1-3)与4个MYBA2基因位点的等位基因(VvmybA2w、VvmybA2r、VlmybA2、VlmybA1-2)构成[18]。由表3可知:本试验中有A、B、C-Rs、E1、E2、F、C-N、G这8种单倍型,共组成了16种单倍型组合类型:A、G、AB、AC-N、AC-NE1、AC-Rs、AE1、AE1E2、AF、C-N、C-NE1、C-Rs、CE1、C-RsF、C-RsE1、GF。进一步分析可知,23个不着色品种有2种单倍型:A(22个品种)和AF(1个品种);49个着色品种中单倍型最多的为AC-N,有15个品种,其次为C-N,有8个品种,而单倍体组成类型为AB、AE1E2、C-NE1、C-RsF和GF的各只有1个品种。

表3 不同种群酿酒葡萄的单倍型组合分布Table 3 Distribution of haplotype combinations of different populations of wine grapes
由表3可以看出:在48个欧亚种酿酒葡萄品种中,共有10种单倍型组合,包括16个单倍型为A和14个单倍型组合为AC-N的品种,分别占全部欧亚种葡萄的33.33%和29.17%。31个欧亚种着色的葡萄中有14个单倍型组合为AC-N的品种,表明欧亚种着色葡萄品种大部分单倍型组合为AC-N。此外,19个欧美杂交种酿酒葡萄的单倍体组合共有7种,其中有6个单倍型为A的品种和4个单倍型为AE1的品种,占欧美杂交种葡萄总数的31.58%和21.05%。在13个欧美杂交种中,AE1、C-N和C-RsE1这3种单倍型组合占欧美杂交种着色葡萄总数的52.63%,而AC-N、C-Rs和AE1E2这3种组合各仅有1个。
2.3 酿酒葡萄MYB着色基因的基因型与果皮着色的关系
在72个酿酒葡萄品种中,有56个品种中能检测到VvmybA1a,表明VvmybA1a广泛存在于鉴定的葡萄种质材料中,也说明在葡萄进化以及人为选择过程中VvmybA1a被很好地保存下来;在前人的研究中仅在‘红高’葡萄中检测到VvmybA1BEN基因的存在,这是由于VvmybA1a和VvmybA3发生同源重组产生了新的具有着色调控功能基因[19],而在本试验的72个品种中均未检测到VvmybA1BEN基因的存在,因此可以判断该基因在酿酒葡萄中不常见。
在72个酿酒葡萄品种中有39个品种检测到VvmybA1c,其中欧亚种最多,为25个,欧美杂交种有 9个,欧山杂交种有5个。进一步观察比较图4和图5可发现,‘多米纳’(13)‘黑佳美(19)’‘蛇龙珠’(28)等16个品种无VvmybA1a与VvmybA1b相对应的PCR 扩增产物,仅检测到VvmybA1c的 PCR 扩增片段,由此可以得出以上16个品种MYBA1基因位点组合类型是VvmybA1c的纯合体。并且在田间调查时,可以看到这16个品种成熟果皮颜色都是蓝紫色或紫黑色,着色均较深,颜色深度超过大部分该位点为VvmybA1a与VvmybA1b或VvmybA1a与VvmybA1c杂合状态的品种。
VlmybA1-2、VlmybA2和VlmybA1-3这3个基因在欧亚种中都不存在,在部分欧美杂交种中存在,而VlmybA1-3这一基因存在于全部5份欧山杂交种中,推测这5份欧山杂交种的父母本有其一或者都与欧美杂交种存在血缘关系。
本研究还发现有1份种质材料的单倍型与果皮颜色组成之间没有较大的规律性,‘山西80号’具有VvmybA1c这一可以调控果皮颜色的基因,并且其果皮颜色应为琥珀黄,但在田间调查时其果实颜色却为紫黑色,说明环境条件可以对葡萄的着色情况造成影响。
2.4 酿酒葡萄MYB着色基因的单倍体组成类型与果皮着色的关系
经过对葡萄单倍型与果皮着色之间的分析能够得出,含有HapC-N这一单倍型葡萄的果皮大多数为紫黑色或蓝紫色,是着色品种的单倍体组成类型中含有的最多的组合,有26个品种(包括19个欧亚种、4个欧美杂交种和3个欧山杂交种),说明其在欧亚种群着色葡萄品种中存在普遍。另外,单倍型数量的多少与果皮颜色深浅没有直接关系,仅有一个单倍型的品种,如‘卡拉’(24)的果皮颜色为紫黑色,而含有2个以上单倍型的品种,如‘红玫瑰’(20)的果皮颜色为紫红色,但酿酒葡萄品种总体上呈现出含有的着色功能基因越多则果皮颜色越深的规律,这与前人的研究一致[20]。欧亚种着色葡萄品种中数量最多的单倍型组合为AC-N,欧美杂交种着色葡萄品种中数量较多的单倍型组合为AE1。大多数欧亚种着色葡萄的单倍型组合为AC-N,而欧美杂交种葡萄中的AC-N、C-Rs和AE1E2的单倍型组合数量相当。在所有鉴定的酿酒葡萄品种中,其中有1个品种的基因型与单倍型和果实色泽不切合。‘山西80号’的品种颜色属于白色,C-Rs构成其单倍型,含有调整着色功能基因VvmybA1c,但是果实却不着色,表明环境影响可能造成了基因修饰等现象,导致‘山西80号’葡萄着色出现异常。
3 讨论
使葡萄果皮着色的主要成分是花色苷,花色苷在果皮中的比例以及累积水平的不同使葡萄果皮呈现出红色、紫色或黑色[21-22]。研究发现,不同葡萄品种的果实着色与否主要取决于2号染色体上2个相邻的控制着色的MYB基因位点的基因型及其组成的单倍型[4,7,23-24]。葡萄2号染色体上2个相邻的转录因子VvmybA1和VvmybA2,能够诱导葡萄类黄酮子3-O-葡萄糖基转移酶基因(UFGT)的转录,参与花色苷合成途径,通过调节UFGT的表达从而调控花色苷的生物合成[4-5,7]。由于葡萄果皮着色性状是遗传性状,虽然栽培技术、环境条件及激素等因素对葡萄果皮的着色情况有一定程度的影响[25],但花色苷生物合成相关的结构基因与调节基因共同决定了葡萄是否着色、色泽种类以及着色深浅等。其中,MYB转录因子作为花色苷合成途径重要的调节基因,通过调节(促进或抑制)花色苷合成相关酶的基因表达,来控制其生物合成进而影响果实着色。
研究表明,VvmybA1a、VvmybA1b、VvmybA1c、VvmybA1SUB、VlmybA1-3、VvmybA1BEN是MYBA1位点的基因型[6],不着色即白色葡萄表型是与VvmybA1位点启动子上的一个逆转座因子Gret1的纯合存在有关[19],因为VvmybA1a是伴随葡萄进化中VvmybA1编码序列的上游启动子区域插入一个逆转座子Gret1(retrotransposon 1)导致基因表达受阻,使得葡萄果皮不能合成花色苷,因而VvmybA1a是没有功能的[1,19,24]。VvmybA1BEN等位基因是由VvmybA1a和VvmybA3的同源重组产生的,它的出现可调控果实的着色恢复,改变果实花青素的含量及成分。已有研究证实‘红高’和‘黑玫瑰’葡萄中可检测到VvmybA1BEN基因的存在[19]。本研究中VvmybA1SUB同时出现在了白色和有色品种中,因此推测VvmybA1SUB可能没有参与调控花色苷合成,该结果也验证了前人在起源欧亚种东方品种群的研究内容,包括‘无核白’‘甲州’‘龙眼’和‘牛奶’4个品种[14,22]。VvmybA1b基因仅在‘小红玫瑰’1个品种中检测到,表明VvmybA1b基因型在MYBA1基因位点中不太常见,同时,‘小红玫瑰’葡萄的果实颜色为紫红色,这与前人研究[7]发现具有VvmybA1b基因的‘奥山红宝石’(鲜红色)、‘安芸皇后’(粉红色)、‘红罗莎里奥’(鲜红色)、‘范讷萨无核’(紫红色)等葡萄的果皮着色情况不完全一致,可能是含有该基因的葡萄品种在着色过程中对环境的响应不同造成的,也可能是由于品种不同,对与花色苷合成相关的基因表达存在差异。
MYBA2位点主要有VlmybA1-2、VlmybA2、VvmybA2w和VvmybA2r这4种基因型,其中VlmybA1-2和VlmybA2已被证实只在欧美杂交种葡萄中出现[7,12],本研究的试验结果也证实了这一点。VvmybA2w和VvmybA2r在所有种群中都存在,不同的是VvmybA2w由于编码区存在SNP位点,使该基因失去调控果实着色能力,而VvmybA2r通过形成VvmybA2r-VvMYCA1-VvWDR1复合产物,正调控花青素的合成,且VvWDR1通过与VvmybA2r-Vvmyca1复合物的相互作用,促进花青素的积累,调控果实着色[20]。
本研究中的72个酿酒葡萄品种中98.7%的葡萄种质的基因型和单倍型组成与其果实着色情况相吻合,其中葡萄果皮颜色多为红色或是紫红色的单倍型构成中主要出现 HapB 或者 HapC-Rs,而含有 HapE1、HapE2 或 HapC-N 的葡萄果皮颜色趋于黑色。此外,欧亚种着色葡萄品种中数量最多的单倍型组成类型是AC-N,而欧美杂交种着色葡萄品种中单倍型组成类型数量较多是AE1,与前人的研究基本吻合[20]。另外,在5个欧山杂交种品种中,CE1与AC-NE1均为2个,C-NE1为1个,说明CE1为欧山杂交种中主要的单倍型组成类型。但单倍型数量以及组合与有色品种果皮颜色的关系仍需进一步深入研究。
