基于碳氮稳定同位素技术的小清河口邻近海域底栖食物网结构研究
2022-01-22张传鑫陈静纪莹璐陈琳琳李海汇王全超李宝泉邢荣莲
张传鑫,陈静,纪莹璐,陈琳琳,李海汇,王全超,李宝泉*,邢荣莲
( 1. 烟台大学 生命科学学院,山东 烟台 264005;2. 中国科学院烟台海岸带研究所,山东 烟台 264003;3. 国家海洋局北海预报中心,山东 青岛 266061;4. 寿光市海洋渔业发展中心,山东 寿光 262700)
1 引言
随着沿海城市和农业的发展,河口生态系统进一步受到人类活动的干扰,是最易受到威胁和发生变化的水生生态系统之一[1]。小清河是流入莱州湾的主要河流,河口呈喇叭状,滩面平缓,粉砂底质等水文地貌特征使水力停留时间较长[2],且随着工业的发展,大量工业废水和生活污水的排放,影响到小清河口及邻近海域的生态环境质量[3]以及渔业资源的健康发展,并可能进一步影响到水生生物群落的食物网结构。
食物网是实现生态系统功能的主要渠道,也是保护生物多样性的重要途径,在生态系统的管理和保护方面起到了重要作用[4]。探究河口生态系统中生物的食源特征和营养关系,建立该区域基础食物网,则能更好地了解河口复杂生态系统的物质循环和能量流动过程、生物群落组成结构以及物种之间的取食关系[5]。食物网的传统研究方法是胃含物分析法,通过分析捕食者胃含物的种类组成、数量和重量等,确定食物网的基本结构与营养关系,该方法直观,但带有偶然性,可反映生物短时间内的食性[6-7];而稳定同位素示踪技术则可准确定量较长时期的摄食情况,较真实地反映食物网中生物的营养等级和能量流动,是目前研究生态系统有机物来源和食物网结构的重要研究手段[1,5,8-9]。
碳稳定同位素比值,主要用于确定消费者食物的组成与来源[10];而氮稳定同位素比值随着营养级升高具有明显富集,通常用来研究食物网的结构与营养级[11],将碳、氮稳定同位素结合使用可以更有效地揭示有机质的来源、消费者的食物组成以及各生物在食物网中所处的营养级。当同位素数量为n,而食源数量大于n+1时,生物之间的营养关系无法采用标准线性混合模型进行计算[12-13],而利用贝叶斯混合模型(Mix-SIAR)可以计算多种来源的食物对目标生物的贡献比例,且能提高贡献比例的估算准确度[14]。
以往关于小清河口及邻近海域的研究主要集中于生态系统的环境状况与生物群落变化情况,对于营养结构的研究较为缺乏[2-3,15]。本研究应用碳氮稳定同位素技术和贝叶斯混合模型(MixSIAR)对小清河口邻近海域底栖食物网结构和营养关系进行研究,初步构建小清河口邻近海域生态系统的基础食物网,估算潜在食源对不同功能群的食源贡献率,辨识主要消费者的营养位置,以期为小清河口邻近海域生物多样性保护与生态系统的可持续发展提供基础依据。
2 材料与方法
2.1 样品采集与处理
于2020年10月在寿光小清河口邻近海域(37°15′54″~37°24′32″N,119°08′14″~119°14′16″E)使用拖网渔船进行样品采集(图1)。调查网具为单船底拖网(网长为46 m,网宽为35 m,网口高为3.6 m,网目直径为2 cm),平均拖速为2.5 kn,每网拖行时间为30 min。共设置12个生物采样站位,采集的生物样本包括鱼类、甲壳类、头足类、腹足类、双壳类等,潜在食源样本包括沉积物有机质(Sediment Organic Matter, SOM)、悬浮颗粒有机物(Suspended Particulate Organic Matter, POM)、浮游植物和浮游动物。样品的采集和处理方法遵照《海洋监测规范 第3部分:样品采集、贮存与运输》(GB 17378.3-2007)进行[16]。
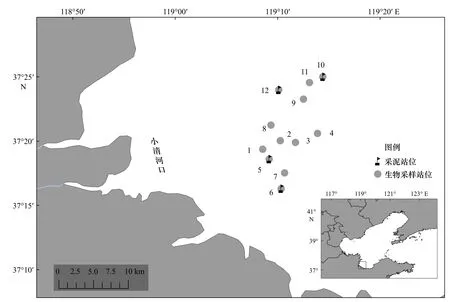
图1 小清河口邻近海域拖网站位图Fig. 1 Trawling stations of the Xiaoqing River Estuary adjacent sea area
2.1.1 潜在食源样本采集和处理
采集方法:采用抓斗式采泥器抓取表层沉积物,取1~2 cm处泥样于聚乙烯袋中,得到SOM样本;使用有机玻璃采水器在距水面0.5 m深处采集2 L海水,用两个1 L聚乙烯瓶保存,得到POM样本;浮游动物样本采集使用浅水II型浮游生物网,水平拖网表层海水,冲网至1 L聚乙烯瓶中保存;浮游植物样本采集使用浅水III型浮游生物网,自底层至表层垂直拖网,冲洗至1 L聚乙烯瓶中保存;以上所有样本均冷冻保存。
室内处理:SOM样本经过1 mol/L的稀盐酸酸化处理后过孔径为63 μm的筛绢,得到SOM。POM样本经孔径为150 μm的筛绢过滤后,抽滤到预先经450℃灼烧5 h的What-man GF/F滤膜上,得到POM。浮游动物样本过孔径为200 μm的筛绢,在显微镜下使用干净的镊子挑出杂质后,得到浮游动物。浮游植物样本过孔径为100 μm的筛绢,除去浮游动物和杂质,抽滤到预先经450℃灼烧5 h的What-man GF/F滤膜上,得到浮游植物。
2.1.2 生物样本采集和处理
采集方法:采用底拖网渔船沿河口断面拖行获取底栖生物样品,并结合抓斗式采泥器采集底栖动物样品。采集到的样品冷冻保存,带回实验室后,进行物种鉴定和体长、体重测量。
室内处理:每个物种选取3个大小相近的个体(采样数量小于3的物种取全部个体),鱼类取第一背鳍下方肌肉,虾类取腹部肌肉,蟹类取第一螯足肌肉,头足类取腕部肌肉,腹足类去壳取肌肉,双壳类取闭壳肌[17]。所有样品去离子水冲洗干净后放入离心管,冷冻干燥机(SCIENTZ-18N)干燥48 h后,用玛瑙研钵研磨成粉。
2.2 碳氮稳定同位素的测定和营养级计算
2.2.1 碳氮稳定同位素测定
将上述样品装入锡囊,用Mat253同位素质谱仪(Thermo Fisher,美国)进行测定。碳稳定同位素的标准物采用美洲拟箭石(Pee Dee Belemnote, PDB),氮稳定同位素的标准物采用空气中纯净的N2。碳氮稳定同位素比值以国际通用的 δ值形式表示:
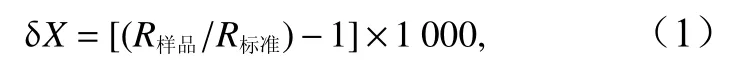
式 中,X表 示13C或15N;R表 示13C/12C或15N/14N,δ13C、δ15N精密度小于0.20‰[18]。
2.2.2 营养级计算
本研究以浮游植物为初级生产者,以浮游动物[19]和双壳类[10-11]作为基准生物,计算不同底栖生物所对应的营养级(TL),公式如下[19]:
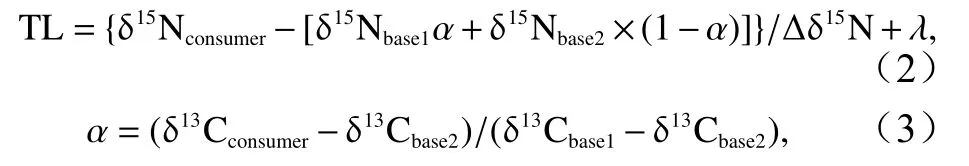
式中,δ13Cconsumer、δ15Nconsumer分别为消费者的碳、氮稳定同位素比值;δ13Cbase1、δ15Nbase1分别为浮游动物的平均碳、氮稳定同位素比值;δ13Cbase2、δ15Nbase2分别为双壳类的平均碳、氮稳定同位素比值;Δδ15N为氮稳定同位素富集度,此处取5.6‰[20];λ为基准消费者营养级,确定为2[11,19]。
2.3 生态位分析和食源分析
考虑到生态位总面积(Total Area, TA)可能因个别数据产生偏差,使用贝叶斯标准椭圆面积(Standard Ellipse Area, SEA)可减少样本误差,当样本数小于30时,采用校正标准椭圆面积(SEAc)可减少因样本数较少而产生的误差,其公式为
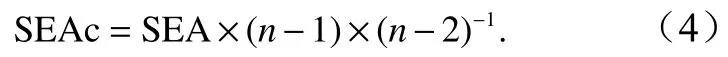
基于 SEAc 在δ-空间中的分布(95%置信区间),计算7种生物类群(双壳类、鱼类、虾类、腹足类、蟹类、头足类和多毛类、棘皮动物)的生态位重叠概率[21]。
35种底栖生物按照食源组成划分为浮游和碎屑食性、杂食性、肉食性3个类群[5,22]。使用R软件(版本:4.0.5)的MixSIAR模型,估算潜在食源对不同功能群的食源贡献率。由于各食源贡献率范围未知,在模拟中采用没有先验信息的狄克雷分布,即假设所有比例出现的概率相同[23]。同位素营养富集因子在生物中波动较大,在不同生物类群中采用不同的营养富集因子,取值范围:Δδ13C为-1.0‰~2.0‰,Δδ15N为0.4‰~5.6‰[20,24-25]。
2.4 数据分析
数据的分析处理在Excel 2010和SPSS 26.0中进行,数值差异显著性采用单因素方差分析(One-way ANOVA)和非参检验(Kruskal-Wallis Test),当p小于0.05时表示存在显著性差异。利用ArcMap 10.3绘制小清河口邻近海域拖网站位图,利用R语言中的MixSIAR模型进行消费者食源分析,利用ggplot 2绘制营养级图。用R语言的 SIBER 包绘制δ13C和δ15N组成的贝叶斯标准椭圆图,并计算不同底栖类群的营养生态位相关参数。
3 结果
3.1 小清河口邻近海域碳、氮稳定同位素特征
3.1.1 潜在食源稳定同位素特征
小清河口邻近海域共采集潜在食源样本15个,其中POM、SOM、浮游植物样本各4个,浮游动物样本3个(表1)。小清河口邻近海域潜在食源中δ13C值范围为-25.56‰~-17.91‰,平均值为-21.65‰±2.69‰;δ15N值的范围为2.43‰~10.33‰,平均值为6.72‰±2.84‰。平均δ13C值由高到低依次为浮游动物、POM、SOM、浮游植物,平均δ15N值由高到低依次为浮游动物、浮游植物、POM、SOM。单因素方差分析显示,浮游植物与浮游动物和POM的碳稳定同位素比值之间存在显著差异,SOM与浮游植物和浮游动物的氮稳定同位素比值之间存在显著差异(p<0.05),而整体上同一食源不同站位样本之间碳(p=0.185>0.05)、氮(p=0.053>0.05)稳定同位素比值没有显著性差异。
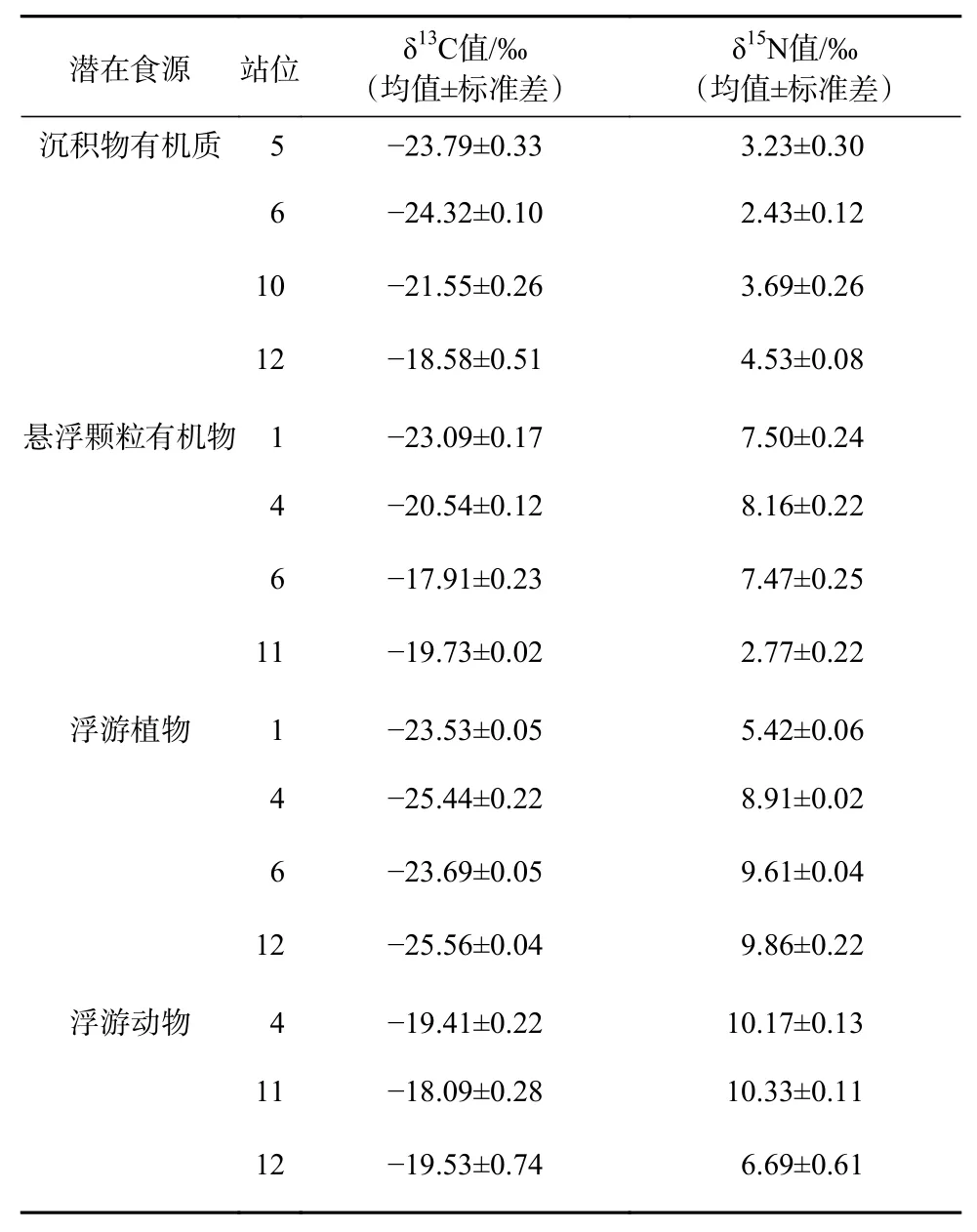
表1 小清河口邻近海域潜在食源的δ13C值及δ15N值Table 1 The δ13C and δ15N values of potential food source in the Xiaoqing River Estuary adjacent sea area
3.1.2 底栖生物稳定同位素特征
共采集到底栖生物样品35种,其中腹足类6种、甲壳类10种、鱼类10种、双壳类6种、头足类1种、多毛类1种、棘皮动物1种,其δ13C值的变化范围为-23.48‰~-18.31‰,平均值为-19.76‰±1.26‰,δ13C值最大的为焦氏舌鳎(-18.31‰±0.06‰),最小的为凸壳肌蛤(-23.48‰±0.05‰);δ15N值的变化范围为8.79‰~18.01‰,平均值为14.11‰±1.98‰,δ15N值最大的为中华栉孔虾虎鱼(18.01‰±0.13‰),最小的为短竹蛏(8.79‰±0.09‰)。本研究中平均δ13C值由高到低依次为多毛类、棘皮动物、鱼类、腹足类、甲壳类、头足类、双壳类,平均δ15N值由高到低依次为头足类、甲壳类、鱼类、腹足类、双壳类、棘皮动物、多毛类。小清河口邻近海域底栖生物的碳、氮稳定同位素值存在显著性差异(p<0.05)(表2)。
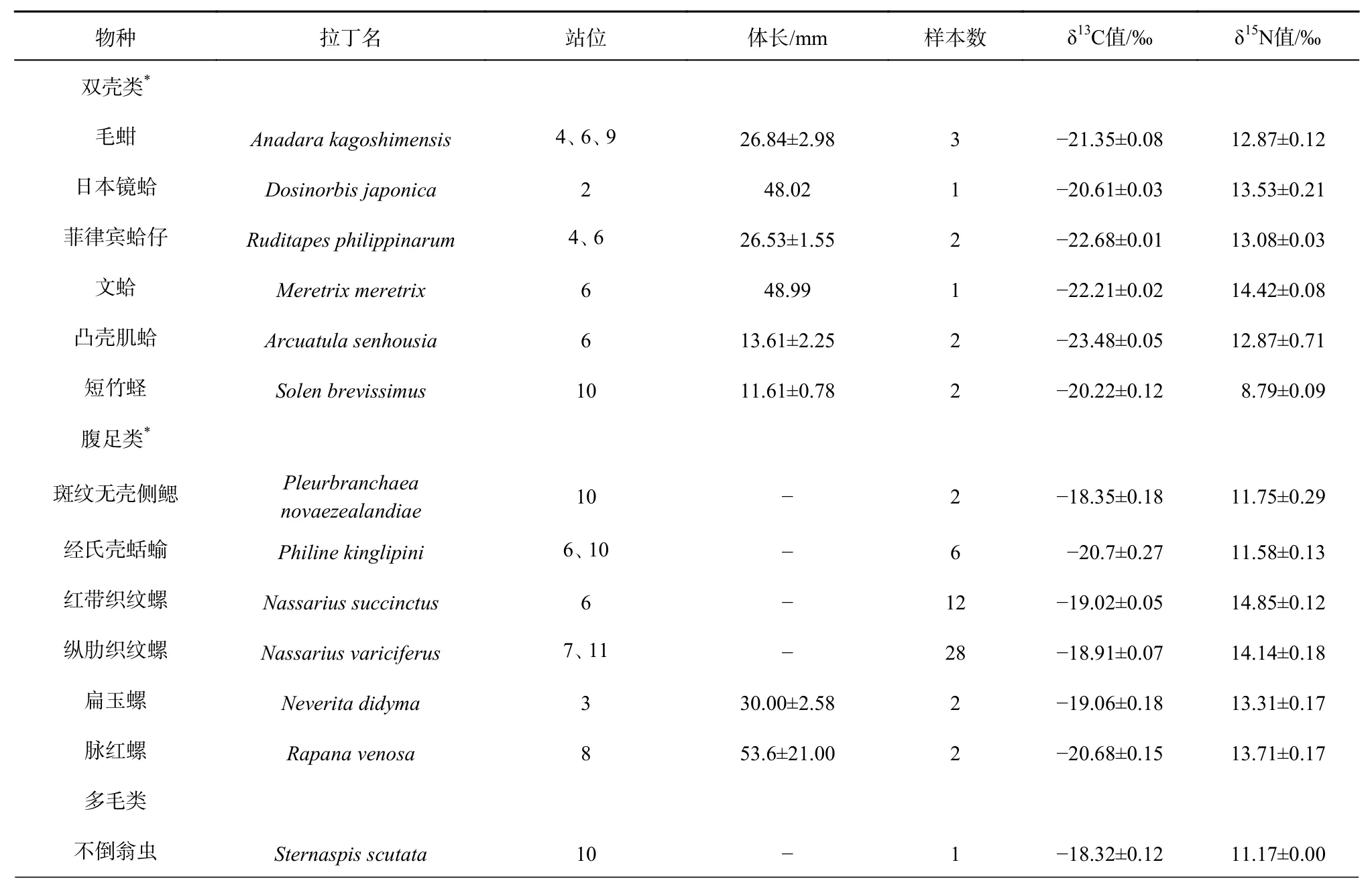
表2 小清河口邻近海域底栖生物的δ13C值及δ15N值Table 2 The δ13C and δ15N values of benthos in the Xiaoqing River Estuary adjacent sea area
3.2 生态位和营养级
小清河口邻近海域底栖动物7种底栖生物类群的营养生态位及生态位重叠状况如图2所示。生态位宽度由大到小依次为双壳类(TA=11.007,SEA=5.881,SEAc=6.249)、鱼类(TA=8.289,SEA=4.235,SEAc=4.386)、虾类(TA=6.574,SEA=3.707,SEAc=3.939)、腹足类(TA=6.960,SEA=3.616,SEAc=3.842)、蟹类(TA=0.777,SEA=0.444,SEAc=0.489)、多毛类和棘皮动物(TA=0.127,SEA=0.101,SEAc=0.126)、头足类(TA=0.003,SEA=0.004,SEAc=0.005)。整体来看,小清河口邻近海域底栖动物7种底栖生物类群存在一定程度的生态位重叠现象,各底栖生物类群之间竞争激烈,其中鱼类和虾类之间营养生态位重叠概率最高,为51.73%。
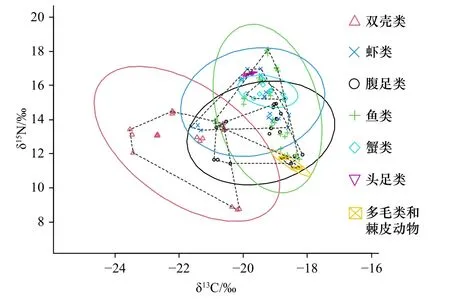
图2 小清河口邻近海域底栖动物营养生态位及生态位重叠状况Fig. 2 The nutritional niche and niche overlap of benthos in the Xiaoqing River Estuary adjacent sea area
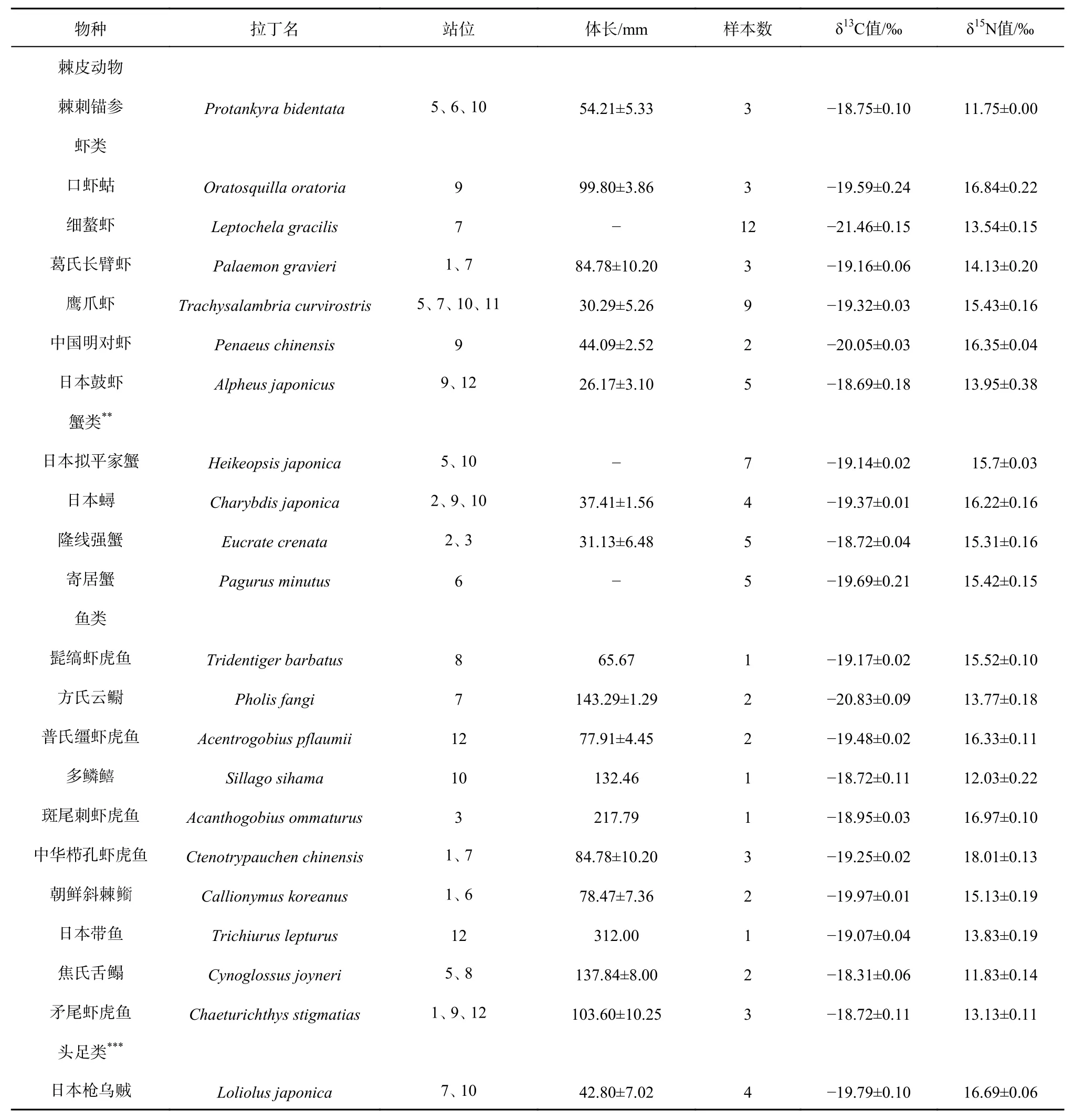
续表 2
本研究以双壳类和浮游动物作为基准生物,计算不同底栖生物所对应的营养级并绘制营养级(图3)。结果如下,小清河口邻近海域底栖生物营养级范围为1.65(凸壳肌蛤)~3.54(中华栉孔虾虎鱼),其中腹足类动物营养级范围为2.06(经氏壳蛞蝓)~3.03(红带织纹螺),甲壳类动物营养级范围为2.24(细螯虾)~3.26(口虾蛄),鱼类营养级范围为2.42(方氏云鳚)~3.54(中华栉孔虾虎鱼),双壳类营养级范围为1.65(凸壳肌蛤)~2.43(日本镜蛤),日本枪乌贼营养级为3.18,不倒翁虫营养级为2.54,棘刺锚参营养级为2.54。
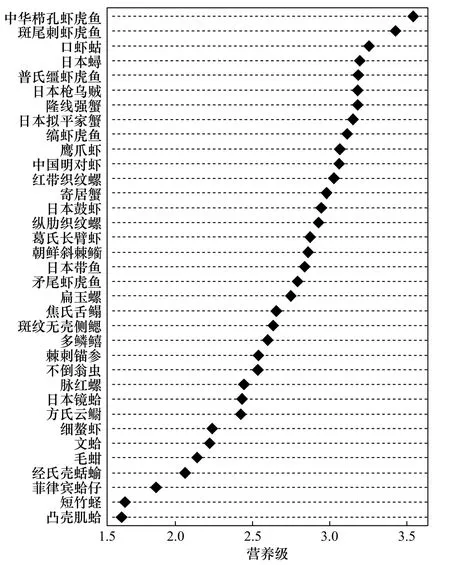
图3 小清河口邻近海域底栖动物的营养级Fig. 3 Trophic levels of benthos in Xiaoqing River Estuary adjacent sea area
3.3 小清河口邻近海域底栖生物的食源
基于MixSIAR模型对35种底栖生物的食源进行溯源,将其划分为浮游和碎屑食性、杂食性、肉食性3个类群。其中,浮游和碎屑食性类群:以悬浮颗粒有机物、浮游动物、浮游植物和沉积物碎屑为食,主要包括双壳类(短竹蛏、凸壳肌蛤、菲律宾蛤仔、毛蚶、文蛤和日本镜蛤)、小型虾类(细螯虾)、不倒翁虫和棘刺锚参;杂食性类群:以悬浮颗粒有机物、浮游动物、浮游植物、沉积物碎屑、双壳类和多毛类为食,主要包括腹足类(纵肋织纹螺、红带织纹螺、扁玉螺、脉红螺、经氏壳蛞蝓和斑纹无壳侧鳃)和小型蟹类(寄居蟹、隆线强蟹、日本拟平家蟹);肉食性类群:以浮游动物、双壳类、小型虾类(细螯虾)、小型蟹类、小型鱼类(方氏云鳚、多鳞鱚和朝鲜斜棘鴨)、腹足类和多毛类为食,主要包括大型鱼类(斑尾刺虾虎鱼、中华栉孔虾虎鱼、普氏缰虾虎鱼、髭缟虾虎鱼)、中型鱼类(日本带鱼、矛尾虾虎鱼和焦氏舌鳎)、小型鱼类、大型虾蟹类(口虾蛄、中国明对虾、鹰爪虾和日本蟳)、中型虾类(日本鼓虾、葛氏长臂虾)和头足类。
各类群食物贡献率如表3所示,浮游和碎屑食性的生物类群中,以 POM 和 SOM为主要食源的包括短竹蛏、不倒翁虫和棘刺锚参,以浮游生物为主要食源的包括双壳类(除短竹蛏外)和小型虾类(细螯虾);以小型虾类、双壳类和多毛类为主要食源的包括杂食性类群中的腹足类、小型蟹类和肉食性类群中的小型鱼类;肉食性类群中的大中型鱼类、大中型虾蟹类和头足类食性相对较为广泛,以多毛类、小型虾蟹类和双壳类为主要食源。
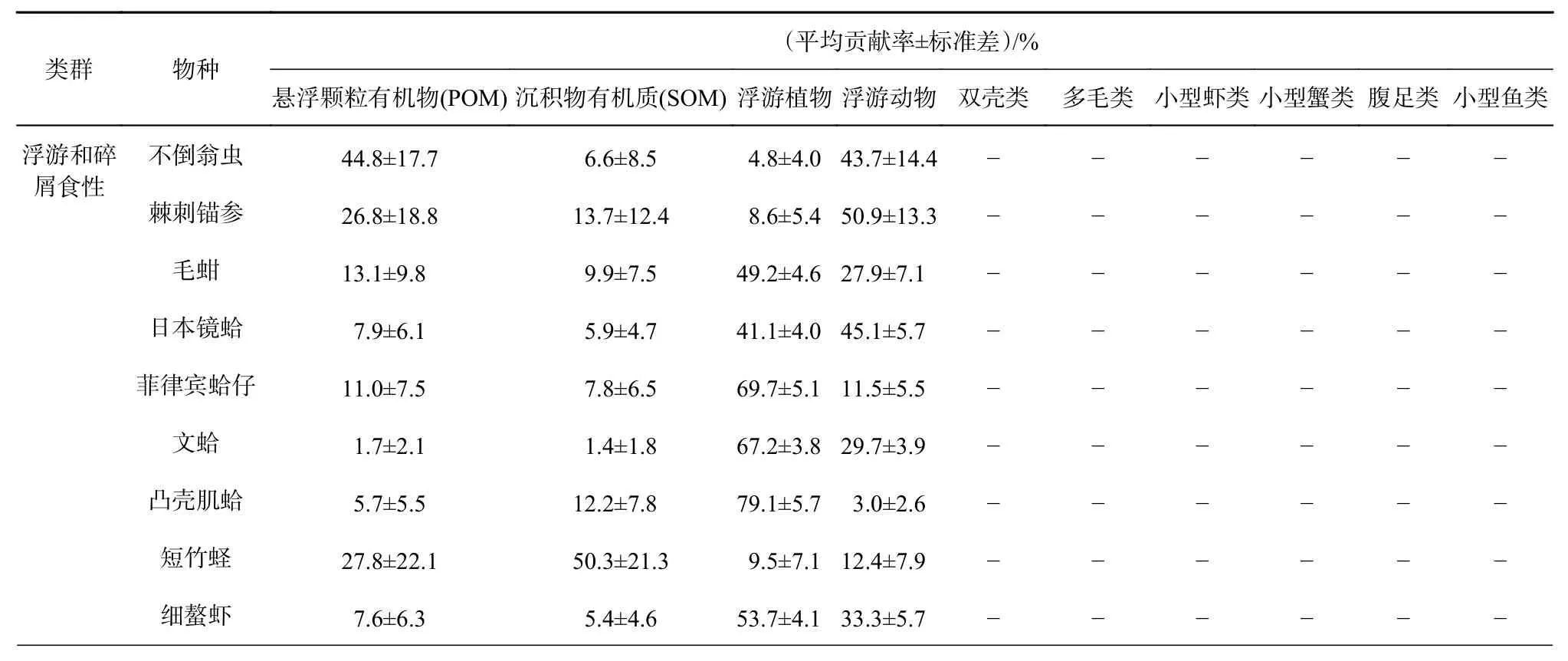
表3 小清河口邻近海域底栖生物食物贡献率Table 3 Food contribution rate of benthos in the Xiaoqing River Estuary adjacent sea area
3.4 食物网结构
基于小清河口邻近海域底栖生物的营养级和食源特征初步构建底栖食物网结构(图4),主要存在两条能量传递途径,一是以浮游生物为主要能量来源的浮游食物链,其中双壳类(除短竹蛏外)、小型虾类、不倒翁虫和棘刺锚参为主要初级消费者;二是以SOM为主要能量来源的底层食物链,其中短竹蛏和腹足类为主要初级消费者。
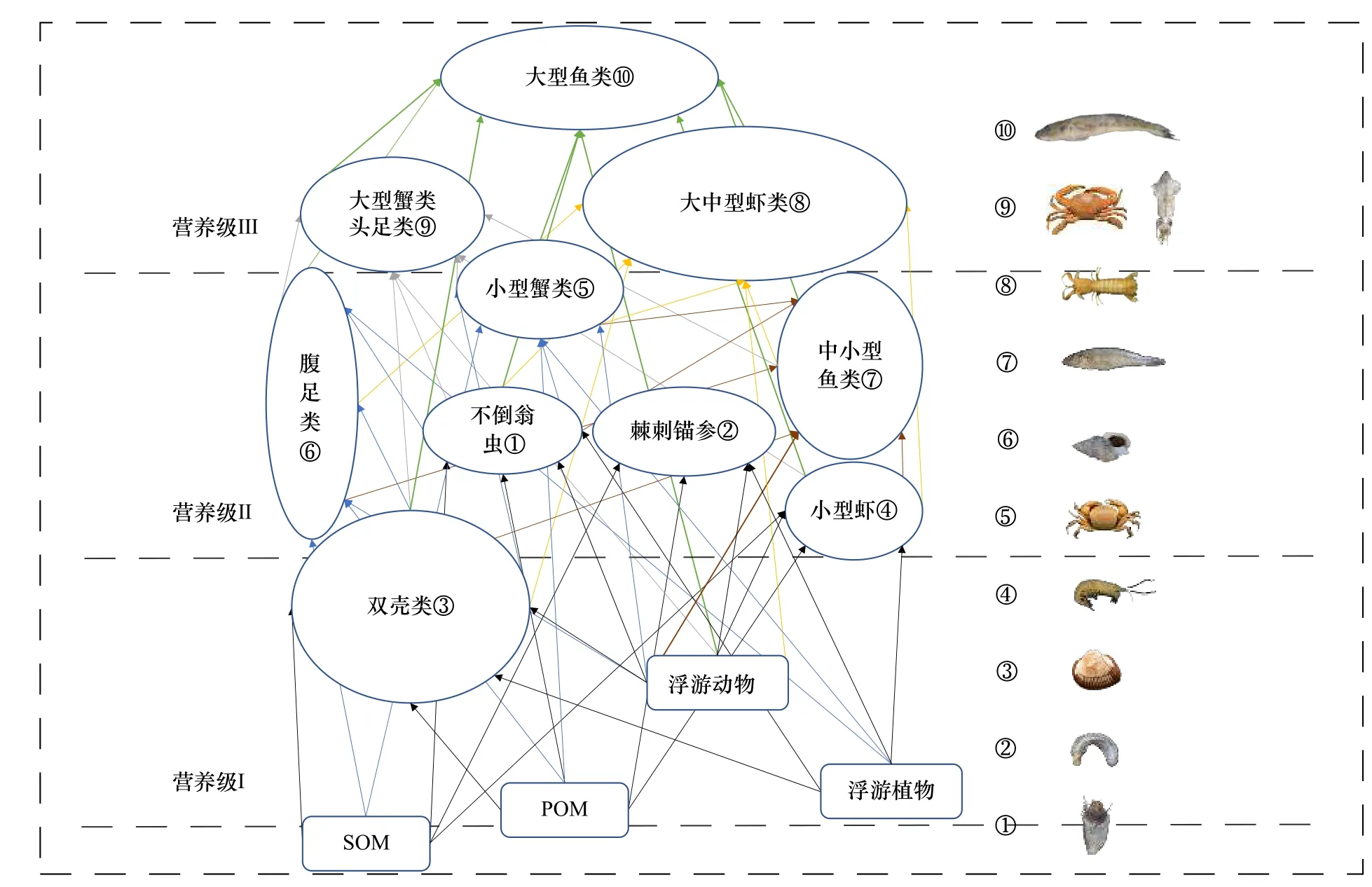
图4 小清河口邻近海域底栖动物食物网结构Fig. 4 The structure of benthos food web in the Xiaoqing River Estuary adjacent sea area
4 讨论
4.1 小清河口邻近海域碳、氮稳定同位素特征
小清河口邻近海域潜在食源由POM、SOM、浮游植物和浮游动物构成,与黄海相比[5],潜在食源δ13C值跨度相对较小,δ15N值跨度相对较大,且POM和浮游植物的氮稳定同位素比值较大,不同站位间同一食源碳稳定同位素比值无显著性差异,氮稳定同位素比值有差异不显著,整体来说,离河口较近的1号站位及靠近龙威渔港的4号和6号站位潜在食源氮稳定同位素比值相对较高,这是由于这些站点离岸较近,潜在食源的δ15N值变化特征和人类活动引起的营养输入关系紧密[25],频繁人类活动对小清河口潜在食源的δ15N值产生影响。小清河口邻近海域浮游植物的碳稳定同位素比值显著比POM和浮游动物小,而黄海的研究显示浮游植物碳稳定同位素比值同样小于浮游动物,但高于POM[5],这是由于浮游植物为浮游动物或其他水生生物提供直接或间接的食物来源,是水生食物网的基础[26];SOM的氮稳定同位素比值显著比浮游植物和浮游动物小,符合莱州湾沉积物氮稳定同位素比值的范围[27]。
小清河口邻近海域底栖动物碳、氮稳定同位素比值存在显著差异,碳同位素高的生物与底栖食物网有关,低的生物与浮游食物网有关[28],说明本研究区域存在浮游食物链和底层食物链。δ13C值的变化范围为-23.48‰~-18.31‰,δ15N值的变化范围为8.79‰~18.01‰,基本符合渤海常见海洋生物的碳氮稳定同位素比值范围(-21.95‰~-15.14‰,9.22‰~16.66‰)[29]。碳值跨度只有5.17‰,但氮值跨度为9.22‰,平均δ13C值和δ15N值均比黄河口和长江口区域高,但δ13C值跨度显著低于黄河口和长江口区域[30-31],这表明小清河口区域底栖动物的食源多样性没有河口三角洲生态系统复杂,生物对食源的选择性较低,δ15N值跨度低于黄河口区域而高于长江口区域[30-31],可能是由于本研究所获种类大多为底栖生物,中上层种类较为缺乏。部分底栖生物δ15N值相对较大,则是因为之前小清河口受污染程度相对较重,虽然近年来有所改善,但沉积物和水体中氮含量仍相对较高[27,32]。沉积物有机质中氮累积会导致生物氮稳定同位素值发生变化,如澳大利亚东南部河口地区生物δ15N值会随着沉积物有机质中氮累积的增加而变大[33];其次氮含量较高水体中初级生产者δ15N值也偏高[34],通过食物链传递导致部分消费者的δ15N值上升。
4.2 生态位和营养级
描述生态位关系最重要的两个指标是生态位宽度和生态位重叠,其中生态位宽度表示物种对栖息地和资源利用及竞争能力的强弱,而生态位重叠表示不同物种间的竞争关系程度[35]。小清河口邻近海域双壳类的SEAc最大,说明双壳类比其他底栖生物类群占据了更广的生态位,7种底栖生物类群存在一定程度的生态位重叠现象,说明各底栖生物类群之间竞争激烈,其中鱼类、虾类、双壳类和腹足类之间营养生态位重叠均较高,表明这些种群的食物来源较为接近,竞争激烈;头足类、蟹类、多毛类和棘皮动物所占生态位较小,与其他类群间重叠度不高,但完全被虾类、鱼类和腹足类所覆盖,说明其对资源的需求高度相似,存在较为激烈的竞争。
基准生物一般选择营养级较低的初级消费者,而选取生物的不同将导致营养级产生差异[36-37],由于浮游动物和双壳类动物δ15N值变化较大,本研究选取双壳类和浮游动物的平均δ15N值作为基准生物的氮稳定同位素值。水域环境中较高氮浓度会导致生物间氮的富集度变大[33-34],考虑到小清河口污染程度相对较重,且本研究生物δ15N值相对较大,因此选择氮稳定同位素富集度为5.6‰。研究结果表明,最低营养级生物为凸壳肌蛤,最高营养级生物为中华栉孔虾虎鱼,而非日本带鱼,已有研究表明,由于食物来源发生变化,北部湾日本带鱼的营养生态位变化明显,在资源利用和环境适应方面都有所下降[38],此外生物体长也会产生不同程度影响[39],本次调查中捕获的日本带鱼个体偏小,摄食能力与成年个体相比较弱也是导致其所处营养级较低的原因。除日本带鱼外大部分生物基本符合渤海常见生物的营养水平[29,40],其中鱼类营养级跨度为1.12,大于甲壳类、双壳类、腹足类的营养级跨度,进一步说明鱼类与其他物种之间竞争激烈。
4.3 食物网结构和营养关系
小清河口邻近海域底栖食物网主要由浮游食物链和底层食物链构成,大部分生物位于浮游食物链,与长江口浮游生物食性的水生生物所占比例升高[6]的特征相似,而张波等[41]对莱州湾渔业资源调查显示该区域食物链越来越短,食物网主要通过碎屑食物链传递能量,这是因为本次调查为秋季10月份,大量渔业活动过后,个体较小,游泳能力较强的生物占主体。李凡等[42]发现,浮游动物食性的种团在春季和秋季均占绝对优势,这与本研究结论相似。主要鱼类的食源组成广泛,对浮游动物、双壳类、小型虾类、小型蟹类、腹足类、多毛类、小型鱼类皆有摄食,其中对双壳类、多毛类和小型虾蟹类的食用比例较大,这是由于一个营养群包含具有类似营养位置的生物,但其成员可能摄食不同的饵料且在食物网内有不同的生态功能[43],亦表明由于食源多样性有限,加剧了该区域生物对资源的竞争程度。杂食性类群腹足类和小型蟹类捕食较多的是双壳类和多毛类,而大型蟹类和头足类除捕食双壳类和多毛类外,多以腹足类和小型蟹类为食,不仅种内竞争激烈,种间竞争同样激烈。
根据秋季(10月)小清河口邻近海域底栖食物网各生物的食性和营养级,将底栖生物主要分为3个营养层次,即初级消费者、次级消费者和高级消费者,初级消费者主要为浮游和碎屑食性类群,包括双壳类、不倒翁虫、棘刺锚参和小型虾类(细螯虾),次级消费者主要为杂食性类群,包括腹足类、小型蟹类(寄居蟹、隆线强蟹和日本拟平家蟹)和小型鱼类(方氏云鳚、多鳞鱚和朝鲜斜棘鴨),高级消费者主要为肉食性类群,包括大型鱼类(斑尾刺虾虎鱼、中华栉孔虾虎鱼、普氏缰虾虎鱼、髭缟虾虎鱼)、中型鱼类(日本带鱼、矛尾虾虎鱼和焦氏舌鳎)、大型虾蟹类(口虾蛄、中国明对虾、鹰爪虾和日本蟳)、中型虾类(日本鼓虾、葛氏长臂虾)和头足类。这一结果同黄海大型底栖动物食物网营养结构基本一致[5],符合我国近海和莱州湾海洋食物网的特征[6,42,44-46]。
5 结论
(1)小清河口邻近海域潜在食源平均δ13C值由大到小依次为浮游动物、POM、SOM、浮游植物,平均δ15N值由大到小依次为浮游动物、浮游植物、POM、SOM;底栖生物平均δ13C值由大到小依次为多毛类、棘皮动物、鱼类、腹足类、甲壳类、头足类、双壳类,平均δ15N值由大到小依次为头足类、甲壳类、鱼类、腹足类、双壳类、棘皮动物、多毛类。
(2)小清河口邻近海域底栖生物的营养级范围为1.65(凸壳肌蛤)~3.54(中华栉孔虾虎鱼),存在浮游食物链和底层食物链两条能量传递途径,分为初级消费者、次级消费者与高级消费者3个营养层次。
(3)底栖生物类群之间存在一定程度的生态位重叠现象,竞争较为激烈,其中鱼类和虾类竞争最为激烈;而且食物网结构受小清河口近海区域环境质量与当地渔业捕捞的影响。
