黔北麻羊GPx3基因克隆、生物信息学分析及在不同性腺组织中的表达分析
2022-01-20付开斌周志楠惠茂茂
付开斌,陈 祥*,周志楠,张 艳,惠茂茂,洪 磊
(1.贵州大学高原山地动物遗传育种与繁殖教育部重点实验室,贵州省动物遗传育种与繁殖重点实验室,贵州贵阳 550025;2.贵州大学动物科学学院,贵州贵阳 550025)
硒是动物机体所必需的微量元素,可以整合到氨基酸序列中形成相应的硒蛋白并发挥其生物学功能。谷胱甘肽过氧化物酶(Glutathione Peroxidase,GPx)家族是最早发现的硒蛋白,现已研究发现的GPx家族成员有8位。谷胱甘肽过氧化物酶3(Glutathione Peroxidase 3,)也被称作血浆GPx,它是含硒谷胱甘肽过氧化物酶家族中具有前导序列、能分泌到细胞外间隙的糖基化蛋白。研究表明,适宜浓度的活性氧(Reactive Oxygen Species,ROS)是维持细胞正常生命活动所必需的条件之一,ROS的过量则会造成生物膜的过氧化损伤、DNA链断裂和蛋白质结构破坏,引起细胞代谢途径紊乱,进而导致细胞坏死、凋亡;GPx3是主要的抗氧化酶之一,它可以利用过氧化氢、脂肪酸氢过氧化物等底物,以实现机体内ROS的动态平衡,其主要来源于肾脏,由近端肾小管上皮细胞和鲍曼囊壁层上皮细胞产生并释放到血液中。同时,也表达于附睾并参与成熟精子免受活性氧损伤,催化降解精子在成熟过程中所接触到的过氧化物。在雌性动物生殖上,可以清除卵泡发育过程中产生的活性氧和母体胎盘硒转移以及参与胎儿发育和生产。Xu等研究发现,在子宫内膜重塑(去苏醒)后的氧化应激过程中,是一种必不可少的酶,可有效降低子宫内膜中的HO含量来为着床做好准备。还可以防止健康卵泡生长过程中氧化应激诱导的细胞凋亡,其活性的降低会引起ROS代谢损伤,导致血小板高反应性的发生和形成血栓的风险增加。综上,的抗氧化功能不仅与机体的疾病健康有关,还影响着动物的生殖调控。
黔北麻羊是贵州省三大优良地方山羊品种之一,具有适应性强、产肉性能良好、肉鲜美可口、蛋白质含量高等优点,深受广大消费者的喜爱,具有重要的经济价值和发展潜力,但繁殖力始终是制约黔北麻羊快速发展的重要因素之一。因此,本研究对黔北麻羊基因的CDS区进行克隆和生物信息学分析,并探究GPx3在单、多羔黔北麻羊不同性腺组织中的表达差异,以期为提高黔北麻羊的繁殖性能提供基础数据。
1 材料与方法
1.1 实验材料 本实验的黔北麻羊均来自贵州省习水县,选取健康、成年且处于相同饲养环境下的产单、多羔的黔北麻羊各6只。按照贵州省地方标准《羊屠宰操作规程》(DB22/T 2740—2017)进行屠宰,屠宰后立即采集黔北麻羊的下丘脑、垂体、子宫、输卵管和卵巢5个组织,对组织样进行处理并标记后放入液氮中冷冻保存,带回实验室后,立即转入-80℃冰箱保存备用。
1.2 实验试剂及仪器 FirstStrand cDNA Synthesis、2×Taq MasterMix均购自贵州艾瑞特生物有限公司;TRIzol RNA 提取试剂盒、胶回收试剂盒均购自康为世纪生物科技有限公司;DNA Marker 2000、pMD-19T克隆载体均购自大连宝生物工程有限公司;LB Broth培养基购自上海生工生物工程技术服务有限公司;PCR扩增仪(C1000 Touch)、凝胶成像系统(Universal Hood II)及电泳仪(DYY-2C型)均购自美国BIORAD公司;37℃恒温摇床、超微量紫外分光光度计(µL trospec 2100 pro)购自安玛西亚中国有限公司;实时荧光定量PCR仪(CFX96 Real-Time System)购自上海博讯实业有限公司医疗设备厂。
1.3 引物的设计与合成 根据NCBI数据库中提供的山羊基因(XM_005683183.3)的mRNA序列设计CDS区扩增引物,使用Premier 5.0软件设计荧光定量引物,以-actin作为qRT-PCR内参基因。引物送至生工生物工程(上海)股份有限公司合成。引物序列信息详见表1。
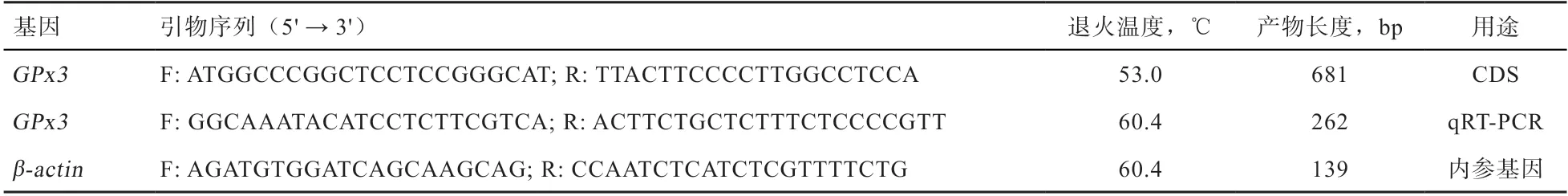
表1 引物信息
1.4 总RNA的提取及cDNA第一条链的合成 使用TRIzol法提取单、多羔黔北麻羊的下丘脑、垂体、子宫、输卵管和卵巢组织的总RNA,使用超微量分光光度计测定RNA的浓度与纯度值。RNA于-80℃冰箱保存。根据逆转录试剂盒说明书,对黔北麻羊组织样品中的总RNA进行逆转录。反应体系为20 μL:RNA模板(ng/μL)9 μL、Oligo(dT)18 Primer 1 μL,RI 1 μL、RT 1 μL,dNTP Mix 2 μL,Buffer 4 μL,Nuclease-free Water 1 μL,Random 1 μL。反应条件为42℃孵育60 min,70℃孵育5 min。结束后在超微量紫外分光光度计下进行浓度和纯度检测。cDNA产物于-20℃冰箱保存。
1.5 实时荧光定量PCR及数据分析 以-actin为内参基因,对所采集的单、多羔黔北麻羊的5种不同组织的基因mRNA进行荧光定量PCR检测。反应体系为10 μL:2×UltraSYBR Mixture 5 μL,Primer Sense(10 pmol/μL)0.5 μL,Primer Anti-sense(10 pmol/μL)0.5 μL,cDNA(ng/μL)0.8 μL,ddHO 3.2 μL。反应条件为:95℃ 2 min,95℃ 15 s,60.4℃ 30 s,72℃ 3 min,循 环40次后进行溶解曲线分析,以每5 s上升0.5℃的速率从65℃上升到95℃,实验的每个样品检测做3个重复,取平均值。采用2法分析基因在单、多羔黔北麻羊5个不同性腺组织中的相对表达量,使用SPSS Statistics软件对2相对定量法所得数据进行分析,分别以<0.05和<0.01为差异显著和极显著的判断标准。
1.6 黔北麻羊基因CDS区的扩增 以cDNA为模板,PCR扩增黔北麻羊基因的CDS区。扩增体系为20 μL:2× Es Taq MasterMix 10 μL,上下游引物各(10 pmol/μL)1 μL,ddHO 6 μL,cDNA(ng/μL)2 μL。反应程序为:95℃预变性3 min;95℃变性30 s,53℃退火45 s,72℃延伸30 s,35个循环;72℃终延伸7 min,4℃保存。
1.7 黔北麻羊基因的T克隆 将经凝胶电泳检测的PCR扩增产物按胶回收试剂盒说明书进行回收,使用超微量分光光度计对回收产物进行浓度和纯度检测,并与pMD-19T载体进行连接反应(金属浴16℃,12~16 h)。连接产物转化至E.coli TOP10感受态细胞中。均匀涂布至LB固体培养基(含氨苄青霉素)上并于37℃恒温箱培养12~16 h。挑取固体培养基上的白斑于含氨苄青霉素和LB液体培养液的10 mL离心管中进行摇菌(37℃,200 r/min,12~16 h)。待菌液浑浊后即进行菌液PCR,并用1%的琼脂糖凝胶电泳进行检测,筛选与目的片段一致的菌液送至北京擎科新业生物技术有限公司进行测序。
1.8 黔北麻羊基因的生物信息学分析 将测序结果用DNAStar软件与NCBI数据库中山羊的CDS区序列进行比对,在比对正确后利用MegAlign软件对黔北麻羊GPx3的CDS区进行同源性分析;分别使用在线网站ExPASy(https://web.expasy.org/protparam/)、ProtScal(https://web.expasy.org/protscale/)分析蛋白质理化性质和蛋白质疏水性;分别使用SOPMA(http://npsapbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)、SWISS-MODEL(https://swissmodel.expasy.org/interactive/EHVM5c/models/)预测蛋白质二级和三级结构;利用PSORT II Preadict(https://psort.hgc.jp/form2.html)进行亚细胞定位分析;使用SignalP 4.1 Sever(http://www.cbs.dtu.dk/services/SignalP-4.1)进行氨基酸信号肽预测;MEGA 6.0和MegAlign软件构建不同物种中的系统进化树和同源性分析。
2 结果与分析
2.1基因在单、多羔黔北麻羊不同性腺组织中的表达分析基因在单、多羔黔北麻羊的不同性腺组织中均有表达,结果如图1所示。组内分析可知基因在黔北麻羊单羔组5个不同组织中的表达趋势由高到低依次为:卵巢>下丘脑>子宫>输卵管>垂体;在多羔组中表达量由高到低依次为:卵巢>垂体>输卵管>子宫>下丘脑。通过组间比较分析得出,黔北麻羊基因在多羔组中的卵巢、垂体、输卵管和子宫的表达量极显著高于单羔组,但在下丘脑中未达到差异显著水平。
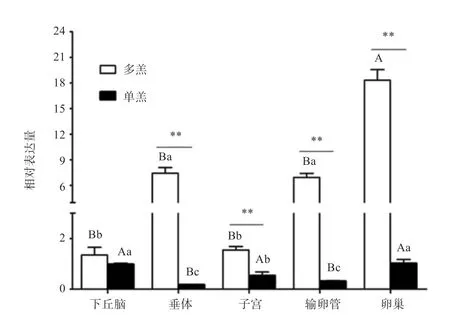
图1 GPx3基因在黔北麻羊单、多羔不同性腺组织中的相对表达量
2.2 黔北麻羊基因的PCR扩增 由图2可知,基因荧光定量引物的扩增条带为262 bp(图2A);CDS区克隆引物扩增条带为681 bp(图2B)。片段大小与预测结果一致,条带清晰明亮、单一,无二聚体等非特异性片段扩增,结果可用于下一步实验。
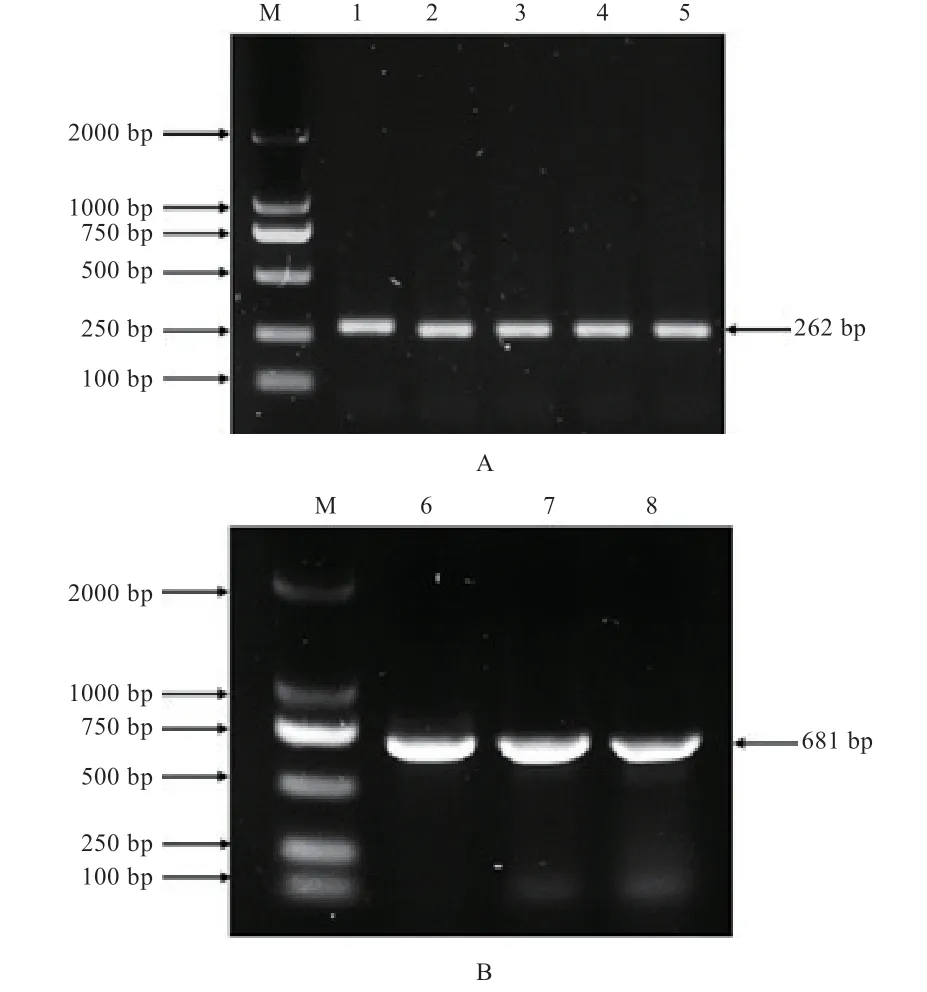
图2 GPx3琼脂糖凝胶电泳检测结果
2.3 黔北麻羊基因的T克隆载体测序鉴定 黔北麻羊基因克隆结果使用1%的琼脂糖凝胶电泳检测,结果显示,目的条带清晰明亮,与目的片段大小一致(图3)。菌液测序验证结果与NCBI数据库中山羊CDS区序列比对吻合度为99.85%(图4)。第611位 的碱基由A突变为T,属于同义突变,所编码的氨基酸不变,皆为甘氨酸。菌液PCR琼脂糖凝胶电泳及测序结果皆显示基因CDS区序列已成功克隆至pMD-19T载体中,表明pMD-19T-GPx3克隆载体构建成功。

图3 GPx3基因菌液PCR检测结果
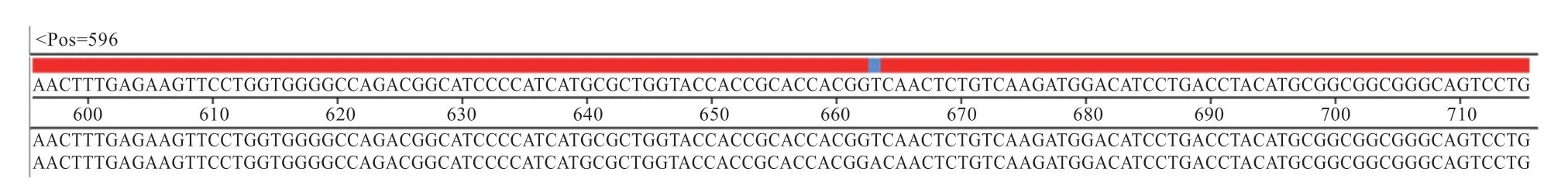
图4 黔北麻羊GPx3基因部分克隆序列与NCBI上传序列比对结果
2.4 黔北麻羊基因生物信息学分析
2.4.1 黔北麻羊GPx3蛋白质理化性质分析 黔北麻羊基因编码区大小为681 bp,共编码225个氨基酸,其编码的蛋白质分子式为CHNOS,原子总数3 573,相对分子质量25 392.24,理论等电点7.63,在哺乳动物机体内的估计半衰期为30 h。该蛋白质的不稳定指数为50.47,属于不稳定蛋白,由20种氨基酸构成,其中亮氨酸含量最高,占总氨基酸数的11.1%,色氨酸和组氨酸含量最低,占氨基酸总数的1.3%。带负电荷的残基总数(Asp+Glu)为25,正电荷残基总数(Arg+Lys)为26,提示黔北麻羊GPx3蛋白的氨基酸序列带正电。由ProtScale分析可知,横坐标代表GPx3蛋白质的氨基酸位置,纵坐标代表GPx3蛋白质的疏水分值,得分低于0为亲水性蛋白质,得分高于0是疏水性蛋白质。GPx3蛋白亲水性最强的是第109位上的谷氨酸(-2.689),疏水性最强的是第15位上的丝氨酸(2.567),肽链上的疏水性氨基酸少于亲水性氨基酸,提示整条肽链表现为亲水性(图5)。
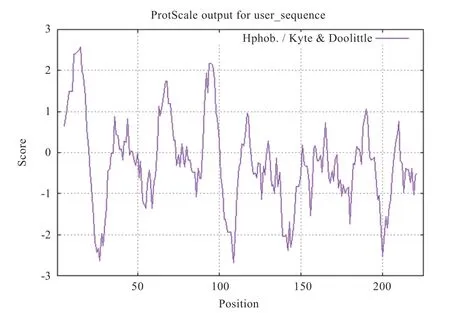
图5 GPx3蛋白疏水性图谱
2.4.2 黔北麻羊GPx3蛋白质高级结构分析与预测 由SOMPA在线软件结果显示,黔北麻羊GPx3蛋白质的二级结构由-螺旋(29.78%)、-转角(8%)、延伸链(17.33%)以及无规则卷曲(44.89%)构成,可见GPx3蛋白质主要由无规则卷曲和-螺旋构成(图6)。GPx3蛋白三级结构预测结果与二级结构分析结果一致(图7)。

图6 黔北麻羊GPx3蛋白质二级结构分析
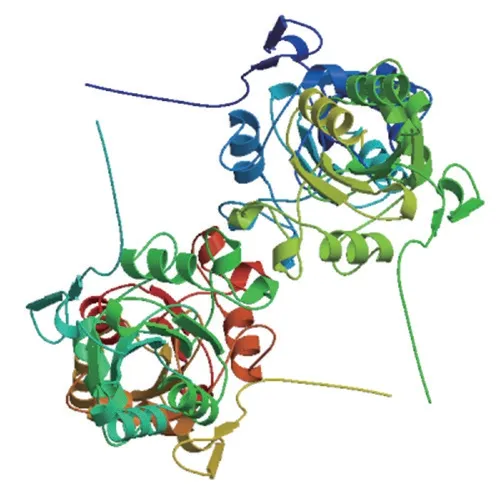
图7 GPx3蛋白三级结构预测
2.4.3 黔北麻羊GPx3蛋白质亚细胞定位分析与信号肽预测 运用PSORT II Preadict对黔北麻羊GPx3蛋白质亚细胞定位分析发现,GPx3蛋白质主要定位在细胞外(66.7%),包括细胞壁;其次为空泡(22.2%);最低是内质网(11.1%)。使用SignalP 4.1预测氨基酸序列中的信号肽及其剪切位点,结果由图8所示,黔北麻羊基因编码的氨基酸序列中具有信号肽,信号肽平均值大于0.5,表明GPx3蛋白属于分泌蛋白;GPx3蛋白可能的剪切位点位于第24位和第25位氨基酸之间,表明成熟肽始于第24位氨基酸。

图8 黔北麻羊GPx3基因编码氨基酸信号肽分析
2.4.4 GPx3氨基酸同源性分析及系统进化树的构建MegAlign进行氨基酸同源性分析,结果显示所克隆的黔北麻羊基因CDS区序列与绵羊、牛、猪、马、犬、小鼠、人、兔、鸡的同源性分别为99.6%、98.2%、88.4%、90.7%、92.0%、86.2%、86.7%、88.4%、68.8%(图9)。MEGA 6.0构建系统发育进化树,结果表明黔北麻羊基因编码的氨基酸序列与绵羊的遗传距离最近,其次是牛,遗传距离最远的是鸡,符合物种进化的规律(图10)。

图9 黔北麻羊GPx3基因编码区同源性分析
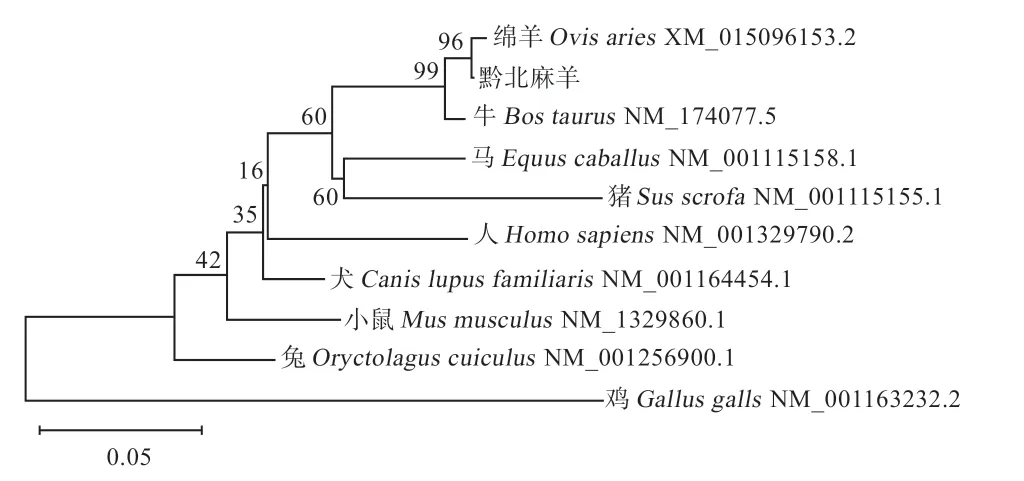
图10 黔北麻羊GPx3基因编码区遗传进化树
3 讨 论
是动物机体重要的抗氧化物质,不仅在维持机体内ROS的动态平衡具有显著的作用,且在动物生殖调控方面也具有重要意义。有大量研究表明,基因与人类的正常妊娠和分娩以及母婴硒转运机制有关,且它可以影响子痫前期和妊娠高血压综合征的发生。熊贤荣等研究显示在牦牛卵母细胞体外成熟过程中,硒可显著提高卵母细胞谷胱甘肽过氧化物酶的活性及其家族基因的表达,进而提高卵丘细胞DNA完整性以及卵母细胞减数分裂和发育能力。同时,姚晓蕾等也报道了硒对母畜相关生殖激素的合成具有积极作用。故本实验以黔北麻羊为研究对象,运用qRT-PCR方法,对产单、多羔黔北麻羊的5个不同性腺组织基因的表达水平进行了检测,发现基因在产单、多羔黔北麻羊的下丘脑、垂体、子宫、输卵管以及卵巢均有表达,与基因在日本沼虾各组织均有表达的结果一致。Tao等研究发现,在刀额新对虾的卵巢快速发育时期GPx的表达量呈现上升趋势。本研究结果显示在黔北麻羊多羔组中基因在卵巢的表达量极显著高于所有组织,单羔组卵巢的表达量也极显著高于垂体和输卵管,显著高于子宫。这提示基因的表达对卵巢的发育具有重要作用,推测可能是在卵巢发育时会产生大量ROS,因此表达量上升以保护卵巢免受氧化伤害,但具体原因及作用机理有待进一步研究。此外,基因在产单、多羔黔北麻羊的子宫中均有表达,这与许袖以小鼠为研究对象的研究结果相反,即在小鼠的子宫内膜中,mRNA在妊娠期的前4天没有表达,第5天才出现特异性表达,且在假孕和延迟着床的子宫中没有表达,推测这可能是不同物种之间存在差异的结果。基因在产多羔黔北麻羊的垂体、子宫、输卵管和卵巢的表达量极显著高于产单羔的黔北麻羊,下丘脑未达到显著水平,提示基因可能参与黔北麻羊产羔性状的调控,其具体作用机制有待进一步研究。
本研究以黔北麻羊的卵巢、输卵管和下丘脑组织cDNA为模板,成功克隆了基因的CDS区,与NCBI上传数据库中山羊的编码区序列进行对比,同源性达99.85%,碱基由A突变为T,属于同义突变,所编码的氨基酸不变,表明黔北麻羊基因所编码蛋白质的功能不发生改变。基因共编码225个氨基酸,理论等电点(7.63)与李蒙等在三疣梭子蟹(7.98)的研究结果差距较小,推测可能是不同物种之间存在差异。GPx3蛋白是疏水性蛋白质,且该蛋白的不稳定指数为50.47,属于不稳定蛋白质。蛋白质的高级结构对其发挥生物学功能起着决定性作用。本研究发现黔北麻羊GPx3蛋白三级结构的预测结果与二级结构分析一致,均主要是由无规则卷曲和-螺旋构成,这与郭笑对人体GPx3蛋白质的预测结果相符。对GPx3蛋白进行亚细胞定位和信号肽分析,程雪艳等研究发现GPx3蛋白主要定位于细胞外,属于分泌蛋白,与本实验的结果一致;SignalP4.1预测结果显示GPx3蛋白具有信号肽,与前人的研究结果相同,说明GPx3蛋白在跨膜蛋白运输中起着信号识别的作用。GPx3蛋白的剪切位点位于第24位和第25位氨基酸之间,提示其成熟肽始于第24位氨基酸。经同源性分析发现,黔北麻羊基因编码区的序列与绵羊同源性最高(99.6%),其次是牛(98.2%),最低的是鸡(68.8%),表明基因的CDS区序列在哺乳动物中具有较高的保守性和种属特异性,这符合物种进化的规律,结果与唐蕾等的研究结果相同。
4 结 论
本研究成功克隆了黔北麻羊基因的CDS区序列,分析发现GPx3蛋白是一种具有信号肽的不稳定的亲水性分泌蛋白质,二级结构主要由无规则卷曲和-螺旋构成。qRT-PCR显示基因在产单、多羔黔北麻羊的5个不同性腺组织中均有表达,且存在组织表达特异性;在多羔组中的表达量皆高于单羔组,提示基因可能对黔北麻羊的产羔性状具有正向调控作用。
