茶轮斑病菌的生物学特性研究
2022-01-19谭荣荣毛迎新黄丹娟王红娟王友平
谭荣荣,毛迎新,黄丹娟,王红娟,陈 勋,王友平
(1.湖北省农业科学院果树茶叶研究所/湖北省农业科技创新中心果茶分中心,湖北 武汉 430064;2.湖北省农业科学院植保土肥研究所,湖北 武汉 430064)
茶树轮斑病是一种半知菌亚门拟盘多毛孢属(Pestalotiopsis)病原菌,该属真菌是引起多种园艺植物重要病害的病原[1-3],侵染茶树叶片表现轮斑症状的致病菌通常指P.Theae菌,浜屋悦次等[4]报道的P.Longiseta,以后陆续报道Pestalotiopsis属的 9 个种如P.guepinii、P.versicolor等,以及盘单毛孢属(Monochaetia)的 1 个种M.karstenii,也同样能侵染茶树叶片,并引起类似症状,统称轮斑病[5,6]。该病主要为害成叶和老叶的叶尖、叶缘或者叶片的其他部位,也为害嫩叶和嫩梢,引起大量叶片脱落,并引起枯梢,致使树势衰弱,产量大幅度下降。中国各产茶省均有分布,印度、斯里兰卡、日本及肯尼亚等东非国家均有发生。高温高湿,排水不良,扦插苗圃或者密植园湿度大时发病严重;机采,强采,修剪及虫害严重的茶园,因伤口过多,有利于病菌的侵入,因而发病也重[7]。为此开展茶轮斑病菌生物学特性研究,为茶轮斑病诊断流行学和综合防治提供理论依据。
1 材料与方法
1.1 试验材料
茶树病叶及室内离体接种叶片均采自湖北省农业科学院果树茶叶研究所资源圃。
1.2 试验方法
将采集的茶轮斑病样本叶片用脱脂棉蘸取酒精擦拭消毒,挑取病菌生长良好的叶片,用手术刀切取病健交界处0.5 cm2组织块,用75% 酒精漂洗3次,每次45 s,用灭菌水冲洗两次。用牙签置于已制备的PDA培养皿中,每皿3个组织块,封口后置于25℃,光照∶黑暗=16 h∶8 h,湿度为68%(培养箱基本条件)的人工培养箱中培养。
挑选生长良好,没有杂菌污染的初步分离的菌,用牙签挑取菌落边缘处菌丝,放至PDA培养皿中,待培养皿长出菌丝后,在边缘挑取菌丝镜检。
1.3 茶轮斑病生物学特性研究
1.3.1 不同pH值对茶轮斑病菌生长速率和产孢量的影响 用浓盐酸和氯化钠粉末分别配置0.1% HCL和0.1% NaCL,用胶头滴管添加至已制备的PDA培养基中,分别调至所需pH值,高温高压灭菌。
用灭菌打孔器打取培养5 d的菌落边缘直径为0.5 cm的菌饼,分别接种至8种不同pH值(4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0)的培养基上,每个处理设置5个重复,封口膜封口做标记,置于人工培养箱中培养。用十字交叉法分别测量培养3、5和7 d的菌落直径,第13 d测产孢量。
1.3.2 不同种类培养基对茶轮斑病菌生长速率和产孢量的影响 选用6种不同的培养基(表1),分别为马铃薯葡萄糖培养基(PDA)、燕麦琼脂培养基(OA)、PDA+茶叶煎汁培养基、固体查彼培养基(Czapek)、麦芽糖琼脂培养基、马铃薯蔗糖培养基(PSA),用灭菌打孔器打取培养5 d的菌落边缘直径为0.5 cm的菌饼,分别接种至6种不同的培养基上,每个处理设置5个重复,封口膜封口做标记。置于人工培养箱中培养。用十字交叉法分别测量培养3 d、5 d 和7 d的菌落直径,第13 d测产孢量。

表1 培养基及配方
1.3.3 不同碳源对茶轮斑病菌生长速率和产孢量的影响 以固体Czapek培养基为基础培养基,分别用等质量碳素的可溶性淀粉、葡萄糖、蔗糖代替基础培养基中的碳源,制备不同碳源培养基。用灭菌打孔器打取培养5 d的菌落边缘直径为0.5 cm的菌饼,分别接种至3种不同的培养基上,每个处理设置5个重复,封口膜封口做标记。置于人工培养箱中培养。用十字交叉法分别测量培养3 d、5 d和7 d的菌落直径,第13 d测产孢量。
1.3.4 不同氮源对茶轮斑病菌生长速率和产孢量的影响 以固体Czapek培养基为基础培养基,分别用等质量氮素的硫酸铵、磷酸二氢铵、甘氨酸置换基础培养基中的硝酸钠,配制不同氮源培养基。用灭菌打孔器打取培养5 d的菌落边缘直径为0.5 cm的菌饼,分别接种至3种不同的培养基上,每个处理设置5个重复,封口膜封口做标记。置于人工培养箱中培养。用十字交叉法分别测量培养3、5和7 d的菌落直径,第13 d测产孢量。
1.3.5 不同温度对茶轮斑病菌生长速率和产孢量的影响 用打孔器在PDA培养基上培养4 d的菌落边缘取菌块,菌块直径0.5 cm,接种至PDA培养基上,分别置于22、25、28、30、32℃恒温培养箱中,每个处理设置5个重复,封口膜封口做标记。置于人工培养箱中培养。用十字交叉法分别测量培养3、5和7 d的菌落直径,第13 d天测产孢量。
1.3.6 不同光照条件对茶轮斑病菌生长速率和产孢量的影响 用打孔器在PDA培养基上培养4 d的菌落边缘取菌块,菌块直径0.5 cm,接种至PDA培养基上,分别置于全光照、12 h光暗交替、全暗条件的培养箱中,每个处理设置5个重复,封口膜封口做标记。置于人工培养箱中培养。用十字交叉法分别测量培养3、5和7 d的菌落直径,第13 d测产孢量。
1.4 数据处理
采用Excel处理数据并进行显著性分析,数据以“M±SD”表示。
2 结果与分析
2.1 不同pH对茶轮斑病菌菌落生长及产孢量的影响
茶轮斑病菌在pH为4.5~8的范围内均可以生长(表2,图1),其中适宜pH值为5.0。培养7 d时,菌落最大直径为8.67 cm。生长前期,不同pH条件下,菌丝生长情况差异明显,随着培养时间的延长差异逐步减小。在pH为7时有最大产孢量。不同pH值对茶轮斑病菌菌丝的密集程度有影响,pH 6~7菌丝较密集,且轮纹状明显,偏酸性环境下,其菌落边缘为波浪状,偏碱性环境对菌落形态有很大影响。

表2 不同pH条件下菌落生长情况和产孢量
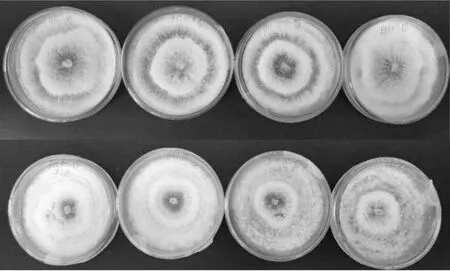
图1 不同 pH对菌落生长的影响(生长7天)Fig. 1 Effect of pH on colony growth in 7 d注:第1排从左至右pH值依次为4.5、5.0、5.5、6.0;第2排从左至右pH值依次为6.5、7.0、7.5、8.0。
2.2 不同培养基种类对茶轮斑病菌菌落生长及产孢量的影响
茶轮斑病菌在不同培养基上的菌落生长情况存在差异(表3、图2)。在不同培养基上菌落均为乳白色,不同培养基菌丝密集程度不同,PDA培养基菌落轮纹状生长,PDA+茶汁培养基上菌落呈花瓣状,Czapek培养基上菌落呈放射状,PSA培养基和OA培养基上菌落呈波浪状。培养3 d时菌落在各种培养基上的生长速度为:PDA >麦芽糖琼脂> PDA+茶汁> PSA > Czapek > OA;培养5 d时菌落在各种培养基上的生长速度为:PDA >麦芽糖琼脂> PDA+茶汁、PSA> Czapek>OA;培养7 d时菌落在各种培养基上的生长速度为:OA>PDA>PSA> PDA+茶汁>麦芽糖琼脂> Czapek。其产孢量为:Czapek> OA> PDA+茶汁> PDA>麦芽糖琼脂>PSA。
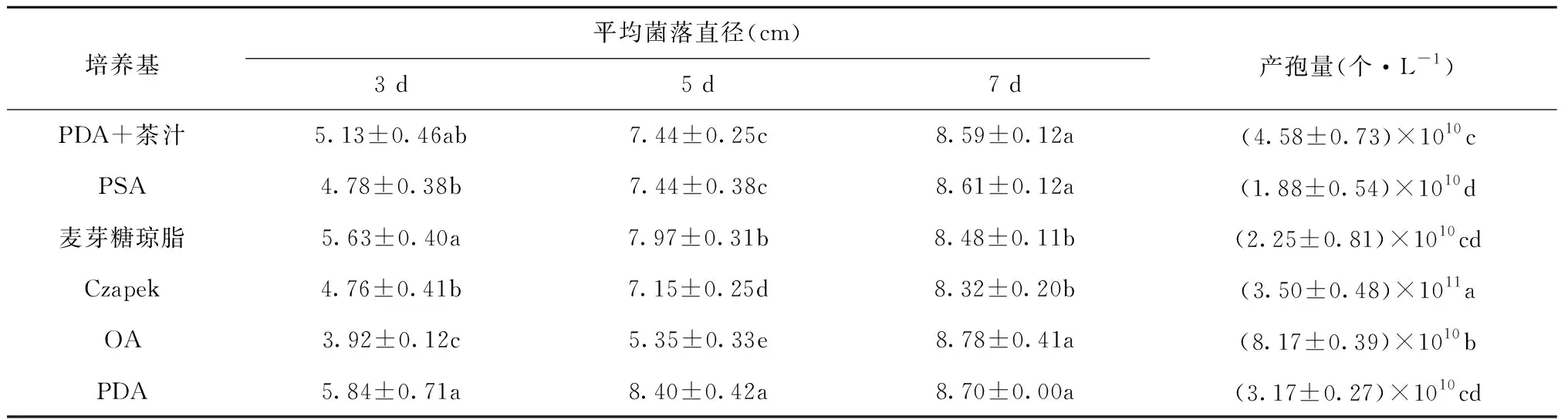
表3 不同培养基条件下菌落生长情况及产孢量
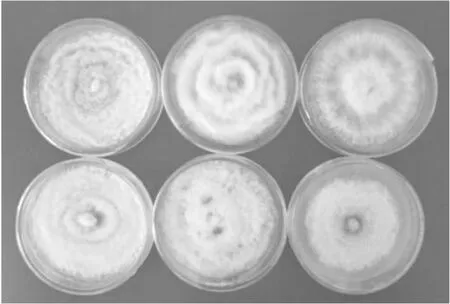
图2 不同种类培养基对菌落生长的影响(生长7天)Fig.2 Effect of media on colony growth in 7d注:培养基第1排从左至右依次为PDA、PDA+茶汁和Czapek,第2排从左至右依次为PSA、麦芽糖琼脂和OA。
2.3 不同碳源对茶轮斑病菌菌落生长及产孢量的影响
茶轮斑病菌在含有不同碳源的培养基上生长情况和产孢量存在差异(表4,图3)。茶轮斑病菌在不同碳源下菌落均为乳白色,菌落不规则。碳源为葡萄糖时菌落为轮纹状,碳源为可溶性淀粉与蔗糖时菌落为波浪状。在整个培养过程中,茶轮斑病菌对各种碳源均可利用,其中菌落生长速度为:蔗糖>葡萄糖>可溶性淀粉。产孢量为:葡萄糖>蔗糖>可溶性淀粉。

图3 不同碳源对病原菌菌落生长的影响(生长7天)Fig.3 Effect of carbon sources on colony growth in 7 d注:碳源从左到右依次为蔗糖、可溶性淀粉和葡萄糖。
2.4 不同氮源对茶轮斑病菌菌落生长及产孢量的影响
茶轮斑病菌在含有不同氮源的培养基上菌落均为白色,边缘波浪状,菌丝生长茂盛。培养初期,以磷酸二氢铵为氮源的菌落生长速度最快(图4)。不同氮源对轮斑病菌菌丝密集程度和菌落形态有影响。茶轮斑病菌在含有不同氮源的培养基上产孢量存在差异(表5),不同氮源培养过程中菌落生长速度为:磷酸二氢铵>甘氨酸>硫酸铵。产孢量为:硫酸铵>磷酸二氢铵>甘氨酸。
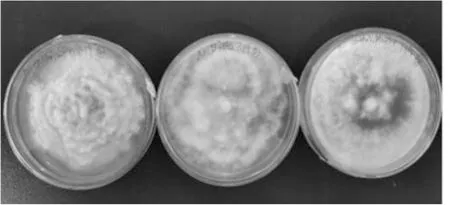
图4 不同氮源对菌落生长的影响(生长7天)Fig.4 Effect of nitrogen sources on colony growth in 7 d注:氮源从左到右依次为硫酸铵、甘氨酸和磷酸二氢铵。

表5 不同氮源条件下菌落生长及产孢量
2.5 不同温度对茶轮斑病菌菌落生长及产孢量的影响
茶轮斑病菌在不同温度下生长情况和产孢量存在差异(表6,图5),茶轮斑病菌在不同温度下生长速度快慢顺序为:25℃>28℃>30℃>22℃>32℃,在22~30℃之间,菌丝均可生长,其中最适生长温度为25~28℃,当温度升至32℃时菌落生长速度明显减缓。在试验过程中,随着温度的变化,产孢量随之改变,其中各温度点产孢量变化趋势为:28℃>22℃>30℃>25℃,当温度升至32℃,产孢量为零。温度对茶轮斑病菌菌落形态和菌丝密集程度有关,菌落均为乳白色。在28℃条件下菌落呈轮纹状,30℃时菌落为斑点状,22℃、25℃时菌落为波浪状,32℃没有形成菌落。
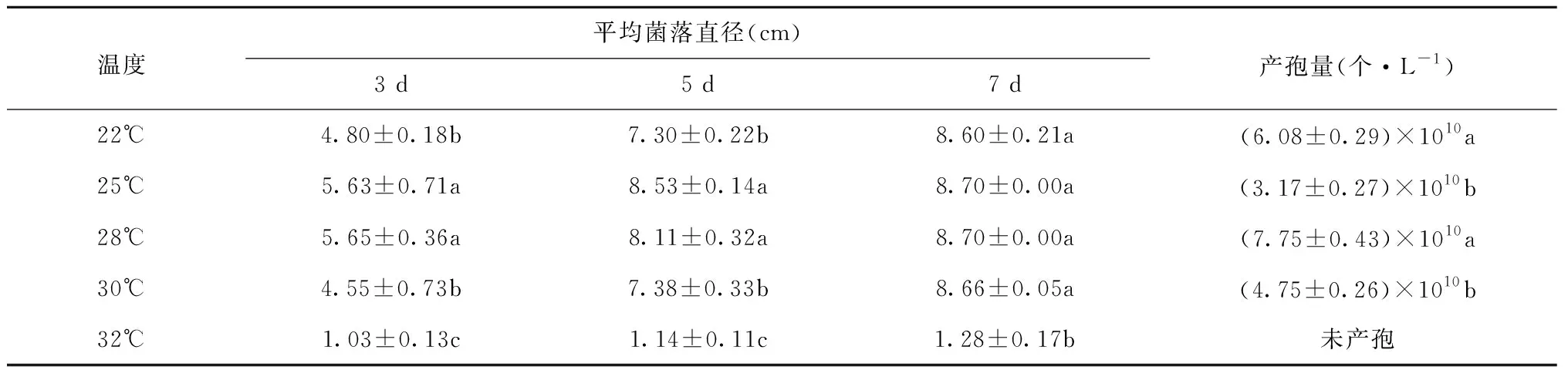
表6 不同温度条件下菌落生长情况及产孢量

图5 不同温度对菌落生长的影响(生长7天)Fig.5 Effect of temperatures on colony growth in 7 d注:从左到右温度依次为22、25、28、30和32℃。
2.6 不同光照对茶轮斑病菌菌落生长及产孢量的影响
茶轮斑病菌在不同光照条件下生长情况和产孢量存在差异(表7,图6),茶轮斑病菌在不同光照条件下菌落生长快慢顺序为:全暗>全光照>光暗交替,全光照条件下培养有最大产孢量。各种光照条件下,茶轮斑菌菌落均为乳白色,圆形,其中全光照培养菌落呈波浪状,全暗和光暗交替条件下菌落生长呈花瓣状。

表7 不同光照条件下菌落生长情况及产孢量

图6 不同光照对菌落生长的影响(生长7天)Fig.6 Effect of light on colony growth in 7 d注:光照从左到右依次为全光照、全暗和光暗交替。
3 讨论与结论
茶轮斑病对茶树致病程度与环境条件有着密切的关系。光照、温度、湿度、营养、酸碱度对茶轮斑病孢子和菌丝的生长有很重要的影响。不同光照条件下,菌丝均可生长,全光照条件下有最大产孢量。在22~30℃条件下,病原菌均可生长,最适合的生长温度是25~28℃。28℃时有最大产孢量。高温会抑制菌丝的生长和孢子的萌发,当温度升至32℃,产孢量为零。pH在5~7范围内病原菌分生孢子均可萌发且芽管伸长较好,过酸或过碱的环境都会抑制病原菌的萌发和菌丝生长。其中病菌生长的最适pH值为6.0,当pH为7时可达到最大产孢量。最适培养基为PDA培养基中,且以蔗糖为碳源的培养基适宜菌丝的生长,以磷酸二氢铵为氮源的培养基菌落生长速度快。
生产上捋采、机械采茶、修剪、排水不良、茶树虫害多以及夏季扦插苗和密植的茶园易发病[8]。茶园中,茶轮斑病主要在叶片和新梢上发生,叶肉较厚、老叶更易于茶轮斑病菌的侵染,侵染初期,病健交界不明显且呈黑褐色坏死,而且发病后病情比较严重。幼叶病菌侵染速度较慢,病健交界明显,黑褐色坏死斑明显且周围有轻微褪绿。轮斑病在茶园内分布特色明显,呈聚集分布,最适合的田间分布型调查是双对角线抽样法[9]。最近研究显示50%多菌灵可湿性粉剂对病原菌菌丝生长的抑制效果最好[10]。
