铁基载氧体煤化学链制氢的强化反应
2022-01-13袁思杰王凌云郭庆杰
安 阳,袁思杰,吴 曼,王凌云,郭庆杰
(青岛科技大学 化工学院,山东 青岛 266042)
二氧化碳的排放会导致气候变化,而氢能作为一种燃烧效率高、无碳排放的二次能源受到广泛关注[1-2]。目前的制氢方式主要是化石燃料重整制氢[3]和可再生资源制氢[4],工业上常用的蒸汽甲烷重整(SMR)制氢需要变压吸附装置(PSA)脱除CO2,能耗较大[5]。我国煤炭资源丰富,开发煤炭高效制氢方式迫在眉睫[6-8]。
制氢工艺基于化学链燃烧技术[9-10]发展而来,兼顾了碳捕集和高效制氢技术[11]。目前化学链与制氢结合的方式主要有3种:化学链重整制氢(CLR)、混合燃烧-气化化学链制氢(HLG)以及水蒸气代替空气的化学链制氢(CLHG)[12]。
CLR工艺是将燃料和水蒸气通入燃料反应器,载氧体(oxygen carrier,OC)提供晶格氧后发生化学链气化,燃料部分氧化得到合成气,经过转变反应器和变压吸附装置后得到高纯氢[13-14]。目前,对CLR工艺的研究较多,但是该工艺复杂,且后续装置耗能较多,还需进一步完善。HLG工艺是将燃料和水蒸气直接气化,通过化学链燃烧进行碳捕集并提供热量[15]。阳绍军等[16]用CaO吸收甲烷重整和水煤气变换产生CO2,化学链燃烧使用NiO作载氧体,模拟计算氢气体积分数为93.23%。蒋景周等[12]将生物质气化,经过分离设备得到高纯氢,剩余不含氢气的气体与载氧体发生化学链燃烧,实现碳捕集,载氧体在空气反应器中再生,同时为气化装置提供热量。HLG工艺中化学链技术的作用有限,同样需要分离装置,能耗较多。
CLHG与化学链燃烧类似,将空气替换成水蒸气,在蒸汽反应器中还原态载氧体被水氧化,生成高纯氢和氧化态载氧体。CLHG是一种绿色、高效得制氢技术[17],研究重点主要集中在载氧体的反应性能优化方面[18],其中铁基载氧体价廉易得[19],惰性组分Al2O3耐烧结性能良好[20],易于大规模制备。孙小燕等[21]对以Fe3O4为载氧体的二反应器CO化学链制氢进行了模拟和热重分析,得出了部分反应机理和动力学参数。Chiesa等[22]使用铁基载氧体从热力学方面模拟了三反应器天然气化学链制氢的可行性,氢气纯度和碳捕集效率良好。Zhu等[23]提出了一种用于氢气和合成气联产的化学循环干重整工艺,在还原的铁基载氧体上可以实现CO2和CH4到合成气的有效转化,在蒸汽氧化阶段中提高氢气产率,但是对于化学链制氢工艺的优化方面的研究仍有不足之处。
为完善更加经济、高效的制氢工艺,本文中拟综合二反应器煤CLHG和三反应器煤CLHG的优势,以煤为燃料,通过增加反应过程实现对化学链制氢过程的强化,称为强化煤化学链制氢(enhanced coal chemical looping hydrogen generation,强化煤CLHG)。强化煤CLHG的优化过程为:选取廉价的铁基载氧体,以梅花井烟煤为原料,在固定床上进行相关实验,首先探究煤与铁基载氧体的质量比对强化煤CLHG工艺的影响;对比强化煤CLHG与三反应器煤CLHG工艺,通过XRD表征不同阶段铁基载氧体的变化;对比二反应器煤CLHG、三反应器煤CLHG以及强化煤CLHG这3种工艺过程在循环实验中的氢气产量,探究强化煤CLHG工艺的可行性,以期为工业化应用提供参考依据。
1 实验
1.1 制氢原理
化学链制氢的主要反应式有
Fe2O3+C→CO2+H2O+FeO或Fe,
(1)
FeO或Fe+H2O→Fe3O4+H2,
(2)
Fe3O4+C→FeO或Fe+CO2+H2O,
(3)
Fe3O4+O2→Fe2O2。
(4)
3种化学链制氢方式的反应流程示意图如图1所示。图1(a)为二反应器煤CLHG,图1(b)为三反应器煤CLHG,图1(c)为强化煤CLHG。由图1(c)可知,强化煤CLHG的反应流程为:在燃料反应器(FR)中Fe2O3载氧体被煤还原,发生的反应为式(1);在蒸汽反应器(SR)中还原态的载氧体FeO或Fe被水蒸气部分氧化,制取氢气,发生的反应为式(2);部分氧化的载氧体Fe3O4进入FR与新加入的煤进行反应为式(3);还原态载氧体FeO或Fe在SR中与水再次反应制氢,发生的反应为式(2);最后Fe3O4进入空气反应器(AR)煅烧实现载氧体的再生,发生的反应为式(4)。综上,相比于二、三反应器煤CLHG,强化煤CLHG进行了2次制氢,使用空气反应器的次数少,能够有效降低能量消耗。
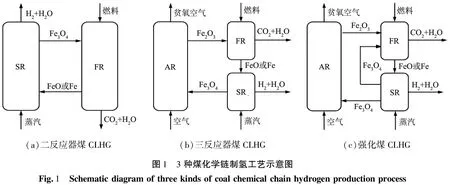
(a)二反应器煤CLHG(b)三反应器煤CLHG(c)强化煤CLHG图1 3种煤化学链制氢工艺示意图Fig.1 Schematicdiagramofthreekindsofcoalchemicalchainhydrogenproductionprocess
1.2 铁基载氧体的制备
采用浸渍法制备Fe4Al6载氧体(Fe2O3质量分数为40%,Al2O3质量分数为60%)。相比于其他制备方法,浸渍法制备的载氧体负载均匀,制备时间较短,适合大规模生产。制备方法如下:将202.4 g的Fe(NO3)3·9H2O(分析纯,国药集团)溶于去离子水中,将60 g的Al2O3(分析纯,国药集团)作为载体加入溶液中,在80 ℃下加热搅拌2 h,然后移入100 ℃的烘箱中干燥10 h,最后在950 ℃的马弗炉中煅烧4 h,即可获得Fe4Al6载氧体。将样品进行压碎并筛分,获得粒径为150~450 μm的均质颗粒。
1.3 煤样
选取宁夏梅花井煤作原料,对煤样进行粉碎、筛分处理,获得粒径为97~125 μm的均质颗粒,装袋备用。梅花井煤样的工业分析与元素分析见表1。
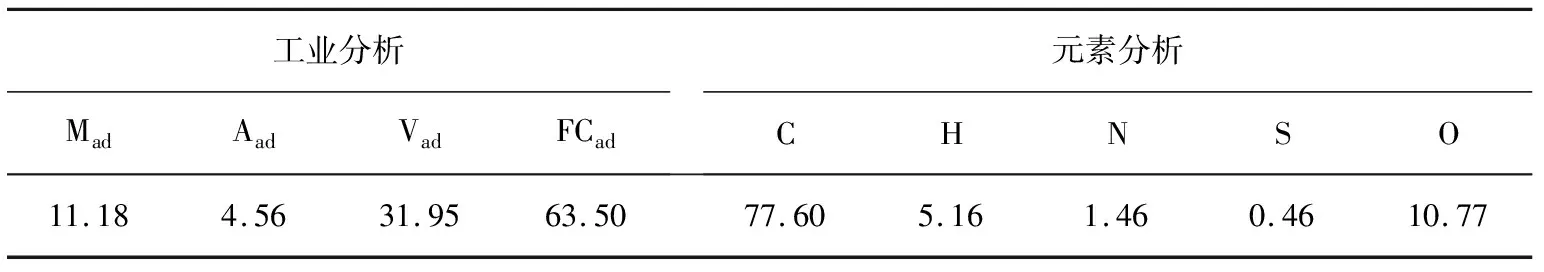
表1 煤样的工业分析和元素分析
1.4 装置及流程
管式炉反应器实验装置示意图如图2所示。由图可知,实验装置由气体分配系统(空气和氩气储气罐、气体流量计)、蒸汽发生系统(蠕动泵、蒸汽发生器)、管式炉反应系统(管式炉反应器、石英舟、温度控制系统)、冷却系统、检测分析系统(湿式气体流量计、气相色谱仪)组成。蒸汽发生器由蠕动泵控制水流量,在300 ℃的炉内预热,产生的蒸汽进入管式炉。气相色谱仪可对气体中各组分的含量进行分析。
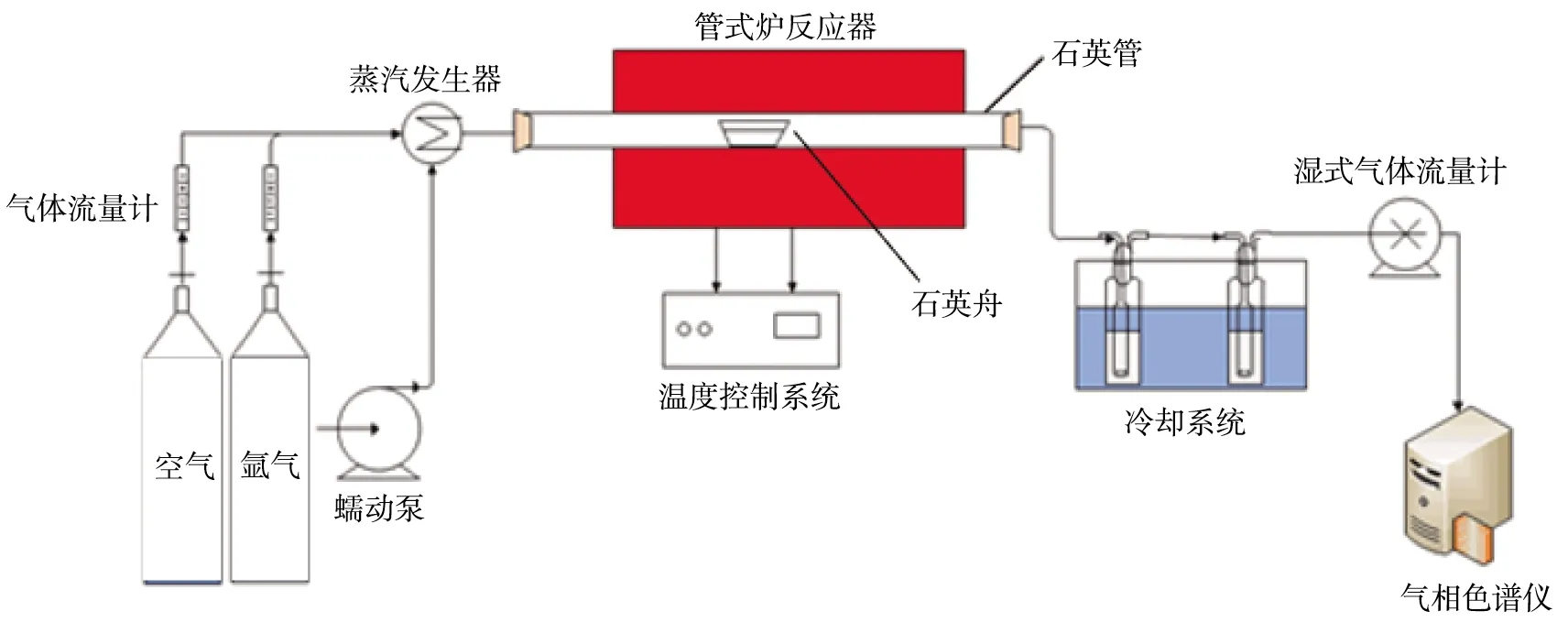
图2 管式炉反应器实验装置示意图
实验流程为:在还原阶段,称取一定质量的煤和载氧体,混合均匀后置于石英舟中,将其放在石英管的冷温区;采用高纯氩作吹扫气和保护气,以200 mL/min的气体速率对管内持续吹扫20 min;当系统温度达到设定值时,迅速将石英舟推至石英管的中间加热区,设定反应时间为90 min;出口气体经冷却系统、流量计后,通过气袋收集气体,每组气袋收集5 min;在蒸汽氧化阶段,氩气氛下通入速率为0.1 g/min的水蒸气,反应90 min后得到部分氧化的载氧体,同时收集出口气体;将部分氧化的载氧体与煤按比例混合均匀,重复上述步骤1次;蒸汽氧化阶段结束后,关闭氩气气路,通入空气,反应时间为90 min,使载氧体完全氧化。
1.5 数据处理方法
气体产物的体积分数φi的计算公式为
(5)
式中:φi(i分别代表H2、CO、CO2、CH4)为出口气体中各气体的体积分数,%;Vi为各气体的体积,L。
碳转化率rC的计算公式为
(6)
式中:rC为气体产物中的碳与煤中碳的物质的量之比,%;Vg为气体产物的总体积,L;mcoa为煤样质量,g;wC为煤中碳的质量分数,%。
2 结果与讨论
2.1 煤与载氧体的质量比对强化煤CLHG的影响
在强化煤CLHG工艺中,煤与铁基载氧体的质量比(记为mcoa∶mOC)对碳转化率、氢气产量和氢气体积分数的影响如图3所示。
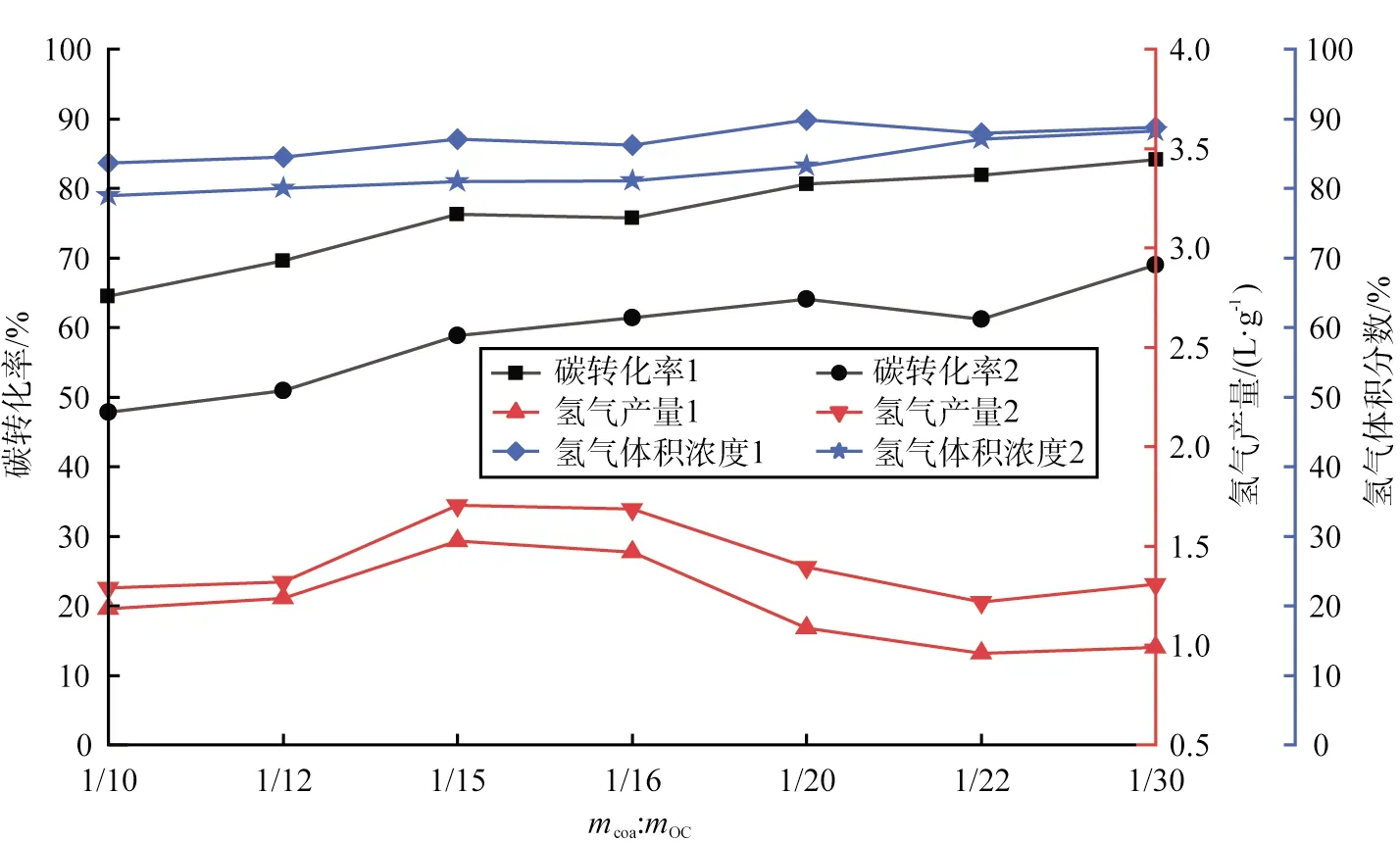
图3 煤与载氧体的质量比对碳转化率、氢气产量和氢气体积分数的影响
由图可知,随着铁基载氧体质量的增加,碳转化率逐渐上升,当mcoa∶mOC为1∶30时,碳转化率达到最大值84.16%,这是因为有更多的晶格氧与煤进行反应;然而氢气产量与mcoa∶mOC并不是线性关系,随着铁基载氧体质量的增加,产氢量先上升后降低,在mcoa∶mOC为1∶15时氢气产量达到峰值1.74 L/g;在mcoa∶mOC为1∶15之前,铁基载氧体质量增加,意味着有更多的FeO或Fe参与反应,使得氢气产量逐渐增加;而在mcoa∶mOC为1∶15之后,随着铁基载氧体质量增加,铁基载氧体的深度还原能力变弱,还原阶段后产生的Fe逐渐减少,化学反应式为
3FeO+H2O→Fe3O4+H2,
(7)
3Fe+4H2O→Fe3O4+4H2。
(8)
由式(7)、(8)可知,Fe与水蒸气反应产生的氢气量是FeO与水蒸气反应的4倍,所以氢气产量逐渐下降,氢气体积分数基本没有变化。综上,强化煤CLHG工艺中mcoa∶mOC最佳值为1∶15,氢气产量峰值为1.74 L/g。
2.2 强化煤CLHG与三反应器CLHG的对比
通过对比强化煤CLHG与三反应器CLHG,2种制氢工艺的出口气体体积分数随反应时间变化的曲线如图4所示。由图可知,2种制氢工艺的还原阶段即0~90 min,三反应器煤CLHG以Fe2O3为载氧体,其出口气体主要是CO2和CO,煤炭未被完全转化;强化煤CLHG以Fe3O4为载氧体,其出口气体主要是CO,CO2的体积分数较三反应器煤CLHG明显降低;这主要是因为Fe3O4的晶格氧含量低于Fe2O3,导致氧源不充足,煤无法完全氧化成CO2,但是铁基载氧体更多地还原成低价态,有利于铁基载氧体与水的反应。在蒸汽氧化阶段即90~180 min,2种制氢工艺的主要出口气体均是H2,体积分数峰值出现在115 min,三反应器煤CLHG的体积分数峰值为21.6%,强化煤CLHG的体积分数峰值为22.2%,H2体积分数在达到峰值后的下降速度比三反应器煤CLHG缓慢,CO2体积分数稍高,说明还原阶段后的残余焦炭在蒸汽氧化阶段进一步反应。
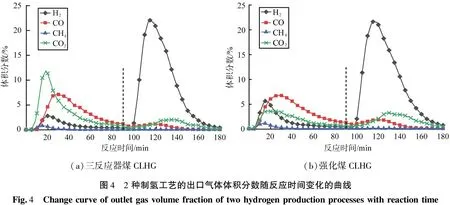
(a)三反应器煤CLHG(b)强化煤CLHG图4 2种制氢工艺的出口气体体积分数随反应时间变化的曲线Fig.4 Changecurveofoutletgasvolumefractionoftwohydrogenproductionprocesseswithreactiontime
三反应器煤CLHG的碳转化率为73.14%,氢气产量为1.47 L/g;强化煤CLHG的碳转化率为60.83%,低于三反应器煤CLHG的,说明三反应器煤CLHG更能促进煤的转化,Fe2O3载氧体的反应性能更高,但是不利于载氧体的还原。强化煤CLHG的产氢量为1.74 L/g,比前者提高了18.37%,氢气全部来自FeO或Fe与水蒸气的反应,分析原因主要有2点:强化煤CLHG的铁基载氧体深度还原,更多的载氧体被转化成FeO和Fe;还原阶段的残炭在蒸汽氧化阶段与部分氧化的载氧体进一步反应,使得部分Fe3O4再次被还原成FeO或Fe,如式(3)。
不同反应阶段载氧体的XRD图谱如图5所示。根据文献[24-25]可知:FeAl2O4在还原阶段不利于Fe0的生成,因为热力学性质很难与水反应。由曲线(b)、(d)比较可知,曲线(d)中的FeAl2O4特征峰减弱,Al2O3和Fe的特征峰增强,说明铁基载氧体被深度还原,使得更多的还原态载氧体与水蒸气反应,导致氢气产量增加;由曲线(c)、(e)比较可知,前者仍存在明显的Fe特征峰,而后者的Fe特征峰减弱,说明后者在蒸汽氧化阶段铁基载氧体与水蒸气充分反应。
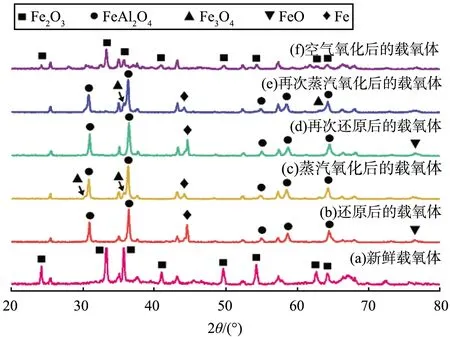
图5 不同反应阶段载氧体的XRD图谱
2种制氢工艺的碳转化率和氢气产量如表2所示。由表可以看出,除残炭后,强化煤CLHG的产氢量(1.13 L/g)比三反应器煤CLHG(1.03 L/g)高出9.71%,说明铁基载氧体被深度还原,与XRD表征结果一致。与未除残炭结果对比可以发现,除残炭后的氢气产量(1.13 L/g)明显低于未除残炭的(1.74 L/g),说明还原阶段后的残炭量是影响氢气产量的主要因素,FeO或Fe被水蒸气部分氧化成Fe3O4,残炭将Fe3O4进一步还原成FeO或Fe,使得更多的水蒸气参与反应,最终氢气产量增加。

表2 2种制氢工艺的碳转化率和氢气产量
2.3 3种制氢工艺的多循环实验
进行二反应器煤CLHG、三反应器煤CLHG、强化煤CLHG实验后,分别收集载氧体,与煤混合后重复3种制氢工艺实验,探究载氧体的循环性能。3种制氢工艺在多循环实验中的碳转化率和氢气产量如图6所示。由图可知,在6次循环实验中,二反应器煤CLHG的碳转化率快速下降,三反应器煤CLHG的循环实验中,碳转化率和氢气产量都轻微下降;强化煤CLHG在6次循环实验中,碳转化率和氢气产量上下波动,但是未出现下降趋势;与三反应器煤CLHG相比,碳转化率总体相差不大,产氢量一直高于三反应器煤CLHG的;在二反应器煤CLHG中,Fe3O4作为载氧体,深度还原导致载氧体表面积炭严重,从而阻塞了载氧体的孔道结构,同时高温下载氧体发生了烧结,最终影响了晶格氧的释放;在蒸汽氧化阶段,残炭进一步反应,使得铁基载氧体被再次还原,从而使得氢气产量下降缓慢;对比三反应器煤CLHG,强化煤CLHG的第2、4、6次循环实验中,铁基载氧体被深度还原,产生更多的FeO或Fe,在蒸汽氧化阶段有部分残炭与载氧体再次反应,增强还原态的铁基载氧体与水的反应性能,使得氢气产量增加。
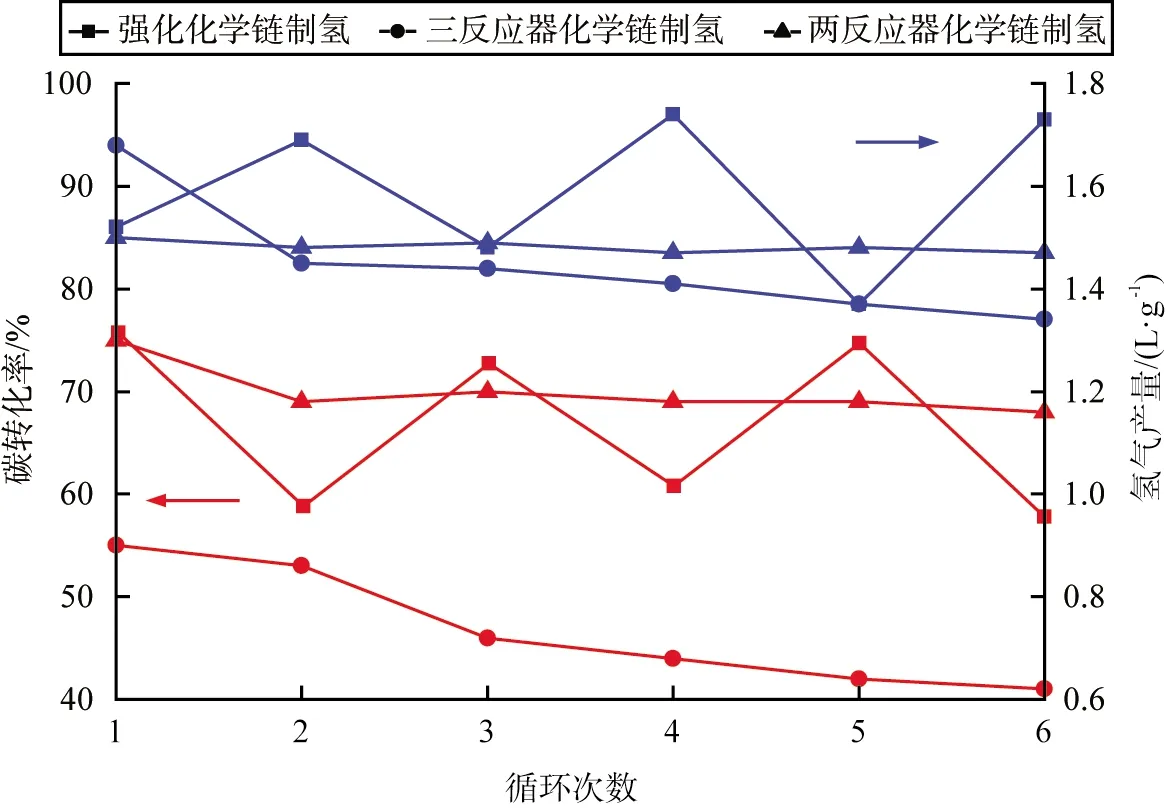
图6 3种制氢工艺在多循环实验中的碳转化率和氢气产量
3 结 论
1)强化煤CLHG与三反应器煤CLHG相比,铁基载氧体被深度还原,还原阶段的残炭被充分利用,氢气产量为1.74 L/g,比三反应器煤CLHG的1.47 L/g提高了18.37%。
2)随着铁基载氧体质量的增加,强化煤CLHG的氢气产量先增加后降低,这是铁基载氧体还原程度和残炭共同作用的结果,煤与载氧体的质量比为1∶15时,铁基载氧体的反应性能最佳,氢气产量峰值为1.74 L/g。
3)6次循环实验中,强化煤CLHG与三反应器煤CLHG的碳转化率总体相差不大,二反应器煤CLHG下降严重;强化煤CLHG的氢气产量始终高于二反应器CLHG和三反应器CLHG的。强化煤CLHG的铁基载氧体的循环反应性能更为优异。
