仙芎骨康颗粒对骨关节炎大鼠组织病理学及MMP-13、IL-1β影响的研究
2022-01-11倪宇峰汪轩尹华章建华
倪宇峰 汪轩 尹华 章建华
1.浙江中医药大学附属第一医院 杭州 310006 2.浙江中医药大学药学院中药标准化研究实验室
仙芎骨康颗粒是治疗骨关节炎(osteoarthritis,OA)的中药新药,其处方源自《太平圣惠方》的仙灵脾散,由淫羊藿、川芎、威灵仙、桂心、苍耳子等中药组成,具有补肾壮骨、活血通络、祛风止痛之功效,临床常以该方为基础随证加减,治疗骨关节疾病。浙江中医药大学附属第一医院骨伤科临床实践发现,应用该方治疗OA疗效显著。本研究建立半月板-前交叉韧带联合损伤的大鼠OA模型,通过软骨组织病理学、基质金属蛋白酶-13 (matrix metallopeptidase-13,MMP-13)、白细胞介素-1β(interleukin-1β,IL-1β)等指标检测,探讨仙芎骨康颗粒对大鼠OA模型的作用及相关机制,为OA的新药研发提供科学依据。
1 材料和方法
1.1 实验动物 雄性清洁级SD大鼠48只,体质量(200±20)g,购于上海斯莱克实验动物有限公司[实验动物生产许可证号码:SCXK(沪)2017-0005],饲养于浙江中医药大学动物实验中心屏障系统内[实验动物使用许可证号码:SYXK (浙)2018-0012],设有温度、湿度、光照、压力梯度等自动控制和显示系统,温度(22±1)℃,相对湿度(60±10)%,换风次数15~20次/h,光照12 h明暗交替。所有大鼠饲喂60Co辐照全价营养饲料,正式实验前适应性饲养1周。
1.2 药物及试剂 淫羊藿(柔毛淫羊藿)购于华东药材饮片有限公司(批号:141117),威灵仙、川芎、肉桂、苍耳子均购于浙江中医药大学中药饮片有限公司(批号:141101、141001、141101、141101), 均符合现行版《中国药典》规定。仙芎骨康药液由浙江中医药大学中药标准化研究实验室制备,上述饮片各50 g,10倍量50%乙醇回流提取2次,每次1 h,浓缩成含生药3 g·mL-1的药液;塞来昔布胶囊购于辉瑞制药有限公司(批号:R55865);盐酸氨基葡萄糖胶囊购于海南澳美华制药有限公司(批号:1504174);大鼠MMP-13、IL-1β酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购于苏州卡尔文生物科技有限公司(批号:20151201A、20150801A)。
1.3 主要仪器 Bio-Rad 680全自动酶标仪购于美国Bio-Rad公司;IX 71倒置相差显微镜购于日本Olympus公司;Centrifuge 5804R冷冻离心机为德国Eppendorf公司产品;Laborota 20 Compact旋转蒸发仪购于德国Heidolph公司。
1.4 方法
1.4.1 动物分组、模型建立及给药 大鼠适应性饲养1周后,随机分为空白对照组,模型组,仙芎骨康低、中、高剂量组,阳性对照组,每组8只,各组间体质量差异无统计学意义(P>0.05)。除空白对照组外,其余各组大鼠均采用Hulth法建立半月板-前交叉韧带损伤OA模型,具体方法:大鼠以3%巴比妥钠3 mL·kg-1腹腔注射,麻醉后左侧膝关节剃毛,聚维酮碘溶液消毒后,以膝关节髌骨为中心,沿髌骨内侧缘上下各2 mm依次切开皮肤与关节囊,显露关节腔,切断前交叉韧带,并用尖头刀刮损半月板,最后依次缝合关节囊和皮肤,建立OA模型。术后每只大鼠左侧大腿肌肉注射青霉素10 000 U·d-1,连续3 d。按照人与实验动物间体表面积折算等效剂量法(大鼠体质量以200 g计、人以70 kg计),折算出大鼠仙芎骨康药液的临床等效剂量为22.50 g·kg-1,以此作为中剂量,设置低剂量为11.25 g·kg-1,高剂量为45.00 g·kg-1;阳性对照组大鼠所用盐酸氨基葡萄糖和塞来昔布的临床等效剂量分别为0.09 g·kg-1、0.75 g·kg-1。 造模与灌胃给药同时进行,模型组和空白对照组灌胃给予等量0.9%氯化钠注射液,各组大鼠给药均为1次/d,连续8周。
1.4.2 指标检测
1.4.2.1 一般情况 观察各组大鼠的一般情况,每3 d称量记录大鼠的体质量,比较各组大鼠的活动、饮食、排便、皮毛肤色及精神状况。
1.4.2.2 组织病理学检测 处死各组大鼠,取膝关节,10%中性甲醛溶液固定,石蜡包埋,切片,制成3 μm的薄片,分别进行苏木精-伊红(hematoxylineosin,HE)染色、番红O(safranin O,SO)染色,光镜下观察组织病理学变化。
1.4.2.3 ELISA检测血清MMP-13、IL-1β表达水平 给药8周后,大鼠禁食12 h,取血,4℃下3 000 r/min离心10 min,分离血清,按试剂盒说明书操作,酶标仪上检测血清中MMP-13、IL-1β的水平。
1.5 统计学分析 采用SPSS 27.0统计软件进行统计学分析,计量资料以±s表示,组间比较采用单因素方差分析(one-way ANOVA)。 以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠体质量及一般情况比较 造模及给药期间,空白对照组大鼠精神状态良好,自主活动与饮食饮水均正常;模型组大鼠出现自主活动减少、静卧懒动、饮水减少等现象,但无抽搐颤栗、流涎、呼吸困难、痉挛等异常情况,毛顺光亮,粪便成型,与空白对照组无明显差别;各给药组大鼠表现优于模型组,给药3 d后,各给药组大鼠自主活动、饮水进食、精神状态开始恢复,1周左右活动饮食等均恢复正常,直至实验结束。实验期间,空白对照组大鼠体质量持续增长,与空白对照组比较,模型组大鼠体质量增长减缓,各时间点差异具有统计学意义(P<0.05,P<0.01);随着给药时间增加,各给药组大鼠体质量亦持续增长,但均明显低于同时间点空白对照组大鼠(P<0.05,P<0.01);与模型组比较,各给药组大鼠体质量增长差异无统计学意义(P>0.05)。 见表1。
表1 各组大鼠体质量比较(±s,g)Tab.1 Comparison of body mass in each group(±s,g)
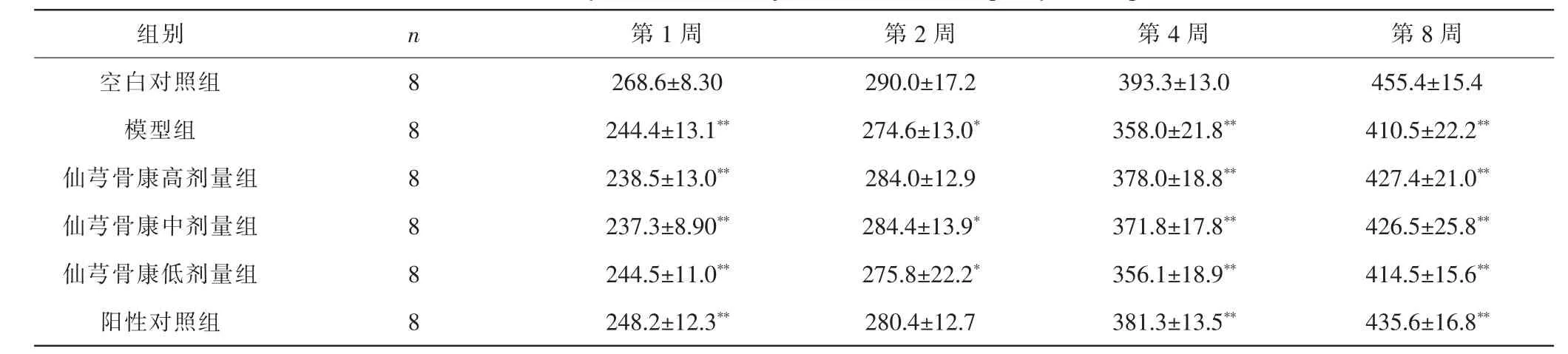
表1 各组大鼠体质量比较(±s,g)Tab.1 Comparison of body mass in each group(±s,g)
注:与空白对照组比较,*P<0.05,**P<0.01。Note:Compared with blank control group, *P<0.05,**P<0.01.
?
2.2 各组大鼠膝关节组织病理学表现比较 HE染色可见,空白对照组大鼠膝关节软骨层厚度均匀,表面光滑,四层结构清晰可见,无软骨细胞核固缩、坏死现象;与空白对照组比较,模型组大鼠关节软骨层变薄、粗糙,四层结构不易辨认,部分区域软骨细胞核固缩、坏死,偏于一侧,钙化层软骨细胞呈簇状堆积,排列紊乱,潮线多不规整甚至完全消失,软骨下骨质外露;与模型组比较,各给药组大鼠关节软骨层增厚,骨细胞增多,脂肪细胞减少,且仙芎骨康中、高剂量、阳性对照组较低剂量组软骨层修复更为明显。见图1。
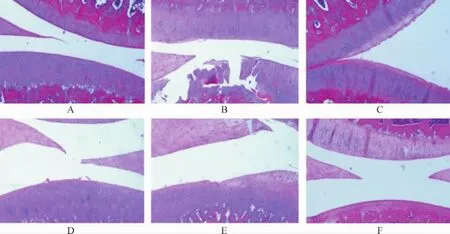
图1 各组大鼠膝关节病理变化(HE染色,25×)Fig.1 Pathological changes of knee joints of rats in each group (HE staining, 25×)
SO染色可见,空白对照组大鼠膝关节软骨层厚度正常,表面光滑;与空白对照组比较,模型组大鼠软骨明显变薄,软骨细胞局部排列紊乱;与模型组比较,各给药组大鼠膝关节软骨细胞增多,软骨层明显增厚,且仙芎骨康中、高剂量组、阳性对照组较低剂量组改善效果更为明显。见图2。
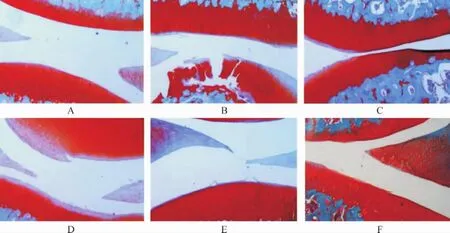
图2 各组大鼠膝关节病理变化(SO染色,25×)Fig.2 Pathological changes of knee joints of rats in each group (SO staining, 25×)
2.3 各组大鼠血清MMP-13、IL-1β水平比较 与空白对照组比较,模型组及各给药组大鼠血清MMP-13水平均显著升高(P<0.01);与模型组比较,仙芎骨康中、高剂量组和阳性对照组大鼠血清MMP-13水平显著降低(P<0.01), 但三组间差异无统计学意义(P>0.05),而且仙芎骨康低剂量组大鼠血清MMP-13水平与模型组差异无统计学意义(P>0.05)。与空白对照组比较,模型组与各给药组大鼠血清IL-1β水平均显著升高(P<0.01);与模型组比较,各给药组大鼠血清IL-1β均显著降低 (P<0.01),且给药组间差异无统计学意义(P>0.05)。 见表2。
表2 各组大鼠血清MMP-13、IL-1β水平比较(±s)Tab.2 Comparison of MMP-13 and IL-1β serum level in each group(±s)
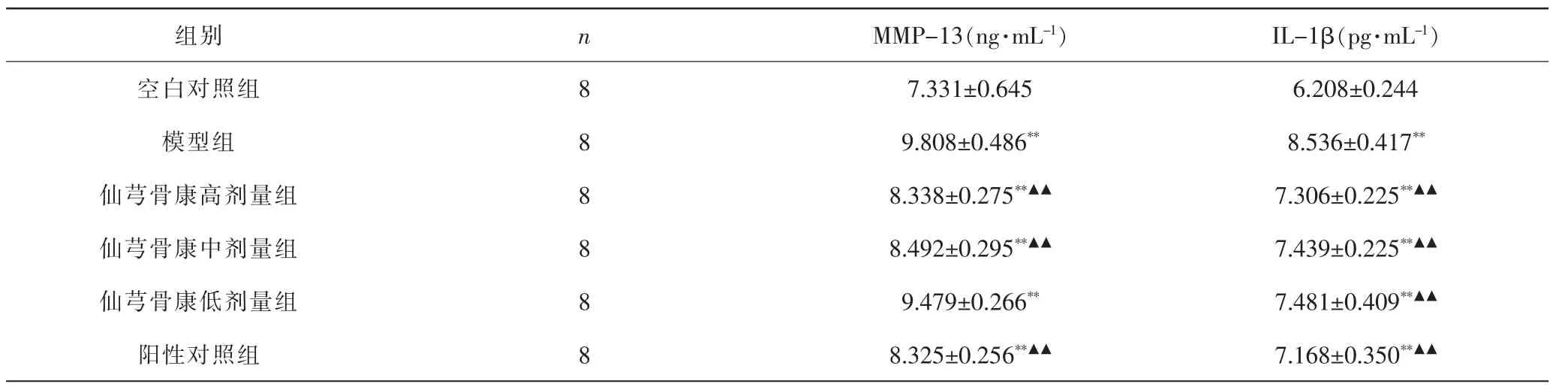
表2 各组大鼠血清MMP-13、IL-1β水平比较(±s)Tab.2 Comparison of MMP-13 and IL-1β serum level in each group(±s)
注:与空白对照组比较, **P<0.01;与模型组比较,▲▲P<0.01。Note:Compared with blank control group, **P<0.01;compared with model group,▲▲P<0.01.
组别 n MMP-13(ng·mL-1) IL-1β(pg·mL-1)空白对照组 8 7.331±0.645 6.208±0.244模型组 8 9.808±0.486** 8.536±0.417**仙芎骨康高剂量组 8 8.338±0.275**▲▲ 7.306±0.225**▲▲仙芎骨康中剂量组 8 8.492±0.295**▲▲ 7.439±0.225**▲▲仙芎骨康低剂量组 8 9.479±0.266** 7.481±0.409**▲▲阳性对照组 8 8.325±0.256**▲▲ 7.168±0.350**▲▲
3 讨论
仙芎骨康颗粒是项目组在《太平圣惠方》仙灵脾散的基础上自主研发的中药新药,主治早、中期OA。方中淫羊藿补肾阳、强筋骨、祛风湿为君药,川芎和威灵仙活血通络、祛风止痛为臣药,桂心补火助阳、散寒止痛、温通经脉为佐药,苍耳子祛风散寒止痛为使药。现代药理学研究表明,淫羊藿可减少蛋白多糖丢失、下调基质金属蛋白酶-3(matrix metallopeptidase-3,MMP-3)、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)表达,减缓关节软骨退变[1-2];还能够促进软骨细胞增殖、分化,抑制软骨细胞外基质降解,减轻滑膜炎症反应[3-4]。川芎能促进软骨细胞增殖,抑制软骨细胞凋亡,促进早期软骨血管新生[5];还能降低OA大鼠关节液中一氧化氮(nitric oxide,NO)、前列腺素E2(prostaglandin E2,PGE2)水平[6],从而能够减轻关节软骨退变,修复软骨损伤[7]。威灵仙能抑制膝关节软骨MMPs、TNF-α表达,维持和促进软骨合成蛋白多糖与Ⅱ型胶原[8-9];减轻关节软骨退变,改善骨关节功能[10-11]。肉桂能抑制IL-1β诱导的OA大鼠软骨细胞的凋亡和炎症因子的释放[12],减轻关节组织的炎症反应和骨质破坏[13]。苍耳子具有明显的抗炎、镇痛作用,可用于关节炎的治疗[14]。
本研究采用的Hulth法是OA经典的手术造模方法[15],主要通过切断前交叉韧带,刮损内侧半月板造成关节失稳,导致关节面间磨损增加,促使关节软骨退变,与OA临床病症更为吻合。由于OA的病程发展往往不可逆转,考虑中药起效较慢、给药周期较长(一般需2个月),为缩短实验周期,本文采用预防性给药(给药、造模同时进行),即造模开始至造模完成的整个过程中,同时给予药物干预,观察比较干预8周后各给药组与模型组、空白对照组的差异。本研究采用HE染色和SO染色,观察膝关节组织病理学改变[16-18],提示仙芎骨康颗粒可促进软骨细胞增殖,修复膝关节软骨层。
OA病变过程复杂,其发病机制尚不明确。MMP-13是促使软骨降解的主要酶类,IL-1β则是促使软骨代谢平衡转向分解和诱导软骨退化的主要细胞因子之一。许多临床研究和实验研究均表明,OA患者或OA模型中MMP-13和IL-1β呈高水平表达[19-27],因此本研究将血清中MMP13和IL-1β的水平作为药效的评价指标。ELISA结果表明,仙芎骨康颗粒能有效抑制OA大鼠IL-1β的表达,中、高剂量则能有效抑制OA大鼠MMP-13的表达。鉴于在药效相同的情况下,药物服用的剂量越小有助于减轻不良反应,故选用中剂量为最佳给药剂量。
综上所述,仙芎骨康颗粒对OA具有较好的防治作用,可有效改善OA大鼠膝关节软骨组织病理状态,修复软骨层,其机制可能与下调OA大鼠MMP-13的表达、抑制炎症细胞因子IL-1β的分泌有关。
