多级孔Cr2O3固定化酶的制备及其应用研究
2022-01-10高霞贺曾贤乔成芳
高霞,贺曾贤,乔成芳
(商洛学院化学工程与现代材料学院/陕西省尾矿资源综合利用重点实验室,陕西商洛 726000)
近年来,随着选矿过程中浮选药剂使用量的增加,残留浮选剂的选矿废水引发的环境问题日益突出[1-3]。大部分浮选药剂高毒、高污染、难降解,对生态环境造成了严重危害。其中黑药是浮选废水中主要难降解有机污染物。目前,浮选废水中有关黑药的降解方法有臭氧氧化[4]、化学氧化[5]、催化氧化[6]等物理化学法,以及生物法[7]。有研究表明,物理化学法成本较高,且处理效果不理想,容易造成二次污染;而生物法经济、有效且不会产生二次污染[7],近年来备受关注。宋卫峰等[8]先后采用自制SBR(序批式活性污泥)系统研究了外加基质对含苯胺黑药模拟废水处理效果的影响,并对模拟苯胺黑药废水进行了小试处理,对矿山生态环境的改善具有推动意义。但由于SBR法的间歇性运行特点导致其不能处理连续大规模的废水,同时还存在处理速度慢以及规模小等缺点。因此,开发高效、低耗且稳定达标的浮选废水处理新技术已日趋重要。
与传统的废水处理法相比,生物酶催化技术具有催化效率高、反应条件温和、反应速度快,对温度、浓度和有毒物质适应范围广以及可重复使用等特性[9],在生活污水、印染等工业废水处理中应用较为广泛,而在浮选废水的处理研究涉及较少。生物酶处理有机污染物的机理是先通过酶促反应形成游离基,进而游离基发生化学聚合反应生成高分子化合物沉淀,经过滤即可除去。与其他微生物处理方法相比,生物酶处理法具有催化效率高、反应条件温和、对设备要求低、反应速度快等优点。然而,酶分子在使用过程中存在稳定性差、成本高以及难以从反应体系中回收再利用等问题,将生物酶分子负载到固相载体上被认为是提升酶的稳定性最有效的途径之一,同时负载在固相载体上的酶可通过固液分离实现酶的重复使用,从而降低酶的使用成本。
近年来,多孔纳米材料因其具有大的比表面积、良好的热稳定性和化学稳定性等独特的性能优势而备受关注[10-11],在催化[11]、吸附[12]、超级电容器[13]、能量储存和转化[14]等领域具有潜在的应用前景。通常多孔纳米材料的制备方法主要有化学刻蚀法[15]、离子交换法[16]、模板法[17]以及电弧法[18],其中以模板法最为常见。与传统模板法相比,基于金属有机骨架(MOFs)前驱体煅烧制备多孔纳米材料的方法简单,转化率高,所制备的多孔纳米材料不仅具有MOFs自身的优势,还具有可调的孔隙结构、良好的热稳定性和化学稳定性等优良特性,可以成为理想的酶固定化载体。然而,迄今为止,基于MOF前驱体制备多孔材料用于固载酶的报道较少[19-20]。本文基于“自牺牲模板”策略通过热分解Cr-MOF制备得到两种具有微孔-介孔结构的多级孔MHCr2O3材料,再以“聚多巴胺(PDA)”仿生膜对材料表面进行功能化修饰后首次对辣根过氧化物酶(HRP)进行固载,并研究了固定化酶在黑药降解中的应用。
1 材料与方法
1.1 试剂与仪器
辣根过氧化物酶(HRP),95%,北京索莱宝科技有限公司;1,3,5-苯三甲酸(H3BTC),分析纯,梯希爱化成工业发展有限公司;九水合硝酸铬(Cr(NO3)3·9H2O)、冰乙酸、六亚甲基四胺(HMTA)和过氧化氢(H2O2,体积分数30%)均为分析纯,国药集团化学试剂有限公司;盐酸多巴胺(DA),分析纯,上海索莱宝生物科技有限公司;N,N-二甲基甲酰胺(DMF),99.5%,梯希爱(上海)化成工业发展有限公司;2,2'-连氮-二(3-乙基苯并噻唑啉-6-磺酸)(ABTS),98%,Sigma-Aldrich公司;聚乙烯吡咯烷酮(PVP),99%,Sigma-Aldrich公司;苯胺黑药和丁铵黑药均为分析纯,广东翁江化学试剂有限公司;SX3型陶瓷纤维节能高温箱式电阻炉(北京科伟永兴仪器有限公司);D/Max-3C型全自动X-射线衍射仪(XRD,日本Rigalcu);UV-1780型紫外可见分光光度计(UV-Vis,日本岛津公司);GL-20B型高速冷冻离心机(上海安亭科学仪器厂);LSHZ-300型冷冻水浴恒温振荡器(苏州市培英仪器设备有限公司);ASAP 2460系列物理吸附仪(美国麦克公司);202-1AB型电热恒温干燥箱(天津市泰斯特仪器有限公司);FV1200型激光共聚焦显微镜(CLSM,奥林巴斯)。
1.2 多级孔MHCr2O3的制备及功能化修饰
将0.4002gCr(NO3)3·9H2O、0.2102gH3BTC、0.655gPVP和1 mL冰乙酸以及29 mL蒸馏水置于50 mL聚四氟乙烯水热反应釜中,超声30 min,密封后在5 h内升温至220℃,恒温24 h,然后缓慢冷却至室温,产物用无水乙醇洗涤多次,80℃真空干燥12 h,得到Cr-MOF前驱体。
取Cr-MOF前驱体约100mg于瓷坩埚中,置于电阻炉中,以2℃/min的速率升温至400~600℃,并分别在400℃和600℃温度条件下保持4 h,然后自然冷却至室温,得到两种MHCr2O3材料,分别标记为 MHCr2O3-400和 MHCr2O3-600。将0.241gMHCr2O3和0.0095gDA分散在50 mL超纯水中,再加入0.102gHMTA,密封涡流30 s后,在90℃条件下温育3 h,自然冷却到室温,离心分离,用无水乙醇洗涤数次,80℃真空干燥12 h,得到PDA@MHCr2O3载体材料。
1.3 HRP@PDA@MHCr2O3的制备
向5 mg PDA@MHCr2O3载体中加入1400 μL pH=3.0的磷酸缓冲液(0.1 mol/L),然后加入 100 μL 0.25 mmol/L的HRP溶液,置于30℃的恒温振荡器中振荡1 h,离心分离,洗涤除去载体表面未固载的HRP,得到HRP@PDA@MHCr2O3。测定上清液中残留HRP的浓度,计算酶的固载量:
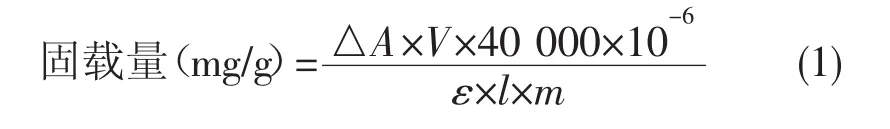
式(1)中,△A为HRP在紫外波长403 nm处的吸光度值的变化,V为体系最终的体积(mL),ε为HRP的摩尔吸光系数102000 L/(mol·cm),l为所用比色皿的宽度(cm),m为加入载体的质量(g)。
1.4 酶催化活性测定
以HRP催化氧化ABTS的过氧化反应为模型反应,以ABTS的转化率来表征HRP的活性。向pH=5.0的磷酸缓冲液中加入30 μL 0.01 mol/L ABTS和一定量的游离HRP或含等量HRP的HRP@PDA@MHCr2O3,最后加入 30 μL 0.1 mol/L H2O2,摇匀,待反应5 min后离心分离,测定上清液在415 nm处的吸光度值,根据文献[21]的方法计算ABTS的转化率。
1.5 热稳定性和重复使用性的测定
将一定量的游离HRP和含等量HRP的HRP@PDA@MHCr2O3加入磷酸缓冲液置于30~100℃温度下温育1 h,再将温育过的游离HRP和固定化酶用于催化ABTS过氧化反应,比较游离HRP和固定化酶的热稳定性。
将每次反应后的固定化酶离心分离洗涤,再次用于催化ABTS过氧化反应,以第一次使用固定化酶的活性记作100%,将之后每次的催化活性与第一次的比较,以残余催化活性表征固定化酶的重复使用性。
1.6 HRP@PDA@MHCr2O3在黑药降解中的应用
1.6.1 模拟废水的配制
根据文献[22]的方法配制模拟浮选废水,由NH4Cl(4 mg/L)、KH2PO4(24 mg/L)、MgSO4(5 mg/L)、CaCl2(2.4 mg/L)、NaOH(35 mg/L)配制得到,利用pH=1.0的HCl调节模拟废水至pH=6.5,试验用模拟废水均为新鲜配制。
1.6.2 黑药降解
向模拟废水水样中加入一定量的游离HRP和含等量HRP的固定化酶,然后加入一定体积的底物苯胺黑药或丁铵黑药(最终浓度为30 mg/L),再向体系中加入80 μL 0.1 mol/L H2O2,保持最终体积为3 mL。室温下避光反应30 min,根据底物的标准曲线方程以及降解后测得吸光度值计算底物降解率(%):

式(2)中,C0为底物的初始浓度,Ct为底物在t时刻的浓度。
1.6.3 标准曲线的绘制
准确配制一系列质量浓度为5~100 mg/L的底物标准溶液,分别测定不同浓度苯胺黑药(或丁铵黑药)标准溶液在230 nm(或220 nm)处的吸光度,绘制底物浓度与吸光度的工作标准曲线如图1所示,苯胺黑药的标准曲线方程为 y=0.0488x-0.0192,R2=0.9997,丁铵黑药的标准曲线方程为y=0.0503x+0.0767,R2=0.9994。
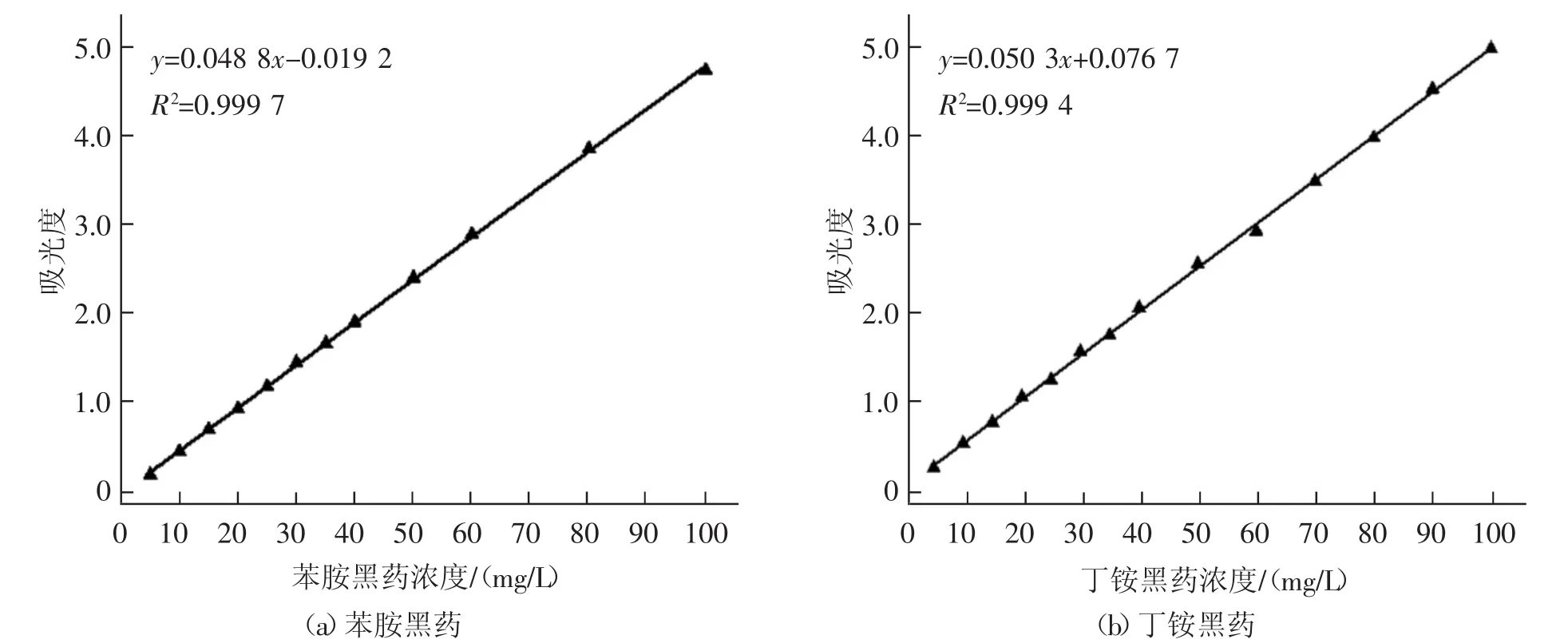
图1 底物测定的标准曲线
1.6.4 化学耗氧量(COD)的测定
化学耗氧量(COD)即化学需氧量,指的是在一定的体系中,采用氧化性较强的氧化剂处理时所消耗掉的氧化剂的量。向20 mL试管中依次加入2.5 mL空白样(蒸馏水),标样和待测样(固定化酶降解黑药后上清液),在每一个试管中分别加入0.7 mL D试剂和4.8 mL E试剂。再将加入D试剂和E试剂的试管置于预热好的COD检测仪中,加热10 min后取出试管,经空气冷却2 min后依次在每个试管中加入2.5 mL蒸馏水,振荡摇匀,水浴冷却2 min。最后依次按顺序将试管中的样倒入已准备好的比色皿中用以检测分析。
2 结果与讨论
2.1 固相载体及其固定化酶的结构表征
2.1.1 X射线粉末衍射(XRD)
图2为Cr2O3的XRD标准谱图以及MHCr2O3的XRD谱图。由图 2可知,MHCr2O3-400和MHCr2O3-600 在衍射角 2θ为 24.49°,33.60°,36.20°,41.48°,50.22°,54.85°,63.45°,65.10°,73.33°和76.85°处出现的衍射特征峰,分别对应于六方体结构 Cr2O3的 (012)、(104)、(110)、(113)、(024)、(116)、(214)、(300)、(119)、(220)晶面,符合标准图谱数据(标准卡片JCPDS 38-1479),表明Cr-MOF前驱体在400℃和600℃的空气气氛条件下煅烧4 h后均完全分解为Cr2O3。
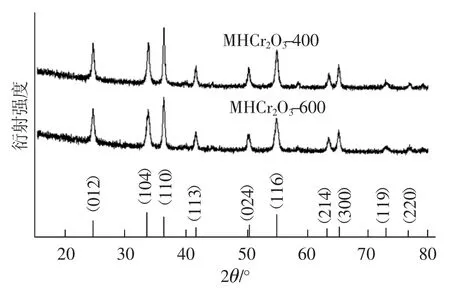
图2 Cr2O3的XRD标准谱图以及MHCr2O3的XRD谱图
2.1.2 N2吸脱附分析
将制备的两种MHCr2O3材料经180℃下过夜脱气后,在液氮温度下(77 K)进行氮气吸脱附测试,结果见图3和表1。如图3所示,两种MHCr2O3材料的氮气吸脱附等温线存在明显滞后环,说明材料具有介孔结构。表1显示两种MHCr2O3材料均含有几类大小不同的孔道,进一步表明所制备的材料具有多级孔孔隙结构。
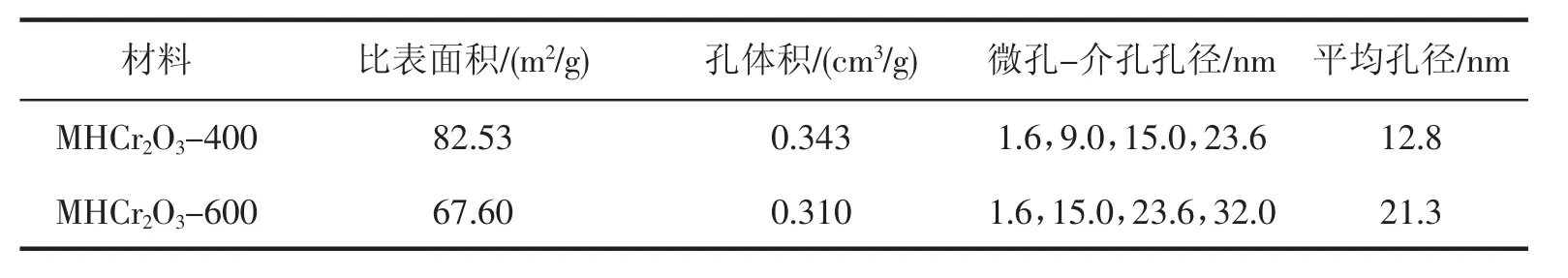
表1 多级孔MHCr2O3材料的孔性质
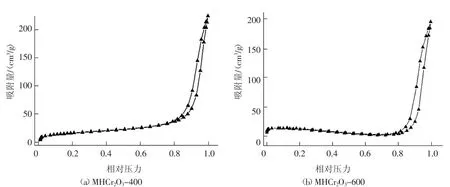
图3 MHCr2O3材料的N2吸脱附等温线
2.1.3 场发射扫描电子显微镜(FESEM)和透射电子显微镜(FETEM)
为了研究热分解过程是否对Cr-MOF前驱体的结构造成影响,取一定量Cr-MOF前驱体和MHCr2O3材料进行FESEM和FETEM测试,结果见图4和图5。从图4(a)和图4(b)可以看出,Cr-MOF前驱体的形貌是由大小基本均一的花瓣状纳米颗粒结构构成。与图 4(c)、图 4(d)、图4(e)和图4(f)对比可知,经400℃和 600℃空气气氛条件煅烧后得到的MHCr2O3材料基本保留了与Cr-MOF前驱体相似的纳米颗粒形貌结构,但纳米颗粒的堆积方式发生了一定的变化,煅烧后纳米粒子的形态变得更为均一规则。从图4和图5可以看出,MHCr2O3-400材料的形貌是由大小均一的葡萄状纳米颗粒结构堆积而成,而MHCr2O3-600材料的形貌是由大小均一的纳米颗粒之间大量的孔隙形成的堆积结构构成,且呈现出较MHCr2O3-400材料的形貌结构更为分散的特点。MHCr2O3-400和MHCr2O3-600两种材料纳米颗粒的尺寸大约在30~50 nm,且颗粒间的分散性良好。

图4 场发射扫描电镜图

图5 场发射透射电镜图
2.1.4 激光共聚焦显微镜(CLSM)
为了证明游离HRP在PDA@MHCr2O3载体材料中的成功固载,将用异硫氰酸荧光素(FITC)标记HRP制备的FITC-HRP@PDA@MHCr2O3用于激光共聚焦显微镜测试,结果见图6。图6(b)中可见许多均匀分布的绿色荧光斑点,由于载体材料自身不是荧光材料,通过观察得知图6(a)中确实没有绿色荧光斑点出现,故所观察到的荧光信号来自于引入PDA@MHCr2O3的FITC-HRP。由此可以证实HRP被固载到了PDA@MHCr2O3材料中。

图6 激光共聚焦显微镜图
2.2 固定化酶性质研究
2.2.1 热稳定性
将游离HRP和含等量HRP的固定化酶分别在 30~100 ℃下温育1h,结果见图7(a)。由图7(a)可见,游离HRP和固定化酶的热稳定性在30~50℃差别不大,其最佳反应温度分别为40℃和50℃,但当温度超过60℃之后,游离HRP的催化活性明显下降,在70℃条件下温育1 h仅能保持18.1%的催化活性,而相同条件下,HRP@PDA@MHCr2O3-400和HRP@PDA@MHCr2O3-600仍分别能保持98.0%和92.7%的催化活性,甚至在90℃条件下温育1 h仍分别能保持95.2%和83.9%的催化活性。结果表明,固定化酶的热稳定性较游离酶显著提高,这是由于酶分子固载后,载体材料给游离酶抵御高温提供了屏障,减少了温度对固定化酶构象的影响。HRP@PDA@MHCr2O3-400表现出较HRP@PDA@MHCr2O3-600更为突出的热稳定性,这是由于MHCr2O3-400和MHCr2O3-600两种材料的孔径效应引起的。由表1可知,MHCr2O3-400和MHCr2O3-600的平均孔径大小分别为12.8 nm和21.3 nm,根据文献[23]报道,游离 HRP的分子尺寸为(4.0×4.4×6.8)nm。 与MHCr2O3-400相比,HRP分子在MHCr2O3-600孔道中在可以实现自由翻转的同时可能会由于孔径的进一步扩大而导致进入载体孔道中的HRP分子增多,而孔道的限域效应会引起酶分子的团聚,底物通道可能瞬间被堵塞,同时也会使底物的传质阻力增大,从而降低酶的催化活性。此外,载体表面“PDA”仿生膜的构建可以在一定程度上抑制材料离心过程中导致的酶分子脱落现象,从而使所制备的固定化酶具有良好的热稳定性。
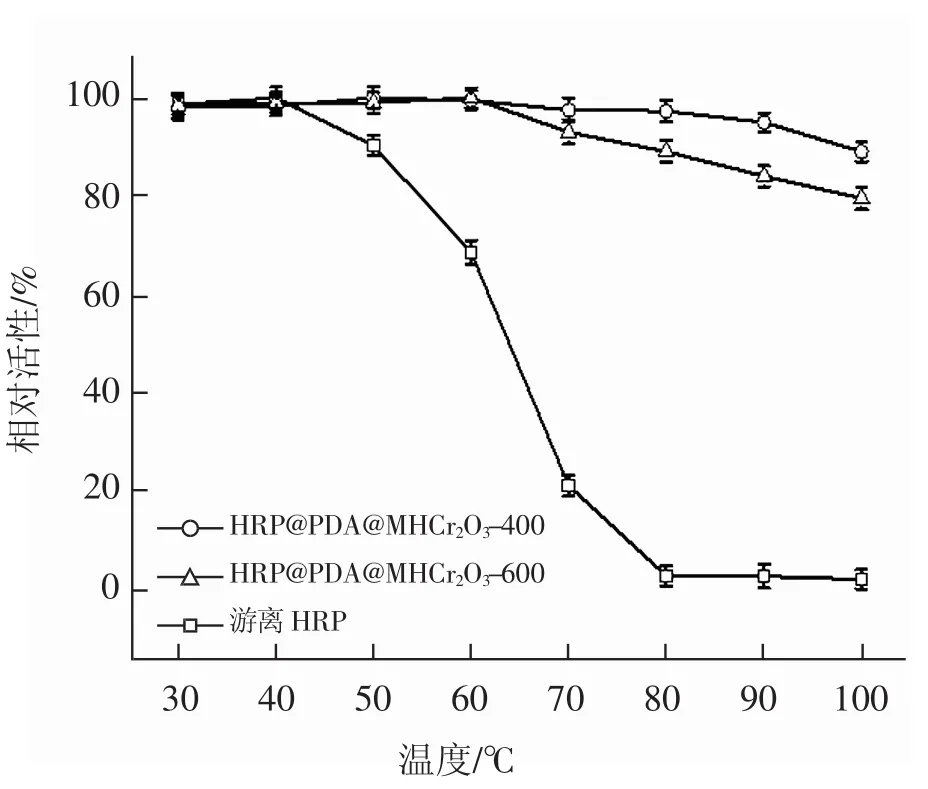
图7 游离HRP和固定化酶的热稳定性
2.2.2 重复使用性
图8为固定化酶在过氧化反应中的重复使用性。由图8可知,HRP@PDA@MHCr2O3-400和HRP@PDA@MHCr2O3-600两种固定化酶均展现出良好的重复使用性,两种固定化酶在重复使用10次后均能保持接近100%的催化活性。根据文献[24]报道,介孔 MOF(Tb-TATB)固定化酶在重复使用7次后,仅能保持53%的催化活性。固定化漆酶[25]在重复使用10次后,仅能保持不到50%的催化活性。MOF固定化葡萄糖淀粉酶[26]在重复使用6次后,仅能保持57%的催化活性。与上述文献报道结果相比,本文制备的HRP@PDA@MHCr2O3固定化酶展现出突出的重复使用性。HRP@PDA@MHCr2O3突出的重复使用性主要源于“PDA”仿生膜对材料表面进行功能化修饰的结果。虽然本研究是利用物理吸附法将HRP固载到PDA@MHCr2O3材料中。与共价法相比,这种存在于酶与载体之间的弱相互作用会不可避免地导致酶的脱落,但由于载体表面“PDA”仿生膜的构建使HRP@PDA@MHCr2O3中酶与载体之间的作用力增强。
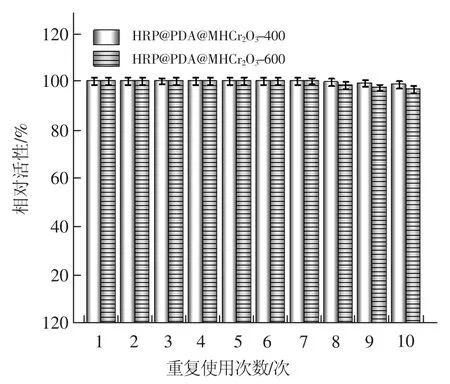
图8 固定化酶的重复使用次数
2.3 黑药降解应用研究
为了考察固定化酶催化降解的实际应用能力,本文采用生物酶催化降解法,利用固定化酶催化降解模拟浮选废水中有机污染物苯胺黑药和丁铵黑药,根据降解率的大小评价固定化酶的催化性能,结果见表2。由表2可知,当苯胺黑药和丁铵黑药的浓度均达到30mg/L时,在30min内含等量HRP的HRP@PDA@MHCr2O3-400和HRP@PDA@MHCr2O3-600对苯胺黑药的降解率均达到70%以上,对丁铵黑药的降解率均达到60%以上,而游离HRP对苯胺黑药和丁铵黑药的降解率均不到40%。结果表明,在同等条件下游离酶对有机污染物黑药的催化效率较其固定化酶降低,且HRP@PDA@MHCr2O3-400对黑药的催化效率明显较HRP@PDA@MHCr2O3-600高。固定化酶较游离酶催化活性提高主要可归因于两个原因:一是载体的微-介孔多级结构,其中较大的孔可以容纳酶分子,而较小的孔可以作为底物和其它溶剂小分子的扩散通道,实现了酶与底物各行其道,更有利于降解反应的进行。二是载体表面“PDA”仿生膜的构建,抑制了固定化酶使用过程中酶的脱落,最大程度保留了酶的催化活性。HRP@PDA@MHCr2O3-400的催化效率较高可归因于MHCr2O3-400的孔径大小合适,能够为酶分子提供一个合适的翻转空间,避免酶分子的团聚。

表2 游离HRP及其固定化酶对黑药的催化降解效率
经测定有机污染物黑药降解前后的COD值及其去除率如表3所示。由表3可知,对于底物来说,降解后的COD值都有一定程度的下降,COD的去除率为48.6%~58.6%,COD的去除率较高,说明降解后体系中有机物的含量降低了。因此,用辣根过氧化物酶(HRP)催化氧化降解有机污染物的这一类型反应的应用具有一定的可行性,符合绿色环保的理念。
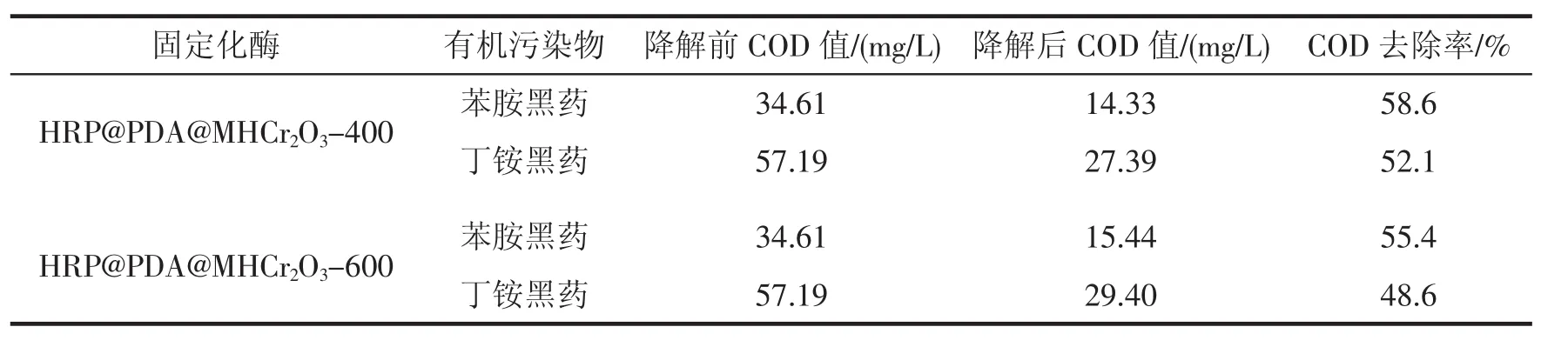
表3 黑药降解前后的COD值及其去除率
3 结论
本文基于Cr-MOF前驱体,采用“自牺牲模板”策略,成功制备出两种具有介孔-微孔结构的多级孔MHCr2O3材料,以“PDA”仿生膜对材料表面进行功能化修饰,并将辣根过氧化物酶(HRP)引入材料中,构筑了HRP@PDA@MHCr2O3固定化酶。本研究发现,利用介孔周围丰富的微孔结构富集底物可以减小其传质阻力补偿固定化酶制备过程中酶催化活性的损失。采用构建“PDA”仿生膜的策略能够抑制固定化酶使用过程中酶的脱落,制备的固定化酶具有十分出色的热稳定性和重复使用性,并且能保留较高催化活性。将固定化酶应用于催化降解模拟废水中有机污染物苯胺黑药和丁铵黑药具有反应时间较短、反应条件温和等优点,同时表现出非常高效的催化降解有机污染物能力,更适合应用于实际降解体系中。
