基于氧化应激探讨毓麟珠调控TSC/Akt通路改善免疫性POI小鼠卵巢功能的机制研究
2021-12-24魏茂林杨珍董晓英冯逊逊
魏茂林 杨珍 董晓英 冯逊逊
早发性卵巢功能不全(primary ovarian insufficiency,POI)是一种严重的内分泌和生殖系统功能紊乱疾病,是介于卵巢储备功能下降和卵巢早衰之间的一种卵巢低反应状态,主要表现为卵巢内卵泡池减少和卵泡功能障碍[1]。POI的发病率逐年升高,严重影响了女性的生殖健康。
研究表明,POI的发生与卵巢微环境密切相关[2]。蛋白激酶B(protein kinase B,PKB/Akt)蛋白可以抑制卵巢氧化应激的发生,改善卵巢微环境,对卵泡发育有一定的积极作用[3]。Akt通过多种机制被激活,活化磷酸化Akt通过抑制结节性硬化症(tuberous sclerosis complex,TSC)复合物TSC1和TSC2,直接或者间接地激活哺乳动物雷帕霉素靶蛋白(mammlian target of rapamycin,mTOR)通路[4]。前期研究表明,毓麟珠可以通过激活mTOR信号通路,调整通路中S6K和4E-BPl等相关蛋白的表达,对免疫性POI模型小鼠卵泡发育有积极影响[5]。在此基础上,本研究观察中药毓麟珠对免疫性POI小鼠卵巢组织氧化应激状态、卵巢组织病理形态以及TSC1、TSC2、Akt和mTOR下游相关蛋白等表达的影响,探讨其治疗免疫性POI的机制机理。
1 材料与方法
1.1 实验动物
选定84只6~8周龄动情周期正常的SPF级BALB/c雌性小鼠,体质量18~22 g。该批动物由北京维通利华公司提供,批号为SCXK(京)2012-0001。实验经北京中医药大学动物实验伦理委员会审批,批号:AEEI-2015-028。
1.2 实验药物
1.2.1 造模试剂 用高精度电子秤称取6 mg ZP3透明带多肽粉末[根据小鼠透明带3(ZP3)330-342个氨基酸序列(NAAAAQFQIHGPR)合成,加入6 mL蒸馏水,溶解混匀,制成透明带多肽溶液],其中一半与等量的弗氏完全佐剂混匀作为免疫制剂,另一半与等量的弗氏不完全佐剂混匀作为免疫增强剂。透明带多肽粉末购自杭州中肽生化有限公司(批号:CR-10-0068Z),弗氏完全佐剂(批号:F5881)、弗氏不完全佐剂(批号:F5506)购自美国Sigma公司。
1.2.2 中药 毓麟珠药物组成:当归、熟地黄、菟丝子各12 g,人参、麸炒白术、茯苓、白芍、杜仲、鹿角霜、川椒各6 g,川芎、炙甘草各3 g。中药饮片均由北京同仁堂有限公司提供。剂型为水煎剂,小鼠给药剂量根据“人与动物体表面积比例”配置高、中、低剂量药液[6],分别为每mL含生药量0.234 g、0.468 g、0.936 g。药物煎出后,4℃保存。
1.2.3 阳性对照药 戊酸雌二醇片(德国拜耳公司,批号:219A2)。小鼠给药剂量参照“人与动物体表面积比例”[6]使用去离子水配置药液,给药量为9 mg/mL。
1.2.4 主要试剂 苏木素染液(北京中科万邦生物科技有限公司,批号:517-28-2);伊红染液(北京中科万邦生物科技有限公司,批号:17372-87-1);二甲苯(国药集团化学试剂有限公司,批号:1330-20-7);EDTA抗原修复液(北京中科万邦生物科技有限公司);牛血清白蛋白V(Solarbio,批号:A8020);DAB显色剂(北京中科万邦生物科技有限公司);羊抗兔IgG(H+L),HRP(Jackson,批号:111-035-003);羊抗鼠IgG(H+L),HRP(Jackson,批号:115-035-003);BCA蛋白定量试剂盒(Cwbiotech,批号:02912E);反转录试剂盒(TaKaRa,批号:RR036A);荧光定量PCR试剂(Roche,批号:04887352001)。
1.3 造模、给药及取材
1.3.1 动物造模 通过阴道涂片挑选出动情周期正常的雌性小鼠84只,随机选择其中14只作为空白组,其余70只用于建立POI模型。造模小鼠于腹部皮下多点注射ZP3多肽免疫制剂(0.15 mL),两周后皮下多点注射ZP3多肽免疫增强剂(0.15 mL)[7];空白组小鼠于相同时间点皮下注射等量生理盐水。
1.3.2 分组给药 造模结束后,通过阴道涂片观察,动情周期紊乱则造模成功。将造模成功的70只小鼠随机分为模型组,阳性药组,毓麟珠高、中、低剂量组,每组14只。除空白组和模型组给予生理盐水灌胃外,其余各组给予相应药物灌胃。每只小鼠灌胃0.5 mL,每周给药6天,每天1次,连续给药6周。
1.3.3 取材 干预结束后第二天进行标本取材。心脏穿刺取血;取两侧卵巢以及子宫并称重,其中一侧卵巢放入液氮中,-80℃保存;另一侧放入4%多聚甲醛中固定,待用。
1.4 检测指标
1.4.1 小鼠卵巢组织形态 取出在多聚甲醛中固定的小鼠卵巢,进行脱水、透明处理、浸蜡包埋、切片、苏木精—伊红(hematoxylin-eosin staining,HE)染色、封片,显微镜下观察。
1.4.2 小鼠卵巢组织中超氧化物歧化酶(superoxide dismutase, SOD)、活性氧(reactive oxygen species,ROS)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和丙二醛(malondialdehyde,MDA)的测定 每组随机挑选出6个在-80℃冰箱中保存的小鼠卵巢组织,梯度复温切碎,加入蛋白裂解液后研磨,13 000 r/分钟,4℃,离心20分钟后取上清,蛋白质定量法测定总蛋白浓度,在酶标仪测定吸光度值,绘制出标准曲线,根据描述的蛋白浓度和标准曲线计算各指标的值。
1.4.3 小鼠卵巢组织中TSC1、TSC2、Akt蛋白表达 以免疫组化法检测。每组随机取出6个固定在多聚甲醛中的卵巢,用不同浓度的酒精梯度脱水,EDTA修复液修复,3%双氧水以及牛血清白蛋白常温孵育,一抗二抗处理后,加入显色剂显色,复染,梯度酒精脱水,透明处理,中性树胶封片,显微镜下观察。
1.4.4 小鼠卵巢组织中RheB、P-4E-BP1、P-sbk1相关蛋白表达 以蛋白免疫印记法检测。每组随机取出6个保存在-80℃的卵巢,梯度复温切碎,加入裂解液,匀浆取上清,利用蛋白质定量法测定蛋白浓度,根据蛋白分子量制胶,加入样品以及Marker,进行电泳。依次转膜、封闭,加入一抗、二抗孵育、洗膜,加入发光液、曝光、显影、定影,最后观察条带状况。
1.5 统计学方法
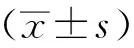
2 结果
2.1 毓麟珠对免疫性POI小鼠阴道分泌物的影响
空白组小鼠阴道涂片显示每隔4~5天小鼠会出现明显的动情周期,动情期间阴道涂片所见以不规则、无细胞核呈落叶状细胞为主,为典型的无核角化上皮细胞。模型组小鼠阴道涂片显示小鼠动情周期紊乱,表现为以有核的白细胞、嗜酸粒细胞为主。各给药组小鼠在给药过程中动情周期逐渐恢复,渐至稳定。
2.2 毓麟珠对免疫性POI小鼠卵巢及子宫质量的影响
与空白组相比,造模成功后模型组小鼠卵巢以及子宫质量均明显降低(P<0.05)。给药6周后,雌激素组、毓麟珠各剂量组小鼠卵巢及子宫质量均增加,其中毓麟珠高剂量组增加最明显(P<0.01),毓麟珠中剂量组及雌激素组次之(P<0.05),毓麟珠低剂量组仅有上升趋势,差异具有统计学意义(P>0.05)。见表1。

表1 各组免疫性POI小鼠卵巢及子宫质量比较
2.3 毓麟珠对免疫性POI小鼠卵巢组织形态的影响
HE染色结果显示:与空白组比较,模型组小鼠卵泡数量明显减少,卵母细胞部分透明带缩小,颗粒细胞排列紊乱,卵母细胞形态不规整或者缩小。与模型组比较,各给药组小鼠卵泡数量增加,卵细胞形态更加规整,颗粒细胞排列整齐,其中毓麟珠高剂量组改善最明显。见图1。
2.4 毓麟珠对免疫性POI小鼠卵巢组织ROS、GSH-Px、SOD、MDA表达水平的影响
造模成功后,模型组氧化因子ROS、MDA明显升高,抗氧化因子GSH-Px、SOD明显降低(P<0.05);给药6周后,雌激素组、毓麟珠各剂量组氧化因子ROS、MDA明显升高,抗氧化因子GSH-Px、SOD明显降低,其中雌激素组效果最为明显(P<0.01),毓麟珠高、中、低剂量组效果稍次,差异具有统计学意义(P<0.05)。见表2。

表2 各组免疫性POI小鼠卵巢组织中ROS、MDA、GSH-Px、SOD表达水平比较
2.5 毓麟珠对免疫性POI小鼠卵巢组织Akt蛋白表达的影响
免疫组化结果显示,Akt蛋白主要分布在卵母细胞的颗粒细胞中。造模后,模型组阳性颗粒明显较少,着色浅,表达不明显;各给药组阳性颗粒表达明显较多,着色深,表达明显;在毓麟珠高、中、低剂量组中阳性颗粒的表达具有明显的剂量依赖性。见图2。

注:A 空白组;B 模型组;C 雌激素组;D 毓麟珠高剂量组;E 毓麟珠中剂量组;F 毓麟珠低剂量组。箭头处为卵泡。

注:A 空白组;B 模型组;C 雌激素组;D 毓麟珠高剂量组;E 毓麟珠中剂量组;F 毓麟珠低剂量组。
2.6 毓麟珠对免疫性POI小鼠卵巢组织TSC1、TSC2蛋白表达的影响
TSC1、TSC2蛋白主要分布在卵母细胞的颗粒细胞中。造模后,模型组阳性颗粒明显较多,着色深,表达明显;各给药组阳性颗粒表达明显较多,着色深,表达明显。在毓麟珠高、中、低剂量组中,阳性颗粒的表达与剂量呈负相关。见图3、图4。
2.7 毓麟珠对免疫性POI小鼠卵巢组织RheB、P-s6k1、P-4E-BP1蛋白表达的影响
造模后,模型组RheB、P-s6k1、P-4E-BP1蛋白表达明显降低(P<0.05,P<0.01);给药后,各给药组RheB、P-s6k1、P-4E-BP1蛋白表达均明显升高,改善较明显的是P-4E-BP1蛋白(P<0.01),而RheB、P-s6k1仅有升高趋势,但差异无统计学意义(P>0.05);其中毓麟珠高剂量组对RheB、P-s6k1、P-4E-BP1蛋白表达改善最明显。见表3,图5。

表3 各组免疫性POI小鼠卵巢组织RheB、P-sbk1、P-4E-BP1蛋白表达水平比较
3 讨论
研究表明,POI的发生与氧化应激密切相关。体内氧化与抗氧化状态失衡,卵巢内部微环境改变,氧化应激增加[8]。而过多的氧自由基(H2O2)可以诱导PI3K表达的下降[9-10],PI3K通过磷酸化激活丝氨酸—苏氨酸激酶Akt[11],Akt通过磷酸化TSC2来抑制TSC2的活性。TSC复合物(TSC1/2)是一种抑癌基因,由三个核心亚基(TSC1、TSC2和TBC1D7)组成,是Rheb的主要上游调节因子,其中TSC2可以促进Rheb的泛素化,将Rheb从活跃形式转化为不活跃的形式,进而抑制mTORC1的活性[12]。P-s6k1、P-4E-BP1处于mTOR的下游,受其调控,在调节卵母细胞的mRNA转录及翻译方面起着重要作用[5]。

注:A 空白组;B 模型组;C 雌激素组;D 毓麟珠高剂量组;E 毓麟珠中剂量组;F 毓麟珠低剂量组。

注:A 空白组;B 模型组;C 雌激素组;D 毓麟珠高剂量组;E 毓麟珠中剂量组;F 毓麟珠低剂量组。

注:1 空白组;2 模型组;3 雌激素组;4 毓麟珠高剂量组;5 毓麟珠中剂量组;6 毓麟珠低剂量组。
毓麟珠出自《景岳全书·妇人规》,由八珍汤加菟丝子、杜仲、鹿角霜、川椒化裁而来。该方主治脾肾阳虚导致的不孕,方中四君子汤健脾益气,使气血化生有源;四物汤活血为主,养血为辅,使全方补而不滞;菟丝子、鹿角霜、杜仲、花椒温肝肾,填精血,调冲任,补命门。全方温补先天肾气以生精,培补后天脾胃以补血,佐以活血调经补冲任,既注意肾中阴阳的平衡,又注意用药的动静结合,使精气充盛,冲任通畅,进而恢复生育功能。临床研究表明,毓麟珠加减能很好地改善脾肾阳虚型卵巢早衰患者的中医症状,并且降低血清促卵泡生成素、促黄体生成素的水平,并升高雌激素的水平[13]。有动物实验表明毓麟珠能促进小鼠卵细胞成熟,改善卵细胞质量[14]。进一步研究表明毓麟珠可以通过改善卵母细胞线粒体功能,进而改善卵母细胞质量与卵巢功能[15]。
本研究发现造模后小鼠动情周期紊乱,同时卵巢、子宫质量下降,卵泡数量减少,表现出模型的阳性改变,影响到了小鼠的生殖功能。模型组小鼠卵巢组织ROS、MDA水平相较于空白组明显升高,GSH-Px、SOD水平相较于空白组降低,说明小鼠卵巢处于氧化应激状态;在给予中药毓麟珠6周之后,模型组小鼠ROS、MDA水平降低,GSH-Px、SOD水平升高,说明毓麟珠可以降低小鼠体内活性氧分子水平,同时提升相关抗氧化酶活性,抑制氧化应激状态。相关实验研究表明毓麟珠中的多味中药如熟地、当归、川芎等均能提高体内过氧化物歧化酶活性,清除体内自由基[16],毓麟珠的抗氧化活性可能与此相关。PI3K/Akt信号通路是卵母细胞内与氧化应激以及卵泡发育密切相关的信号通路[17],其影响卵泡发育的原因可能与TSC1/2的磷酸化密切相关。给予药物治疗后,Akt蛋白表达明显升高,抑制氧化应激的发生,Akt表达的升高会促进TSC2与TSC1分离,结节性硬化症复合物(TSC1/2)是抑制mTORC1的主要物质,两者解离则解除对mTORC1的抑制,激活mTORC1[18],从而使得mTOR信号通路活化。mTOR信号通路下游的P-s6k1、P-4E-BP1蛋白表达升高,进而激活细胞内转录和翻译过程,促进细胞生长发育[19]。本研究结果进一步分析了Akt/TSC信号通路抑制氧化应激改善卵母细胞质量可能与其直接或者间接激活了mTOR信号通路密切相关。
综上所述,毓麟珠通过调控TSC/Akt信号通路抑制氧化应激的发生,可能是减少卵母细胞以及卵泡损伤,改善卵巢微环境的重要机制。接下来的研究将进一步探究毓麟珠治疗POI的靶标,并探究毓麟珠在治疗POI过程中发挥主要作用的有效成份,为临床中更加精确、有效治疗POI提供依据。
