槟榔隐症病毒1型TaqMan实时荧光定量PCR检测方法的建立
2021-12-23林兆威牛晓庆唐庆华宋薇薇孟秀利覃伟权
林兆威 牛晓庆 唐庆华 宋薇薇 孟秀利 覃伟权

摘 要:为了建立一种快速、精准且能定量分析槟榔隐症病毒1型(Areca palm velarivirus 1, APV1)的检测方法。本研究参照GenBank中已登录的APV1全基因组序列,在p21蛋白基因保守区域和p60蛋白基因保守区域之间设计1对特异性RT-PCR引物,并构建阳性重组质粒;在p60蛋白基因保守区域部分设计荧光定量PCR特异性引物和TaqMan-MGB探针,利用阳性重组质粒,构建标准曲线,并对该检测方法的敏感性、特异性、稳定性及其应用效果进行验证。结果显示:该方法对阳性质粒标准品检测的敏感性达3.0×101 copies/μL级别,是常规RT-PCR敏感性的100倍;标准曲线显示,Ct值与拷贝数的对数呈线性关系,其标准曲线方程为y=-3.2748x+42.957,扩增效率为102%,相关系数R2为0.9992;该方法对APV1的检测具有较好的特异性,其他槟榔病原物及内生菌不会对本方法产生非特异性干扰;批内与批间重复性试验结果显示,该方法对APV1的检测具有较好的重复性和稳定性;利用该方法对海南万宁、琼海、定安、文昌等4个市(县)采集的181份疑似樣品进行检测,阳性率分别为91.95%、86.95%、89.65%、73.68%,其阳性的病毒拷贝数最高达1.59×107 copies/μL,表明海南部分地区APV1病毒载量较高、流行情况比较严重。
关键词:槟榔;槟榔隐症病毒1型;TaqMan实时荧光定量PCR
中图分类号:S763.7 文献标识码:A
Abstract: It is aimed to develop a rapid, precision and quantitative detection method for Areca palm velarivirus 1 (APV1). A pair of specificity RT-PCR primers were designed based on the APV1 complete genome sequence registered in GenBank to clone the sequence between the conservative region of p21 and the conservative region of p60, and a positive recombinant plasmid was constructed. Fluorescence quantitative PCR specificity primers and TaqMan-MGB probes were designed in the conservative region of p60 and a positive recombinant plasmid was constructed to establish a standard curve to verify the sensitivity, specificity, stability and application effect of the detection method. The sensitivity of this method to the detection of positive plasmid standards was up to 3.0×101 copies /μL, which was 100 times the sensitivity of conventional RT-PCR. The standard curve showed that the Ct value had a linear relationship with the logarithm of the copy number. The standard curve equation was y=-3.2748x+42.957, the amplification efficiency was 102%, and the correlation coefficient R2 was 0.9992. The method has good specificity for the detection of APV1, and other areca pathogens and endophytes will not be affected by this method. The intra batch repeat test and inter batch repeat test results showed that this method had good repeatability and stability in the detection of APV1. This method was used to detect 181 suspected samples collected from 4 cities and counties in Hainan, including Wanning, Qionghai, Ding’an, and Wenchang. The positive rate was 91.95%, 86.95%, 89.65%, and 73.68%, respectively, and the number of positive virus copies was up to 1.59×107 copies/μL. It shows that APV1 virus load is relatively high and the epidemic situation is relatively serious in some areas of Hainan.
Keywords: areca; Areca palm velarivirus 1; TaqMan RT-qPCR
DOI: 10.3969/j.issn.1000-2561.2021.11.006
槟榔(Areca cathecu L.)是棕榈科槟榔属多年生热带乔木,原产于马来西亚,是我国的“四大南药”(槟榔、砂仁、益智、巴戟天)之首,现主要分布在印度、中国、缅甸、孟加拉国及印度尼西亚等热带及亚热带国家与地区;在我国,槟榔主要栽培于海南、台湾及云南等地,其中海南省槟榔种植面积占全国的95%以上,产量位居世界第二位,是海南省第二大热带经济作物、海南省政府重点发展的“三棵树”(橡胶、槟榔、椰子)之一[1-2]。近年来,国内槟榔消费市场迅速扩张,效益日益增长,据《海南省统计年鉴(2020)》统计,海南槟榔种植面积逐年扩大,2019年种植面积达11.52万hm2。槟榔已成为海南省中东部地区230多万农民的主要收入来源。
随着槟榔种植面积的不断扩大,植保问题日趋严重,槟榔黄化现象倍受关注。Wang等[3]研究指出,槟榔隐症病毒1型(Areca palm velarivirus 1, APV1)是造成檳榔黄化现象的病害因子之一,且该病毒引发的症状与槟榔黄化病(arecanut yellow leaf disease, AYLD)的症状极其相似。随后,本研究团队对海南省槟榔黄化现象进行调查,并对APV1进行RT-PCR检测分析,发现APV1在海南槟榔种植地区危害范围广,且为害面积较大,对槟榔产业健康发展构成潜在的威胁,引起本研究团队的高度重视(该结果待发表)。然而,快速、精准的检测技术对APV1的诊断尤为重要,当前对于该病毒的检测主要采用RT-PCR技术[4]。由于TaqMan实时荧光定量PCR检测技术具有较高的特异性、灵敏性及稳定性,并可对检测的病原物进行定量分析,目前该方法广泛应用于动植物的病原检测[5-9]。因此,本研究根据APV1基因组序列,在p60蛋白基因保守序列中设计TaqMan- MGB探针,建立TaqMan RT-qPCR检测方法,并对该方法的敏感性、特异性、稳定性及其应用效果进行了验证,以期为APV1精准诊断、病原监测及分子流行病学的研究提供可靠的技术手段。
1 材料与方法
1.1 材料
1.1.1 供试样品 槟榔隐症病毒1型(Areca palm velarivirus 1, APV1)、槟榔坏死环斑病毒(Areca palm necrotic ringspot virus, ANRSV)及槟榔黄化植原体(arecanut yellow leaf phytoplasma, AYL)由中国热带农业科学院椰子研究所提供,并分别采用RT-PCR、巢氏PCR技术检测为阳性;槟榔炭疽菌、槟榔叶片分离的内生或致病细菌:Burkholderia andropogonis、Pantoea ananatis、Sphingomonas yantingensis、Curtobacterium al-bidum、Bacillus cereus、Frondihabitans australicus由中国热带农业科学院椰子研究所提供;健康槟榔叶片样品采自中国热带农业科学院椰子研究所槟榔苗圃,经RT-PCR对APV1检测为阴性;疑似APV1样品采自海南万宁87份、琼海46份、定安29份及文昌19份等4个市(县)槟榔园,共181份。
1.1.2 主要试剂与仪器 主要试剂:RNAprep Pure多酚多糖植物总RNA提取试剂盒、反转录cDNA第一链合成试剂盒、2×Taq PCR mix、琼脂糖凝胶回收试剂盒、质粒小提试剂盒及实时荧光定量PCR(探针法)试剂盒购于天根生化科技(北京)有限公司,pMDTM18-T Vector购自TaKaRa公司;DH5α感受态细胞购自北京全式金生物技术有限公司。主要仪器:Bio-Rad T100 PCR仪器,QuanStudio 6 Flex Real-time定量PCR仪,QuantStudio 3 Real-time定量PCR仪,超微量分光光度计 Thermo ND2000。
1.2 方法
1.2.1 引物与探针设计与合成 根据APV1基因组序列(GenBank登录号:MK956940.2),利用DNAMAN软件,在p21蛋白基因保守区域和p60蛋白基因保守区域设计上下游引物APV1-F/ APV1-R,该扩增片段用于构建阳性质粒标准品;并利用Primer Express 3.0软件在p60蛋白基因保守的区域部分设计实时荧光定量PCR特异性引物APV1-F1/APV1-R1和探针APV1-Probe(表1)。引物与探针由生工生物工程(上海)股份有限公司合成。
1.2.2 RNA提取及反转录cDNA合成 利用RNAprep Pure多酚多糖植物总RNA提取试剂盒,参照说明书,提取样品总RNA,并利用反转录cDNA第一链合成试剂盒,将提取的总RNA进行反转录,获得cDNA,‒20 ℃保存。
1.2.3 实时荧光定量PCR引物验证 使用引物APV1-F1/APV1-R1和探针APV1-Probe,以3份阳性样品cDNA为模板,健康槟榔样品cDNA阴性对照,ddH2O为空白对照进行TaqMan RT- qPCR,参照试剂盒说明书,20 μL反应体系:2×SuperReal PreMix (Probe) 10μL,正反向引物(10 μmol/L)各0.6 μL,荧光探针(10 μmol/L)0.4 μL,cDNA模板2 μL,50×ROX Reference Dye3 0.2 μL,RNase-Free ddH2O 6.5 μL。使用QuantStudio 3 Real-time定量PCR仪,设置TaqMan RT-qPCR反应程序:95 ℃预变性15 min;95 ℃变性3 s,60 ℃退火/延伸30 s,40个循环。
1.2.4 阳性质粒标准品的制备 使用引物APV1-F/APV1-R,以APV1 cDNA为模板,健康槟榔样品cDNA阴性对照,ddH2O为空白对照进行RT-PCR,PCR产物进行琼脂糖凝胶电泳检测,切下目的条带,利用琼脂糖凝胶回收试剂盒进行目的条带纯化,纯化后产物连接到pMDTM18-T Vector,并转化进DH5α感受态细胞中,筛选并提取阳性克隆子的质粒,送生工生物工程(上海)股份有限公司进行测序。将测序正确的质粒使用超微量分光光度计测定浓度,置于‒20 ℃保存备用。运用Shirima等[10]的方法计算重组质粒中的拷贝数,重组质粒拷贝数(copies/μL)=(阿伏伽德罗常数×C)/(109×重组质粒碱基对数×660 dalton/bp)。其中阿伏伽德罗常数为6.02×1023;C为重组质粒的浓度(ng/μL)。最终计算得到重组质粒的拷贝数为3.0×1010 copies/μL。RT-PCR反应体系:2×Taq PCR mix 12.5 μL,上下游引物(10 μmol/L)各1.0 μL,cDNA模板2.0 μL,ddH2O 8.5 μL。目的片段RT-PCR反应程序:95 ℃预变性5 min;95 ℃变性45 s,53 ℃退火45 s,72 ℃延伸40 s,35个循环;72 ℃延伸10 min。
1.2.5 敏感性试验与标准曲线的建立 将1.2.4获得的阳性质粒标准品为初始模板,按10倍梯度稀释出10个标准品浓度,拷贝数依次为3.0×109、3.0×108、3.0×107、3.0×106、3.0×105、3.0×104、3.0×103、3.0×102、3.0×101、3.0×100 copies/μL。以上10个梯度浓度阳性质粒标准品为模板,健康槟榔样品为阴性对照,进行TaqMan RT-qPCR。使用QuanStudio 6 Flex Real-time定量PCR仪,反应体系和程序参照1.2.3,得到动力学扩增曲线和PCR扩增循环阈值(Ct值)。运用Excel 2020软件,以Ct值为纵坐标,10为底质粒拷贝数的对数值为横坐标作标准曲线,获得回归直线方程,并计算该组体系的扩增效率:扩增效率(%)= 10(‒1/斜率)‒1。并将上述稀释的10个浓度梯度的阳性质粒标准品为模板,健康槟榔样品为阴性对照,使用APV1-F1/APV1-R1引物进行RT-PCR,PCR产物经凝胶电泳后验证,与TaqMan RT-qPCR敏感性的结果比较。
1.2.6 特异性试验 以槟榔APV1的cDNA为阳性对照、健康槟榔cDNA为阴性对照,ANRSV、槟榔黄化植原体、Burkholderia andropogonis、Pantoea ananatis、Sphingomonas yantingensis、Curtobacterium albidum、Bacillus cereus、Frondihabitans australicus的cDNA为模板进行TaqMan RT-qPCR,检测其特异性,使用QuantStudio 3 Real-time定量PCR仪,反应体系和设置程序参照1.2.3。
1.2.7 重复性试验 选取3.0×109、3.0×108、3.0×107、3.0×106 copies/μL 4个浓度的阳性质粒标准品为模板,进行TaqMan RT-qPCR检测,每个浓度重复3次,共检测3次,进行批内重复性试验,计算Ct值的变异系数。同时,将上述浓度的阳性质粒标准品保存在‒20 ℃ 3、6、9 d后,以相同反应条件重复进行批间试验,计算Ct值的变异系数,验证该方法的重复性和稳定性。使用QuanStudio 6 Flex Real-time定量PCR仪,反应体系和设置程序参照1.2.3。
1.2.8 田间样本检测 从海南万宁、琼海、定安、文昌等4个市(县)槟榔园中分别采集87、46、29、19份疑似APV1病样,并将这181份疑似样品进行总RNA提取,反转录成cDNA,运用本研究建立的TaqMan RT-qPCR方法进行检测,健康槟榔样品为阴性对照,获得该4个市(县)槟榔APV1的检出率,并根据1.2.5的标准曲线回归方程,计算田间样品病毒的最高、最低拷贝数。使用QuanStudio 6 Flex Real-time定量PCR仪,反应体系和设置程序参照1.2.3。
2 结果与分析
2.1 荧光定量PCR引物的验证
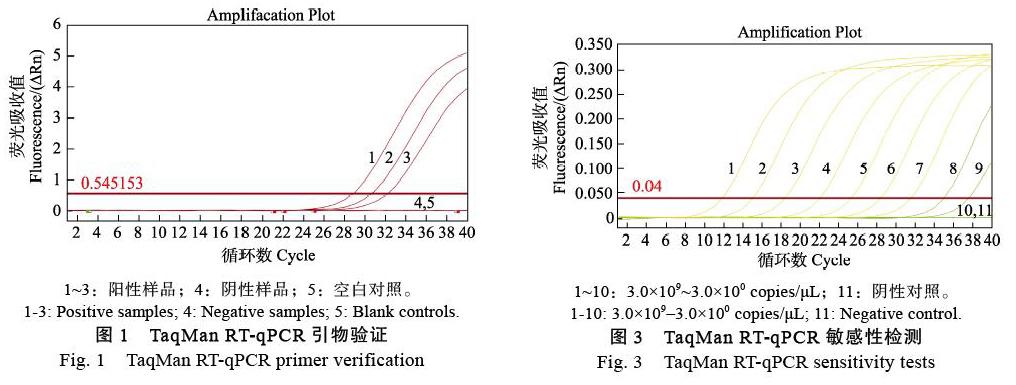
使用引物APV1-F1/APV1-R1和探针APV1- Probe对3份APV1阳性样品和1份阴性样品进行TaqMan RT-qPCR。如图1所示,3份阳性样品均出现“S”形扩增曲线,而阴性样品和空白对照未出现扩增曲线,说明该TaqMan RT-qPCR的引物/探针组合能检测到APV1,可进一步实验。
2.2 阳性标准品的制备
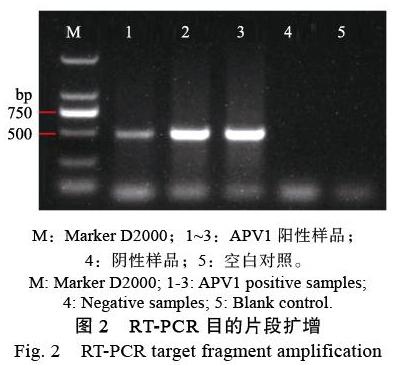
以3份APV1阳性样品为模板,使用引物APV1-F/APV1-R进行RT-PCR,经凝胶电泳,结果如图2,获得约490 bp的扩增片段。经纯化后的产物进行载体连接、感受态细胞转化,并將重组质粒测序后进行NCBI blast比对,与报道的APV1序列(GenBank登录号:MK956940.2)一致性达100%,说明已获得阳性标准品。
2.3 敏感性试验与标准曲线的建立
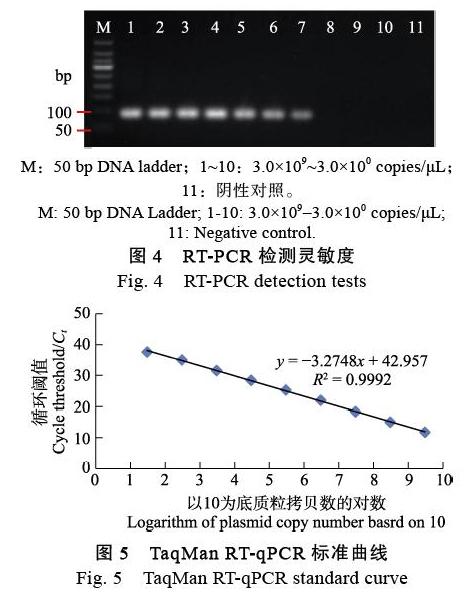
将3.0×109~3.0×100 copies/μL 10个浓度梯度的阳性质粒标准品为模板,健康槟榔样品为阴性对照,进行TaqMan RT-qPCR和RT-PCR,并利用Ct值与拷贝数的对数构建标准曲线。结果表明,该引物/探针对10个浓度梯度的阳性质粒标准品最低能检测到3.0×101 copies/μL(图3),而RT-PCR最低能检测到3.0×103 copies/μL(图4),TaqMan RT-qPCR检测APV1的敏感性是常规RT-PCR的100倍。标准曲线显示,Ct值与拷贝数的对数呈线性关系,其标准曲线方程为y=‒3.2748x+42.957,扩增效率为102%,相关系数R2为0.9992(图5)。
2.4 特异性试验
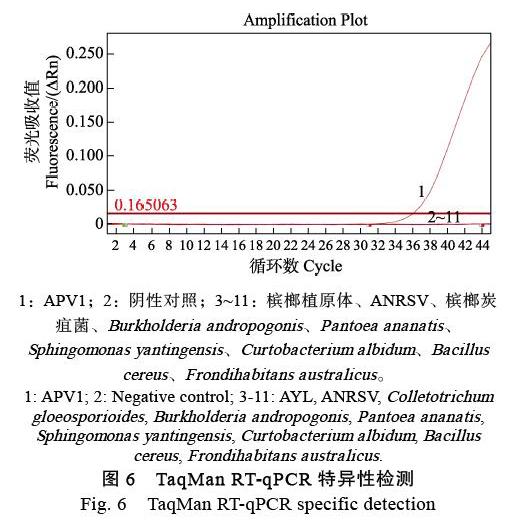
使用槟榔APV1及叶片中主要的病原菌和内生细菌进行TaqMan RT-qPCR特异性验证,结果如图6所示,仅APV1出现扩增曲线,健康槟榔阴性对照、槟榔植原体、ANRSV、槟榔炭疽菌、Burkholderia andropogonis、Pantoea ananatis、Sph-i¬ngomonas yantingensis、Curtobacterium albid¬um、Bacillus cereus、Frondihabitans australicus均未扩增出,说明该TaqMan RT-qPCR方法对APV1的检测具有较好的特异性,其他槟榔病原物和内生菌不会对本检测方法产生非特异性干扰。
2.5 重复性试验
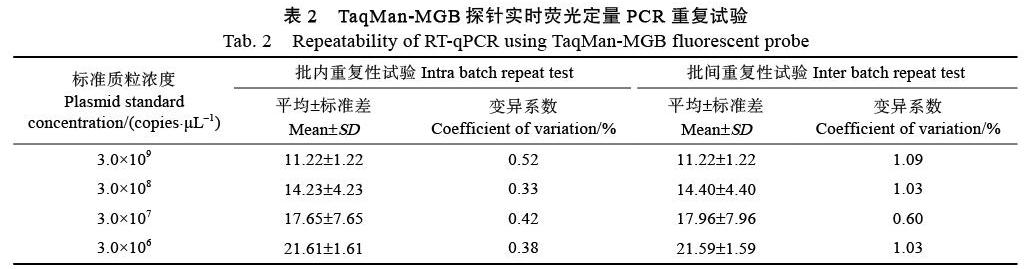
选取3.0×109、3.0×108、3.0×107及3.0×106 copies/L 4个浓度的阳性标准品为模板,进行TaqMan RT-qPCR检测,分别验证该方法的批内和批间的重复性和稳定性。结果如表2所示,批内变异系数小于1%,批间变异系数小于2%,表明该方法对APV1的检测具有较好的重复性和稳定性。
2.6 田间样本检测
运用建立的TaqMan qRT-PCR方法对海南万宁、琼海、定安、文昌等4个市(县)的槟榔园中采集的181份疑似样品进行检测。结果显示,万宁、琼海、定安、文昌的阳性率分别为91.95%、86.95%、89.65%、73.68%,其阳性的病毒拷贝数在11.23 copies/μL~1.59×107 copies/μL之间,表明海南部分地区APV1病毒载量较高、流行情况比较严重。
3 讨论
3.1 TaqMan RT-qPCR检测APV1方法的建立
目前对APV1的检测主要有RT-PCR技术和酶联免疫检测技术[4, 11]。相较于TaqMan RT-qPCR技术,传统的RT-PCR技术敏感性较低,且耗时久;虽然酶联免疫检测具有便捷、快速及直观的特点,但该技术敏感性未能达到更高的检测要求,并且准确性往往依赖于抗血清的品质[12]。TaqMan RT-qPCR技术具有较高的特异性和敏感性,该技术不仅可用于定性检测,也可用于定量分析。在本研究中,该TaqMan RT-qPCR检测方法的敏感性可达3.0×101 copies/μL级别,比RT-PCR的敏感性高100倍,在实际应用中,可检测含量最低至11.23 copies/μL的病毒,并且具有较高的稳定性和特异性。因此,该TaqMan RT-qPCR检测方法的建立,对APV1的病原监测及分子流行病学的研究提供了可靠的技术手段。
3.2 APV1对槟榔产业发展具有潜在的威胁性
隐症病毒属可为害甜菜、葡萄、柑橘、小麦及胡萝卜等多种经济作物,属于正义ssRNA病毒[13]。由隐症病毒属引起的甜菜黄化病毒(Beet yellows virus, BYV)一般年份的发病率达50%~60%,块根减产20%~25%,含糖率下降2%~3%,染病种子减产30%[14];葡萄卷叶伴随病毒2(Grapevine leafroll-associated virus 2, GLRaV-2)是我国葡萄卷叶病的主要病原之一,该病毒严重影响葡萄产量和质量[15];柑橘衰退病毒(Citrus tristeza virus, CTV)则严重为害世界柑橘生产的重要病原物之一[16]。槟榔隐症病毒1型(APV1)为长线形病毒科、隐症病毒属病毒,2015年Yu等[17]首次报道在国内发生流行,并对APV1-HN株进行全基因组测序,此后关于APV1的报道较少。至2020年Wang等[3]对APV1-WNY株进行全基因组测序,并阐述APV1与槟榔黄化病存在相关性和APV1的潜在传播媒介为粉蚧。随后,本研究团队于2020年对海南省槟榔黄化现象进行调查,并检测APV1,发现APV1在全省槟榔中分布广,并且发病率较高。在本研究中,应用TaqMan RT-qPCR检测方法对海南万宁、琼海、定安、文昌等4个市(县)的槟榔园中采集的181份疑似样品进行检测,其阳性率分别为91.95%、86.95%、89.65%、73.68%,表明APV1病毒在海南槟榔主栽区发病率高,对海南槟榔产业发展具有潜在的威胁性,需提高重视,加强该病害的监测、检测及其流行病学的研究。
参考文献
[1] 杨连珍, 刘小香, 李增平. 世界槟榔生产现状及生产技术研究[J]. 世界农业, 2018(7): 121-128.
[2] 代文婷, 吉建邦, 康效宁, 等. 槟榔干制技术研究进展[J]. 食品工业, 2021, 42(3): 258-262.
[3] Wang H X, Zhao R B, Zhang H W, et al. Prevalence of Yel-low Leaf Disease (YLD) and its associated Areca palm velarivirus 1 (APV1) in betel palm (Areca catechu) plantations in Hainan, China[J]. Plant disease, 2020, 104(10): 1-33.
[4] 黃 惜, 王洪星, 赵瑞白, 等. 一种槟榔黄化病相关病毒及其检测方法: CN111187756A[P]. 2020-05-22.
[5] 韩 玉, 王 涛, 潘 力, 等. 基于非洲猪瘟病毒CD2v基因TaqMan荧光定量PCR检测方法的建立[J]. 中国兽医学报, 2021, 41(5): 847-852.
[6] 王 琛, 馬跃宇, 黄思超, 等. 蜜蜂残翼病毒TaqMan- MGB探针荧光定量RT-PCR检测方法的建立[J]. 病毒学报, 2021, 37(3): 686-694.
[7] 王 涛, 韩 玉, 潘 力, 等. 针对非洲猪瘟病毒MGF360-13L基因的TaqMan荧光定量PCR的建立[J]. 中国农业科学, 2021, 54(5): 1073-1080.
[8] 王柱华, 王文鹏, 袁恩平, 等. 喜树丛枝植原体的分子鉴定及TaqMan探针实时荧光定量PCR检测方法的建立[J].植物病理学报, 2021, 51(3): 429-440.
[9] 姜自红, 殷培峰. 3种菊花病毒/类病毒实时荧光定量RT-PCR检测体系的构建与准确性评价[J]. 病毒学报, 2021, 37(1): 169-180.
[10] Shirima R R, Maeda D G, Kanju E, et al. Absolute quantifi-cation of Cassava brown streak virus mRNA by real-time qPCR[J]. Journal of Virological Methods, 2017, 245: 5-13.
[11] 陈 阳, 王洪星, 黄 惜. 槟榔APV1病毒多克隆抗体制备及酶联免疫检测[J/OL]. 分子植物育种. [2021-06-23]. http://kns.cnki.net/kcms/detail/46.1068.S.20210521.1404.008.html.
[12] 张 伟, 徐 硕, 陈德鑫. 常用植物病毒病检测技术比较[J]. 南方农业, 2013, 7(12): 24-28.
[13] 洪雪玉, 陈剑平. 长线形病毒科成员编码蛋白的功能[J]. 浙江农业学报, 2004(1): 51-56.
[14] 刘长兵. 甜菜黄化病毒发生与防治[J]. 新疆农业科技, 2009(4): 41.
[15] Martin R R, Eastwell K C, Wagner A, et al. Survey for vi-ruses of grapevine in Oregon and Washington[J]. Plant Dis-ease, 2005, 89(7): 763-766.
[16] 宋 震, 周常勇. 柑橘衰退病毒分子生物学研究进展[J]. 西南农业学报, 2005(2): 213-218.
[17] Yu H M, Qi S S, Chang Z X, et al. Complete genome se-quence of a novel velarivirus infecting areca palm in Chi-na[J]. Archives of virology, 2015, 160(9): 2367-2370.
责任编辑:谢龙莲
