鳞翅目昆虫内共生菌研究进展
2021-12-23王志鹏陈利民王亚如侯有明
刘 媛, 王 浩, 王志鹏, 陈利民, 王亚如, 侯有明,*
(1. 福建农林大学植物保护学院, 闽台作物有害生物生态防控国家重点实验室, 生物农药与化学生物学教育部重点实验室,福州 350002; 2. 福建省昆虫生态重点实验室, 福州 350002)
昆虫在自然界中种类丰富,数量庞大,已知60%以上的昆虫都含有内共生菌。内共生菌与昆虫的相互作用不仅是亲密的,往往还错综复杂,在长期的协同进化过程中,内共生菌一般生活在宿主特化的含菌细胞内,宿主昆虫为其提供生长所必需的小生境;而内共生菌能赋予宿主昆虫新的生物学效应(Latorre and Manzano-Marín, 2017),在宿主的生长发育、生殖调控、环境适应、遗传进化等诸多方面发挥重要作用(Cardozaetal., 2006; Oliveretal., 2009),它们彼此相互依赖、相互影响、协同进化(Baumannetal., 1995)。
近年来,昆虫与其体内共生菌的互作关系受到越来越多的关注。由于内共生菌无法离体培养,对其研究只能以宿主昆虫为载体,所以建立有或没有某种共生菌的昆虫种群体系已被证明是一个强有力的手段,对于有效评估单个或多个共生菌在复杂生物体中发挥的潜在作用等提供了可能,但仍面临诸多挑战(Liuetal., 2020)。目前国内外关于昆虫内共生菌的研究大多以半翅目(Hemiptera)和双翅目(Diptera)昆虫为主,如豌豆蚜Acyrthosiphonpisum(Wangetal., 2020)、烟粉虱Bemisiatabaci(Shanetal., 2021)、灰飞虱Laodelphgaxstriatellus(Duanetal., 2020)、黑腹果蝇Drosophilamelanogaster(Mazzuccoetal., 2020)、尖音库蚊Culexpipiens(Altinlietal., 2020)及白纹伊蚊Aedesalbopictus(Huetal., 2020)等。
目前,鳞翅目(Lepidoptera)昆虫与其体内共生菌作用的模式和机制研究正在受到越来越多的关注和重视。鳞翅目是昆虫纲中仅次于鞘翅目(Coleoptera)的第2大目,包括蛾、蝶两类昆虫,属有翅亚纲(Pterygota),全变态类昆虫。全世界已知鳞翅目昆虫约20万种,中国已知约8 000种(其中,蛾类约6 000种,蝶类约2 000种),分布范围也极广,以热带种类最为丰富。它们主要作为植食者、传粉者在生态系统中发挥作用。关于鳞翅目昆虫生理学、生态学、遗传进化学等方面的研究多有涉及,但直到近期,鳞翅目昆虫与其体内共生菌的互作关系才成为研究的热点之一。本文主要以鳞翅目昆虫为研究对象,阐述鳞翅目昆虫体内共生菌感染状况、传播方式、生物学效应及研究手段,并对今后的研究进行展望,以期为探索基于内共生菌-鳞翅目昆虫互作关系的新型害虫防治策略提供参考。
1 鳞翅目昆虫内共生菌感染状况
昆虫内共生菌指生活在昆虫细胞内部的共生菌,并被宿主来源的共生体膜(symbiosomal membranes)单独包裹(Schwartzmanetal., 2015)。昆虫内共生菌主要包括细菌和真菌2类,根据内共生菌在宿主昆虫体内的分布及其与宿主的进化关系,可将其分为原生共生菌(primary symbiont)和次生共生菌(secondary symbiont)(Baumann, 2005; 李迁等, 2016)。在长期的协同进化中,昆虫体内的原生共生菌如烟粉虱B.tabaci体内的CandidatusPortiera aleyrodidarum(Santos-Garciaetal., 2012)、豌豆蚜A.pisum体内的Buchneraaphidicola(Russelletal., 2014)、木虱体内的Carsonellaruddii(Morrowetal., 2017)、粉蚧体内的Trenblayaprinceps(López-Madrigaletal., 2015),它们一般分布于宿主特化的含菌细胞内。与原生共生菌不同,次生共生菌个体小、形状不规则、分布广泛,主要有Wolbachia,Spiroplasma,Rickettsia,Cardinium及Arsenophonus等。它们不仅可以分布于含菌细胞内,也可以分布于宿主昆虫的血淋巴、马氏管、生殖器官以及唾液腺等组织中(Bi and Wang, 2020)。
自然界中,许多昆虫都携带内共生菌,主要包括半翅目、双翅目、膜翅目(Hymenoptera)、鞘翅目、鳞翅目、直翅目(Orthoptera)(Werrenetal., 1995; Vavreetal., 2002)。需要强调的是,同半翅目、双翅目昆虫相比,鳞翅目昆虫内共生菌群落多样性相对较低,主要以次生共生菌Wolbachia为主,少数物种也感染有Spiroplasma,Arsenophonus及Rickettsia(Duplouy and Hornett, 2018)。具体如:Russell等(2012)对蚂蚁和鳞翅目[特别是灰蝶科(Lycaenidae)和蛱蝶科(Nymphalidae)]的内共生菌Wolbachia,Spiroplasma,Cardinium,Hamiltonella及Arsenophonus的感染情况进行检测,研究发现鳞翅目灰蝶科和蛱蝶科中,24.7%的种类仅存在Wolbachia,2.5%的种类仅存在Spiroplasma,而Cardinium,Hamiltonella及Arsenophonus在鳞翅目昆虫中均未检测到。柴换娜等(2013)研究指出黑龙江哈尔滨、贵州惠水、吉林吉林、河南南阳及江苏扬州水稻二化螟Chilosuppressalis5个地理种群体内Arsenophonus的感染率为5.0%~50.0%。Weinert等(2015)研究指出Rickettsia在鳞翅目昆虫中也罕见,在14~32个未定名的物种中仅1个物种(夜蛾科)受到感染。
昆虫及其他节肢动物内共生菌的研究大多集中在Wolbachia。Wolbachia属变形菌纲(Alphaproteobacteria)立克次氏体目(Rickettsiales)立克次氏体科(Rickettsiaceae)(Hertig and Wolbach, 1924)。根据多位点序列分型分析(multilocus sequence typing, MLST),Wolbachia可分为多个超群,其中以A-D超群研究报道最多,而鳞翅目昆虫感染的Wolbachia多属于A超群和B超群,且大多都属于B超群(Tagami and Miura, 2004; Ahmedetal., 2016)。越来越多的研究发现,Wolbachia在鳞翅目昆虫中分布最为广泛,但不同地理种群的鳞翅目昆虫Wolbachia的感染比例存在差异(表1)。其中,巴拿马的43种鳞翅目昆虫中Wolbachia的感染率为16.3%(Werrenetal., 1995);乌干达的24种邻珍蝶属Acraea蝴蝶中Wolbachia的感染率为29.0%(Jigginsetal., 2001);日本的9科鳞翅目中,有7科[粉蝶科(Pieridae)、灰蝶科、蛱蝶科、弄蝶科(Hesperiidae)、螟蛾科(Pyralidae)、夜蛾科(Noctuidae)、枯叶蛾科(Lasiocampidae)]感染Wolbachia(占比77.8%),仅2科[凤蝶科(Papilionidae)、凤蛾科(Epicopeiidae)]中未检测到Wolbachia,且在49种鳞翅目昆虫中有22种(菜粉蝶Pierisrapae、宽边黄粉蝶Euremahecabe、东亚豆粉蝶Coliaseratepoliographus、斯赭灰蝶Ussurianastygiana、蓝灰蝶Everesargiades、酢浆灰蝶Zizeeriamahaargia、红灰蝶Lycaenaphlaeas、翠蓝眼蛱蝶Junoniaorithya、黄钩蛱蝶Polygoniacaureum、美眼蛱蝶Junoniaalmanac、朱蛱蝶Nymphalisxanthomelas、幻紫斑蛱蝶Hypolimnasbolina、拟旖斑蝶Ideopsissimilis、朴喙蝶Libytheaceltis、拟稻眉眼蝶Mycalesisfrancisca、东北矍眼蝶Ypthimaargus、小弄蝶Leptalinaunicolor、玉米螟Ostriniascapulalis、地中海粉螟Ephestiakuehniella、红棕灰夜蛾Sarcopoliailloba、甘蓝夜蛾Mamestrabrassicae、赤松毛虫Dendrolimusspectabilis)感染Wolbachia(占比44.9%)(Tagami and Miura, 2004);印度的56种蝴蝶Wolbachia的感染率为50.0%(Salunkeetal., 2012);西西伯利亚的120种鳞翅目昆虫Wolbachia的感染率为58.3%(Ilinsky and Kosterin, 2017)。Ahmed等(2015a)对全球36个国家(指除南极洲以外的所有大陆)的10总科17科300种7 604头鳞翅目昆虫进行研究,结果表明鳞翅目中25.0%~33.4%的昆虫个体、80.0%的昆虫物种被Wolbachia感染,并指出鳞翅目昆虫体内Wolbachia的感染流行率与宿主地理位置的纬度梯度存在显著相关性,其中Wolbachia感染频率较低的宿主多位于纬度较高的地区。
2 鳞翅目昆虫内共生菌的传播方式
昆虫内共生菌常呈严格的母系垂直传播,即由雌性带菌昆虫经卵传给后代,是典型的“过卵巢传播”模式(安鹏等, 2019),Shan等(2021)也揭示了Rickettsia随着宿主昆虫的卵子发生和胚胎发育,到达和进入子代体内的途径与机制。值得一提的是,昆虫内共生菌的垂直传播并非一成不变,在进行垂直传播的同时也会发生小比例的水平传播(Ahmedetal., 2015b; 刘媛等, 2020),这也解释了为什么内共生菌在节肢动物中如此丰富,为什么亲缘关系相距甚远的昆虫可以感染有相同或相似的内共生菌。而内共生菌能成功地在鳞翅目等其他昆虫种内或种间进行水平传播,主要取决于内共生菌的种类、丰度及其定殖新宿主的存活能力。
现提出的水平传播途径主要有植物介导的水平传播、寄生蜂介导的水平传播、两性交配介导的水平传播及其他途径(刘媛等, 2020)。 Ahmed等(2016)通过Wolbachia的多位点序列分型分析(MLST)及其与鳞翅目昆虫的基因组学等技术,在31个宿主昆虫中发现了至少 7个可能的水平传播案例, 其中既有涉及鳞翅目昆虫种内的,也有鳞翅目与其他节肢动物之间的水平传播,也指出了共享同一食物来源、相同的天敌都是水平传播的可能途径,为Wolbachia的水平传播补充了鳞翅目的证据。同时,有研究发现Wolbachia的序列型ST19可能通过寄主植物或寄生蜂介导实现在鳞翅目、膜翅目、鞘翅目昆虫中传播(Masuietal., 2000; Bordenstein and Wernegreen, 2004)。 Jiggins等(2000a)研究表明,在邻珍蝶Acraeaencedana中,宿主体内的Wolbachia可能是物种间水平转移的,也有可能是母系传播的。当然,水平传播也会对受体鳞翅目昆虫产生积极的影响,如水平传播的DNA细菌已经在几种蛾类和蝶类中鉴定出能参与氰化物解毒,这使得这些鳞翅目昆虫能够利用原本有毒的植物(Wybouwetal., 2014)。然而,在宿主基因组中发现DNA细菌并不一定意味着功能性,许多水平传播的Wolbachia基因在宿主中没有以显著水平表达(Dunning Hotoppetal., 2007; Nikohetal., 2008)。噬菌体WO在细胞内共生菌基因组间是频繁横向转移的,而它的基因转移可以驱动细胞内共生菌基因组的有利进化(Bordenstein and Wernegreen, 2004)。

表1 鳞翅目昆虫体内共生菌感染情况Table 1 Infection status of the endosymbionts in lepidopteran insects
3 鳞翅目昆虫内共生菌的生物学效应
3.1 影响宿主昆虫的生长发育
越来越多的研究表明,昆虫内共生菌通常被认为可以提高鳞翅目昆虫自身的适合度,使其朝着互利共生进化(Duplouy and Hornett, 2018)。ukasiewicz等(2016)研究揭示了阿波罗绢蝶Parnassiusapollo翅畸形(包括变形与缩小)与Wolbachia缺失的相关性,发现大多数(86.0%)正常有翅蝴蝶感染有Wolbachia,而Wolbachia在70%翅畸形蝴蝶中均未检测到其存在。虽然这种现象的机制还有待阐明,但有人认为Wolbachia可能在阿波罗绢蝶的个体发育中起保护作用,只是它们的前后因果关系还有待进一步研究。此外,昆虫内共生菌还可以提高宿主利用寄主植物营养资源的能力,Kaiser等(2010)研究发现,斑幕潜叶蛾Phyllonorycterblancardella能够利用体内的共生菌(最有可能是Wolbachia)增加植物枯黄叶片内的细胞分裂素,使得枯黄叶片上的被取食部位成“绿岛”状,进而使斑幕潜叶蛾获得更多的营养物质满足自身生长所需。然而,并非所有的内共生菌都对鳞翅目昆虫的发育有利,Herren等(2007)研究发现,金斑蝶的前翅长度与Spiroplasma的存在呈负相关,同时,该菌可能对幼虫的发育历期、生长率产生不利影响。
3.2 参与宿主昆虫的生殖调控
昆虫内共生菌作为生殖调控因子在自然界普遍存在,如Wolbachia,Spiroplasma,Rickettsia,Cardinium及Arsenophonus,而最受关注且研究最多的是Wolbachia。在鳞翅目昆虫中,目前已知Wolbachia主要以诱导杀雄(male killing)、雌性化(feminisation)及细胞质不亲和(cytoplasmic incompatibility)3种方式,调控鳞翅目昆虫的生殖和发育(Duplouy and Hornett, 2018)。值得一提的是,除Wolbachia外,其他内共生菌(Spiroplasma等)也在鳞翅目昆虫的生殖调控方面发挥着重要作用(图1; 表2)(Werrenetal., 2008; 朱翔宇等, 2020)。
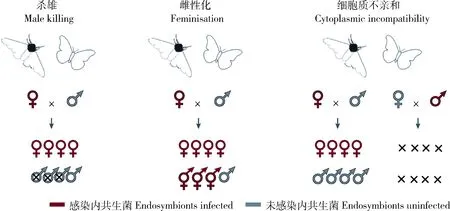
图1 鳞翅目昆虫体内共生菌的生殖调控方式(Werren et al., 2008; 朱翔宇等, 2020)Fig. 1 Reproductive manipulation of endosymbionts in lepidopteran insects (Werren et al., 2008; Zhu et al., 2020)
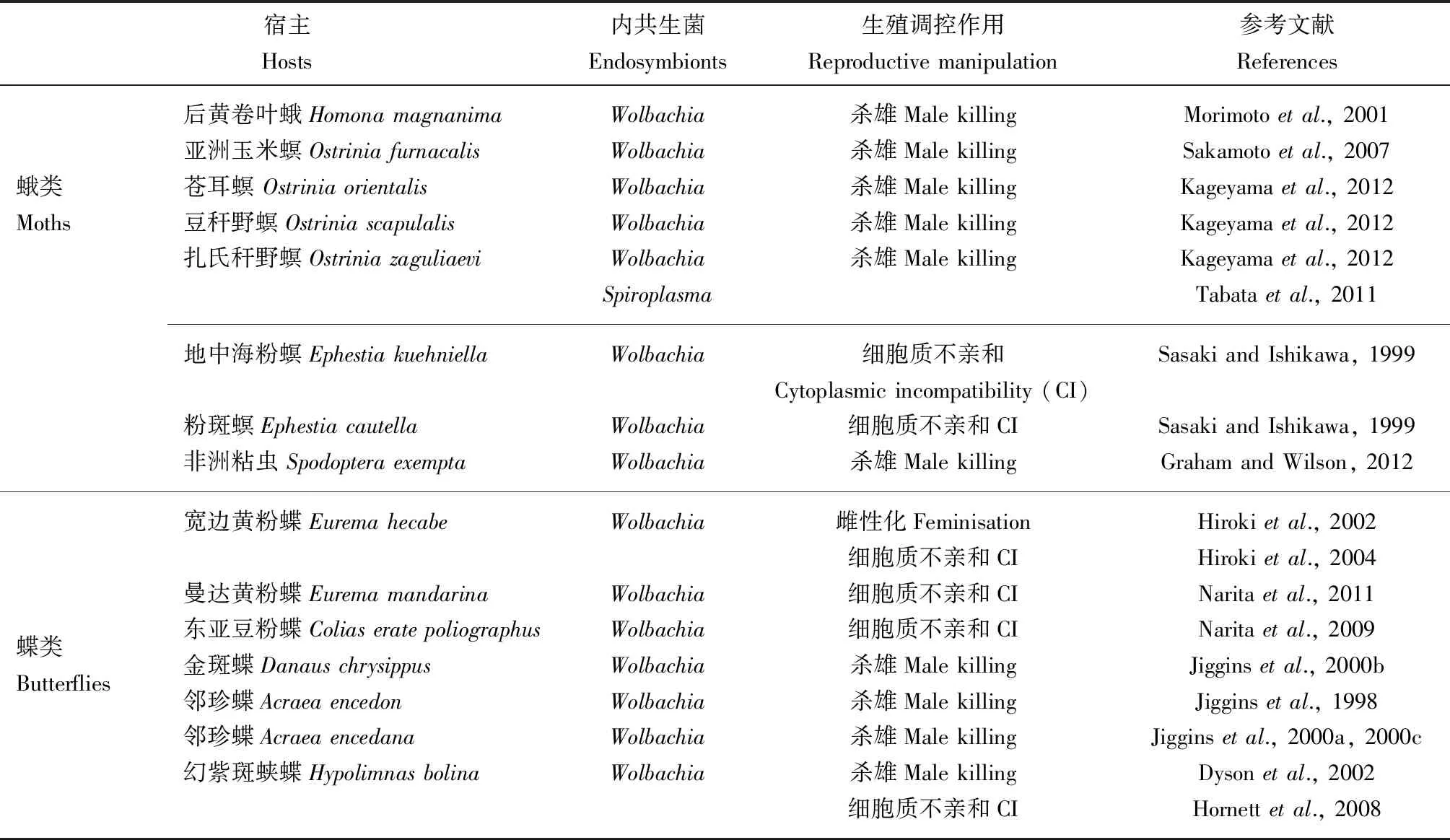
表2 鳞翅目昆虫体内共生菌参与宿主生殖调控的相关研究Table 2 Case studies on the endosymbiont-involved reproductive manipulation in lepidopteran insects
3.2.1杀雄:杀雄,指昆虫及其他节肢动物体内的共生微生物(细菌、原生生物、线虫、病毒等)引起宿主雄性后代早期胚胎或幼虫死亡,从而导致雌性性比明显偏高的现象。目前,杀雄作用的分子机制尚不完全清楚。有研究指出,杀雄作用与多种因素相关,Wolbachia也不是杀雄作用唯一的内共生菌,其他共生菌如Spiroplasma等也具有杀雄能力(Harumotoetal., 2018)。其中至少25个物种(幻紫斑蛱蝶,金斑蝶,邻珍蝶属Acraea的A.encedon和A.encedana,秆野螟属Ostrinia亚洲玉米螟O.furnacalis、苍耳螟O.orientalis、豆秆野螟O.scapulalis和扎氏秆野螟O.zaguliaevi,大丽瓢虫属Adalia二星瓢虫A.bipunctata和十星瓢虫A.decempunctata,十九星瓢虫Anisostictanovemdecimpunctata,异色瓢虫Harmoniaaxyridis,龟纹瓢虫Propyleajaponica,六斑月瓢虫Menochiliussexmaculatus,潜叶甲Brachystesselatus,黑拟粉甲Triboliummadens,果蝇属Drosophila黑腹果蝇、双条白果蝇D.bifasciata、D.nebulosa、D.borealis、D.innubila、D.neocardini、D.ornatifrons和D.paraguayensis,以及拟蝎Cordylochernesscorpioides等)表现出杀雄作用,分别属于5个目[ (鳞翅目、鞘翅目、双翅目、半翅目、伪蝎目(Pseudoscorpionida)],而在鳞翅目中尤为常见(Kageyamaetal., 2012)。在内共生菌-鳞翅目昆虫系统中,有人认为,杀雄不仅能使受感染的雌性个体获得更多的益处,还可以减少雄性对资源的竞争(Hurst and Majerus, 1993; Hurstetal., 1997)。
最早期的杀雄记录发生在野外采集和人工饲养的邻珍蝶A.encedon、A.encedana、幻紫斑蛱蝶中,Wolbachia被列为是导致杀雄的主要原因(Jigginsetal.,1998, 2000b, 2000c; Hurstetal., 1999; Dysonetal., 2002)。有研究指出,杀雄经常以极高的频率在蝴蝶种群中被报道,例如:杀雄Wolbachia在乌干达的邻珍蝶A.encedana雌性种群中感染率为95.0%,其中仅6%的野生蝴蝶是雄性(Jigginsetal., 2000c)。Dyson和Hurst(2004)研究也发现,在萨摩亚群岛上感染Wolbachia的99.0%雌蝶可以导致雌雄性比100∶1的杀雄结果。而后黄卷叶蛾Homonamagnanima、豆秆野螟O.scapulalis、亚洲玉米螟及非洲粘虫Spodopteraexempta的雌虫感染杀雄Wolbachia株系后,会发生性别比例扭曲,产生几乎全部雌性后代(Morimotoetal., 2001; Kageyama and Traut, 2004; Sakamotoetal., 2007; Graham and Wilson, 2012)。此外,扎氏秆野螟Ostriniazaguliaevi体内的Spiroplasma也能诱导杀雄(Tabataetal., 2011)。目前,特异性杀雄的确切机制尚不完全清楚,但有研究揭示,同未感染的早期胚胎相比,杀雄Wolbachia显著降低了亚洲玉米螟雄性基因Masc的表达,而当注射体外转录的MasccRNA到含Wolbachia的胚胎中时,发现其可以营救雄性后代,于是得出结论,Wolbachia诱导的杀雄是由于鳞翅目昆虫性别决定基因的剂量补偿失败引起的(Fukuietal., 2015)。
3.2.2雌性化:雌性化,指通过某些调控机制使基因型为雄性的个体表现为雌性表型。其中Wolbachia诱导的雌性化,最典型的研究发现在甲壳纲等足目的动物中,如大多数含雌性化寄生性别因子(feminizing parasitic sex factors, PSF)的野生鼠妇Armadillidiumvulgare原则上其所有个体都为遗传雄性(ZZ),仅当PSF调控Z染色体上携带的雄性决定因子时才能产生雌性表型(Juchaultetal., 1992)。当然,其他雌性为异性配子的节肢动物,如叶蝉(XX/X0)、鳞翅目昆虫(ZZ/ZW)也有相关报道(Negrietal., 2006)。有研究指出,鳞翅目昆虫体内Wolbachia诱导的遗传雄性(ZZ)的雌性化表型与正常的雄性个体(ZZ)交配后,所产生的后代都应该是雄性个体(ZZ)(董鹏和王进军, 2006)。需要强调的是,除Wolbachia外,Cardinium也能在除鳞翅目的其他昆虫中诱导雌性化(Chigira and Miura, 2005; Groot and Breeuwer, 2006),且该生殖调控方式有利于物种进化的多样性。
目前,雌性化的具体机制尚不完全清楚。Hiroki等(2002)对性别比例有雌性偏向的宽边黄粉蝶进行了调查,发现这种性别比例的扭曲是由Wolbachia导致的可垂直传递的雌性化,但自然种群中Wolbachia的感染动态及雌性化机制还有待进一步研究。Hiroki等(2004)首次发现Wolbachia多重感染可以引起宽边黄粉蝶发生双重生殖操纵,包括营救细胞质不亲和及雌性化。Narita等(2007)为了了解Wolbachia如何以及何时让基因型为雄性的个体发生雌性化,用含抗生素的食物饲喂不同龄期的宽边黄粉蝶,发现一旦成虫羽化,它们中许多个体的翅、生殖器官及生殖器均表现出中性表型,其中这些中性表型在1龄幼虫饲喂处理下发育的成虫最为显著,其次是2, 3和4龄幼虫,于是得出结论,抗生素处理可以抑制雌性化的出现。也有研究指出,曼达黄粉蝶Euremamandarina(以前的宽边黄粉蝶Y型)感染的Wolbachia两种不同株系(wCIEm和wFemEm)也能诱导基因型为雄性的个体完全雌性化(Naritaetal., 2011)。
3.2.3细胞质不亲和:细胞质不亲和,包括单向不亲和、双向不亲和两种形式,也是宿主生殖调控作用中最常见的一种方式,指未感染雌性个体与感染雄性个体交配产生的后代无法正常发育。其中影响细胞质不亲和的因素主要包括宿主遗传背景、共生菌株系、共生菌基因型、共生菌密度(浓度、滴度)、共生菌分布及环境因素等(张艳凯等, 2015)。
Wolbachia经常被描述可以诱导细胞质不亲和,许多鳞翅目昆虫中已经观察到细胞质不亲和性,如地中海粉螟、粉斑螟Ephestiacautella、东亚豆粉蝶、黄蝶Euremahecabe及幻紫斑蛱蝶(Sasaki and Ishikawa, 1999; Hirokietal., 2004; Hornettetal., 2008; Naritaetal., 2009)。Sasaki 和Ishikawa(1999)研究发现,粉斑螟体内的Wolbachia可以全部诱导细胞质不亲和,即感染的雄性个体与未感染的雌性个体交配后没有卵孵化;在日本土浦、横滨两地的地中海粉螟中却表现出部分细胞质不亲和。当幻紫斑蛱蝶进化出抑制杀雄的Wolbachia株系时,发现存活的感染雄性与未感染的雌性个体是不相容的(Hornettetal., 2008)。Narita等(2009)研究也发现,Wolbachia在不同东亚豆粉蝶日本种群中不仅能垂直传播,还可以诱导细胞质不亲和。此外,多位点序列分型分析(MLST)揭示了该Wolbachia是序列型ST141,属B超群。值得一提的是,昆虫及其他节肢动物体内可以携带多种不同表型的Wolbachia株系,如黄蝶感染两种既能诱导雌性化,也能诱导细胞质不亲和的Wolbachia株系,这也是首次发现在同一宿主不同Wolbachia株系中诱导多种不同表型(Hirokietal., 2004)。
3.3 调控宿主昆虫对不良环境的适合度
昆虫内共生菌介导的保护作用,形式极其多样,主要包括提高宿主对不良环境(逆境胁迫)的耐受力,对天敌(寄生性天敌、捕食性天敌)、病原微生物(真菌、细菌、病毒等)的防御能力等(Brownlie and Johnson, 2009; Engletal., 2018)。Engl等(2018)研究发现,内共生菌可以通过影响其昆虫宿主的角质层厚度、黑色素及碳氢化合物的分布,进而增强宿主的耐旱性,从而提高其在干燥条件下的适应度。也有研究指出,内共生菌具有产生多种生物活性物质的能力(如毒素、抗菌物质等),有些昆虫能够利用这些物质保护自己,免受生物因素、非生物因素的干扰,增强自身对外界刺激的抵抗力,如提高自身存活率、生殖力或天敌死亡率等(Degnan and Moran, 2008; Moranetal., 2008)。Lei等(2020)研究指出,Wolbachia可以提高宿主二化螟对氟虫腈和阿维菌素的抗性。相反,Graham等(2012)通过田间和室内实验首次报道,非洲粘虫体内的Wolbachia极大地增加了其对非洲粘虫核型多角体病毒(Spodopteraexemptanucleopolyhedrovirus, SpexNPV)的敏感性,导致宿主昆虫更高的病毒感染率、死亡率。于是得出结论,自然界分布广泛的Wolbachia不仅没有使宿主非洲粘虫免受病毒感染,反而使它们更易感,导致宿主的适应性降低。但造成这种截然不同结果的原因尚不完全清楚。
3.4 加快宿主昆虫的进化
在鳞翅目昆虫中,内共生菌的多样性不仅会受到非生物因素(地理位置、气候条件等)的影响,还会受到生物因素(同一宿主体内其他内共生菌)作用(Kawaharaetal., 2013; Stamatakis, 2014),而宿主昆虫与其体内共生菌的协同作用可以导致宿主遗传进化。如Lohman等(2008)研究发现,亮灰蝶Lampidesboeticus可能因为感染Wolbachia而加速种群进化,而在含两种Wolbachia株系(wCauA和wCauB)的粉斑螟中,人为将能诱导细胞质不亲和的wCauA感染到地中海粉螟中,发现在新宿主中该菌却诱导杀雄(Sasakietal., 2002, 2005)。也有研究指出,在性别比例严重扭曲的情况下,宿主会加快进化的步伐。据推测,普通卷甲虫Armadillidiumvulgare以显性常染色体M基因形式的雄性因子在宿主体内进化,来对抗雌性化内共生菌带来的影响(Rigaud and Juchault, 1993; Caubetetal., 2000)。Charlat等(2007)研究也发现,在2001-2006年,萨摩亚群岛上雌雄性别比例100∶1的幻紫斑蛱蝶逐步进化出对杀雄的抗性,使得感染Wolbachia的雄性能够存活,进而在宿主种群中迅速重建1∶1的性别比例。同时,这种关于杀雄的性别决定抑制基因位于性染色体上(Hornettetal., 2014)。
4 鳞翅目昆虫内共生菌的研究手段
4.1 内共生菌的检测方法
昆虫内共生菌是宿主昆虫不可或缺的“重要器官”,一般不能在宿主细胞体外独立生存,只能生活在宿主体内,所以很难用传统的微生物学方法对其进行研究(Mavinguietal., 2005; Masson and Lemaitre, 2020; 王争艳等, 2020),这也一定程度上限制了其发展。自20世纪80年代中期诊断性聚合酶链反应(polymerase chain reaction, PCR)、克隆和测序等技术的普及,使从分子水平上对昆虫内共生菌种类鉴定和系统发育关系的分析成为可能,如Wolbachia一般选取wsp,ftsZ, 16S rDNA及23S rDNA等基因编码区设计特异性引物进行PCR扩增。后来随着基因组学和生物信息学分析(包括微生物基因的高通量扩增子测序、宏基因组学)的应用,人们开始认识到所有生物都有可能被各种各样的微生物感染,包括真菌、细菌和病毒等,大多数的节肢动物都携带内共生菌,而且还可以对单个共生菌、共生菌间及共生菌种群进行功能预测,分析其与宿主昆虫生长发育、生殖调控、环境适应及遗传进化等方面的互作关系(表3)。如Chai和Du(2011)通过Wolbachia的wsp基因测序,指出中国23个地点的二化螟种群Wolbachia的感染情况存在较大差异。Gao等(2019)利用Illumina MiSeq对甜菜夜蛾Spodopteraexigua16S rRNA基因进行测序,研究发现甜菜夜蛾最主要的两类共生微生物是变形菌门(Proteobacteria)和厚壁菌门(Firmicutes),且总体相对丰度为90.03%。Xia等(2017)利用宏基因组学分析,揭示了小菜蛾Plutellaxylostella特定肠道细菌在植物细胞壁分解、植物酚类物质解毒和氨基酸合成中的重要作用。

表3 鳞翅目昆虫体内内共生菌检测方法的应用举例Table 3 Case studies on detecting methods for endosymbionts in lepidopteran insects
4.2 内共生菌的比较基因组学
随着高通量测序成本的降低,目前,已有许多利用基因组学阐述宿主昆虫与其体内共生菌进化及功能的报道。由于大多数内共生菌无法体外培养,且获得纯度高、足够量的DNA样品很难直接分离和测序,所以内共生菌基因组序列常被作为宿主基因组测序的副产品被回收利用,但随着分子生物学的发展,大多数节肢动物内共生菌的基因组已经完成测序和组装,只是涉及鳞翅目昆虫相关研究偏少。Lindsey等(2016)对16个Wolbachia基因组进行比较,确定了一个由496组同源基因组成的核心Wolbachia基因组,其中14组是立克次氏体目中Wolbachia所特有的。已有研究表明,对Wolbachia基因组的深入研究,有助于揭示不同株系Wolbachia与其宿主相互作用的分子机制。Duplouy等(2013)通过对密切相关的幻紫斑蛱蝶体内的杀雄Wolbachia株系wBol1b基因组,与尖音库蚊体内诱导细胞质不亲和Wolbachia株系wPip基因组进行比较分析,发现了许多对wBol1b特异的基因,而这些基因可能是诱导杀雄的潜在候选基因。值得一提的是,Spiroplasma的基因组也已在许多节肢动物中完成测序鉴定(Bolaosetal., 2015),但在鳞翅目昆虫中尚未报道。
5 小结与展望
迄今,鳞翅目昆虫及其体内共生菌的互作关系受到越来越多的关注。其中大多数针对鳞翅目昆虫内共生菌的研究,都与Wolbachia有关,Wolbachia在自然界中高度流行,形式多样,且在宿主性别决定的进化中发挥着重要作用,但其背后的分子机制尚待深入研究。当然,我们毫不怀疑鳞翅目昆虫内共生菌的研究仍会以Wolbachia为主,但我们建议应该更多地关注除Wolbachia外的其他内共生菌的存在和互作机制研究,因为丰度较低的其他内共生菌也可能在宿主昆虫体内参与重要功能。
值得一提的是,随着微生物群落的高通量扩增子测序、基因组学、宏基因组学、宏转录组学、蛋白质组学及代谢组学的快速发展,人们可以借助各种生物技术手段不断探索宿主体内共生菌的种类、定位、功能及作用。如利用高通量扩增子测序检测宿主体内的微生物群落结构;运用基因组、宏基因组预测宿主体内共生菌的潜在功能;借助宏转录组、蛋白组推测宿主体内共生菌与宿主的分子功能交流;然后通过代谢组学分析为宿主体内共生菌调控宿主提供更为直接的代谢证据。综上基于多组学关联分析,阐明宿主体内共生菌诱导表型变化的分子机制。最后,当我们对内共生菌-鳞翅目昆虫系统有了更深的了解,就可以从生产应用的角度出发,利用Wolbachia等其他内共生菌的生物学效应,如杀雄、雌性化、细胞质不亲和等,定向调控昆虫内共生菌,诱导鳞翅目昆虫产生新的理想表型,从而形成新的害虫可持续绿色防控策略,达到对害虫生物防治的效果。
