冷驯化对松墨天牛幼虫脂代谢的影响
2021-12-23陈俊贤魏洪义赵莉蔺
陈俊贤, 周 娇, 魏洪义, 赵莉蔺,3,4,*
(1. 江西农业大学农学院, 南昌 330045; 2. 中国科学院动物研究所, 农业虫害鼠害综合治理研究国家重点实验室, 北京 100101;3. 中国科学院大学, 北京 100049; 4. 中国科学院生物互作卓越创新中心, 北京 100049)
温度为生物生境中重要的环境因子,生物在应对温度变化,尤其是低温胁迫时,会采取多种生存策略适应低温。昆虫为变温动物,其生理状态极易受到温度的影响,而耐寒性则对于昆虫种群的扩散和分布起关键作用。昆虫的耐寒策略大致可分为行为和生理两种策略(Danks, 2004, 2005; 冯宇倩等, 2014),在行为上,昆虫通过寻找温差变化较小、相对温暖的场所进行越冬;在生理上,昆虫可通过改变过冷却点、冰点、含水量,产生并利用低分子糖醇、抗冻蛋白、热激蛋白等方式调节自身稳态适应低温,同时自身的脂代谢也会响应参与调节(Clark and Worland, 2008; 秦明等, 2017; 吕兵等, 2020)。
脂肪体可作为昆虫的器官,调控能量储备、合成循环代谢物及响应激素调节(Arrese and Soulages, 2010)。脂肪体富含大量的脂肪,昆虫主要利用脂类进行能量的贮存与转化。脂肪为昆虫各个发育阶段的重要能量来源,昆虫可通过分解积累的脂肪所产生的能量支持其变态、飞行、繁殖与越冬等生理活动(Ziegler 1991; Behroozietal., 2012; Wang, 2017)。除基本的储能作用外,脂类物质及其代谢产物还参与昆虫应对低温的耐受过程。昆虫对抗寒冷胁迫的重要防御措施之一是抗冻保护剂低分子量多元醇的积累,如游离氨基酸(free amino acid, FAA)可作为一种保护性化合物,作用于黑菌虫Alphitobiusdiaperinus的耐寒过程(Lalouetteetal., 2007)。甘油可作为重要的防冻剂(Storey and Storey, 1986)来响应昆虫短期和长期的冷适应,和其他低温保护剂共同作用提升昆虫的过冷却能力,参与细胞渗透压的调节,稳定低温胁迫环境下昆虫的细胞膜和蛋白质的结构与状态(Crosthwaiteetal., 2011)。有研究发现,在红尾肉蝇Sarcophagacrassipalpis中检测存在的甘油 (Leeetal., 1987),在热带的麻蝇Peckiaabnormis和Sarcodexiasternodontis中却并未检测到其存在(Chenetal., 1990)。脂肪酸(fatty acids, FAs)为脂代谢重要产物之一,是一类一端中含一羧基的长链有机化合物,在生物代谢能量的储存、细胞和生物膜结构以及生理学的调节等方面具多种功能(Jump, 2004)。昆虫的卵母细胞可利用脂肪酸合成三酰甘油等参与体内的生理代谢(Ferenz, 1985);游离脂肪酸可杀灭或抑制真菌和细菌的生长(Feldlauferetal., 1993; Benkendorffetal., 2005; Urbaneketal., 2012; 邢东旭等, 2017),维持包括脂肪体在内的其他组织的代谢活性(Arrese and Soulages, 2010);脂肪酸潜在的营养价值还可被开发与利用(高正辉等, 2017)。此外,有研究表明游离脂肪酸还与昆虫的耐寒性相关,昆虫可通过改变磷脂中不饱和脂肪酸与饱和脂肪酸的比例使自身在寒冷条件下维持液晶状态而不被冻结,减少低温损伤(lachtaetal., 2002)。且不同昆虫间的脂肪酸组成存在差异,还受其食用饲料、自身发育情况、所处的气候环境等多种因子的影响(Joanisse and Storey, 1996; Khanietal., 2007; Izumietal., 2009; Oonincxetal., 2020)。
媒介昆虫作为一种传播病原的重要昆虫对控制病原具有关键的作用,但对媒介昆虫的脂肪动员过程中游离脂肪酸的种类和功能的研究则相对缺乏(Gondimetal., 2018)。松墨天牛Monochamusalternatus属鞘翅目(Coleoptera)天牛科(Cerambycidae)沟胫天牛亚科(Lamiinae)墨天牛属Monochamus,是一类为害松树的蛀干型林业检疫害虫,其成虫是携带及传播松材线虫Bursaphelenchusxylophilus的重要媒介昆虫,在取食为害松树,影响树内营养输送的同时,加快了松树枯萎病(pine wilt disease, PWD)的传播。且松墨天牛在中国、日本、韩国等多个亚洲国家均有分布(杨宝君等, 2003),为亚洲地区松材线虫病最重要的传播媒介(Akbulut and Stamps, 2012)。我国大部分区域均为松墨天牛的适生区(时鹏等, 2019),现已有包括浙江、四川、福建、湖北、辽宁等共18个省级行政区的松树被松材线虫病侵染(国家林业和草原局, 2020),经济损失严重(朱诚棋等, 2017)。松墨天牛幼虫的适应性与抗逆能力极强,在严寒地区仍可完成完整的世代发育。据国家气象科学数据中心(data.cma.cn)数据统计显示,辽宁省内部分地区连续4年(2016-2020年)的冬季(11月-次年1月)的冬季平均气温低至- 6℃,最低平均温度可达-20℃。因此耐寒能力成为影响松墨天牛幼虫成功越冬的重要因素,也是控制松墨天牛种群数量和决定其在不同温区内成功定殖的关键因子,脂代谢在天牛幼虫越冬期的作用和响应就显得尤为重要。
本研究组的前期实验发现,松墨天牛幼虫经10 d的4℃低温处理后,其耐寒性增强,且其过冷却点在第7天时最低,与常温下(25℃)的对照组天牛幼虫存在极显著性差异(Zhangetal., 2020)。故本实验以松墨天牛的4龄幼虫为供试昆虫,分别设置25℃处理的常温对照组和4℃处理7 d的冷驯化组,测定分析松墨天牛在应对低温环境下的体内脂质代谢的变化,在一定程度上揭示松墨天牛的生理状态及其抗寒应对策略,可为研究松墨天牛幼虫的生长发育的适应机制提供理论基础,为松墨天牛的种群动态变化的预测和综合防治等研究提供参考。
1 材料与方法
1.1 供试虫源
本研究所用的松墨天牛初始种群采自浙江省杭州市富阳区新登镇(30°4′34.93″N, 119°35′5.54″E)的马尾松Pinusmassoniana木段中,经实验室人工饲料饲养建立室内实验种群,至用于实验时已连续饲养20余代。
1.2 试虫饲养方法及其脂肪体收集
室内实验种群松墨天牛全程置于智能人工气候培养箱内饲养,饲养条件:温度25℃±1℃,相对湿度70%±10%,光周期12L∶12D。其中,天牛幼虫光照条件模拟其在野外出于松树内的黑暗环境,不设置光照周期。将野外采回的松墨天牛幼虫在装有人工饲料的10 mL的离心管内进行单头饲养,至老熟幼虫化蛹羽化后,喂食松枝并提供新鲜木段供其产卵,待其在木段中孵化并取食长至1-2龄幼虫后,从木段中剖出幼虫,继续以主要成分为松树木屑的复合人工饲料进行饲养。选取同一代成虫所产的卵,将孵化后长至4龄幼虫选为试虫。随机选取30头天牛幼虫,将其中15头从25℃转至4℃条件中进行低温冷适应,其余15头继续处于25℃条件下。7 d后,分别取出,并置于体视显微镜下解剖,除去头部、表皮、中肠及马氏管,将脂肪体收集入1.5 mL离心管内,随后迅速用液氮冰冻转至-80℃冰箱中存用。
1.3 脂滴尼罗红染色
用1×PBS缓冲液将收集的松墨天牛幼虫的脂肪体清洗3次后,加适量的含20%甘油的已稀释的尼罗红染料(尼罗红染料∶1×PBS=1∶10 000, v/v)进行染色。避光染色3~5 h后,再次用1×PBS缓冲液清洗组织3次,随后转至贴好鸡眼圈的载玻片上,并滴加抗荧光淬灭剂,将组织伸展开后盖上玻片,用中性树脂固定封片。转至激光共聚焦显微镜(Zeiss LSM710)在63倍油镜下观察并拍摄脂滴照片,选用激发波长543 nm,发射波长626 nm。
1.4 脂肪含量测定
参照Liu等(2009)和Feng等(2014)的方法。在脂肪体收集阶段,称量脂肪体样品的鲜重(fresh weight, FW)。随后将脂肪体置于10 mL离心管中,在60℃条件下干燥48 h,直至样品质量不再发生变化,称量得到干重(dry weight, DW)。用手持电动研磨仪将其磨成粉末后,加入4 mL混合溶液(甲醇∶氯仿=1∶2, v/v),充分混匀后转至离心机2 600 g离心10 min,滤掉上清液,再加入混合溶液混匀,离心、弃上清,重复两次。随后再次在60℃条件下干燥72 h,直至样品质量不再发生变化,称取此时残渣的瘦干重(lean dry weight, LDW)。脂肪含量=[(DW-LDW)/FW]×100。
1.5 脂肪酸甲酯化和游离脂肪酸的测定
参照Wang等(2017)的方法,使用气相色谱-质谱联用仪(Agilent Technologies 6890N GC-5973 MSD)进行检测。样品处理:将松墨天牛的脂肪体样品放入1.5 mL加5 μL十三酸甲酯作为内参,再加入1 mL HPLC级的混合试剂(硫酸∶甲醇=1∶49, v/v)均匀研磨。恒温金属浴锅预先加热至80℃,用防爆夹夹紧离心管,温育1 h。待冷却至室温后,将样品转移至5 mL离心管内,加入1.5 mL双蒸水和0.3 mL HPLC级正己烷溶液,充分震荡进行萃取,使脂肪酸甲酯化后,使用离心机5 000 g离心10 min。随后吸取50 μL上层有机相到进样瓶(Agilent)中,剩余的上层有机相存入样品瓶中密闭好,置于-20℃备用。色谱条件: HP-5MS毛细管柱(60 m×0.25 mm×0.25 μm)(J&W Scientific, Folsom, CA)。 柱温升温程序: 50℃ 30 s;以5℃/min速率升至200℃;换用2℃/min速率升至240℃;再以5℃/min速率升至250℃;250℃后保持10 min;最后以3℃/min速率升至280℃;280℃保持3 min。GC-MS传送杆: 280℃离子源: 230℃四级杆: 50℃组分分析电子能: 70 eV,扫描范围35~400 amu,溶剂延迟3 min。
1.6 总RNA提取及cDNA第1链合成
参照总RNA提取试剂盒(TIANGEN)说明书提取松墨天牛幼虫脂肪体的总RNA,再用NanoDrop 2000分光光度计(NanoDrop Products, 美国)测定RNA的浓度与纯度(OD260/OD280),取1 μg提取的总RNA进行反转录,余下RNA保存于-80℃保存备用。最后参照Fast Quant cDNA 第1链合成试剂盒(TIANGEN)将RNA反转录为cDNA。并用RNase-Free ddH2O将cDNA的量浓度统一至200 ng/μL,以此作为模板利用PCR检测cDNA质量合格后置于-20℃保存备用。
1.7 基因表达量实时荧光定量PCR(RT-qPCR)测定
使用Primer Premier 6.0软件设计基因的特异性引物(表1),扩增基因片段长度150~300 bp,送至深圳华大基因科技有限公司合成。

表1 引物信息Table 1 Primer information
以β-actin基因为内参基因,使用Super Real PreMix Plus试剂盒(TIANGEN)进行荧光定量检测,按说明书配制反应体系溶液。利用ABI 7300实时荧光定量PCR采用三步法进行检测和数据收集。每个处理含10个生物样品重复,每个样品进行3次技术重复。
1.8 数据分析
使用GC-MS(Gas Chromatography-Mass Spectrometer)软件结合NIST02数据库(Rev. D.04.00, Agilent Technologies, Palo Alto, CA, USA)以及标准品滞留时间对松墨天牛游离脂肪酸的数据进行定性及定量分析,其组成采用峰面积归一化法计算解析组分的相对百分含量。数据的综合统计分析采用软件Excel 2016和SPSS 22.0;各处理组采用独立样本T检验比较法进行差异显著性分析;作图利用软件GraphPad Prism 7.0完成。
2 结果
2.1 冷驯化后松墨天牛4龄幼虫脂肪体内脂肪含量变化
为研究低温是否会影响松墨天牛脂肪的积累水平,我们检测了脂肪的含量并染色观察其状态变化。将松墨天牛幼虫进行7 d的冷处理(4℃)后,对其脂肪体进行尼罗红染色,我们观察到脂肪体内的脂滴存在明显变小且密度降低的现象,表明松墨天牛幼虫在低温环境下脂质代谢发生了变化,脂质被分解消耗(图1)。且松墨天牛冷处理前后的脂肪含量差异由图2可知,松墨天牛的脂肪积累受到低温环境的影响,对照组脂肪含量为15.70%±2.72%,处理组脂肪含量为13.18%±2.67%。经历低温后的脂肪含量较之前有所下降,说明低温下脂肪分解代谢。松墨天牛幼虫在越冬期进食量减少,通过体内储备脂肪的消耗来维持其基本代谢。
2.2 冷驯化后松墨天牛4龄幼虫脂肪体内游离脂肪酸种类
为了进一步证明低温加快脂分解代谢,我们对β-氧化信号通路上游的游离脂肪酸进行了定性和定量分析。如图3所示,利用GC-MS检测分析松墨天牛4龄幼虫脂肪体中的游离脂肪酸,发现对照组和处理组中的主要脂肪酸均为C16∶0, C18∶0, C16∶1, C18∶1和C18∶2,共5种。此外,此次共检测到11种脂肪酸(表2),含7种饱和脂肪酸:月桂酸(C12∶0)、十五烷酸(C14∶0)、棕榈酸(C16∶0)、十七烷酸(C17∶0)、硬脂酸(18∶0)、花生酸(C20∶0)、山俞酸(C22∶0);4种不饱和脂肪酸,其中含3种单不饱和脂肪酸:棕榈油酸(C16∶1)、油酸(C18∶1)和二十碳烯酸(C20∶1),1种多不饱和脂肪酸——亚油酸(C18∶2)。一般情况下,随温度的降低,生物体内脂肪总量会发生变化,脂肪酸也会相应发生改变。本研究中,对照组和处理组松墨天牛4龄幼虫脂肪体内的脂肪酸组成成分相同,但其各部分含量发生了变化。两组中C16∶0, C18∶0, C16∶1, C18∶1和C18∶2为主要脂肪酸,其中C18∶2的相对含量在两组中均为最高,在25℃时达31.83%±8.82%,经冷驯化后降至25.16%±2.88%。C16∶0, C16∶1和C18∶2脂肪酸含量经冷驯化后也均呈下降趋势。而冷驯化后,C18∶0与C18∶1的相对含量则呈上升趋势,C18∶1的含量由25℃下的14.43%±1.92%增至冷驯化后的16.37%±1.06%,与之前Kostal和Simek(1998)所报道的地中海灯蛾Cymbalophorapudica幼虫经冷处理后的C18∶1含量变化的趋势一致(表2)。

图1 冷驯化后松墨天牛4龄幼虫脂肪体中脂滴形态变化Fig. 1 Morphological changes of lipid droplets in the fat body of the 4th instar larvae of Monochamus alternatus after cold acclimationA: 未经冷驯化,松墨天牛4龄幼虫一直在常温(25℃)下饲养(对照组)Non-subjected to cold acclimation, the 4th instar larvae of M. alternatus were reared at room temperature (25℃) all the time as the control group. B: 经历冷驯化,松墨天牛4龄幼虫由常温(25℃)转至低温(4℃)下饲养7 d(处理组) Subjected to cold acclimation, the 4th instar larvae of M. alternatus were transferred from room temperature (25℃) to low temperature (4℃) and reared for 7 d as the treatment group.

图2 冷驯化后松墨天牛4龄幼虫脂肪体中脂肪含量的变化Fig. 2 Changes in the fat content in the fat body of the 4th instar larvae of Monochamus alternatusafter cold acclimation以一直在25℃下饲养的幼虫为对照组;以从25℃转移至4℃冷驯化7 d的幼虫为处理组。Larvae reared at 25℃ all the time as the control group, and those transferred from 25℃ to 4℃ and subjected to cold acclimation for 7 d as the treatment group. 下同The same below. 图中数据为平均值±标准误,每个处理均有5头昆虫作为重复;两组间采用独立样本T检验进行差异显著性分析。Each value in the figure represents mean±SE of 5 individual replicates. Statistical significance of differences between the two groups was analyzed using independent-samples t-test. nsP>0.05.
2.3 冷驯化后松墨天牛4龄幼虫脂肪体中主要游离脂肪酸相对丰度变化
昆虫的不饱和脂肪酸/饱和脂肪酸的比例与昆虫的抗寒性相关。未经冷驯化的对照组和经冷驯化的处理组中,松墨天牛4龄幼虫脂肪体的主要脂肪酸组成均以不饱和脂肪酸所占丰度最高(图3)。经冷驯化后松墨天牛4龄幼虫脂肪体中的脂肪酸丰度由于脂质的消耗,整体呈下降趋势(图4),其中C16∶0, C16∶1及C18∶2的丰度下降显著,分别减少了30.95%, 47.85% 及35.56%。但冷处理后的松墨天牛的游离脂肪酸的双键指数UFA/SFA(不饱和脂肪酸/饱和脂肪酸的比例)上升,由25℃条件下的2.32±0.16增至4℃低温处理后的2.41±0.21。
2.4 冷驯化后松墨天牛幼虫脂肪体中脂肪酸β-氧化关键酶基因表达变化
根据前部分实验结果可知,松墨天牛4龄幼虫在经历低温处理后其脂肪体内的脂肪含量减少(图2),游离脂肪酸含量及相对丰度呈下降趋势(表2和图4),幼虫脂肪体的脂质被分解消耗,脂肪代谢发生改变。为进一步探索松墨天牛幼虫在低温条件下的脂肪代谢水平的变化,我们分别对未经冷驯化和经冷驯化的松墨天牛4龄幼虫脂肪体中脂肪酸β-氧化关键代谢酶[carnitine palmitoyltransferase 1(CPT1), 4-ketoacyl-CoA thiolase(4KCT), very long chain acyl-CoA dehydrogenase(VLCAD), enoyl-CoA hydratase (ECH), 3-hydroxyacyl-CoA dehydrogenase(3HCD-1)]基因的相对表达量进行了测定和分析。经历7 d的低温处理后,松墨天牛4龄幼虫脂肪体中脂肪酸酶的表达水平均呈上调状态,但只有VLCAD编码基因的表达量在两组间存在显著性差异(P<0.05),处理组的表达量显著高于对照组的表达量(图5)。这表明松墨天牛幼虫脂肪体的脂肪酸的代谢水平在经历低温处理后高于未经历低温的对照组的代谢水平,且此时的脂肪酸分解水平升高,松墨天牛幼虫通过脂肪酸的β-氧化获得能量,维持其在低温下的内部稳态,增强了天牛幼虫的抗逆能力。
3 讨论
温度可影响昆虫的进食、繁殖等生理活动,对其生长发育、代谢及种群的分布具有重大生物学意义。本研究以媒介昆虫松墨天牛的幼虫为研究对象,探究了低温下其脂肪代谢的变化,并探讨了游离脂肪酸的种类和含量在其耐寒过程中的作用。我们发现,松墨天牛幼虫在经历低温驯化期间的储存脂肪被充分动员分解,脂肪酸酶的代谢水平加快,脂肪酸双键指数上升,脂肪及其代谢物质在天牛幼虫自身的供能和耐寒保护机制中起重要作用。
昆虫的脂肪含量的变化对其耐寒性产生了影响。本研究中松墨天牛幼虫在经历冷处理后进入低温滞育状态,取食量减少,只能依靠现有的脂肪贮存来进行脂代谢,故其脂滴变小,密度下降,且脂肪含量下降(图1和2)。 这与之前在如Ocneriaterebinthina及Arimaniacomaroffi等一些越冬昆虫中观察到的脂肪含量变化趋势一致,研究人员发现这些越冬昆虫在越冬前积累脂肪,之后脂肪含量随越冬时间延长而逐渐下降,越冬结束后的脂肪含量显著低于越冬前(Behroozietal., 2012; Bemanietal., 2012; 杨海博等, 2019; 吴有芳等, 2019)。一般动物在越冬前,会通过增加体内贮存的脂肪含量来抵御寒冷,大多越冬昆虫也如此,在其滞育或越冬前会进行脂肪的积累(Hahn and Denlinger, 2007)。积累的脂质可通过氧化作用为大部分昆虫供能,作为昆虫越冬和越冬后活动的主要燃料,维持生命活动。且昆虫可通过提高脂肪含量,降低体内含水量来增高体内的溶质浓度,减缓新陈代谢速率(Canavosoetal., 2001; 任小云, 2016)从而提高自身的耐寒性,而越冬结束时所储存的脂质含量明显比开始时减少(Sinclair and Marshall, 2018)。本实验冷驯化处理组与常温对照组间松墨天牛幼虫体内的脂肪含量差异不显著(图2),或许与低温冷处理持续的时间有关,若松墨天牛长期处于低温环境或滞育状态,其累积的脂肪消耗含量可能会表现出显著差异。这说明松墨天牛等昆虫在低温条件下,利用脂代谢产生的能量维持生理稳态。
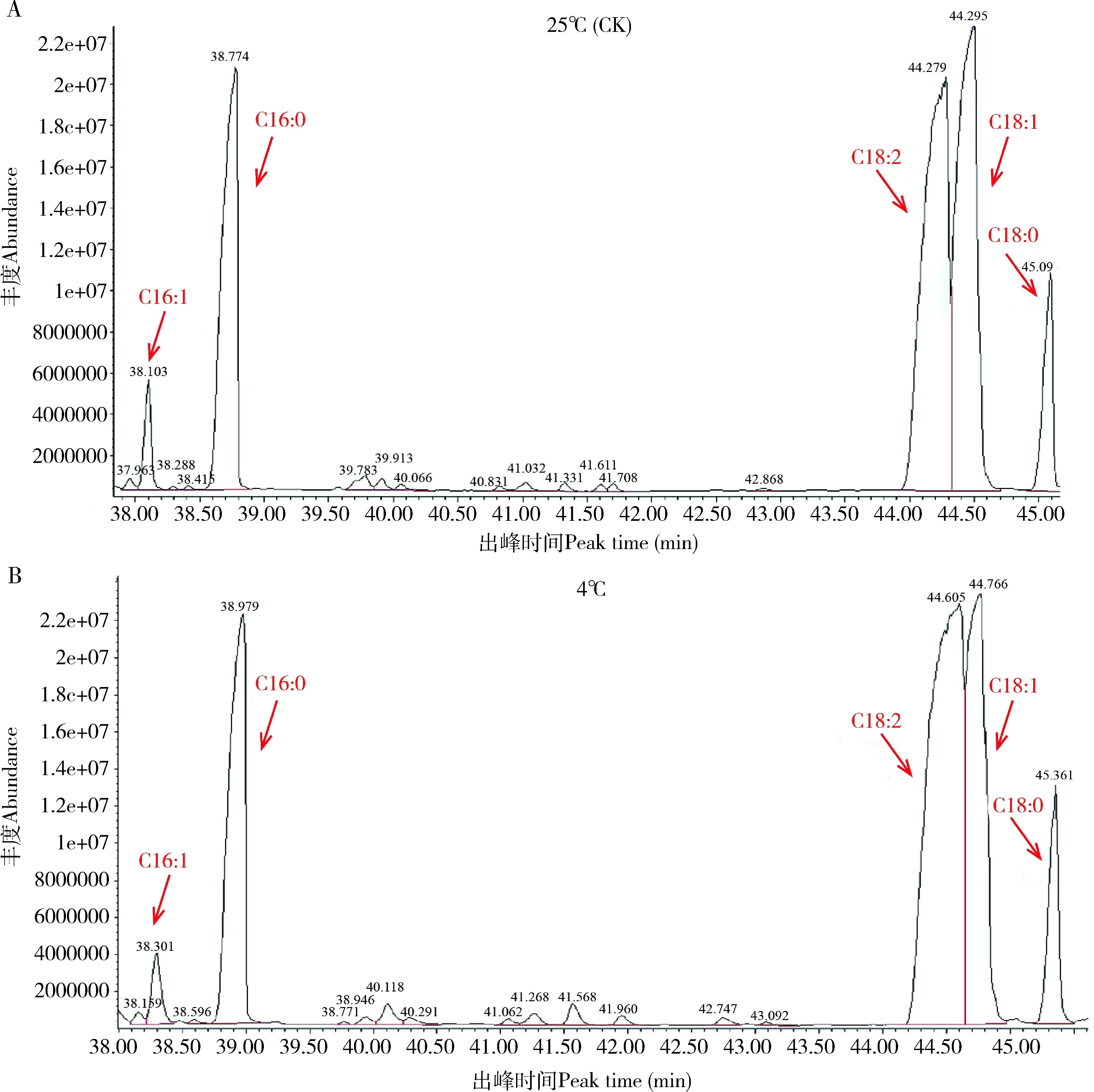
图3 气相色谱-质谱联分析松墨天牛4龄幼虫经冷驯化后脂肪体中主要游离脂肪酸组成的变化Fig. 3 Changes in the composition of main free fatty acids in the fat body of the 4th instar larvae of Monochamus alternatus after cold acclimation analyzed by GC-MSA: 25℃未经冷驯化(对照组)Non-subjected to cold acclimation at 25℃(CK); B: 4℃冷驯化7 d Subjected to cold acclimation at 4℃ for 7 d. 检测的物质均为甲酯化的游离脂肪酸。The substances detected were the products of methyl esterification of free fatty acids.
脂肪酸的含量变化会影响昆虫的耐寒性,昆虫在受到低温胁迫后会通过一系列的脂代谢调控策略为自身在寒冷环境下的生存提供有力的保障。松墨天牛4龄幼虫进入低温环境后,取食活动停止,其主要游离脂肪酸的相对丰度下降(图4),脂肪酸β-氧化的关键酶基因的表达量上调(图5),脂肪酸的分解代谢水平升高,从而产生并获取能量维持基本代谢。与此同时,在人工冷驯化过程中天牛为适应环境温度的变化,其C18∶1的相对含量增加(表2),体内不饱和脂肪酸与饱和脂肪酸的比例(UFA/SFA)上升,与Kostal和Simek(1998)研究报道经冷处理的地中海灯蛾C.pudica幼虫的双键指数及Joanisse和Storey(1996)研究报道的金针瘿蚊Eurostasolidaginis幼虫及白斑小卷蛾Epiblemascudderiana幼虫越冬后的双键指数变化趋势一致。此现象在处于自然低温环境变化中和人工低温驯化条件下的部分昆虫中均有发现(Izumietal., 2009; 易杰群等, 2015),由此增加低温下细胞膜的流动性,减少膜的脂流动性,从而提高昆虫自身的耐寒性(Khanietal., 2007; Rozsypaletal., 2014)。游离脂肪酸的组成种类会随着昆虫物种及其自身所处环境的差异而产生变化(Ohtsuetal., 1993; Rozsypaletal., 2014; Zhuetal., 2016),但几乎所有的昆虫都能生物合成C16∶0, C18∶0和C18∶1(Stanley-Samuelsonetal., 1988),且在本实验中还作为松墨天牛幼虫的主要游离脂肪酸被检测出,天牛幼虫的游离脂肪酸种类在经历低温处理的前后均未发生改变(表2)。目前未有直接证据指明昆虫能合成亚麻酸(C18∶3),此次在松墨天牛幼虫中也未检测到,但在日常膳食含有C18∶3的昆虫体内中可检测到其存在。南美大闪蝶Morphopeleides因其生境中的食物紫檀叶中富含C18∶3不饱和脂肪酸,长期进食过程中极大地增加了幼虫体内不饱和脂肪酸含量,使其耐寒力增强,顺利越冬(Wangetal., 2006)。
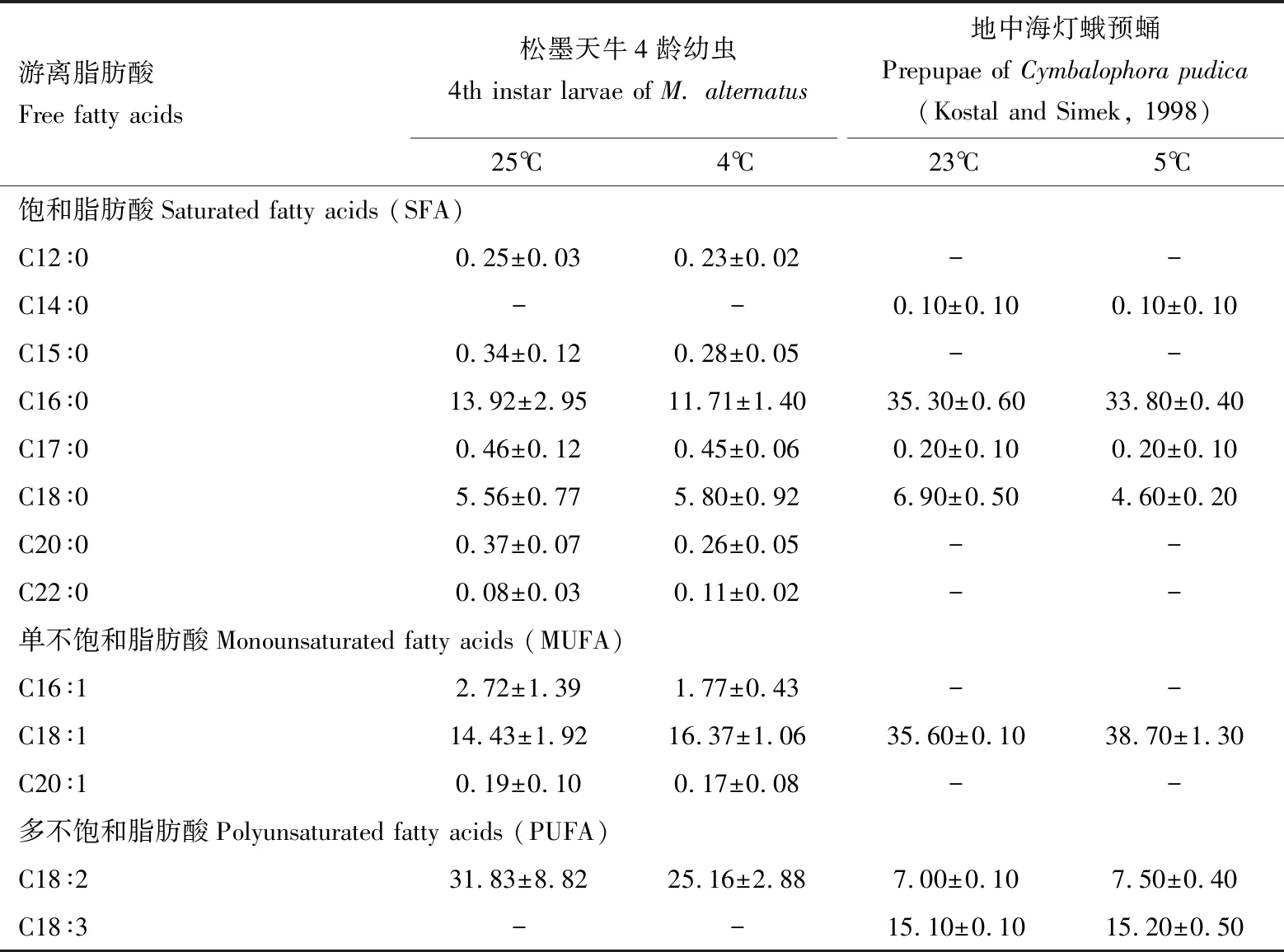
表2 经冷驯化后松墨天牛4龄幼虫脂肪体中游离脂肪酸相对含量Table 2 Relative contents of the free fatty acids in the fat body of the 4th instar larvaeof Monochamus alternatus after cold acclimation

图4 冷驯化后松墨天牛4龄幼虫脂肪体中主要游离脂肪酸相对丰度的变化Fig. 4 Changes in the relative abundance of main free fatty acids in the fat body of the 4th instar larvae ofMonochamus alternatus after cold acclimation图中数据为平均值±标准误,每个处理均有10头昆虫作为重复;组间采用独立样本T检验比较法进行差异显著性分析。Each value in the figure represents mean±SE of 10 individual replicates. The significance of statistical differences was analyzed using independent samples t-test. nsP>0.05; * 0.01≤P≤0.05. 图5同The same for Fig. 5.
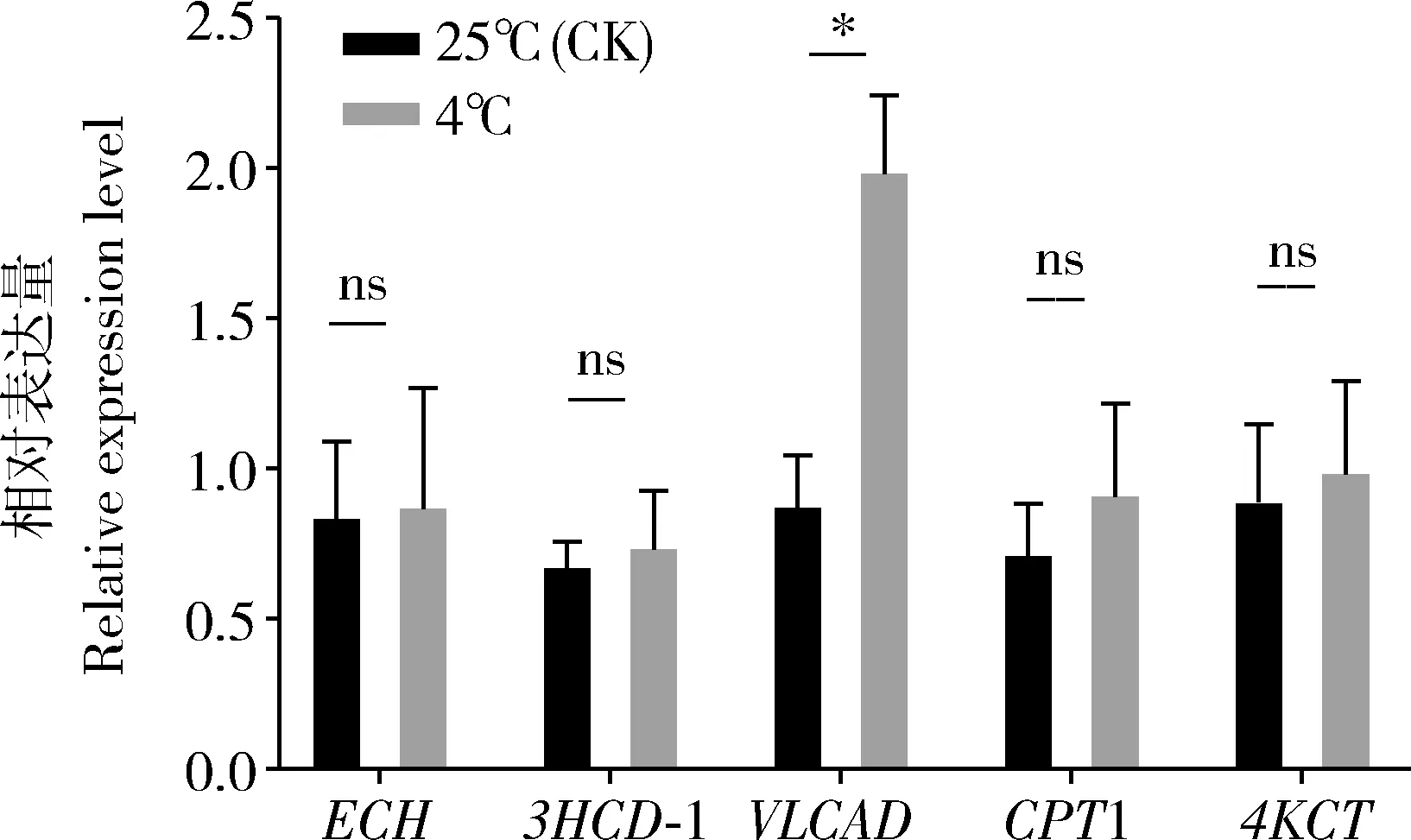
图5 冷驯化后松墨天牛幼虫脂肪体中脂肪酸β-氧化过程关键代谢酶基因在mRNA水平上的变化Fig. 5 Changes in the mRNA levels of genes of key enzymes involved in fatty acid β-oxidation in the fat body of the 4th instar larvae of Monochamusalternatus after cold acclimation以β-肌动蛋白基因作为PCR过程中的内参基因。β-Actin gene was used as the reference gene in the PCR process.
综上所述,本研究发现,松墨天牛在低温环境下因自身有限的能源储备,调整了耐寒生存策略,降低整体的代谢水平从而维持基本生命活动。松墨天牛的脂代谢在此期间发生了一系列适应性的改变:(1)脂肪作为能源物质被利用消耗,其脂滴变小,密度及脂肪含量下降;(2)脂肪酸种类未发生变化,但脂肪酸含量随脂肪的减少而下降;(3)脂肪酸分解代谢水平升高,通过β-氧化获取能量;(4)脂肪酸双键指数(UFA/SFA),即不饱和脂肪酸的相对比例上升,防止了储存脂肪的凝固,并保持了其流动性,增强了松墨天牛的耐寒性。下一步可联系其生活史中的各个因素探究低温时脂肪酸脱饱和酶(fatty acid desaturase, FAD)对松墨天牛体内不饱和脂肪酸形成的影响,对松墨天牛的耐寒生理适应策略开展进一步研究。总之,脂类物质可作为松墨天牛幼虫在低温环境下的基础能量来源并增强其低温抗逆能力,脂肪代谢为松墨天牛幼虫耐寒生理反应机制中的重要环节。这些发现对研究松墨天牛的耐寒性及其种群地理分布具有一定的理论指导意义。
