番茄抗病种质资源分子标记筛选
2021-12-21杨再俊郑家瑞潘鹏程潘寅涛高彬李云洲
杨再俊 郑家瑞 潘鹏程 潘寅涛 高彬 李云洲


摘 要:番茄是现代蔬菜的支柱产业,也是脱贫攻坚的优势产业,为了满足番茄生产种对抗病抗逆性的需求,挖掘利用抗病资源育种越来越被关注,本研究利用已明确的番茄根结线虫抗性基因Mi,抗PVY病毒病基因Pvr4,抗番茄黄化曲叶病毒(TYLCV)基因Ty-1/Ty-3,对贵州本土16个番茄种质资源进行分子标记筛选。结果表明:通过三对根结线虫抗性分子标记REXF1/REXR2、PM3Fb/PM3Rb和Mi23F/Mi23R對16个番茄种质资源进行检测,结果显示所有材料均含Mi基因,但是通过PMiF3/PMiR3对其检测,结果显示只有GZ09、GZ14、GZ10、GZ13等4个番茄材料含有Mi基因,而其他品种均不含Mi基因;另外,本研究通过Pvr4/Pvr7-F和Pvr4/Pvr7-R引物对16个番茄种质资源的马铃薯Y病毒(PVY)抗性分子标记进行检测,结果只有GZ04、GZ07和GZ06三个番茄材料含有Pvr4基因;用TYLCV抗性分子标记引物qR180/qF180扩增 16 个番茄材料,结果显示,GZ02、GZ19、GZ04、GZ07、GZ01、GZ08、GZ09、GZ03、GZ16、GZ05、GZ13、GZ18、GZ11等13个番茄品种含有抗性基因Ty1/Ty3。综合分析三种抗病分子标记,确定GZ04、GZ07和GZ06为三个优异抗病材料,可用于将来的番茄抗病育种,本研究初步明确了贵州大学16个番茄种质资源的抗性分子标记,为番茄抗病育种提供材料选择,为贵州省‘红酸汤产业奠定材料基础。
关键词:番茄;抗性基因;分子标记;种质资源
中图分类号:S641.2
文献标识码:A
文章编号:1008-0457(2021)06-0030-07
国际DOI编码:10.15958/j.cnki.sdnyswxb.2021.06.004
Abstract:Tomato is a pillar industry of modern vegetables and an advantageous industry for poverty alleviation.In order to meet the demand for disease and stress resistance in tomato production,more and more attention has been paid to the exploitation and utilization of resistance resources for breeding.This study used theresistance gene Mi of tomato root-knot nematode resistance gene Mi,the resistance gene Pvr4 of PVY virus disease,and resistance gene Ty-1/Ty-3 of tomato yellow leaf curl virus(TYLCV)to identify the resistance molecular marker about 16 tomato germplasm resources from Guizhou.Sixteen tomato germplasm resources were tested by three pairs of root-knot nematode resistance molecular markers REXF1/REXR2,PM3Fb/PM3Rb and Mi23F/Mi23R.The results showed that all materials contained Mi genes.When these materials were tested by PMiF3/PMiR3,the test results showed that only 4 tomato materials,such as GZ09,GZ14,GZ10,GZ13,contained Mi genes.In addition,this study used Pvr4/Pvr7-F and Pvr4/Pvr7-R primers to detect the potato virus Y(PVY)resistance molecular markers of 16 tomato germplasm resources.Only three tomato materials(GZ04,GZ07 and GZ06)contained Pvr4 gene.Sixteen tomato materials were amplified with TYLCV resistance molecular marker primer qR180/qF180.Thirteen tomato varieties contained the resistance gene Ty1/Ty3,such as GZ02,GZ19,GZ04,GZ07,GZ01,GZ08,GZ09,GZ03,GZ16,GZ05,GZ13,GZ18,GZ11,etc.GZ04,GZ07 and GZ06 were determined to be the excellent materials by comparing the three resistance molecular markers,which can be used for resistant breeding in tomato.This study has preliminarily clarified the resistance molecular markers of 16 tomato germplasm resources from Guizhou University,which provides material selection for tomato resistance breeding,and lays a material foundation for the "red and sour soup" industry in Guizhou Province.
Keywords:tomato;resistance gene;molecular marker;germplasm resources
番茄(Solanum lycopersicum L.),属于茄科(Solanaceae)蔬菜作物,因其经济价值高,已成为现代蔬菜的主导产业,更是脱贫攻坚的优势产业。目前,中国番茄产量排名世界第一,在我国乃至地区经济发展中发挥重要作用。另外,番茄也是贵州省特色‘红酸汤的基本原料,在贵州省番茄的产量和种植面积呈稳步增长趋势[1]。番茄在贵州省种植历史悠久,其中野生番茄具有较高的抗逆性和抗病性[2],但经过育种工作者的长期定向选育,很多野生番茄中携带的优异基因丢失[3],如番茄裂果[4]、长花柱表型不稳定[5]。目前,栽培番茄生产过程中面临严重的病虫害威胁,日益增长的病害成为番茄生产的一大威胁,病害严重影响了番茄的产量与质量。当前对我国番茄产生为害的主要病害有番茄黄化曲叶病毒病(Tomato Yellow Leaf Curl Virus,TYLCV)、番茄斑萎毒病(Tomato Spotted Wilt Virus,TSWV)、番茄早疫病、番茄灰霉病、番茄叶霉病、番茄根结线虫病、番茄青枯病、番茄枯萎病、番茄细菌性髓部坏死病等[6-10]。因此,针对番茄生产中的主要病害,进行对番茄抗病种质的筛选、创制和优质多抗番茄品种的選育对于当前番茄抗病、抗逆育种是必要的选择。
与传统杂交育种相比,高效分子标记辅助育种技术有很多优势,如缩短育种时间,快速检测抗病基因、成本低等。目前关于番茄抗性基因或分子标记有很多,如番茄黄化曲叶病毒抗性分子标记有Ty-1、Ty-2、Ty-3、Ty-4、Ty-5、Ty-6[11-20],其中,Ty-1/Ty-3是一对等位基因,Verlaan等[18]发现Ty-1/Ty-3定位于6号染色体的同一区域,该区域有R170、R180和R190三个基因,通过VIGS沉默R180,植株抗性消失,该结果表明R180是Ty-1/Ty-3抗性标记的关键基因。番茄抗根结线虫(Root-Knot Nematodes)基因Mi-1;抗马铃薯Y病毒(PYV)基因/分子标记主要有va、va1、va2、lF4E-pvr2、Pvr4/Pvr7 [21-22]。正是得益于分子标记辅助育种技术的快速发展,我国番茄育种事业才取得快速发展,如侯富恩等[23]利用与Ty-1、Ty-2、Ty-3连锁的分子标记P6-6、T0302、P6-25筛选出同时含有‘TY1-2和‘TY1-3的聚合单株,通过抽样调查发现该单株均含有Ty-1和Ty-2、Ty-1和Ty-3抗病基因;刘梦姣等[24]通过田间抗性表型结合分子标记辅助育种技术,筛选樱桃番茄抗晚疫病材料,确定了TL32、TL101两个番茄材料不仅对晚疫病有良好抗性,而且还抗TYLCV(携带Ty-2抗性基因);孟凡娟等[25]采用群体分离分析法(Bulk segregation analysis,BSA)和随机扩增多态性DNA标记(Random Amplified Polymorphic DNA,RAPD)技术筛选与抗病基因连锁的分子标记研究番茄抗叶霉病和感叶霉病亲本组合(03036×03748)的 F2分离群体,结果确定该番茄特异性叶霉病抗性基因Cf6。Arnedo-Andrés等[26]利用BSA发现与Pvr4基因相关的RAPD分子标记。Devran等[27]将番茄6号染色体上抗根结线虫的单核苷酸多态性(Single Nucleotide Polymorphism,SNP)标记序列转化为KASP基因分型试验,使用共显性序列特征扩增区( sequence characterized amplified regions, SCAR)引物对Mi23F/Mi23R特异性的扩增番茄品种Mi基因部分,结果表明,KASP法适用于番茄育种中大群体的高通量筛选。
为了满足番茄生产对抗病、抗逆品种的需求,加速番茄育种,本试验采用分子标记辅助育种手段,对贵州大学农学院番茄种质资源库中16个本土材料,进行抗病分子标记筛选,为番茄高聚合抗病育种奠定基础。
1 材料与方法
1.1 试验材料
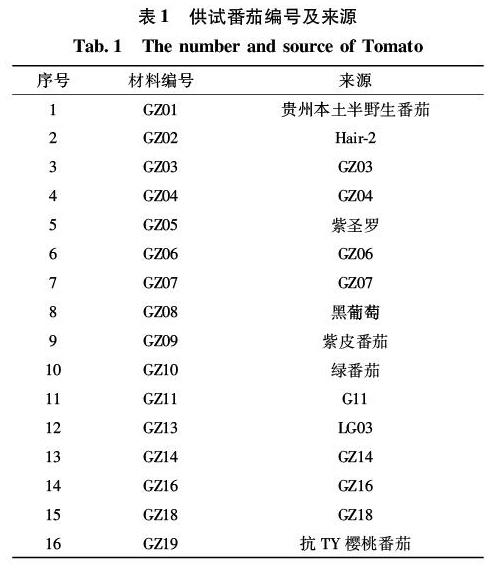
本试验所用材料均为来自贵州大学农学院植物病理教研室(表1),材料于2019年4-10月在贵州大学农学院本科教学实习基地进行。
1.2 抗性基因的分子标记检测
1.2.1 总DNA的提取
参照TIANGEN公司植物组DNA提取试剂盒(型号:DP180123)说明书进行提取番茄总DNA,DNA 样品于 -20 ℃贮存备用。
1.2.2 抗根结线虫基因的分子标记检测
番茄抗根结线虫Mi基因CAPS引物REXF1/REXR2序列见表2。PCR反应体系20 μL,包括1.0 μL gDNA模板,正反向引物各1.0 μL,10 μL 2×Taq Master Mix(Novoprotein Scientific Inc.),7 μL ddH2O共20 μL。反应程序为:预变性94 ℃ 3 min,变性94 ℃ 30 s,退火55 ℃ 0.5 min,延伸72 ℃ 1 min,35个循环。72 ℃延伸10 min。PCR 产物经1%琼脂糖凝胶电泳检测。
番茄抗根结线虫Mi基因引物对组合PM3Fb/PM3Rb和PMiF3/PMiR3[28]的序列见表2,反应程序参照REXF1/REXR2[28]检测体系,退火温度分别为54 ℃。PCR产物经1%琼脂糖凝胶电泳检测。
番茄抗根结线虫Mi基因SCAR引物Mi23F/Mi23R序列见表2。反应程序参照REXF1/REXR2检测体系,退火温度分别为56 ℃。PCR产物经1.0%琼脂糖凝胶电泳检测。
1.2.3 抗PVY病毒病基因的分子标记检测
抗 PVY Pvr4位点的 CAPS 标记引物对PM3Fb/PM3Rb序列见表2。反应程序参照REXF1/REXR2检测体系,退火温度分别为 55 ℃。PCR 产物经 1%琼脂糖凝胶电泳检测。
1.2.4 抗黄化曲叶病毒基因的检测
抗黄化曲叶病毒Ty1/Ty3基因引物对qF180/qR180[18]序列见表2。反应程序参照REXF1/REXR2检测体系,退火温度分别为 56 ℃。PCR产物经1%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 抗根结线虫基因的检测
2.1.1 CAPS 法检测Mi基因
采用引物REXF1/REXR2扩增各番茄品种基因组 DNA 的 REX-1 位点,结果显示:所有供试番茄品种都能扩增出 1 条约 740 bp 的特异条带。表明供试的所有番茄品种均含有Mi基因(图 1)。
2.1.2 引物对组合PM3Fb/PM3Rb检测Mi基因
用引物对PM3Fb/PM3Rb 扩增 16 个番茄品种的基因组 DNA,结果显示:GZ09、GZ14、GZ10、GZ13等4个番茄品种能扩增出一条550 bp的特异条带,其余12个番茄品种不能擴增出条带。表明只有GZ09、GZ14、GZ10、GZ13等4个番茄品种含有Mi基因(见图2)。
2.1.3 引物对组合PMiF3/PMiR3检测 Mi基因
用引物对PMiF3/PMiR3扩增 16 个番茄品种的基因组 DNA,结果显示:仅GZ14能扩增出550 bp和350 bp两条条带,显示为Mi/mi杂合基因型,GZ10和GZ13能扩增出550 bp的条带,其余13个番茄品种均能扩增出350 bp的条带,显示为Mi/Mi纯合基因型。表明除GZ10、GZ13和GZ14其余13个番茄材料均含有纯和的Mi基因(见图3)。
2.1.4 SCAR 标记检测 Mi基因
用引物对Mi23F/Mi23R扩增 16 个番茄品种的基因组 DNA,结果显示:所有供试番茄品种都能扩增出1条380 bp的特异性条带,表明它们为Mi/Mi纯合基因型,即含有Mi基因(见图4)。
2.2 引物对Pvr4/Pvr7-F和Pvr4/Pvr7-R检测Pvr4基因
用引物对Pvr4/Pvr7-F和Pvr4/Pvr7-R扩增 16 个番茄品种的基因组 DNA,结果显示:GZ04、GZ07和GZ06等3个品种能扩增出一条444 bp的独立条带,GZ19、GZ08、GZ14、GZ10、GZ16、GZ13、GZ18、GZ11等品种扩增出杂合条带,其余品种均未能扩增出条带。表明GZ04、GZ07和GZ06含有Pvr4基因,GZ19、GZ08、GZ14、GZ10、GZ16、GZ13、GZ18、GZ11等品种可能含有Pvr4基因,而其余品种均不含Pvr4基因(见图5)。
2.3 引物对qF180/qR180检测Ty1/Ty3基因
用引物对qR180/qF180扩增 16 个番茄品种的基因组 DNA,结果显示:GZ02、GZ19、GZ04、GZ07、GZ01、GZ08、GZ09、GZ03、GZ16、GZ05、GZ13、GZ18、GZ11等13个番茄品种能扩增出特异性条带,表明其含有抗性基因Ty1/Ty3;而GZ14、GZ10、GZ06等三个品均不能扩增出特异性条带,表明其不含抗性基因(见图6)。
3 结论与讨论
为了明确贵州大学番茄种质资源中16个本土番茄资源的抗性情况,本试验采用分子标记辅助育种手段,结果显示16个本土材料基本覆盖目前抗病育种所需要的基因资源,可根据目标抗性进行配合育种。
由Mi基因调控的寄主抗性在许多商业番茄品种中都存在,并且对最常见的热带根结线虫(南方根结线虫(Meloidogyne incognita)、爪哇根结线虫(Meloidogyne javanica )和沙蚕根结线虫(Radix nodus Nematodae)有效。这种抗性有一些缺点,如缺乏对其他常见根结线虫物种,如北方根结线虫(Meloidogyne hapla)和象耳豆根结线虫(Meloidogyne enterolobii)线虫的活性,南方根结线虫(M.incognita)抗性破坏小种的广泛出现,以及据报道的Mi基因的热特性[29]。本试验在番茄抗根结线虫Mi基因的检测中,利用三对引物REXF1/REXR2、PMiF3/PMiR3、Mi23F/Mi23R进行检测结果基本一致,所有参试番茄品种均含有Mi基因;但在PM3Fb/PM3Rb检测Mi基因的结果与以上三对引物的结果不一致,可能该基因对不同种类的根结线虫抗性不同,其检测出的结果中,只有GZ09、GZ14、GZ10、GZ13等4个番茄品种含有Mi基因,而其他品种均不含Mi基因。同样检测番茄抗根结线虫Mi基因的引物出现的不同结果,即PM3Fb/PM3Rb检测Mi基因的结果与其他三对引物的检测结果有差异,这种差异可能是由于不同抗性基因对不同种类的根结线虫的抗性不同造成的,这与戴均涛等[28]进行的方法比较结果一致;不同的是,引物对PM3Fb/PM3Rb检测Mi基因的结果不含Mi基因的番茄品种,而本试验中PM3Fb/PM3Rb检测Mi基因的结果中仍然有含Mi基因的番茄品种,可能是品种的不同引起的结果差异,也可能是分子标记中存在的假阳性引起的差异。在将来的抗根结线虫研究中,要明确与Mi基因对应的根结线虫种类。另外可以利用QTL定位技术精确定位抗性基因[30],也可以通过基因编辑技术定向改变植株性状[31],另外为了提高番茄抗病育种效率可以通过转基因技术或RNA干扰(RNAi)技术干扰病毒基因保守片段[32]。
本研究发现部分材料(GZ04、GZ07和GZ06)含有抗PVY基因Pvr4,而Hu等[33]发现番茄Tm-2(2)基因可以抵抗多种病毒,如TMV,ToMV,PVX和PVY,而这些材料是否含有Tm-2(2)基因,仍需进一步研究。GZ19、GZ08、GZ14、GZ10、GZ16、GZ13、GZ18、GZ11等品种出现了扩增杂合条带的情况,可能含有Pvr4基因,推测其原因,可能是退火温度略有不同,也可能是番茄品种的差异性。
抗TYLCV检测结果表明GZ02、GZ19、GZ04、GZ07、GZ01、GZ08、GZ09、GZ03、GZ16、GZ05、GZ13、GZ18、GZ11等13个番茄品种含有抗性基因Ty1/Ty3。结合Pvr4抗性番茄种质,表明GZ04、GZ07和GZ06 3个品种含有抗根结线虫基因Mi,可以应用于番茄抗根结线虫育种,同时兼备抗PVY病毒病Pvr4抗性基因、抗根结线虫Mi基因和抗黄化曲叶病毒Ty1/Ty3基因,在后续的育种工作中应重视对GZ04、GZ07和GZ06这3个番茄品种的开发与利用。
本试验利用 6 对与抗根结线虫基因、抗PVY病毒病基因以及抗TYLCV基因紧密连锁的分子标记,对 16个番茄品种开展了抗性基因的分子检测,明确了16个本土番茄材料的抗性分子标记,为番茄抗病育种提供了材料基础。
参 考 文 献:
[1] 马兆红.从生产市场需求谈我国番茄品种的变化趋势[J].中国蔬菜,2017(3):1-5.
[2] 王洋,李锡香,王海平,等.茄科蔬菜野生资源的研究与利用[J].植物遗传资源学报,2020,21(6):1468-1482.
[3] 李云洲,闫见敏,须文,等.番茄种质资源主要植物学性状的遗传多样性及相关性[J].贵州农业科学,2019,47(2):68-74.
[4] 朱玉,范丽娜,黄泽军,等.番茄耐裂果基因Cr3a的精细定位[J].園艺学报,2020,47(2):275-286.
[5] 马雅琳,梁燕.番茄长花柱性状遗传规律与QTL分析[J].园艺学报,2020,47(2):264-274.
[6] 权建华,陈修斌,鄂利锋,等.番茄抗病育种研究概况及展望[J].蔬菜,2020(1):43-47.
[7] 刘子记,杜公福,牛玉,等.番茄主要病害的发生与防治技术[J].长江蔬菜,2019(19):59-62.
[8] 李云洲,默宁,闫见敏,等.番茄斑萎病毒病研究进展[J].园艺学报,2018,45(9):1750-1760.
[9] 曾昭明,涂瑞友.番茄主要病虫害防治技术[J].现代农业科技,2014(21):124-125.
[10] 王世荣.番茄主要病害及其防治措施[J].现代农村科技,2010(11):31.
[11] 李云洲,梁燕,李翠,等.番茄黄化曲叶病毒(TYLCV)基因介导抗病性研究进展[J].中国蔬菜,2012(20):15-19.
[12] KIM M,PARK Y,LEE J,et al.Development of molecular markers for Ty-2 and Ty-3 selection in tomato breeding[J].Scientia Horticulturae,2020:265.
[13] VOORBURG C M,YAN Z,BERGUA-VIDAL M,et al.Ty-1,a universal resistance gene against geminiviruses that is compromised by co-replication of a betasatellite[J].Molecular Plant Pathology,2020,21(2):160-172.
[14] GILL U,SCOTT J W,SHEKASTEBAND R,et al.Ty-6,a major begomovirus resistance gene on chromosome 10,is effective against Tomato yellow leaf curl virus and Tomato mottle virus[J].Theoretical and Applied Genetics,2019,132(5):1543-1554.
[15] CHEN Q,XU X,JIANG J,et al.Transcriptome resequencing analysis of the responses of ty-5-mediated resistance to TYLCV via in resistant vs.susceptible tomato cultivars[J].Basic & Clinical Pharmacology & Toxicology,2019,125:18-18.
[16] PRASANNA H C,KASHYAP S,KRISHNA R,et al.Marker assisted selection of Ty-2 and Ty-3 carrying tomato lines and their implications in breeding tomato leaf curl disease resistant hybrids[J].Euphytica,2015,204(2):407-418.
[17] CARO M,VERLAAN M G,JULIAN O,et al.Assessing the genetic variation of Ty-1 and Ty-3 alleles conferring resistance to tomato yellow leaf curl virus in a broad tomato germplasm[J].Molecular Breeding,2015,35(6):132.
[18] VERLAAN M G,HUTTON S F,IBRAHEM R M,et al.The tomato yellow leaf curl virus resistance genes Ty-1 and Ty-3 Are allelic and code for DFDGD-class RNA-dependent RNA polymerases[J].Plos Genetics,2013,9(3):e1003399.
[19] HUTTON S F,SCOTT J W,SCHUSTER D J.Recessive resistance to tomato yellow leaf curl virus from the tomato cultivar tykingis Located in the same region as Ty-5 on chromosome 4[J].Hortscience,2012,47(3):324-327.
[20] YUANFU J,SCOTT J W,SCHUSTER D J,et al.Molecular mapping of Ty-4,a new tomato yellow leaf curl virus resistance locus on chromosome 3 of tomato[J].Journal of the American Society for Horticultural Science,2009,134(2):281-288.
[21] 李宁,宫丽媛,高升华,等.辣椒种质的抗性基因分子标记检测[J].中国蔬菜,2020(8):19-32.
[22] 陈万胜.烟草马铃薯Y病毒病抗性遗传及分子标记[D].北京:中国农业科学院,2008.
[23] 侯富恩,郝科星,张涛,等.番茄抗TYLCV分子标记辅助聚合育种[J].中国瓜菜,2019,32(1):18-21.
[24] 刘梦姣,黄庆岛,龙彪,等.广西樱桃番茄抗晚疫病材料的筛选[J].北方园艺,2019(2):20-24.
[25] 孟凡娟,许向阳,李景富,等.番茄抗叶霉病基因Cf_6的RAPD及SCAR标记[J].中国农业科学,2008(7):2191-2196.
[26] ARNEDO-ANDRS M,GIL-ORTEGA R,LUIS-ARTEAGA M,et al.Development of RAPD and SCAR markers linked to the Pvr4 locus for resistance to PVY in pepper(Capsicum annuum L.)[J].Theoretical & Applied Genetics,2002,105(6-7):1067-1074.
[27] DEVRAN Z,GKNUR A,MESCI L,et al.Development of molecular markers for the Mi-1 gene in tomato using the KASP genotyping assay[J].Horticulture Environment & Biotechnology,2016,57(2):156-160.
[28] 戴均濤,张慎璞,王暄,等.3种检测番茄抗根结线虫Mi基因分子标记法的比较[J].南京农业大学学报,2018,41(5):848-853.
[29] REGMI H,DESAEGER J.Integrated management of root-knot nematode(Meloidogyne spp.)in florida tomatoes combining host resistance and nematicides[J].Crop Protection,2020,134(105170):1-11.
[30] 杨旭东,赵芳明,罗洪发,等.基于染色体片段代换系的水稻穗部性状QTL定位[J].山地农业生物学报,2020,39(5):78-81.
[31] 岳宁波,李云洲,王勇,等.CRISPR/Cas9介导的番茄SlMAPK6突变对植株形态的影响[J].核农学报,2020,34(9):1881-1888.
[32] 方远鹏,李云洲,岳宁波,等.植物RNA干扰抗病毒机制研究进展[J].山地农业生物学报,2020,39(5):50-56.
[33] HU Z,LIU G,GAO J,et al.Tomato Tm-2(2) gene confers multiple resistances to TMV,ToMV,PVX,and PVY to cultivated potato[J].Russian Journal of Plant Physiology,2015,62(1):101-108.
