pH对共沉淀法制备甲苯催化燃烧用Cu-Co-Ce复合氧化物催化剂的影响
2021-12-09姚太仓戚国琴浦渊竞
孟 浩,刘 怡,姚太仓,周 超,戚国琴,徐 佳,浦渊竞,赵 洁,郭 燏
(1.南京工业大学 化工学院 材料化学工程国家重点实验室,江苏 南京 211800;2.南京工业大学 环境科学与工程学院,江苏 南京 211800)
挥发性有机化合物(VOCs)的污染对环境和人类健康产生较大威胁。由于VOCs废气的催化燃烧处理法具有净化率高、反应温度低、操作经济、无二次污染等特点[1-2],已成为VOCs废气治理的主要技术之一。贵金属催化剂因具有较低起燃温度、良好的净化效果等优点,而成为该领域的主流催化剂[3]。但另一方面,昂贵的价格、较差的抗卤中毒性及稀缺的资源性等缺点,限制了贵金属催化剂在工业上的大规模应用[4]。在此背景下,价格低廉且抗卤性较强的过渡金属氧化物催化剂受到越来越多的关注[4-7]。
作为过渡金属氧化物催化剂的主催化剂或助催化剂成分,Cu[6]、Co[1]、Mn[7]、Cr[4]、Ni[8]等过渡金属元素以及Ce[9]、La[10]等稀土元素,已经被相关研究证实具有较好的VOCs催化活性。近年来的研究进一步揭示,多组元的复合金属氧化物催化剂往往显示出超越单组元氧化物催化剂的催化活性[10-15]。Liu等[11]使用沉淀法制备CuO、MnO2和Cu-Mn复合金属氧化物催化剂,比较其在甲苯催化燃烧中的活性,结果表明,Cu、Mn氧化物之间的相互作用,使复合氧化物催化剂性能明显优于单组元催化剂,从而显示出更加优异的催化活性。类似的结论在Co-Mn[7]、Cu-Co[1]、Co-Ce[10]等二组元体系,Co-Mn-Ce[12]、Cu-Co-Ce[13]等三组元体系也有所报道。例如,Carrillo等[1]和Lu等[14]分别采用浸渍法和多元醇法制备Cu-Co复合氧化物催化剂,结果表明,Cu与Co之间存在的相互作用促进活性中心的分散,从而提高催化性能。Carabineiro等[10]和Liotta等[15]分别选用模板剂法和共沉淀法制备Co-Ce复合氧化物催化剂,研究发现,Ce的存在能够促进氧物种的迁移,Co和Ce之间存在着较强的相互作用,增大氧化物相的分散度。Delimaris等[16]采用尿素燃烧法制备Cu-Ce复合氧化物催化剂,相比单组元氧化物催化剂,Cu-Ce复合氧化物具有更好的可还原性和更大的比表面积,从而产生了优异的催化性能。Somekawa等[13]采用焙烧混合法制备Cu-Co-Ce三组元复合氧化物催化剂。Cu、Co、Ce氧化物之间存在的强相互作用被认为是其优于二组元或单组元体系的重要原因。
众所周知,催化剂的性能与其制备方法是密切相关的。在前期的研究中[17-18],课题组分别采用分步/共沉淀法、干/湿混合法及溶胶-凝胶法等方法制备Cu-Co-Ce三组元复合氧化物催化剂,比较了催化剂在甲苯催化燃烧反应中的活性。研究表明,不同制备方法得到的催化剂在比表面积、晶粒尺寸、表面氧含量、氧化还原性等方面具有较大的差异。共沉淀法制得的催化剂显示出最优的甲苯催化活性。
本文中,笔者采用共沉淀法,通过调节溶液pH制备一系列的Cu-Co-Ce三组元复合氧化物催化剂,并测试催化剂在甲苯催化燃烧反应中的性能。使用现代分析测试方法对催化剂的物理、化学性质及表面元素等进行表征,重点研究制备过程中溶液pH的变化对催化性能的影响。
1 实验
1.1 催化剂的制备
采用共沉淀法制备一系列Cu-Co-Ce复合金属氧化物催化剂。按Cu、Co、Ce的摩尔比为2∶5∶3的比例分别称量一定量Cu(NO3)2·3H2O、Co(NO3)2·6H2O和Ce(NO3)3·6H2O,以去离子水为溶剂,配制金属元素总浓度为0.5 mol/L的混合溶液。在搅拌的同时,向溶液中缓慢滴加氨水,调节pH至一定值。室温下搅拌2 h后,在70 ℃下继续搅拌,加热1.5 h蒸去大部分水,直至溶液变为稠浆状。110 ℃干燥12 h,并在500 ℃空气中焙烧3 h后,即可制得所需样品。pH=2、5、7、9、10和11时,制备的样品分别记为S1、S2、S3、S4、S5和S6。
1.2 催化剂表征
采用北京恒久公司的TGA-HKG型热分析仪(TG)对催化剂进行分析。采用德国BRUKER公司的D8 Advance X-ray diffi-actometer型X线粉末衍射仪(XRD)测试催化剂的晶体结构,Cu靶Kα线为辐射源,管电压和管电流分别为40 kV和50 mA。采用荷兰Ankersmid公司的BelSorp-Mini型低温N2吸附-脱附分析仪(BET)对样品的织构特性进行测定,测试前所有样品均在250 ℃下脱气预处理2 h。采用美国Thermo Fisher Scientific公司的Escalab 250Xi型X线光电子能谱(XPS)测试,用Al靶Kα线为辐射源,功率和电压分别为150 W和1 486.6 eV,以本体污染碳C 1s结合能(284.6 eV)为标准,对样品实施校正。采用美国Micromeritics公司的AutoChem Ⅱ 型化学吸附仪进行H2程序升温还原(H2-TPR)分析。样品在Ar氛围中300 ℃下预处理30 min,然后冷却到常温,在体积分数5%H2-Ar的还原气体(气体流速50 mL/min)中,升温至550 ℃(升温速度10 ℃/min)。
1.3 催化性能测试
参考文献[11]进行催化活性测试。反应管进气(体积分数)为0.05%甲苯-21%O2-N2。在250 L/(h·g)的高空速下测试催化剂的活性。甲苯转化率均为某一温度下反应达到稳定后(反应1 h)测得的数据。
2 结果与讨论
2.1 热分析
使用110 ℃干燥后的Cu-Co-Ce样品(未焙烧)作为复合氧化物催化剂的前驱体,对其进行了热分析,以确定前驱体的焙烧温度。以S4为例,S4前驱体在加热过程中的质量变化如图1所示。由图1可得:以360 ℃为分界,样品共出现2个温度阶段的质量损失。前一个10.5%的质量损失对应于物理或化学吸附水的脱除,而后一个9.7%的质量损失是与氢氧化物或部分硝酸盐的分解有关。在500 ℃之后,未观察到明显的质量损失。上述结果表明,催化剂前驱体在空气氛围中500 ℃能够被完全热分解为金属氧化物。
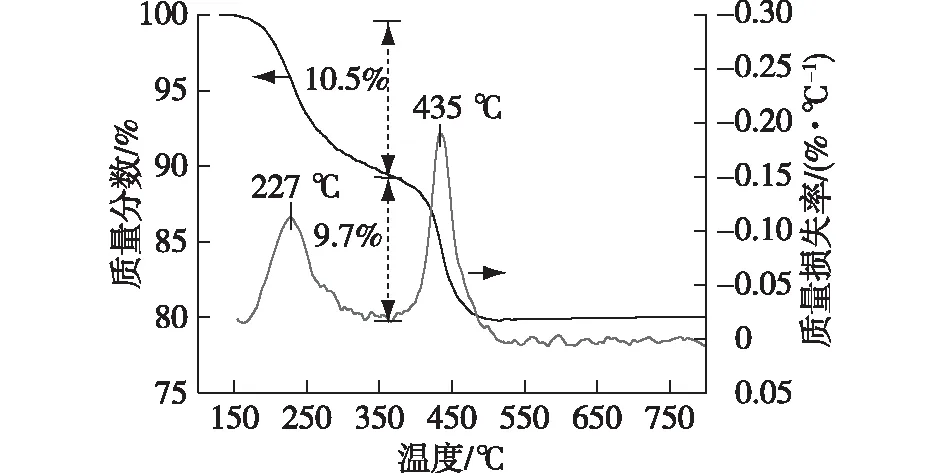
图1 S4样品前驱体的热分析Fig.1 Thermogravimetric analysis of the precursor of S4 sample
2.2 催化剂的结构与织构特性
图2为S1—S6催化剂样品的XRD图谱,以pH=9时制备的单组元Cu、Co、Ce氧化物样品Cu-9、Co-9、Ce-9为参考样品。由图2可见:除Co3O4和CeO2之外,未检测到其他Co、Ce化合物的衍射峰,这与热分析结果一致。Co、Ce分别以晶体Co3O4、CeO2的状态存在于焙烧后的催化剂样品中。
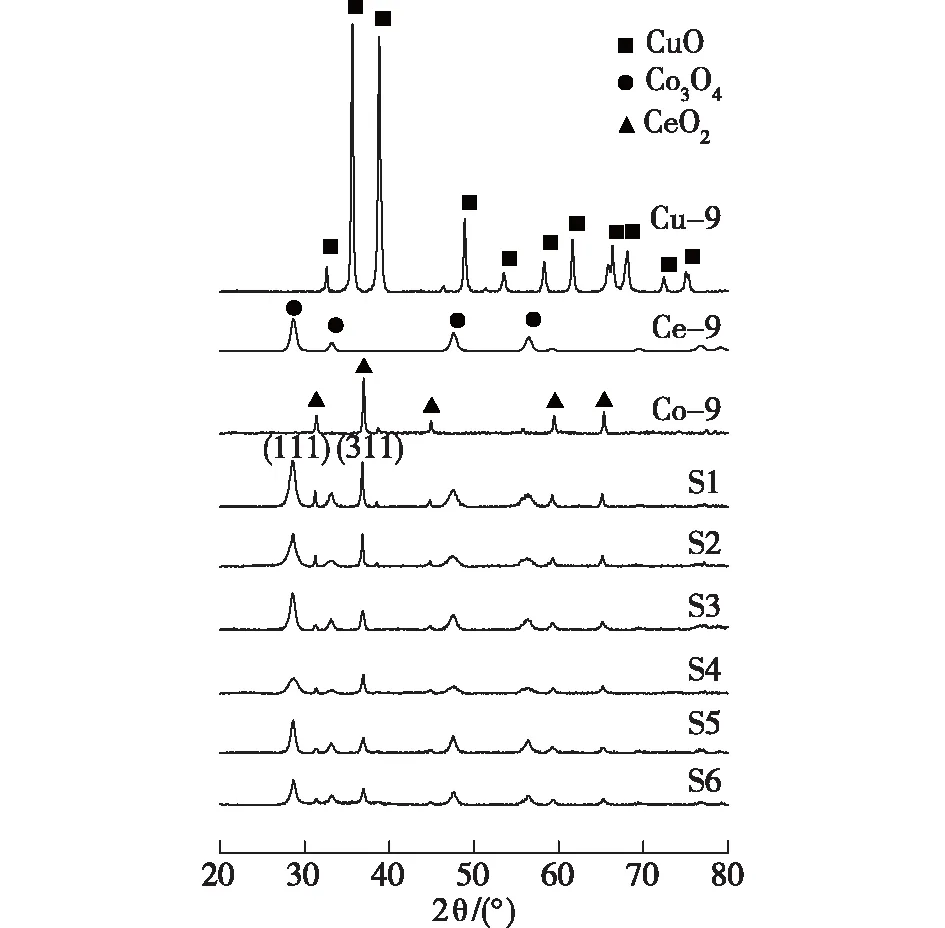
图2 S1—S6催化剂样品的XRD图谱Fig.2 XRD spectra of S1-S6 catalyst samples
由图2还可见:与单组元相比,在S1—S6的XRD图谱中未发现Cu的相关衍射峰。这说明Cu可能以无定形或高分散状态存在于催化剂表面。通过谢乐公式计算Co3O4和CeO2的晶粒粒径,结果见表1,计算单组元的Cu-9样品中CuO的晶粒粒径为27.8 nm,在三组元体系中Cu系物质则呈现高分散或无定形状态。由表1可得:对于Co3O4而言,随着pH增大,晶粒粒径出现先逐渐减小后略增大的趋势。pH=2的S1样品与Co-9样品中Co3O4的晶粒粒径相近,分别为30.4和31.5 nm。pH=9的S4样品中Co3O4的晶粒粒径最小(16.6 nm)。CeO2的晶粒大小也出现了类似的变化,在S4样品中晶粒粒径最小(9.1 nm)。这种复合金属氧化物晶粒粒径的降低,通常被认为是MOx(M=Cu、Co、Ce)之间存在强相互作用的结果。MOx抑制了彼此晶核的长大,使得分散度提高,甚至是以非晶相状态存在[11, 19-20]。
由表1还可得:三组元体系催化剂样品S1-S6中CeO2的晶面间距(0.310 2~0.312 1 nm)普遍小于等于单组元体系Ce-9中CeO2的晶面间距(0.312 1 nm)。晶面间距的变化表明,部分Cu或Co可能进入了CeO2萤石晶格中形成了固溶体。Cu或Co的离子半径(0.050~0.070 nm)小于Ce的离子半径(0.094 nm),Cu或Co向萤石晶格中的掺杂将导致晶胞收缩。随pH的增大,三组元体系中CeO2的晶面间距呈先降低后略增大的趋势,在pH=9的条件下得到了最小的晶面间距,说明此时Cu和Co的掺杂量最大。需要指出的是,Co3O4的特征衍射峰非常类似于[20]Cu-Co尖晶石类氧化物,例如Cu0.3Co2.7O4(JCPDS 25-0270)、Cu0.27Co2.73O4(JCPDS 78-2173)、Cu0.76Co2.24O4(JCPDS 36-1189),付冬等[21]采用柠檬酸低温固相合成法制备了一系列Cu-Co复合氧化物,也发现了类似的现象。据此,本文的三组元体系中特征衍射峰类似于Co3O4的Cu-Co尖晶石相也可能存在。
文献[20]及本课题组前期对Cu-Mn复合氧化物的研究[11]发现,结晶度低的尖晶石或高分散的氧化物粒子是两组元氧化物体系的甲苯催化燃烧活性优于单组元体系的主要原因之一。因此,出现的Cu(或Co)-CeO2的固溶体或Cu-Co尖晶石相,被认为是对甲苯的催化燃烧反应较为有利的因素。
表1还给出了不同样品的比表面积。由表1可得:三组元体系的比表面积显著高于单组元体系(S1除外)。随着pH的增大,比表面积呈先增大后略降低的趋势,S4样品的比表面积最大(73 m2/g)。比表面积的变化趋势与Co3O4和CeO2的晶粒粒径的变化规律相反,这表明比表面积上升的主要原因是氧化物粒子的高分散。
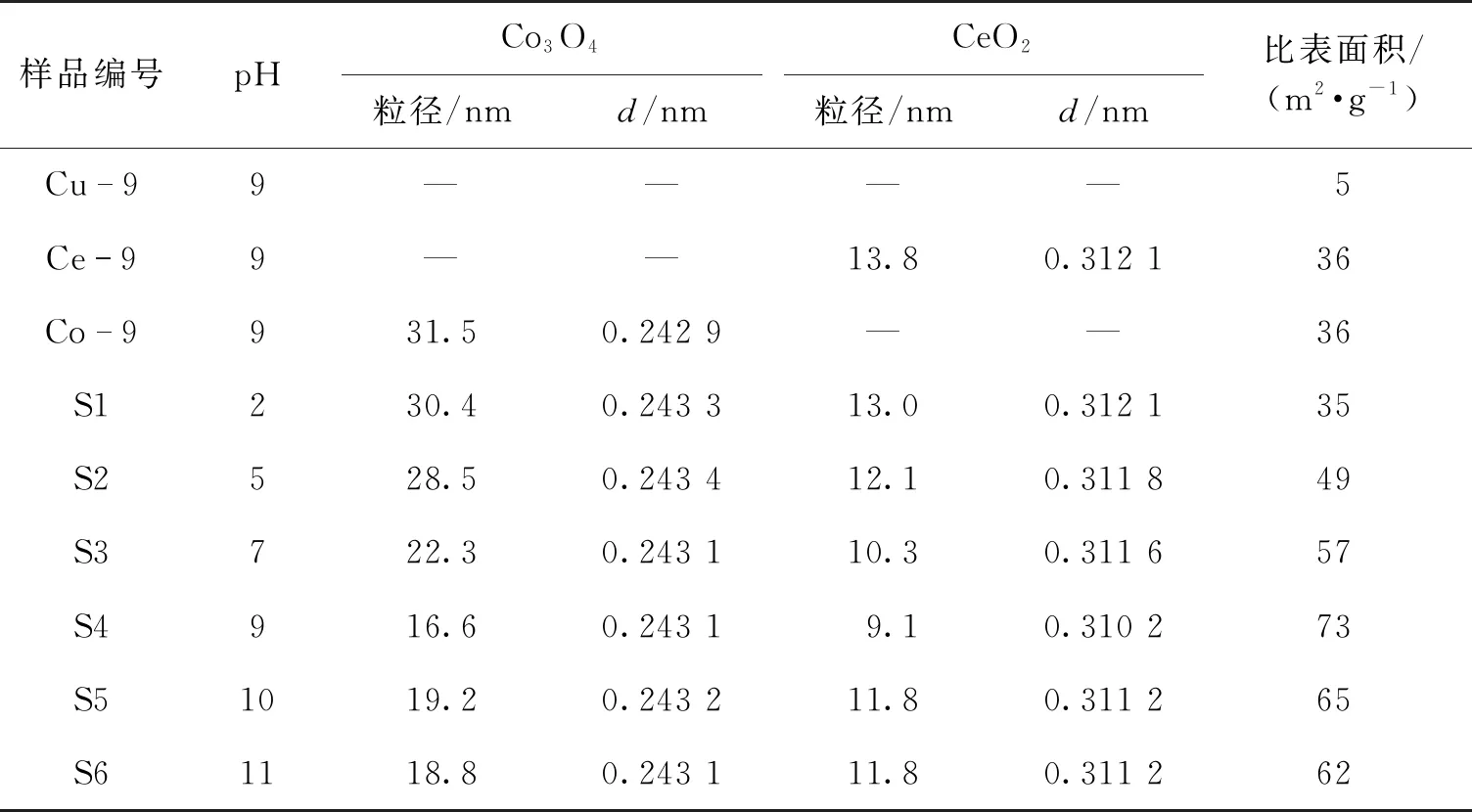
表1 S1—S6样品的晶粒尺寸、比表面积、TPR还原温度及催化活性
2.3 催化剂的氧化还原特性
众所周知,过渡金属氧化物催化多相氧化反应,通常是通过催化剂自身的反复氧化还原来完成催化循环的。大量VOCs催化燃烧的相关研究也表明催化剂的氧化还原特性往往与催化活性密切相关[11,20-22]。Mars-Van Krevelen理论也被广泛地用于VOCs的动力学研究[23]。
S1—S6样品的H2-TPR分析结果如图3所示。由图3可得:Ce-9在464 ℃附近有一个较为微弱的宽峰,对应氧化态金属被还原[24]。Cu-9的还原峰主要出现在227 ℃,对应于Cu2+被还原为Cu[25]。Co-9分别在277和318 ℃附近出现一个小肩峰和一个大还原峰,分别对应Co3+→Co2+和Co2+→Co0的转变[26]。
由图3还可得:多组元体系的还原峰温度远低于单组元的。S4样品的3个重叠还原峰出现在80~220 ℃,最低温还原峰的温度为108 ℃。这些重叠的还原峰主要是由不同物相或结构的金属氧化物的还原所致。通常,较低温度还原峰是由与其他氧化物(如CeO2)有强相互作用的金属氧化物的还原所致,而较高温度还原峰可能与大颗粒氧化物及其中间体的还原有关[24]。参考文献[11,24]可得:S4的最低温还原峰是由与CeO2有强相互作用的高分散的Cu系物质的还原所致,其后的几个重叠峰则对应了Co系物质的还原。复合氧化物催化剂按最低温还原峰的温度由大到小依次为S1(pH=2)、S3(pH=7)、S6(pH=11)、S4(pH=9),这与按晶粒粒径由大到小的排序基本一致。如前所述,随pH的上升,氧化物之间的相互作用被逐渐强化,在晶胞收缩程度最大且CeO和Co3O4的晶粒粒径最小的S4上出现温度最低的还原峰。文献[11,22,24]指出,氧化物催化剂的活性与低温还原峰紧密相关,较低的还原温度表明催化剂具有较高的表面氧浓度和更好的氧迁移率。
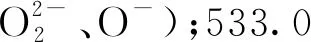
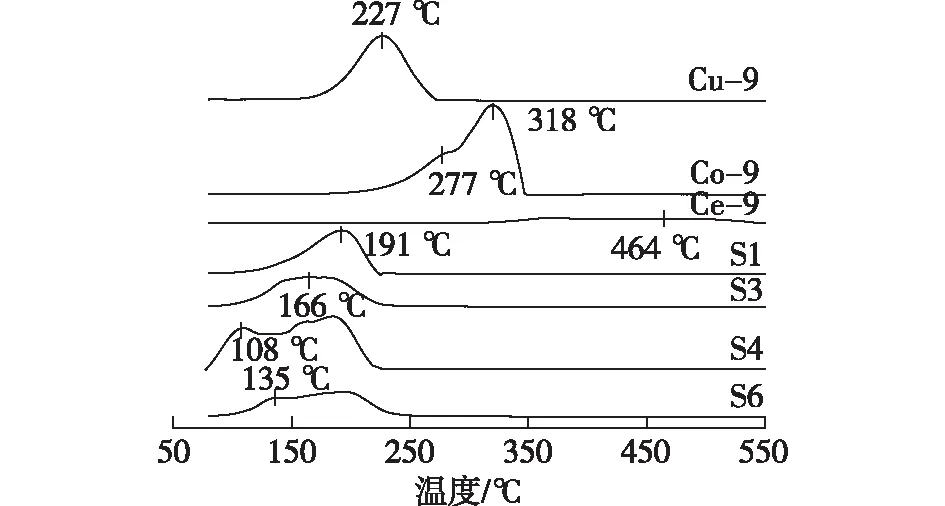
图3 催化剂样品的H2-TPR曲线Fig.3 H2-TPR profiles of catalyst samples
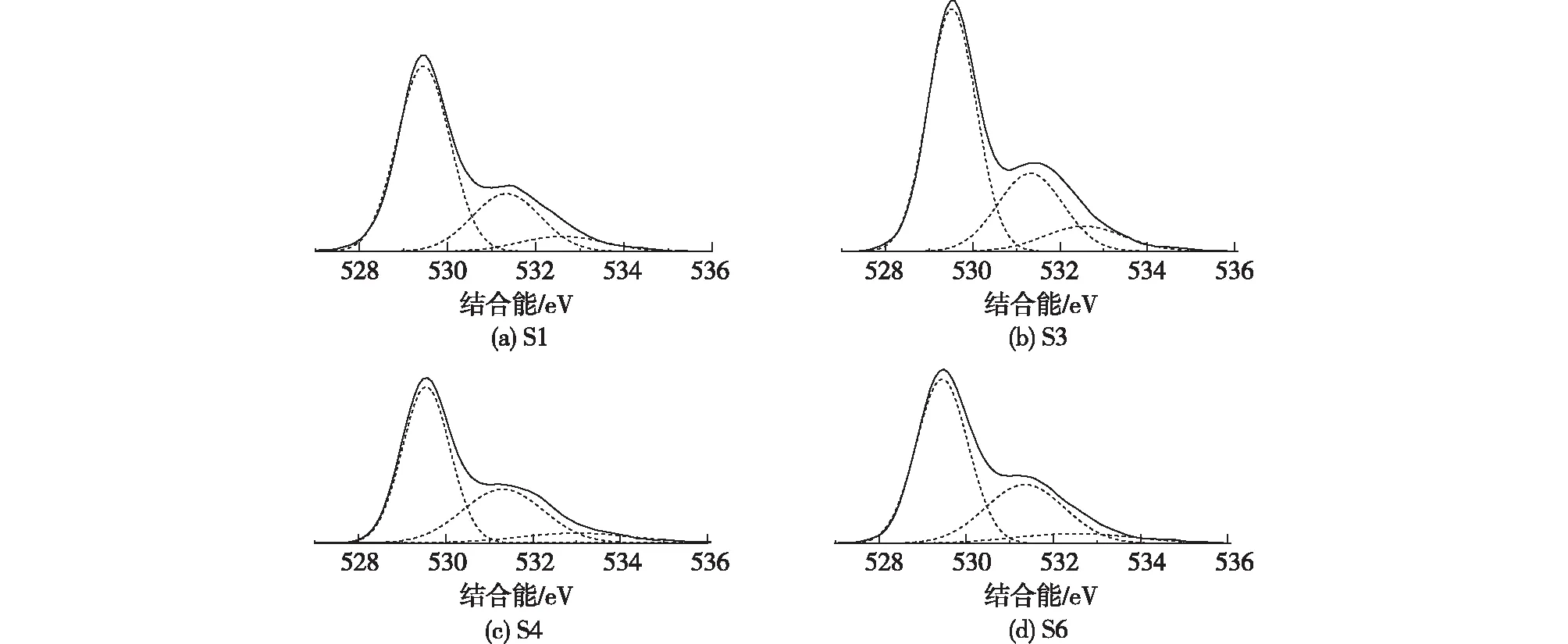
图4 催化剂样品的O 1s XPS谱图Fig.4 XPS spectra of O 1s obtained from catalyst samples
VOCs催化燃烧领域中的相关文献[11,22,24]表明,Cu、Co、Mn、Ce等的单组元或多组元催化体系的活性通常与M—O的断裂有关(尤其是表面氧)。一般而言,亲电性的Osur容易参与完全氧化反应,晶格氧Olatt多与选择性氧化有关[28]。表面氧能增强催化剂的还原性以及氧迁移性,从而促进催化剂催化活性[22,24,30]。图5为催化剂表面Osur、Cu和Co摩尔分数随pH的变化曲线。由图5可得:随着pH的增大,Osur摩尔分数逐渐升高,在pH=9的条件下得到了18.4%的最高Osur摩尔分数。随pH进一步上升,Osur摩尔分数略有下降。这表明,随pH的上升而被强化的氧化物之间的相互作用应该是催化剂表面Osur浓度上升的主要原因。
由图5还可得:在催化剂表面,Cu的摩尔分数明显高于理论含量(根据催化剂合成配料比计算理论Cu摩尔分数为20%),这表明催化剂表面有Cu系物质富集并且不是所有的Cu都掺入了CeO2晶格中。另外,Co的摩尔分数低于理论含量(30%),这与Co3O4结晶相的存在或高分散的Cu系物质在表面富集有关。
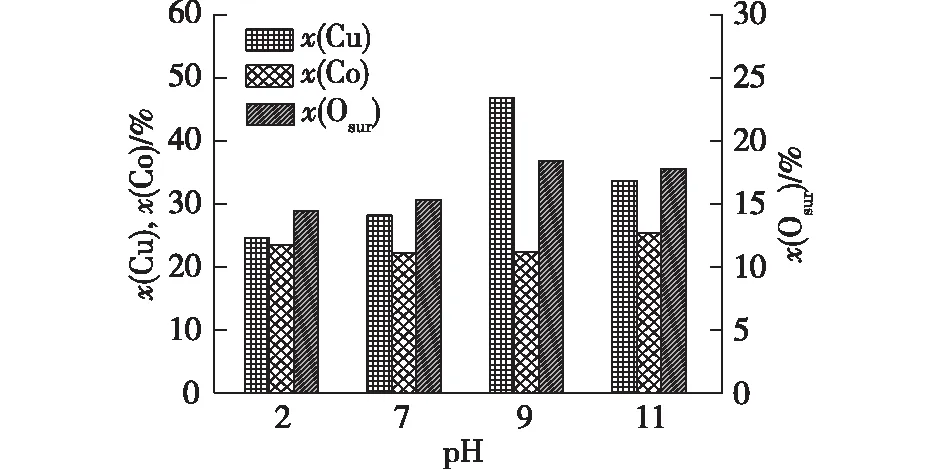
图5 不同催化剂表面上Cu、Co和Osur的摩尔分数Fig.5 Cu, Co and Osur mole fractions on different catalyst samples
2.4 pH对催化性能的影响
图6为S1—S6样品在甲苯催化燃烧反应中的活性。由图6可得:S1样品活性最差,275 ℃下甲苯转化率仅为56.4%。当pH增大到5(S2样品),在275 ℃下的转化率上升至69.2%。继续增大pH,甲苯转化率持续上升,在S4样品上获得了最高的甲苯转化率,275 ℃时转化率为90.1%,并且当温度达到300 ℃时基本实现了甲苯的完全氧化。但是,随着pH进一步上升到11,甲苯转化率被抑制,S6样品在275 ℃时的转化率降至78.1%。
综上可知,随着pH的变化,催化剂的比表面积、表面Osur浓度均呈现出与甲苯转化率基本一致的变化趋势,而Co3O4晶粒尺寸和H2-TPR最低温还原峰温度则为相反趋势。所有曲线都显示为火山形或倒火山形,相互之间的温度区间的对应性较好。这种较好的温度对应性被认为是由MOx物质之间的相互作用导致。随相互作用的强化,一方面更多的Cu或Co进入CeO2晶格中导致晶胞收缩并形成固溶体(或结晶度低的尖晶石结构),另一方面未进入晶体结构的Cu或Co系物质在催化剂表面富集。这种固溶体(或结晶度低的尖晶石)的出现提供了更多的氧空穴和更好的氧迁移性,导致催化剂表面的Osur浓度的增大以及还原峰向低温移动。同时,高分散状态的金属氧化物通过改变初级粒子的聚集状态,产生了更大的比表面积。上述这些变化的出现,最终大幅提高了甲苯催化燃烧的反应活性。
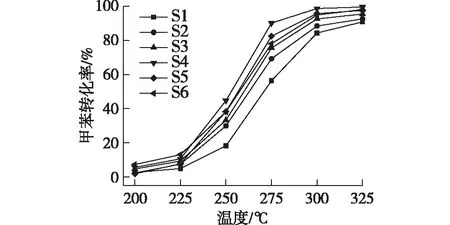
图6 S1—S6催化剂样品上甲苯催化燃烧反应的转化率Fig.6 Conversion of the toluene catalytic combustion reaction obtained from S1-S6 catalyst samples
3 结论
1)调节催化剂制备过程中的pH,对Cu-Co-Ce复合氧化物催化剂的比表面积、表面Osur浓度、晶粒尺寸及还原温度等产生了显著影响,不同催化剂上的甲苯催化燃烧活性也显示出明显的差异。随pH的增大,比表面积、Osur浓度与转化率的变化趋势一致(先增加后略降低),而晶粒尺寸和H2-TPR最低温还原峰的温度则出现相反趋势。
2)在诸多影响因素中,多组元氧化物之间的相互作用被认为是pH对催化剂影响的根本原因。随pH的变化而导致的相互作用的强弱对催化剂的理化特性产生了不同程度的影响。
3)在pH=9的条件下制得的Cu-Co-Ce复合氧化物催化剂展现了最优的甲苯催化燃烧活性,当温度大于300 ℃时可实现甲苯的完全转化。
