木薯种质资源中醇腈裂解酶基因12G132600编码区终止突变及频率的研究
2021-12-08周新成,陈新,卢诚,廖明馨,王海燕,唐清杰,任军方,王文泉
周新成,陈新,卢诚,廖明馨,王海燕,唐清杰,任军方,王文泉


摘 要:木薯是重要的糧食作物,但块根中含有的氰苷及其产生的氢氰酸严重影响木薯的食用品质,增加加工成本。α-醇腈裂解酶(alpha-hydroxy nitrile lyase, HNL)是植物催化醇腈裂解产生氢氰酸的关键酶。重测序数据显示,‘华南8号木薯品种中HNL编码基因家族的一个成员12G132600在编码区内部发生了终止突变,导致基因编码区变短。本研究对国内外251份木薯种质资源的重测序结果进行分析,共发现60份材料醇腈裂解酶基因12G132600存在相同的终止突变,该60份材料全部是终止突变与非终止突变的杂合基因型,且全部为栽培类型木薯。说明该突变是木薯由野生型驯化为栽培型以后发生的。通过对木薯品种‘华南9号该基因的克隆测序以及与已发表的木薯品种‘TME3基因组序列的比对分析,证实了该突变在木薯品种中真实存在。
关键词:木薯;氢氰酸;醇腈裂解酶;种质资源;基因突变
中图分类号:S533 文献标识码:A
Premature Mutation Frequencies in Coding Region of Gene 12G132600 Encoding Alpha-hydroxy Nitrile Lyase in Cassava Germplasms
ZHOU Xincheng1,2, CHEN Xin1,2, LU Cheng1,2, LIAO Mingxin1,2, WANG Haiyan1,2, TANG Qingjie3,
REN Junfang4,5*, WANG Wenquan1,2*
1. Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences. Haikou, Haina 571101, China; 2. Key Laboratory of Biology and Genetic Resources of Tropical Crops, Ministry of Agriculture and Rural Affairs. Haikou, Hainan 571101, China; 3. Alimentarn Crop Institute, Hainan Academy of Agricultural Sciences, Haikou, Hainan 571100, China; 4. Tropical Horticulture Research Institute, Hainan Academy of Agricultural Sciences, Haikou, Hainan 571100, China; 5. Hainan Key Laboratory for innovative Development and Utilization of Tropical Special Economic Plants. Haikou, Hainan 571100, China.
Abstract: Cassava is an important food crop in the world. The presence of high-level cyanogenic glucosides and HCN produced poses a major nutritive drawback and means a higher labor costs to remove these toxic substances. Cyanogensis is an important protective mechanism for plant to avoid grazing by animals. Alpha-hydroxy nitrile lyase (HNL) plays a key role in cyanogensis reaction. We found that there was a premature termination mutation in the coding sequence of HNL gene of cassava variety SC8, which would result in short length in protein encoded and could affect the function of the protein. These researches would give useful information about the role of the point mutation and provide new ideals for selecting cassava accessions with low-content hydrocyanic acid in molecular breeding. Firstly we surveyed the resequencing data of 251 cassava varieties from all around the world to characterize the same mutation site in HNL gene and found that there were sixty accessions belonging to cultivated cassava harboring the same mutation as SC8, indicting the premature mutation occurred during or after cassava domestication. We cloned and sequenced the orthologous genes of 12G132600 in SC9 by PCR and compared the corresponding sequence of TME3 from the genome assembly. The results further strengthened the evidence of this premature mutation in cassava varieties.
Keywords: cassava; hydrocyanic acid; alpha-hydroxy nitrile lyase; germplasms; gene mutation
DOI: 10.3969/j.issn.1000-2561.2021.10.004
木薯(Manihot esculenta Crantz)是世界三大薯类作物之一,可作为粮食供人类食用。世界上将木薯作为主粮的人群超过7亿人,主要分布在非洲和中南美洲国家,例如尼日利亚,年产鲜薯4000万吨,其中90%以上充当粮食。目前在我国,鲜薯主要作为加工淀粉和酒精的原料,较少直接食用。但随着我国耕地逐年减少、人口越来越多,粮食安全问题日益突出。而木薯具有抗旱、耐瘠薄等特点,在较少水肥条件下也可获得比较高的收成,因此,选育食用木薯品种、发展食用木薯生产,可在一定程度上缓解我国的粮食紧张问题。
木薯作为食物的一个主要限制因子是其块根的氰苷含量较高。氰苷,又名生氰葡萄糖苷,是一种广泛存在于高等植物中的糖苷类次生代谢产物,在植物受到虫害、动物啃食等损伤的情况下,会转化为醇腈,醇腈在α-醇腈裂解酶(又名醇腈酶)催化下裂解产生氢氰酸,对动物产生毒害,从而对植物起保护作用[1-2],这个过程被称为生氰反应(cyanogenesis)。目前已在超过2500多种植物中检测到含有氰苷类物质,包括常见的高粱、豆类、苦杏仁等等,木薯也以含氰苷闻名[3-4]。含氰苷可使植物抗逆性增强,对自身是有益的,但高氰苷含量的木薯,不仅食用时有苦味,而且会使人中毒。因此,了解木薯氰苷代谢规律,选育低氰苷含量或者很少产生有毒氢氰酸的木薯品种,是发展食用木薯的重要课题。
在植物体内,人们对生氰反应的基本过程已经明确,首先是由少数几种氨基酸经过氧化反应生成醇腈,醇腈不稳定,需要在糖基转移酶的作用下转化为稳定性好的氰苷。例如,在高粱中,L-酪氨酸在2种细胞色素P450氧化酶CYP79A1和CYP71E1的作用下首先生成不稳定的醇扁桃腈[5-6],最后在糖基转移酶UGT85B1的作用下生成稳定的蜀黍氰苷(dhurrin)[7]。在动物啃食过程中,不稳定的醇扁桃腈在pH>6时会自发产生氢氰酸,在pH<6时,需要α-醇腈裂解酶催化才可产生氢氰酸,木薯中情况也是如此[8]。由于植物代谢经常产生有机无机的酸类物质,细胞内pH通常小于6,所以α-醇腈裂解酶是植物生氰反应的关键酶[8]。人们从植物中早已提取到α-醇腈裂解酶的纯化物,并获得该酶的X-射线晶体结构图。该酶分子由大约260个氨基酸组成,其中121~165位的肽段为底物识别和结合区域。而保守的位于第80位的丝氨酸、第208位的天冬氨酸和第236位的组氨酸是催化活性中心位点。这些酶活性结构的知识为利用该酶将氢氰酸人工合成生产醇腈类化合物奠定了重要基础,也使该酶成为基因工程中重要的工程酶。人们已经从木薯中分离到多个编码α-醇腈裂解酶的基因序列并验证了其表达规律和功能,同时发现木薯基因组中存在至少7个编码该酶的基因,但确切的有几个基因编码并不清楚[4, 8-10]。
近年来,国内外学者分别对5个木薯材料的基因组进行了测序与基因组注释,并对100多份栽培品种进行了重测序[11-13]。序列注释表明,木薯基因组中存在11个HNL基因成员,串联分布在12号和13号染色体上。在对‘华南8号木薯品种重测序序列进行分析时,我们发现其中一个编号为12G132600的基因在编码区内部存在一个单碱基突变,即SNP,该SNP的出现使编码精氨酸的CGA突变成终止密码TGA,理论上该基因编码的蛋白质长度缩短了30%左右。从结构上分析,该短的蛋白序列包含121~165位的底物识别和结合区域,也包含第80位的丝氨酸催化位点,但缺少第208位的天冬氨酸和第236位的组氨酸这2个起催化作用的位点。因此,该突变属于自然突变,可能使基因丧失功能,利用该突变为降低木薯氢氰酸毒性提供了一种可能途径。
本研究对251份木薯材料的重测序数据进行分析,重点研究12G132600基因编码区内部的终止突变,并对食用木薯品种‘华南9号的12G132600基因进行克隆和Sanger测序,验证重测序的结果,旨在了解木薯种质群体中该醇腈裂解酶基因编码区终止突变的分布状况,为利用该基因培育低氢氰酸品种提供有用信息。
1 材料与方法
1.1 材料
木薯群体重测序数据包括241份国外已发表文章的材料[14],另外还对10份引进的木薯种质材料进行了重测序,一共251份。包括栽培品种(系)、木薯野生亚种(Manihot esculenta ssp. flabellifolia)和在进化上与木薯栽培类型较近的野生种(Manihot glaziovii)。国外测序材料中,栽培品种(系)共217份,野生亚种flabellifolia的材料13份,野生種Manihot glaziovii有11个。本研究进行重测序的材料有10个,即‘GR4‘HB60‘Mianbaomushu‘NZ199‘SC10‘R3‘SC6068‘SC9(‘华南9号)‘Wenchang?hon?gxin‘Yinniyeshengzhong。其中‘Yinniyes?he?ngzhong为野生种Manihot glaziovii,采自巴西Bahil省,其余9份材料属栽培类型,种植于中国热带农业科学院热带生物技术所试验田。251份分析材料的种、亚种及地理来源等信息见表1。
1.2 方法
1.2.1 木薯种质重测序数据及单核苷酸多态性(SNP)提取 国外已发表木薯重测序数据从网站ftp://ca?s?s?-avabase.org/HapMapII/WGSseq/下载。本研究的10份木薯材料首先利用艾莱德公司新型植物基因组DNA提取试剂盒提取高质量基因组DNA,送诺禾致源公司进行建库和测序。
重测序数据利用BWA软件[15]进行基因组比对,然后利用SAMtools v1.4[16]及BCFtools v1.9[17]软件进行SNP提取。
1.2.2 ‘华南9号木薯12G132600基因的克隆测序 木薯基因组有11个α-醇腈裂解酶基因,序列相似度高,为了克隆到12G132600基因,在基因的编码区上游和下游各成员非保守区设计引物,特异性扩增12G132600基因。所用引物为HNL-1L(5′-GCAGCTGGCCACAAGGTT-AC-3′),HNL-1R(5′-TTTCTGGAAGGCGATGG-AGTT- 3′);另一对引物为HNL-2L(5′-TGTTGCC-ATT-GC?T?G???CTGATAAA-3′),HNL-2R(5′-TGGAA- ?GG?CG?A?T?GGAGTTGC-3′)。扩增条件为:(1)95 ℃变性5 min;(2)95 ℃变性30 s;(3)53 ℃复性45 s;(4)72 ℃延伸1.5 min;(5)72 ℃延伸10 min;(6)4 ℃保存。第2步到第4步循环34次。PCR产物经1%琼脂糖凝胶电泳后用胶回收试剂盒(Omega生物技术有限公司)回收,末端加A后用T载体连接,转化大肠杆菌后挑克隆送上海生工生物公司测序。
2 结果与分析
2.1 木薯群体重测序数据中α-醇腈裂解酶基因的变异情况
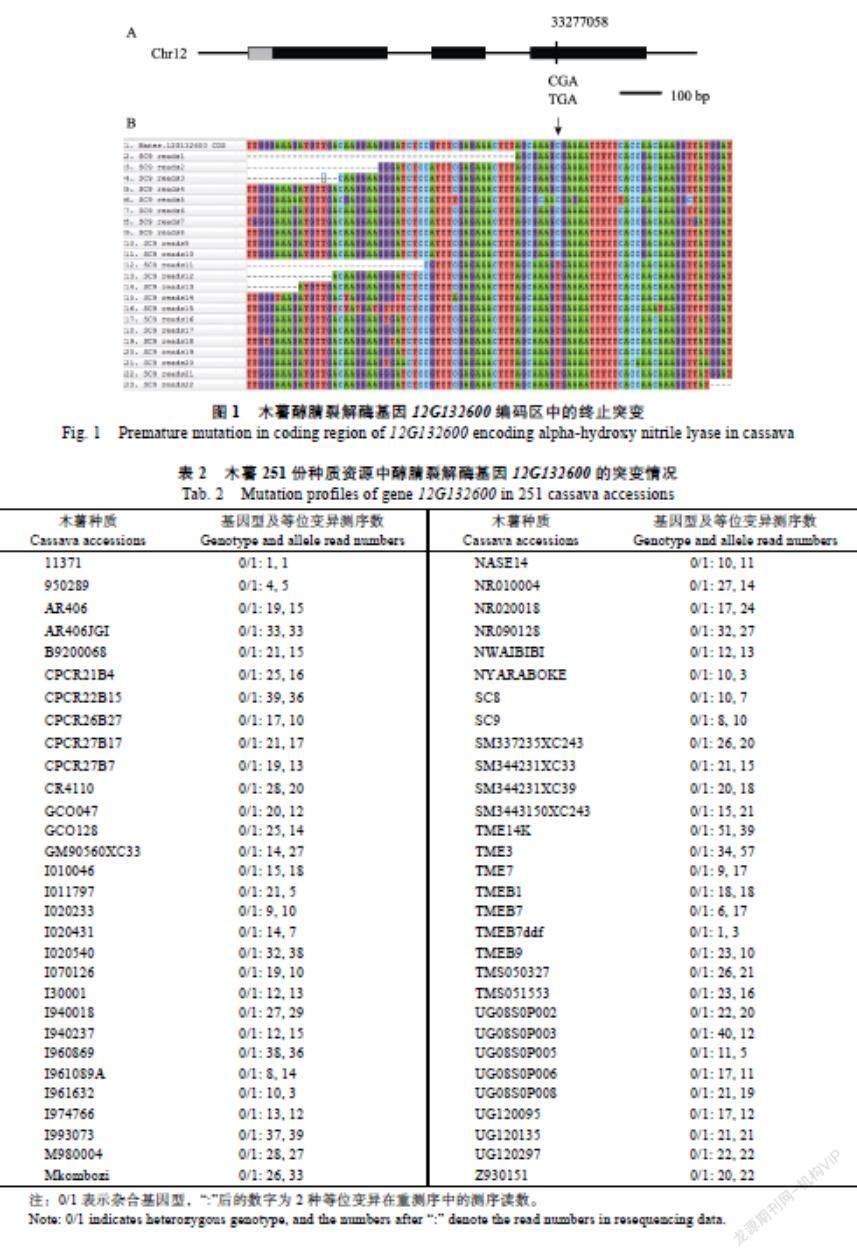
文献中测序的木薯品种‘华南8号中α-醇腈裂解酶基因HNL发生编码区提前终止突变的是编号为12G132600的基因。在最新V7.0版木薯AM560基因组上,突变位点发生在12号染色体33277058位点处(图1A)。图1A显示该基因有2个内含子,终止突变发生在第3个外显子上,在编码区的2/3长度处。通过SNP提取,我们测序的10份材料中只有SC9发生了同样的终止突变(图1B)。在SC9重测序结果中,覆盖到该突变位点的测序reads数为22,在22条reads中,有10条在33277058位点与AM560相同,另12条则发生C->T的点突变(图1B箭头所示)。
另外检测的241份国外材料中,有59份材料与SC8、SC9在该位点的突变情况相同,即都发生了G->A的突变,对应密码子则发生了CGA-> TGA的终止突变(表2)。
2.2 木薯品种‘华南9号12G132600基因的克隆与测序
二代测序因为技术原因,测序结果可能发生一定错误,尤其在测序覆盖度不高的情况下更是如此。本研究分析的测序深度都在10倍覆盖度以上,而且在251份木薯材料中有近1/4的材料都在该位点有相同SNP检出,这说明了分析数据的可靠性。然而,我们自己实验室对‘华南8号(SC8)木薯品种进行了重测序和10×Genomics测序,对结果进行分析时,在12G132600基因相同位点未发现变异,与国外所测结果不同。为进一步证明木薯群体中12G132600基因编码区内部存在终止突变的真实性,本研究对‘华南9号木薯品种中的该基因用高保真酶扩增,TA克隆后采用Sanger法进行测序,以验证该变异的真实性。以设计的2对引物对‘华南9号和‘华南8号进行扩增后得到了目标大小的条带(图2A)。随后采用效果更理想的第1对引物对‘华南9号DNA进行扩增,随机挑选6个克隆送样测序,其中3个测序结果证明了该突变确实存在(图2B,第742位),另3个克隆则无突变。
2.3 木薯品种‘TME312G132600基因序列分析
国外学者已对木薯品种‘TME3的基因组进行了测序和组装[13],本研究利用木薯‘AM560的12G132600基因编码区序列与‘TME3基因组进行比对,结果显示,序列比对最好的位置在‘TME3基因组的Scaffold7上,编码区从位点25931695到位点25932635。第3个开放阅读框区的比对结果见图3。其中‘TME3Scaffold7上25931919处的序列碱基为T(图3箭头所指),正是本研究发现的提前终止突变位置。‘TME3的基因组序列为国外学者独立组装,验证了本研究发现的12G132600基因编码区内部存在终止突变的结果。
3 讨论
随着测序技术的不断发展,越来越多的动植物基因组将被测序。当一个物种有了参考基因组后,通过价格便宜的高通量测序,就可以发现物种内部大量的遗传变异,这些遗传变异对于理解该物种内功能基因的多样性、重要性状的演化规律等非常重要。目前已经在水稻、玉米、棉花等多种作物中都进行了相关的研究,不仅发现了基因内部以及基因间存在的大量的遗传变异,更重要的是找到了与重要性状关联的变异。相比于Genotyping by sequencing等简化重测序方法,全基因组重测序的覆盖度更高(通常在10倍以上),覆盖基因组区域的范围更广,因此所得到的变异的可靠性更强。本研究所发现的木薯群体基因组中α-醇腈裂解酶基因编码区内部存在提前终止突变,正是通过重测序发现的,且在‘华南9号木薯品种中的Sanger测序也证实了重测序的可靠性。可以说,重测序技术是后基因组时代研究物种群体遗传学的有力工具。
木薯屬共有90多个物种[18],在M. esculenta这个种内,包括栽培类型亚种(M. esculenta ssp esculenta)和野生类型亚种(M. esculenta ssp flabellifolia),现在普遍认为栽培类型的木薯是由野生亚种驯化而来。其余的种都为野生型,其中与栽培木薯亲缘较近的野生种是M. glaziovii。本研究所分析的251份木薯种质中,包括栽培类型的木薯种质213份,木薯近缘野生亚种(M. esculenta ssp flabellifolia)16份,另还有9份野生种M. glaziovii和13份野生栽培杂交种材料。值得指出的是,α-醇腈裂解酶基因编码区存在终止突变的60份材料均为栽培类型。说明该变异是在木薯从野生亚种驯化成栽培类型以后才出现的。当然,由于野生种及野生亚种的材料数较少,该结果需要进一步扩大群体进行证实。另外,所有检测到含终止突变的栽培木薯材料均为杂合基因型,即有一个未突变的等位基因与突变基因同时存在。这可能是该基因在某些特定组织或在特定发育时期表达,不能完全突变,突变基因纯合的状况对植物的保护作用大大减弱,不利于木薯对病虫害等伤害的抵御。
实践证明,通过基因组重测序,可以在物种内不同种质材料间发现大量的遗传变异,包括单核苷酸多态性和插入缺失等各种变异,并为此开发了ANNOVAR[19]等一些生物学软件来对重测序数据中的变异的功能进行注释。目前的基因组测序与注释表明木薯基因组上存在11个HNL基因家族的成员,这11个成员分别串联分布在第12号和13号染色体上[10]。其中,13G092100编码的氨基酸序列与已发表的经过功能验证的MeHNL10同源性达100%,应该是同一个基因[8],国内学者王丹等[9]及程树华等[10]克隆的木薯醇腈酶基因经过序列比对及进化分析,事实上也应该是HNL10的等位基因。其他的成员(包括12G132600)在结构上具有与α-醇腈裂解酶相同的结构域,但其功能尚需要进一步实验验证。通过转录组数据可以看出,这11个成员中有5个在叶片和块根组织中有表达,12G132600是其中之一(结果未发表)。由于本研究发现的突变发生在编码区,会导致所编码的蛋白质长度缩短30%左右。从结构上分析,该短的蛋白序列包含底物識别和结合区域,也包含丝氨酸催化位点,但缺少C端的天冬氨酸和组氨酸这2个起催化作用的位点。有报道指出,结构相似的同工酶之间可通过竞争底物的方式相互产生干扰[20]。该突变基因表达的蛋白能否结合底物以及是否具有催化活性,在表达时能否和正常未突变的α-醇腈裂解酶存在底物竞争的关系,这是非常值得研究的。如果该突变蛋白能和底物结合,但没有催化活性,那么其在体内大量表达时便会与正常的α-醇腈裂解酶竞争结合底物,从而阻止α-醇腈裂解产生氢氰酸,这样即可一定程度避免人类、动物等在食用木薯时受到氢氰酸的毒害。
参考文献
[1] János V. Plant cyanogenic glucosides[J]. Toxicon, 2000, 38(1): 11-36.
[2] M?ller B M. Functional diversifications of cyanogenic glucosides[J]. Current Opinion in Plant Biology, 2010, 13(3): 337-346.
[3] Kannangara R, Motawia M S, Hansen N K K, et al. Characterization and expression profile of two UDP-glucosyltrans?f?erases, UGT85K4 and UGT85K5, catalyzing the last step in cyanogenic glucoside biosynthesis in cassava[J]. Plant Journal, 2011, 68(2): 287-301.
[4] White W L B, Arias-Garzon D I, Sayre M M T. Cyanogenesis in cassava: The role of hydroxynitrile lyase in root cyanide production[J]. Plant Physiology, 1998, 116(4): 1219- 1225.
[5] Sibbesen O, Koch B, Halkier B A, et al. Isolation of the hem-thiolate enzyme cytochrome P-450TYR, which catalyzes the committed step in the biosynthesis of the cyanogenic glucoside dhurrin in Sorghum bicolor (L.) Moench[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91: 9740-9744.
[6] Kahn, R A, Bak S, Svendsen I, et al. Isolation and reconstitution of cytochrome P450ox and in vitro reconstitution of the entire biosynthetic pathway of the cyanogenic glucoside dhurrin from sorghum[J]. Plant Physiology, 1997, 115(4): 1661-1670.
[7] Jones P R, M?ller B L, and H?j, P B. The UDP-glucose: p-hydroxymandelonitrile-O-glucosyltransferase that catalyzes the last step in synthesis of the cyanogenic glucoside dhurrin in Sorghum bicolor[J]. The Journal of Biological Chemistry, 1999, 274(50): 35483-35491.
[8] Hughes J, Keresztessy Z, Brown K, et al. Genomic organization and structure of α-hydroxynitrile lyase in cassava (Manihot esculenta Crantz)[J]. Archives of Biochemistry and Biophysics, 1998, 356(2): 107-116.
[9] 王 丹, 万 洁, 李 维, 等. 木薯醇腈酶(HNL)cDNA在大肠杆菌中高效表达的初步研究[J]. 四川师范大学学报(自然科学版), 2006, 29(3): 360-363.
[10] 程树华, 严共鸿, 吴 襟, 等. 木薯α-羟腈酶的克隆、表达及其初步应用[J]. 生物工程学报, 2001(1): 78-83.
[11] Wang W Q, Feng B X, Xiao J F, et al. Cassava genome from a wild ancestor to cultivated varieties[J]. Nature Communi- cations, 2014, 5: 5110.
[12] Bredeson J V, Lyons J B, Prochnik S E, et al. Sequencing wild and cultivated cassava and related species reveals extensive interspecific hybridization and genetic diversity[J]. Nature Biotechnology, 2016, 34(5): 562-570.
[13] Kuon J E, Qi W H, Schl?pfer P, et al. Haplotype-resolved genomes of geminivirus-resistant and geminivirus- susceptible African cassava cultivars[J]. BMC Biology, 2019, 17(1): 75.
[14] Ramu P, Esuma W, Kawuki R, et al. Cassava haplotype map highlights fixation of deleterious mutations during clonal propagation[J]. Nature Genetics, 2017, 49(6): 959-965.
[15] Li H. Aligning sequence reads, clone sequences and assembly contigs with BWA-MEM[J/OL]. Genomics, 2013. https://figshare.com/articles/poster/Aligning_sequence_reads_clone_sequences_and_assembly_con_gs_with_BWA_MEM/963153/1.
[16] Li H, Handsaker B, Wysoker A, et al. The Sequence alignment/map (SAM) format and SAMtools[J]. Bioinformatics, 2009, 25(16): 2078-2079.
[17] Narasimhan V, Danecek P, Scally A, et al. BCFtools/RoH: a hidden Markov model approach for detecting autozygosity from next-generation sequencing data[J]. Bioinformatics, 2016, 32(11): 1749-1751.
[18] Nassar N M A, Hashimoto D Y C, Fernandes S D C. Wild Manihot species: Botanical aspects, geographic distribution and economic value[J]. Genetics and Molecular Research, 2008, 7(1): 16-28.
[19] Wang K, Li M, Hakonarson H. ANNOVAR: Functional annotation of genetic variants from next-generation sequencing data[J]. Nucleic Acids Research, 2010, 38: e164.
[20] Erp H V, Shochey J, Zhang M, et al. Reducing isozyme competition increases targets fatty acid accumulation in seed Triacylglycerols of transgenic Arabidopsis[J]. Plant Physiology, 2015, 168: 36-46.
責任编辑:崔丽虹
