酸性天然气生成水合物条件实验测定与应用
2021-12-08李瑞景汪周华王庆文
刘 煌,李瑞景,汪周华,王庆文
(1.西南石油大学,四川 成都 610500;2.中国石油辽河油田分公司,辽宁 沈阳 110316)
0 引 言
天然气水合物是由天然气和水在低温、高压条件下生成的一种类似冰状非化学计量的笼型晶体物质,俗称可燃冰[1]。天然气水合物是储量丰富的高效清洁能源,能释放出天然气。但在天然气藏开发和天然气运输过程中,生成的天然气水合物会造成生产井、管线堵塞,尤其是天然气中含有大量的H2S、CO2等酸性气体时,更容易生成水合物[2-10]。因为相对于CH4,酸性气体H2S和CO2的存在使得天然气可在更高温度、更低压力的条件下与水生成水合物,进而导致气井产能和运输管线输运能力下降甚至停产[11]。因此,准确掌握酸性天然气生成水合物的条件对于预防水合物堵塞具有重要意义。
气体水合物相平衡条件确定方法主要有实验测定法和理论预测法[12]。其中,实验测定法主要包括观察法和图形法[13-14]。观察法要求反应釜和反应溶液可视,以便观察水合物的形成与分解,实验一般先让一定量的水合物在恒定温度、压力下在高压透明反应釜中形成,再保持其中一个实验参数不变,通过降低压力或升高温度使水合物分解,最后极少量水合物晶体稳定存在的条件即为该体系的水合物相平衡数据,因此,实验法包括定温搜索压力法和定压搜索温度法,由于压力的改变和维持稳定要更加灵敏,通常用定温搜索压力法代替观察法。图形法是通过保持3个实验参数(压力p、体积V、温度T)中某一参数不变,改变其他2个参数中的一个参数,另一个参数同时也会随着变化。从简化操作出发,一般是定V,改变p和T,最后找到水合物生成过程p-T曲线和分解过程p-T曲线的交点,交点对应的条件即为水合物相平衡条件。观察法的优点是直观、准确;图形法适用于一些可视性差、不易观察的体系,以及一些不含气相的体系。但2种实验过程都要尽量避免天然气在水溶液中溶解而影响气相的组成,导致测试结果失真。实验测定法的缺点是耗时较长、操作复杂,特别对于一些含有毒性组分天然气的测试,需要确保实验操作的安全性。理论预测法要简便得多,现有气体水合物热力学预测模型主要有vdW-P模型和Chen-Guo模型[15],这2种模型的建立皆基于大量单组分和多组分气体的水合物生成条件实验数据,具有较好的预测精度,被广泛使用。然而,含酸性天然气在地层水中生成水合物条件测定数据鲜有报道,因此,这2个模型针对于该体系的水合物相平衡条件模拟预测精度还有待进一步的验证。
该文采用定温搜索压力法测量了西部地区2个CO2物质的量分数分别为22.97%和52.10%的天然气样品在其共存地层水中的水合物生成条件,并结合该气藏不同井筒深度内的温度压力数据,预测井筒内是否生成水合物以及出现水合物的井筒位置,预测结果能有效指导现场生产,为应对水合物堵塞生产管线采取预防措施。
1 实验部分
1.1 实验仪器
该装置主要由全透明高压蓝宝石釜、恒温空气浴、搅拌装置及温度压力测量检测器4部分组成(图1)。其中,高压蓝宝石釜为该装置核心部分,有效容积为64 cm3,最大工作压力为20.00 MPa,安装在空气浴中。蓝宝石釜的工作容积可以通过连接在其底部的手动泵移动活塞来改变。为了有效观察蓝宝石釜中的实验现象,反应釜壁面安置了一个LG100H型冷光源。装置的压力和温度测量精度分别为0.05 MPa和0.1 ℃。
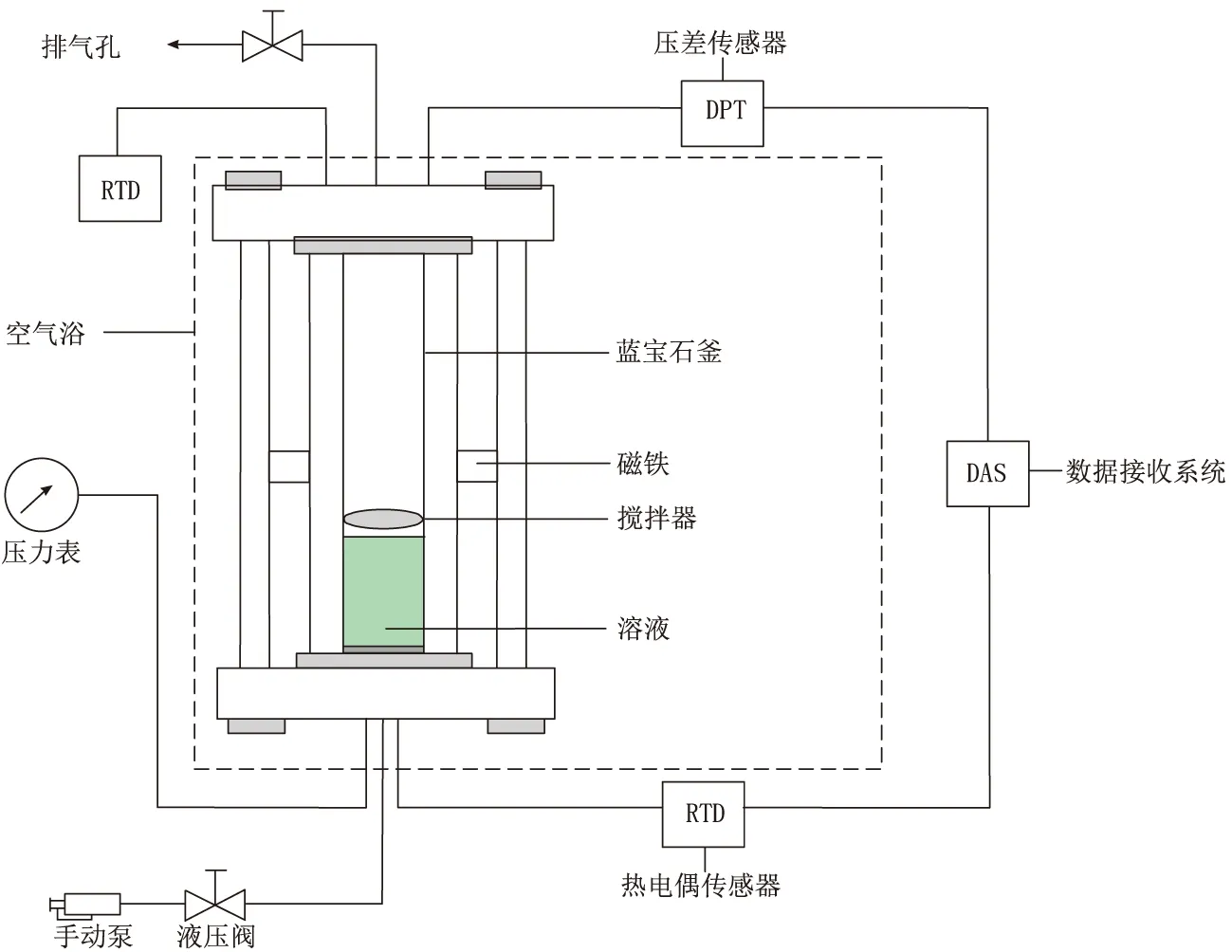
图1 蓝宝石釜装置示意图Fig.1 The schematic diagram of sapphire reactor
1.2 实验材料
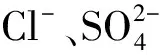
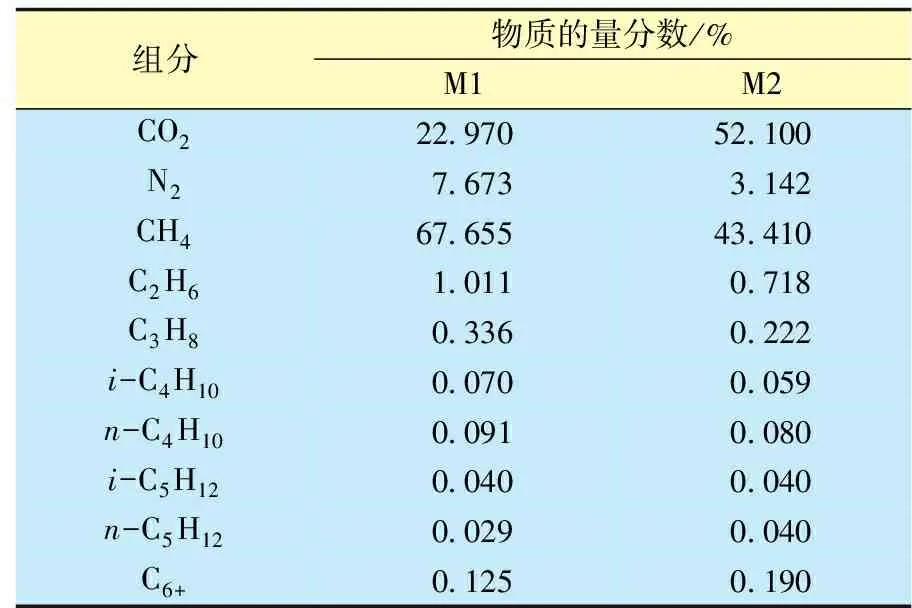
表1 M1和M2天然气样品的组成Table 1 The composition of M1 and M2 natural gas samples
1.3 实验步骤
①用蒸馏水清洗蓝宝石釜并干燥,将活塞置于反应釜底部,然后加入1 mL水溶液(避免天然气在水中溶解过多而影响气体的组成);②将蓝宝石釜安装到设备中并检查装置气密性,用准备好的原料气吹扫蓝宝石釜3次,以确保釜内没有空气;③将一定量的原料气注入蓝宝石釜中,通过推动蓝宝石釜底部连接的手动泵,将蓝宝石釜中的压力提高到比预估的平衡压力高出约2.00 MPa,通过空气浴设定所需的实验温度开始制冷;④当反应釜中出现水合物的时候,通过推动手动泵缓慢降低体系压力,使水合物晶体完全分解。当所有水合物晶体消失后,再升高系统压力0.05 MPa,使微量水合物晶体再次出现。对于每个步骤,系统压力和温度都保持5 h。
如果在此期间,蓝宝石釜中的水合物晶体完全消失,系统的压力再增加0.05 MPa,直至水合物晶体出现。当水合物晶体在蓝宝石釜中停留5 h后,将相应的系统压力和温度作为被测天然气形成水合物的一组平衡条件。在一系列所需温度下重复以上步骤。
2 实验结果与讨论
2.1 地层水样品的的离子含量
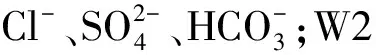
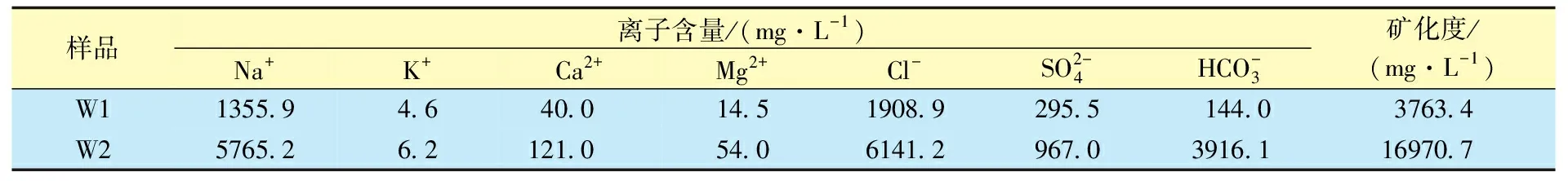
表2 W1和W2地下水样品的离子含量Table 2 The ion content of W1 and W2 undergroundwater samples
2.2 M1和M2天然气生成水合物的相平衡特征
表3为W1和W2地层水样品中M1和M2混合气生成水合物的条件。由表3可知,对于M2样品,相同温度条件下,其在纯水中的水合物生成压力要远低于CH4在纯水中的生成压力,这是由于高含CO2的缘故。同时,M2在对应地层水中的水合物生成压力要高于在纯水中。经计算,7 ℃下M2在W2中形成水合物的压力比在的纯水中要高出41%以上,这种现象归因于W2中的盐离子对水合物形成的抑制作用。这在实际应用中很受欢迎,因为可以选择相对较高的生产压力而不会形成水合物堵塞。对于M1混合气体,尽管其CO2含量远小于M2混合气,但在所有测试温度下,M1在W1地层水中的水合物生成压力均比M2在W2中的要小,其原因是W1和W2对水合物形成抑制程度不同。如表2所示,W1的矿化度远低于W2,这表明W1的水合抑制作用要远弱于W2。基于此,可以得出地层水中天然气水合物生成条件与其天然气成分浓度和地层水的矿化度有关,但后者的影响相对更大。
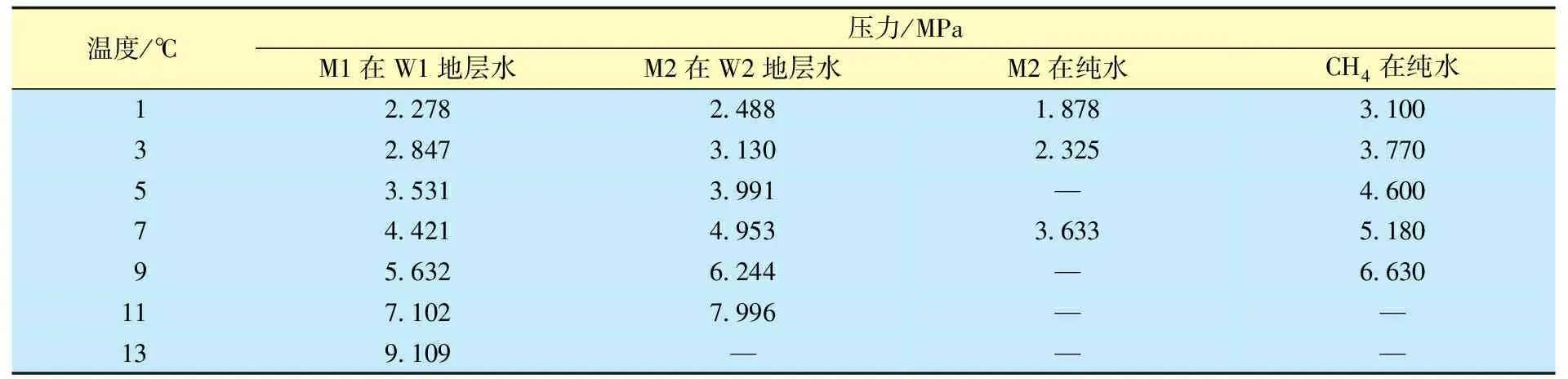
表3 地下水和纯水混合M1和M2气体的水合物形成条件Table 3 The hydrate formation conditions of undergroundwater and pure water mixed with M1 and M2 gas
为进一步了解地层水对高含CO2天然气水合物相态特征的影响程度,利用Chen-Guo和CSMHYD水合物模型分别计算了M1和M2在纯水中水合物形成的数据[19],模拟结果绘制在图2中。在计算过程中
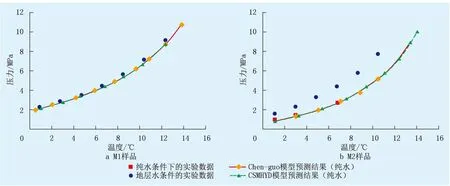
图2 天然气在地层水和纯水中的模型预测数据与实验数据对比Fig.2 The comparison of model prediction data and experimental data of natural gas in formation water and pure water
将CH4、C2H6、C3H8、n-C4H10和i-C4H10视为水合物形成剂,将n-C5H12、i-C5H12和C6+视为非水合物形成剂,因为其分子直径大于水合物包合物腔的内半径。显然,对于M1和M2在纯水中的水合物生成条件预测,Chen-Guo模型和CSMHYD模型给出了几乎相同的预测结果。M2在纯水中的水合物生成条件实验值与模拟结果相差不明显,导致细微变化的原因可能是CO2溶解于水中后对水活度系数产生了一些影响[20]。这也意味着Chen-Guo模型和CSMHYD模型对于模拟纯水体系中天然气的水合物相平衡特征是可靠的。对于M1,计算发现相同压力下其在W1地层水中的水合物生成温度与在纯水体系中相比均小于0.5 ℃,这说明高含CO2天然气生成水合物的稳定性不受咸水(低矿化度地层水)和CO2在水溶液中溶解的显著影响。但是,盐水使天然气水合物生成条件大大偏离在纯水中的结果。当然,为了更准确地了解地层水矿化度对天然气水合物相平衡特征的抑制作用,需要在不同盐度的电解质水溶液中进行更多的水合物相平衡实验测试。
根据文献报道[20],当被测系统远离临界点时,Clausius-Clapeyron方程可用于计算天然气水合物的分解焓。分解焓是指水合物分解时所吸收的热量,计算如下:
(1)
式中:p为天然气-水合物-水三相平衡后的系统压力,MPa;T为天然气-水合物-水三相平衡后的系统温度,K;ΔH为天然气水合物的分解焓,kJ/mol;R为通用气体常数,J/(mol·K);z为偏差系数。
基于Clausius-Clapeyron方程和图2中实验结果绘制了图3。由图3可以看出,纯水和地层水中M1和M2的水合物相平衡数据点都位于具有相同斜率的直线上,这表明地层水中溶解的盐对天然气水合物的分解焓基本没有影响。同时,lnp与1/T之间的良好线性关系也表明了实验数据的可靠性。基于图3中直线的斜率,计算出M1和M2形成的水合物分解焓约为62 kJ/mol,该数值介于纯CH4水合物和CO2水合物的分解焓之间,也处于文献中所报道数值范围之内[21-22],这表明由CO2含量高的天然气形成的水合物是结构I型水合物(CH4和CO2气体分子均能形成I型水合物,其中,CH4小分子可以进入Ⅰ型水合物的小晶穴和大晶穴,而CO2只能进入大晶穴)。尽管M1和M2中均存在少量的N2、C3H8、n-C4H10和i-C4H10,这些组分被认为在中等压力下所生成水合物为结构Ⅱ型(像C3H8这种大分子只能进入Ⅱ型水合物的大晶穴中)。通过分析,认为N2有可能赋存于形成的结构I型水合物的512小笼子中,C3H8、n-C4H10和i-C4H10由于在进料气中的分压太低而在水溶液中以溶解气状态存在而没有进入水合物晶格中。

图3 基于M1和M2天然气水合物平衡数据的Clausius-Clapeyron图Fig.3 The Clausius-Clapeyron diagram based on M1 and M2gas hydrate balance data
2.3 实验数据与现场生产动态结合
进一步将实验测定数据与现场生产动态数据结合(图4),图4中给出了M1和M2气藏分别在4个不同的地表温度、产量为1.5×104m3/d条件下井筒中天然气的温压变化曲线,其中,地表温度为16.30 ℃下的温压曲线为现场实际测定值,其他地表温度下的温压曲线为采用Fluent软件模拟计算值。由图4可知:当地表温度为16.30 ℃时,M1气藏井口流体的压力为6.59 MPa,温度为19.40 ℃,数据点在气体水合物生成曲线右侧,说明此时井筒和地面管线中不会生成水合物;当地表温度下降至6.70 ℃时,井筒温压曲线和气体水合物生成曲线开始出现交点,表明地表温度低于6.70 ℃时,井口和地面管线有开始生成水合物的风险;当地表温度为0.00 ℃时,气藏井口温度降至4.10 ℃,计算发现此时井下139.5 m(温度为10.19 ℃)内油管以及地面运输管线均可能出现水合物堵塞的风险。同理,对于M2气藏,在地表温度为16.30 ℃、产量为1.5×104m3/d时,也不会出现生成水合物堵塞管道的风险,但当地表温度降至6.30 ℃时,气藏的温压曲线和气体水合物生成曲线开始产生交点,表明此时井口油管和地面运输管线存在水合物生成并发生堵塞的风险;当地表温度进一步降至0.00 ℃时,气藏井口温度降至3.98 ℃,此时井下151.3 m(温度为9.93 ℃)内油管以及地面运输管线均有水合物生成的风险。结合气藏所处的环境,当深秋以及冬季环境温度降至5.00 ℃以下时,应考虑对井筒上部和地面运输管线采取水合物生成预防措施,针对井筒上部,可在井底装节流阀降低流体压力或注入水合物生成热力学抑制剂;针对地面运输管线,可考虑将采出的天然气脱水再运输或注入水合物生成热力学抑制剂。
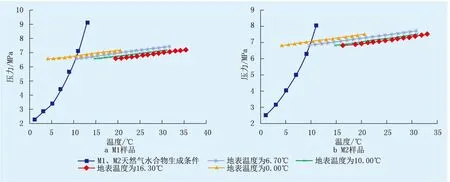
图4 天然气水合物生成条件与不同地表温度下井筒中温压变化Fig.4 The gas hydrate formation conditions and temperature-pressure changes in the wellbore at different surface temperatures
3 结 论
(1) 实验中向反应釜中加入的地层水体积仅为1 mL,避免了天然气在水中溶解而影响气相的组成,使得定温搜索压力法能够适用于多组分体系水合物相平衡条件测定;开始采用定高压法让地层水完全生成水合物再让水合物分解,使地层水产生记忆效应,加快了测试速度。
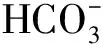
(3) 地层水中溶解的盐对天然气水合物的分解焓基本没有影响,M1和M2形成的水合物分解焓约为62 kJ/mol,证明高含CO2天然气生成的水合物为结构I型水合物。
(4) 现场设定1.5×104m3/d产量生产,当环境温度高于6.70 ℃时,M1气藏不需要考虑天然气水合物生成造成井筒和地面运输管线堵塞的风险,但当环境温度降到6.70 ℃以下时,应考虑实施预防水合物生成措施,环境温度越低,井筒中生成水合物的风险越高。M2气藏生成天然气水合物造成堵塞风险的临界环境温度为6.30 ℃。
