重组人金属硫蛋白-Ⅲα短肽对UVB致HaCaT细胞氧化损伤的缓解作用
2021-12-07甘俊英孙左义秦建新原海亮李强薛玉英
甘俊英,孙左义,秦建新,原海亮,李强,薛玉英,*
1. 环境医学工程教育部重点实验室,东南大学公共卫生学院,南京 210000 2. 马鞍山市疾病预防控制中心,马鞍山 243000 3. 苏州汇涵医用科技发展有限公司,常熟 215500 4. 常熟市市场监督管理局,常熟 215500
随着环境中污染物的增加,大气层破坏导致紫外线辐射对人类健康的损伤十分严重,超氧化物侵袭超过机体耐受程度,最终出现炎症、衰老及代谢调节功能的紊乱,甚至诱发基因突变和癌症[1]。对抗氧化和由脂质过氧化反应引起的疾病研究,已成为人类对健康的新追求[2]。中波紫外线(ultraviolet B, UVB)是造成皮肤损伤的主要光谱,其引起的皮肤光损伤主要通过氧化应激反应产生过多的活性氧(reactive oxygen species, ROS),导致细胞发生凋亡及细胞氧化损伤,从而引起皮肤光老化,诱发皮肤癌[3],多年来,研究者们致力于寻求一种天然无毒的防晒修复剂。
金属硫蛋白(metallothionein, MT)是一类分子量较低、富含半胱氨酸的金属结合性蛋白,在生物体内分布广泛[4],其具有的清除自由基功能,可有效降低机体氧化损伤水平[5],提示MT可用来预防和治疗UVB辐射造成的光氧化损伤。但内源性MT的抗氧化损伤作用有限,随着氧化损伤的积累,超过机体耐受临界值之后,MT应答效应逐渐减弱,因此研究者们开始关注外源性补充MT的抗氧化损伤作用研究。
MT可从动植物组织中提取[6-8],但由于来源不足、纯度不高等原因,在一定程度上阻碍了MT的发展,相对于这种方法,基因工程制备的MT[9]纯度高,性能更加稳定,使人源MT走向商品化成为可能。本试验用重组人金属硫蛋白Ⅲα短肽(recombinant human metallothionein Ⅲα, rh-MT-Ⅲα),由苏州汇涵医用科技发展有限公司利用基因工程制备,与完整MT比较,具有分子量更低,更易被吸收特点。这种rh-MT-Ⅲα在基因序列上与动植物中提纯的MT相比具有更高生物相容性,与内源性完整MTα域在结构和巯基含量基本一致。由于rh-MT-Ⅲα属于新物质,目前尚未有其毒性评价及功能相关研究,若能较完整地阐述和确证外源性补充这种新rh-MT-Ⅲα的安全性及抗氧化功能,将有望替代化学防晒剂。
在前期研究rh-MT-Ⅲα对细胞及线虫的毒性效应的基础上[10],利用体外化学共浴方法研究rh-MT-Ⅲα对自由基清除功能并计算出IC50(rh-MT-Ⅲα对自由基清除率达50%时所需的浓度),同时建立UVB损伤细胞模型,选用人类皮肤毒性评价常用模型HaCaT细胞,经UVB损伤处理后,加入不同浓度rh-MT-Ⅲα继续培养24 h后检测细胞存活率、细胞形态、细胞凋亡及细胞内ROS水平,从细胞水平上初步研究rh-MT-Ⅲα的抗光氧化损伤作用,为其作为化学防晒替代提供实验参考。
1 材料与方法(Materials and methods)
1.1 主要试剂仪器与细胞来源
1.1.1 材料与试剂
rh-MT-Ⅲα由苏州汇涵医用科技发展有限公司提供,商品名为重组人巯基短肽,利用大肠杆菌基因工程高密度发酵并纯化获得的人源金属硫蛋白Ⅲα亚基片段,分子量3.7 kD,每分子蛋白含游离巯基6个,蛋白SDS-PAGE纯度≥98%。
DMEM高糖培养液(美国Gibco公司),胰蛋白酶(美国Gibco公司),胎牛血清(浙江天杭生物科技有限公司),磷酸盐缓冲液(PBS)(博士德生物工程有限公司),噻唑蓝(MTT)(美国Sigma公司),活性氧试剂盒(碧云天生物公司),细胞凋亡试剂盒(美国BD公司),分析纯无水乙醇(南京晚晴生物有限公司),1,1-二苯基-2-苦苯肼自由基(DPPH)(合肥博美生物科技有限公司)。
1.1.2 主要仪器
3423型CO2培养箱(美国Thermo Scientific公司);Biobase生物安全柜(中国博科控股集团有限公司),FSX型生物图像导航仪(日本Olympus公司),5424R型离心机(德国Eppendorf公司);Epoch型酶标仪(美国Bio Tek公司);MVS-1型涡旋混合器(北京金紫光科技发展有限公司);5424R型离心机(德国Eppendorf公司);BS-210S型电子天平(北京赛多利斯天平有限公司);MilliQ Advantage型超纯水系统(美国密理博公司);UV1780紫外分光光度计(日本岛津公司);UVB灯管(313 nm模拟太阳光老化,购自北京中仪商城);FV3000激光共聚焦显微镜(日本OLYMPUS公司);BD FACSCalibur流式细胞仪(美国BD公司)
1.1.3 实验细胞
HaCaT细胞是非肿瘤来源的人正常皮肤永生化角质形成细胞株,与正常人角质形成细胞分化特性相似,可以繁殖150代以上。HaCaT细胞购自上海名劲生物科技有限公司。
1.2 实验方法
1.2.1 溶液配制
染毒液配制:使用超纯水配制不同浓度rh-MT-Ⅲα溶液(25、50、100、200和400 μg·mL-1),现配现用。
80 μg·mL-1DPPH溶液配制:称取DPPH粉末10 mg,加入无水乙醇定容至125 mL,制得DPPH溶液备用。
1.2.2 实验剂量与程序
体外自由基清除试验:实验方法参照文献[11]并略作修改。向1.5 mL DPPH溶液中,分别加入1.5 mL不同浓度的rh-MT-Ⅲα溶液(25、50、100、200和400 μg·mL-1),对照组加入同体积超纯水,混匀,室温避光静置30 min后,利用紫外分光光度计在517 nm条件下测定吸光度值(OD),每剂量组设3个平行。按公式计算自由基清除率(K),K(%)=(1-Ax/A0)×100%,式中:Ax为样品测定管OD值,A0为空白测定管OD值。计算IC50以评价rh-MT-Ⅲα体外清除自由基能力。
UVB诱导HaCaT细胞损伤模型的构建:将UVB灯管垂直置于UVB照度计上方,调整灯管高度至辐照强度为100 μW·cm-2,固定灯管。选取对数生长期、生长状态良好的HaCaT细胞,调整细胞悬浮液浓度为1×105个·mL-1,分别接种于96孔板(每孔0.2 mL)中,每组设3个平行,于37 ℃、5% CO2恒温培养箱中培养12 h后,弃去原培养液,加入200 μL PBS覆盖,置于UVB灯管正下方分别处理1、2、3、4和5 min,完全培养基为空白对照,含细胞避光处理组(锡箔纸盖住)为阴性对照。处理结束后,缓慢吸去PBS,加入完全培养基200 μL,于培养箱中继续培养24 h后,依据MTT法检测各组细胞存活率,依据细胞存活率来确定UVB模型辐照剂量。细胞存活率(%)=[(Ax-Ak)/A0]×100%,式中:Ax为各UVB处理组吸光度值,Ak为空白对照组吸光度值,A0为避光对照组吸光度值。
建立的UVB模型:依据前期rh-MT-Ⅲα细胞毒性结果,在400 μg·mL-1剂量时,乳酸脱氢酶释放实验结果显示,rh-MT-Ⅲα对HaCaT细胞膜造成了明显的损伤,低于此剂量时未观察到明显毒性。选用不同浓度(25、50、100和200 μg·mL-1)rh-MT-Ⅲα处理经UVB辐照的细胞,继续培养24 h后,从细胞存活率、细胞形态、细胞凋亡率及细胞内ROS含量各指标与避光对照组和单一UVB处理组进行比较,评价rh-MT-Ⅲα在细胞水平上的抗氧化损伤作用。
细胞内ROS观察:(1)激光共聚焦显微镜观察ROS。处理结束后,弃去原培养液,PBS缓慢清洗2遍。按照活性氧检测试剂盒说明书,用无血清的DMEM培养液将DCFH-DA探针按1∶1 000比例稀释,混匀后加入到激光共聚焦小皿中,每孔0.5 mL,37 ℃细胞培养箱内处理20 min。孵育结束后,将探针液吸出,用不含血清的培养液洗2遍,再用PBS洗2遍,最后向每孔加入1 mL PBS,放置生物导航仪下观察并拍照。
(2)流式细胞仪检测ROS。染毒结束后,弃去原培养液,PBS洗2遍,加入0.25%胰酶消化细胞,完全培养基终止消化,将细胞转移到1.5 mL离心管中,1 000 rmin-1离心5 min。离心结束后,弃上清,加入1 mL PBS,缓慢吹打混匀,1 000 rmin-1离心5 min,离心后,重复PBS清洗一次。按照活性氧检测试剂盒说明书,用无血清的DMEM培养液将DCFH-DA探针按1∶1 000比例稀释混匀,加入到含处理好细胞的1.5 mL离心管中,每管1 mL,混匀,37 ℃孵育20 min,期间每隔3 min颠倒混匀一下。孵育结束后,用PBS洗3次,以充分去除未进入细胞的DCFH-DA探针,最后加入500 μL PBS悬浮细胞,用流式细胞仪在Ex/Em=488 nm/525 nm波长下进行检测。
1.2.3 数据处理
采用SPSS Statistics 22.0软件进行数据分析,多组之间比较采用方差齐性检验和单因素方差分析(One-Way ANOVA)。两组之间比较,若符合方差齐性,则采用LSD-t检验方法,若方差不齐,则采用Games-Howell检验方法。实验数据均以mean±SD表示,检测水平为P<0.05差异有统计学意义。
利用SPSS软件计算rh-MT-Ⅲα清除DPPH自由基的IC50。计算步骤参照文献[12]:(1)建立SPSS数据集,包括剂量组、清除率和总数等;(2)按要求计算好的实验数据输入,总数均填100;(3)根据顺序点击,Analyze→Regression→Probit→将剂量组导入Covariates,清除率导入Response frequency,总数导入汇总Total,Transform点击选择Log based 10→选择Model Probit→OK,从而计算出IC50及其95%置信区间。
2 结果(Results)
2.1 体外自由基清除率结果
DPPH是研究体外自由基清除的主要材料[13],在乙醇中是一种稳定的自由基,溶液呈紫色,于517 nm处显示最大吸收峰。当DPPH遇到质子供体物质,例如抗氧化剂,颜色从紫色变为黄色,随后吸光度降低[14],由此可测定化学物质的自由基清除能力。利用紫外分光光度计在517 nm测得吸光度值,按照1.2.2中的公式计算rh-MT-Ⅲα对DPPH清除率,结果如图1所示,随着rh-MT-Ⅲα剂量的增加,其对DPPH自由基的清除率逐渐增加,由SPSS软件计算出rh-MT-Ⅲα对DPPH自由基的清除率达到50%时的浓度为184.23 μg·mL-1(P>0.05),模型拟合度好。IC50的95%置信区间为151.00~230.90 μg·mL-1。
2.2 UVB诱导HaCaT细胞氧化损伤模型构建
不同UVB辐照剂量对HaCaT细胞存活率影响测定结果如表1所示,随着UVB辐照时间的增加,HaCaT细胞存活率降低,与避光对照组存活率相比,3、4和5 min处理组显著降低(P<0.05)。考虑模型生物学意义,去除与避光对照组无差异的1 min和2 min(该辐照剂量下,细胞损伤不明显)和细胞损伤过于严重的4 min和5 min (该辐照剂量下,细胞损伤大,一定程度上会弱化受试物的抗氧化作用,不利于观察受试物真实的抗氧化能力),选定模型UVB辐照时间为3 min,辐照强度为100 μW·cm-2。
2.3 rh-MT-Ⅲα对UVB致HaCaT细胞氧化损伤的抗氧化作用研究
2.3.1 细胞存活率
HaCaT细胞经UVB处理后,利用不同浓度(25、50、100和200 μg·mL-1) rh-MT-Ⅲα继续培养24 h后,测得细胞存活率结果如图2所示。结果显示,与避光对照组相比,UVB处理后细胞存活率均有所下降,随着rh-MT-Ⅲα浓度的升高,各UVB+rh-MT-Ⅲα处理细胞存活率呈现先增高后略有降低,在50 μg·mL-1和100 μg·mL-1剂量下与避光对照组无显著差异。尤其在100 μg·mL-1时,细胞存活率较单一UVB处理组细胞存活率显著升高。

图1 重组人金属硫蛋白Ⅲα短肽(rh-MT-Ⅲα)对 1,1-二苯基-2-苦苯肼(DPPH)自由基的清除率Fig. 1 The free radical scavenging rate on 1,1-diphenyl-2-picrylhydrazyl (DPPH) by recombinant human metallothionein Ⅲα peptide (rh-MT-Ⅲα)

表1 不同UVB辐照剂量对HaCaT细胞存活率 影响(mean±SD, n=3)Table 1 The effect of different dose of UVB on viability of HaCaT cells (mean±SD, n=3)
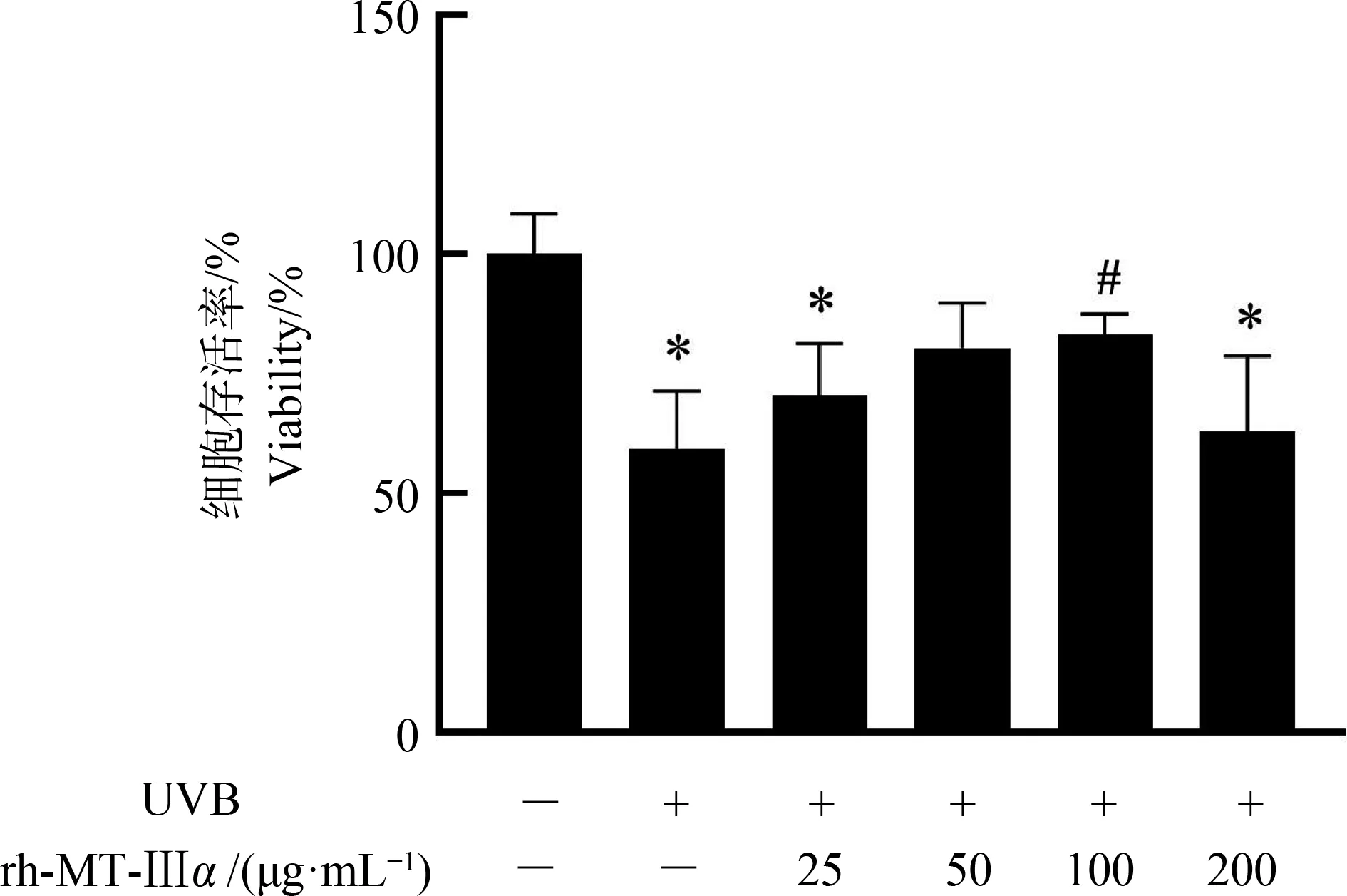
图2 rh-MT-Ⅲα对UVB损伤后的HaCaT 细胞存活率的影响注:与避光对照组相比,*P<0.05;与单一UVB处理组相比, # P<0.05;-表示不含有,+表示含有。Fig. 2 The effect of rh-MT-Ⅲα on viability of HaCaT cells after exposed to the UVBNote: Compared with the negative control group, *indicates significant differences at P<0.05 level; compared with the single UVB group, # indicates significant differences at P<0.05 level; - means contained; + means not contain.
2.3.2 细胞形态学结果
经处理完成后,在激光共聚焦显微镜下观察rh-MT-Ⅲα对UVB损伤后的HaCaT细胞形态学的影响,结果如图3所示。经UVB处理后,与避光对照组相比,单一UVB组细胞连接不紧密,细胞变圆,单个视野可见细胞数明显减少。在25~100 μg·mL-1剂量下,随着rh-MT-Ⅲα浓度的增加,细胞形态较UVB组逐渐改善,细胞连接逐渐紧密,呈铺路石状,单个视野可见细胞数明显增加,在100 μg·mL-1时尤为明显。在高浓度时,这种改善作用有所降低。
2.3.3 细胞凋亡率
处理结束后,利用流式细胞仪检测HaCaT细胞凋亡率,结果如图4和图5所示,与避光对照组相比,UVB处理后细胞凋亡率均有所上升,随着rh-MT-Ⅲα浓度的增加,细胞凋亡率呈现先降低后略有升高趋势。在100 μg·mL-1剂量下,细胞凋亡率较单一UVB处理组显著降低(P<0.05),与避光对照组差异无统计学意义。
2.3.4 活性氧检测结果
激光共聚焦显微镜下观察细胞内ROS的含量情况如图6所示。与避光对照组相比,经UVB处理后的细胞荧光强度增加。与单一UVB处理相比,rh-MT-Ⅲα处理后细胞荧光强度减弱,在50 μg·mL-1及100 μg·mL-1剂量下细胞荧光强度显著降低。
流式细胞仪检测细胞内ROS含量结果如图7和图8所示,与避光对照组相比,单一UVB及UVB+rh-MT-Ⅲα(25 μg·mL-1和200 μg·mL-1)组细胞ROS含量显著增加,UVB+rh-MT-Ⅲα(50 μg·mL-1和100 μg·mL-1)组细胞ROS略有增加,但无统计学意义。与单一UVB剂量组相比,除25 μg·mL-1剂量组外均显著降低。UVB+rh-MT-Ⅲα处理组细胞ROS含量随着rh-MT-Ⅲα剂量的增加,呈现先降低后略有升高的趋势,且在100 μg·mL-1时显著降低,恢复至正常水平。

图3 rh-MT-Ⅲα对UVB损伤后的HaCaT细胞形态的影响(400×)注:(a)避光对照组;(b)单一UVB处理组;(c)~(f) UVB+25~200 μg·mL-1 rh-MT-Ⅲα。Fig. 3 Effect of rh-MT-Ⅲα on morphology of HaCaT cells after exposed to the UVBNote: (a) negative control group; (b) single UVB expose group; (c)~(f) UVB+25~200 μg·mL-1 rh-MT-Ⅲα.

图4 rh-MT-Ⅲα对UVB损伤后的HaCaT细胞凋亡率的影响注:FITC/PI表示流式细胞仪荧光通道;(a)避光对照组;(b)单一UVB处理组;(c)~(f) UVB+25~200 μg·mL-1 rh-MT-Ⅲα。Fig. 4 Effect of rh-MT-Ⅲα on atoposis of HaCaT cells after exposed to the UVBNote: FITC/PI represents flow cytometer fluorescence channel; (a) negative control group; (b) single UVB expose group; (c)~(f) UVB+25~200 μg·mL-1 rh-MT-Ⅲα.

图5 rh-MT-Ⅲα对UVB损伤后HaCaT细胞凋亡率影响注:与避光对照组相比,*P<0.05;与单一UVB处理组相比, # P<0.05;-表示不含有,+表示含有。Fig. 5 Effect of rh-MT-Ⅲα on atoposis of HaCaT cells after exposed to the UVBNote: Compared with the negative control group, *indicates significant differences at P<0.05 level; compared with the single UVB group, # indicates significant differences at P<0.05 level; - means contained; + means not contain.
3 讨论(Discussion)
DPPH在实验体系中为稳定自由基,其含有以氮为中心的吸电子基团,体系呈紫色,在517 nm可见光下出现强烈吸收峰。向体系中加入受试物,如果受试物能够清除DPPH,则吸光度值降低,表明其具有清除氧自由基作用,该实验方法简捷、重复性好[15]。依照加入rh-MT-Ⅲα后体系吸光度的改变,可间接判断rh-MT-Ⅲα是否具有清除自由基功能及其功能大小。实验结果表明,rh-MT-Ⅲα对DPPH自由基具有清除作用,其半数清除率浓度为184.23

图6 rh-MT-Ⅲα对UVB损伤后的HaCaT细胞活性氧(ROS)含量的影响(400×)注:(a)避光对照组;(b)单一UVB处理组;(c)~(f) UVB+25~200 μg·mL-1 rh-MT-Ⅲα。Fig. 6 Effect of rh-MT-Ⅲα on reactive oxygen species (ROS) content of HaCaT cells after exposed to the UVB (400×)Note: (a) negative control group; (b) single UVB expose group; (c)~(f) UVB+25~200 μg·mL-1 rh-MT-Ⅲα.

图7 流式细胞术检测rh-MT-Ⅲα对UVB损伤后的HaCaT细胞ROS含量的影响注:FITC/Count为流式细胞仪荧光通道;(a)避光对照组;(b)单一UVB处理组;(c)~(f) UVB+25~200 μg·mL-1 rh-MT-Ⅲα。Fig. 7 Effect of rh-MT-Ⅲα on ROS content of HaCaT cells after exposed to the UVB by flow cytometryNote: FITC/Count represents flow cytometer fluorescence channel; (a) negative control group; (b) single UVB expose group; (c)~(f) UVB+25~200 μg·mL-1 rh-MT-Ⅲα.
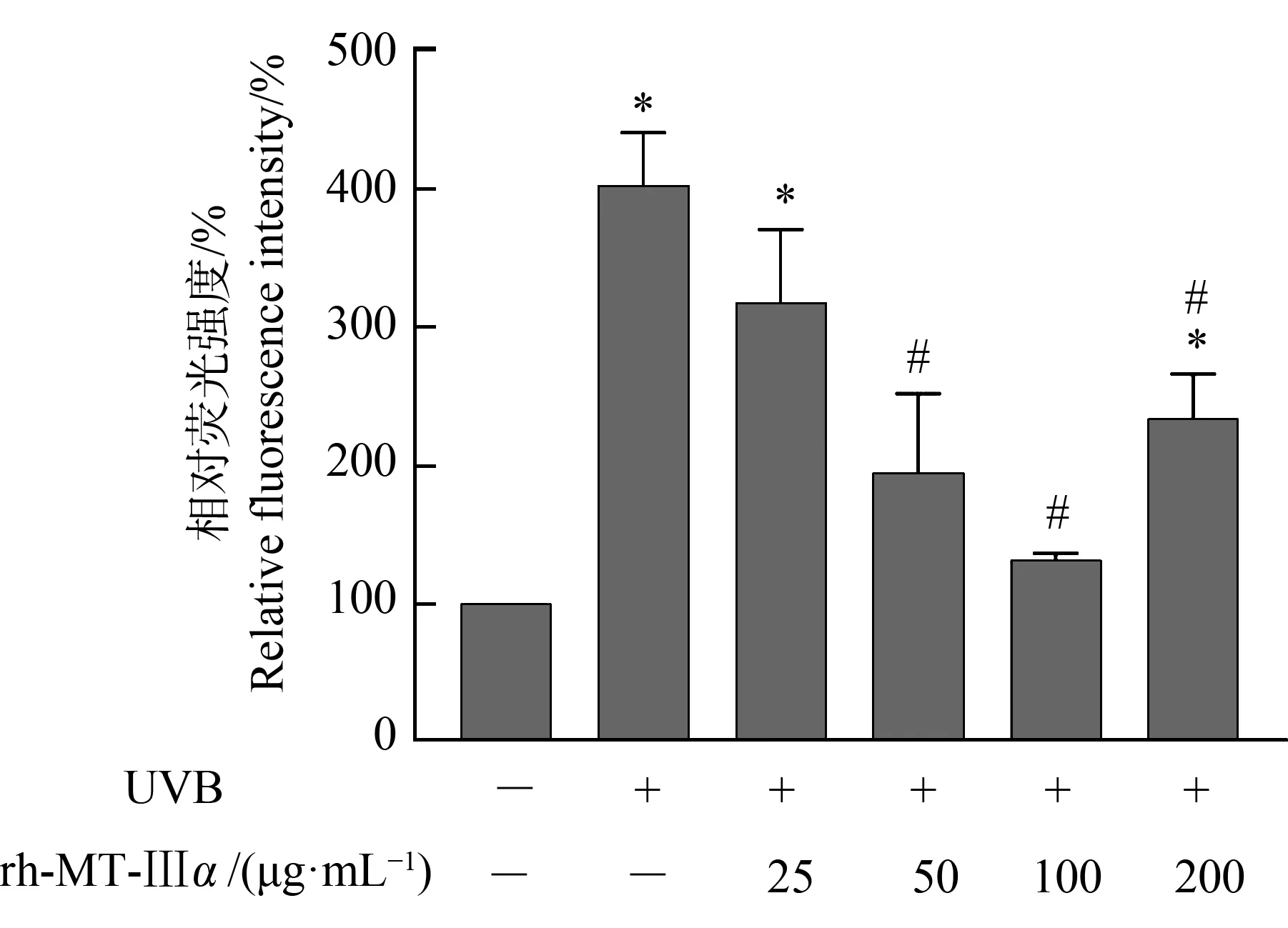
图8 流式细胞术检测rh-MT-Ⅲα对UVB损伤后 HaCaT细胞ROS含量的定量影响注:与避光对照组相比,*P<0.05;与单一UVB处理组相比, # P<0.05;-表示不含有,+表示含有。Fig. 8 Effect of rh-MT-Ⅲα on ROS content of HaCaT cells after exposed to the UVB by flow cytometryNote: Compared with the negative control group, *indicates significant differences at P<0.05 level; compared with the single UVB group, # indicates significant differences at P<0.05 level; - means contained; + means not contain.
μg·mL-1。本实验结果与前人的研究结果存在差异[16-17],已有研究者采用锌合金属硫蛋白(Zn-MT)及酵母源金属硫蛋白Ⅰ和Ⅱ,研究MT对DPPH自由基清除能力,并获得IC50约为58 μg·mL-1,远低于184.23 μg·mL-1。金属硫蛋白主要有4种异构体,MT-Ⅰ、MT-Ⅱ主要分布于哺乳动物器官如肝、肾组织中,MT-Ⅲ主要分布于中枢神经系统,MT-Ⅳ主要在皮肤和胃肠道上部表达。本研究所用材料为人源大肠杆菌发酵所得的金属硫蛋白Ⅲα短肽,分析研究结果相差较大的主要原因可能有两方面:一是不同来源及不同亚型的MT在功能方面存在原始差异;二是完整MT包含α和β这2个结构域,其巯基含量远大于只含α结构域的MT短肽,从而造成其功能上的差异。不同制备方式及MT成品纯度在一定程度上,也会对其功能产生影响。对于rh-MT-Ⅲα与不同亚型及来源的完整MT抗氧化能力的差异机制探索及比较,有待进一步研究。
紫外线主要有3种波长范围:长波紫外线(ultraviolet A, UVA)、UVB和短波紫外线(ultraviolet C, UVC),波长为280~320 nm的中波紫外线是致人体皮肤光氧化损伤的主要光谱[18]。长期的紫外线辐射,尤其是中波紫外线还可引起皮肤角质形成细胞分泌一系列的炎症因子,诱导各种皮肤病甚至是皮肤癌的发生[19-21]。体外自由基清除实验表明,rh-MT-Ⅲα具有较强的自由基清除能力,提示其可能存在抗UVB氧化损伤的作用。我们建立了以细胞为基础,UVB为处理因素的评价rh-MT-Ⅲα抗氧化损伤功能的模型。结果表明,单一UVB(强度为100 μW·cm-2)处理HaCaT细胞后,随着辐照时间的增加,细胞存活率随之降低,表明细胞损伤越严重,依据细胞存活结果及损伤修复生物学意义,选定辐照时间为3 min (59.39%±12.01%),此剂量下既可以观察到UVB对细胞的损伤,又可以减少过度损伤导致弱化rh-MT-Ⅲα抗氧化损伤的功能,使观察结果更具可靠性。
UVB辐射使机体内自由基含量增加,超出机体耐受范围后产生氧化损伤,而氧化损伤的发生常伴有ROS含量的异常升高,如果ROS生成量超过机体的耐受水平,则会导致应激损伤,破坏遗传大分子及关键蛋白质,从而导致衰老与疾病的发生[22]。ROS是细胞代谢不可避免的产物[23],UVB辐照后可通过直接作用和间接作用产生大量的ROS。UVB模型处理的HaCaT细胞,再经不同浓度(25、50、100和200 μg·mL-1)rh-MT-Ⅲα处理后,在25~100 μg·mL-1剂量下细胞存活率呈上升趋势,且在100 μg·mL-1剂量下,细胞存活率显著高于单一UVB染毒组。细胞形态、细胞凋亡和活性氧含量指标与细胞存活率结果一致,均在100 μg·mL-1剂量下显著改善,与单一UVB处理组细胞相比,100 μg·mL-1剂量组细胞连接更加紧密,细胞凋亡率及活性氧含量均显著降低,这些结果表明,rh-MT-Ⅲα具有抗氧化损伤功能,且在100 μg·mL-1剂量下作用显著,可使细胞恢复至正常水平。这种作用在高剂量下有所减弱,结合前期细胞毒性评价研究,考虑是随着rh-MT-Ⅲα剂量的增加,其对细胞膜的损伤作用越来越明显,在安全有效剂量(考虑在100~200 μg·mL-1)之间,但需要进一步研究来确证)内,其抗氧化作用随着剂量的增加而增强,一旦超过安全剂量,rh-MT-Ⅲα对于细胞膜的损伤削弱了其抗氧化损伤作用,从而导致抗氧化损伤作用在高剂量时降低。ROS含量从侧面反映了氧化损伤水平,未来需进一步探讨氧化损伤程度指标,如丙二醛含量、谷胱甘肽含量以及抗氧化损伤基因的表达量等。
研究首先探索了不同浓度rh-MT-Ⅲα对DPPH自由基的体外清除能力,继而通过构建UVB损伤HaCaT细胞模型,研究不同浓度rh-MT-Ⅲα对UVB损伤后的细胞各生物学终点的影响,在细胞水平上验证了rh-MT-Ⅲα抗氧化损伤功能,为天然防晒剂探索提供了实验数据支持。
