电化学法检测芴的细胞毒性
2021-12-07周实李锦莲李秀玲郭晓玲张树萌武冬梅
周实,李锦莲,李秀玲,郭晓玲,张树萌,武冬梅
佳木斯大学药学院,佳木斯 154007
芴被世界卫生组织和美国环境保护局列为多环芳烃(PAHs)类化合物大气暴露的评价指标,它是一种可被人体吸入的神经毒性物质[1],结构简单,仅由2个苯环及一个五元环组成,因其挥发性高,具有毒性,且空气中含量高,被美国环境保护局列为16种优先控制的PAHs之一[2]。芴主要来源于汽车尾气排放、秸秆燃烧、工业生产,是制备塑料、农药、树脂、染料和药品的重要工业原料[3]。近年由于环境污染,芴逐渐进入人类日常生活领域,甚至在人类的食品中也出现了芴的踪影,是食品中PAHs类污染物的主要来源。Essumang等[4]对烟熏鱼样品进行检测发现芴的检出率高达18%~52%;马运明等[5]在污水处理厂的入水和回用水中均检测出较高含量的芴。
研究表明,PAHs类化合物具有“三致效应”,长期接触PAHs会对人体造成不可逆的损害。近年来,体外试验[6]成为PAHs对环境和人类潜在风险评估的快速方法,常用的方法有染料排斥法、克隆形成实验、四唑盐比色法(MTT)和三磷酸腺苷(ATP)发光试验,然而这些方法难免需要使用有毒的染色剂、前处理复杂、检测范围有限,新兴的细胞电化学技术凭借其简单、快速、灵敏和可即时检测等优点成为了细胞活性评价的一个可靠方法。2015年,Zhu等[7]利用细胞电化学法评价重金属类和氯酚类污染物的毒性,发现通过细胞中嘌呤核苷酸代谢过程中嘌呤含量的变化,可以更早检测到外源物质对细胞的影响,而传统的MTT法是通过终点变化评价细胞活性的体外试验,只有在细胞发生死亡时才能检测到变化,细胞电化学法的灵敏度明显优于传统的MTT法。
笔者所在团队前期研究了V79和BALB/c 3T3这2种细胞的电化学行为及信号来源,其中黄/鸟嘌呤(G/X)的信号相比尿酸(UA)更明显[8]。因此,本文以黄/鸟嘌呤的电化学信号为定量依据,利用基于石墨烯量子点/玻碳电极(RGOQDs/GCE)的细胞电化学法研究了芴作用下2种细胞核苷酸代谢过程中黄/鸟嘌呤含量的变化,对比芴对2种细胞活性的影响,并与MTT法对比。本研究为PAHs的毒性评价提供了科学依据。
1 材料与方法(Materials and methods)
1.1 试剂与仪器
小鼠胚胎成纤维细胞(BALB/c 3T3)购自上海细胞库(中国);中国仓鼠肺细胞(V79)购自上海细胞库(中国);芴(Flu)购自中国Aladdin公司;黄嘌呤(X)购自美国Sigma公司;鸟嘌呤(G)购自美国Sigma公司;青霉素/链霉素混合溶液(penicillin-streptomycin solution)购自北京索莱宝科技有限公司(中国);胰蛋白酶(C6H15O12P3)购自北京索莱宝科技有限公司(中国);胎牛血清(FBS)购自上海双洳生物科技有限公司(中国);三蒸水为实验室自制;DMEM培养基(Dulbecco’s modified eagle medium)购自美国Gibco公司;非必需氨基酸(nonessential amino acid)购自北京索莱宝科技有限公司(中国);其他试剂均为分析纯。
恒电位仪(CHI 615,辰华仪器有限公司,中国);高效液相色谱仪系统(G1311Agilent 1100,安捷伦科技有限公司);酶联免疫检测仪(Multiskan FC,美国Bio Tek公司);微量移液器(P型,Eppendorf公司,德国);三重纯水蒸馏器(SZ-97,上海亚荣生化仪器厂,中国);二氧化碳恒温培养箱(311,美国Thermo公司);超洁净工作台(VS-1300U,苏州华宇净化设备有限公司,中国);玻碳电极(φ=5 mm)、Ag/AgCl/KClsat(R1000)、铂丝电极(1 mm×10 mm)均购自武汉高仕睿联科技有限公司(中国)。
1.2 细胞培养与收集
配制10%胎牛血清、1% 100 μg·mL-1青霉素/链霉素、1%非必需氨基酸的DMEM培养基,细胞在37 ℃、5% CO2培养箱中培养。采用原位细胞裂解法[9]进行电化学检测,每皿细胞的培养基吸去,磷酸盐缓冲溶液(PBS)冲洗培养皿一次,再加入一定量的PBS,于恒温水浴锅中50 ℃原位裂解30 min后进行电化学检测。
加药组细胞和对照组细胞分别在含芴和二甲基亚砜(DMSO)的完全培养基中培养,DMSO的含量低于0.1%。
1.3 MTT试验
将浓度为1×104cells·mL-1的细胞接种于96孔板,每孔200 μL,培养24 h后,加药组细胞加入含不同浓度芴的培养基,对照组加入含DMSO培养基,空白对照组只加入培养基。培养24 h后,每孔加入20 μL的MTT,培养4 h后弃去培养液,加入DMSO,测定490 nm波长下的吸光度值(A)[10-11]。
细胞毒性公式:
式中:Acontrol、Aexp、Ablank分别为对照组、加药组和空白对照组吸光度值。
1.4 电化学检测方法
利用RGOQDs/GCE工作电极、Ag/AgCl/KClsat和铂丝对电极组成的三电极体系,使用差分脉冲伏安法(DPV)进行电化学检测,电位范围0.4~0.9 V。
细胞毒性公式[11]:
式中:ip,control和ip,exp分别为对照组和加药组细胞裂解液的电流强度。
1.5 高效液相色谱(HPLC)检测
检测条件:Ascenis RP-Amide色谱柱(4.0 mm×1 250 mm×15.0 μm);检测波长254 nm;柱温25 ℃;流动相0.02 mol·L-1的KH2PO4溶液(pH 4.9);流动相流速1.0 mL·min-1;进样量20 μL。样品用0.22 μm微孔滤膜过滤后进样检测。
1.6 数据处理与分析
文中数据为5次测定结果的平均值±标准偏差。利用Origin 2018软件作图,SPSS 20.0软件处理数据。
2 结果(Results)
2.1 HPLC法确定BALB/c 3T3和V79细胞的电化学信号来源
利用HPLC外标法确定BALB/c 3T3和V79这2种细胞裂解液的电化学信号来源。UA、G和X标准品(图1 (a))的保留时间分别为8.707、13.730和15.210 min,与BALB/c 3T3细胞裂解液(图1(b))的保留时间8.755、13.937和15.357 min吻合,与V79细胞裂解液(图1(c))的保留时间8.788、13.962和15.382 min亦吻合,这说明BALB/c 3T3和V79这2种细胞中均含有UA、G和X这3种物质。
2.2 芴作用时间对BALB/c 3T3细胞的影响
通过考察不同作用时间下1 mmol·L-1芴对BALB/c 3T3细胞G/X氧化峰电流的影响,得到相应的时间-效应关系。图2(a)为加药组和对照组细胞的G/X氧化峰电流随作用时间变化图,加药组细胞的G/X氧化峰电流均低于对照组,可能芴的存在抑制了细胞中G/X的产生。加药组和对照组细胞的G/X氧化峰电流均随着培养时间的增加而增加,对照组细胞的G/X氧化峰电流培养至30 h后开始降低,可能是培养基中的营养物质消耗殆尽;加药组细胞的G/X氧化峰电流24 h后呈下降趋势,且加药组与对照组细胞的G/X氧化峰电流差值在30 h时最大。由加药组和对照组细胞的G/X氧化峰电流计算出芴在不同作用时间下的细胞毒性,如图2 (b)所示,随着芴作用时间的增加细胞毒性增强,在30 h处达到最大值,为最佳作用时间。

图1 不同样品的HPLC图注:(a) 35 μg·mL-1尿酸(UA)、10 μg·mL-1鸟嘌呤(G)和10 μg·mL-1黄嘌呤(X)混合标准样品;(b) BALB/c 3T3细胞裂解液, 细胞浓度4×106 cells·mL-1;(c) V79细胞裂解液,细胞浓度4×106 cells·mL-1。Fig. 1 HPLC chromatograms of different samplesNote: (a) the mixture of 35 μg·mL-1 uric acid (UA), 10 μg·mL-1 guanine (G) and 10 μg·mL-1 xanthine (X); (b) BALB/c 3T3 cell suspension, cell concentration 4×106 cells·mL-1; (c) V79 cell suspension, cell concentration 4×106 cells·mL-1.
2.3 芴作用剂量对BALB/c 3T3细胞的影响
通过考察不同剂量芴对BALB/c 3T3细胞G/X氧化峰电流的影响,得到相应的剂量-效应关系,并利用MTT法验证电化学法的准确性。图3(a)为不同剂量芴作用下BALB/c 3T3细胞G/X氧化峰电流的变化图,随着作用剂量的增加,BALB/c 3T3细胞的G/X氧化峰电流降低,说明随着细胞培养环境中芴剂量的增加,细胞的嘌呤核苷酸代谢被抑制,BALB/c 3T3细胞的G/X含量减少。由不同剂量芴作用下BALB/c 3T3细胞的G/X氧化峰电流变化得到对应的毒性曲线,半数抑制效应浓度(IC50)值为0.89 mmol·L-1。利用基于RGOQDs/GCE的细胞电化学法得到的毒性曲线与MTT法测得的毒性曲线趋势一致,如图3(b)所示,且电化学法测得的IC50值低于MTT法(1.34 mmol·L-1),说明该电化学法有望成为毒性评价的可靠方法。

图2 芴作用时间对加药组和对照组细胞氧化峰电流的影响(a)及与BALB/c 3T3细胞毒性的关系(b)注:嵌图为0、6、12、18、24、30和36 h对应的电化学曲线图,细胞接种浓度2.0×105 cells·mL-1。Fig. 2 Effect of culture time on cell oxidation peak currents in the drug group and control group (a) and relationship between fluorene action time and the cytotoxicity to BALB/c 3T3 cells (b) Note: The inset diagram is the corresponding electrochemical curve at 0, 6, 12, 18, 24, 30 and 36 h; cell inoculation concentration is 2.0×105 cells·mL-1.
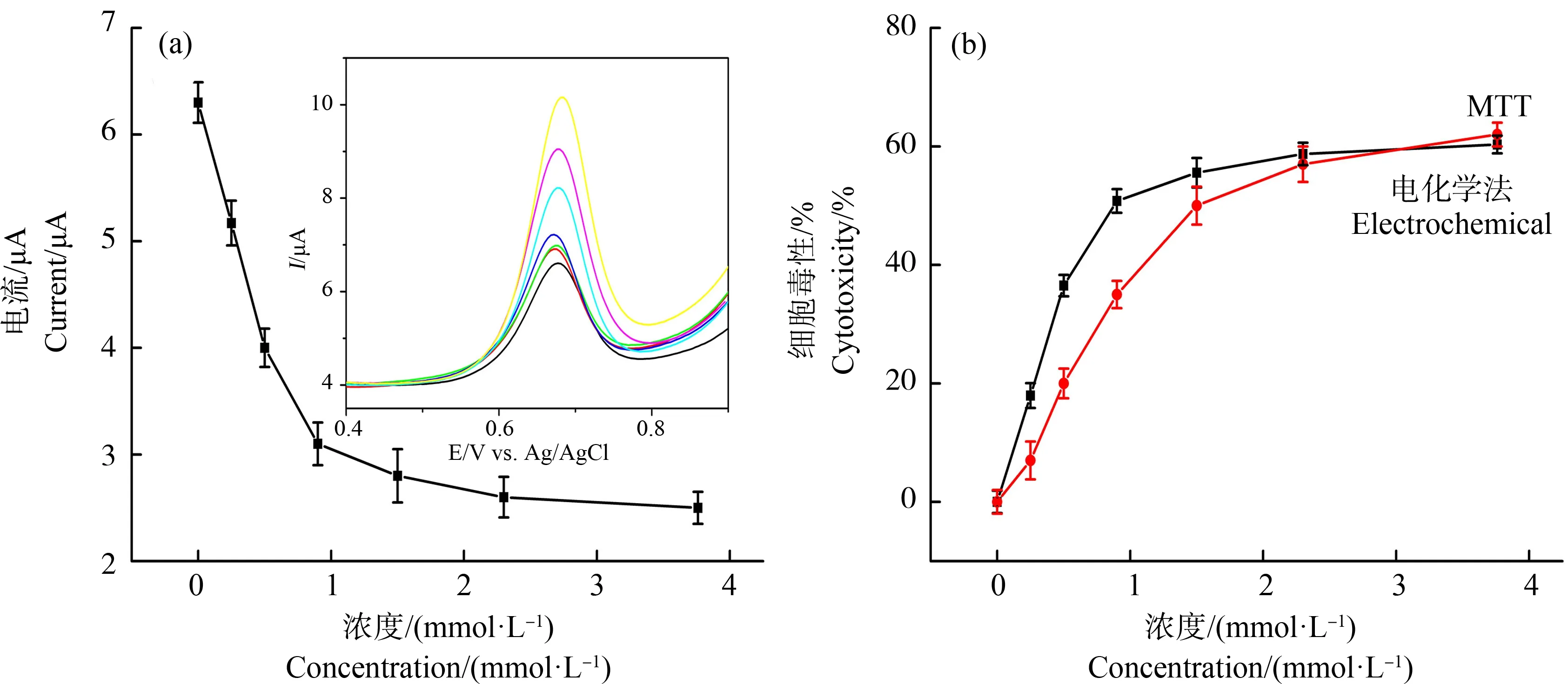
图3 不同剂量芴对BALB/c 3T3细胞的氧化峰电流的影响(a)以及电化学法和MTT法检测芴 对BALB/c 3T3细胞的毒性比较(b)注:嵌图为0~3.8 mmol·L-1芴作用下对应的电化学曲线图;细胞接种浓度2.0×105 cells·mL-1;芴作用时间30 h。Fig. 3 Effect of fluorene at different doses on the oxidation peak currents of BALB/c 3T3 cells (a), and cytotoxicity curves of fluorene acted on BALB/c 3T3 cells by the electrochemical method and MTT assay (b)Note: The inset diagram is the corresponding electrochemical curve at 0~3.8 mmol·L-1 concentration of fluorene; cell inoculation concentration is 2.0×105 cells·mL-1; fluorene-treated time is 30 h.
PAHs的细胞毒性并不强,在体外细胞实验中需要加入代谢活化系统,PAHs被细胞加氧酶分解生成的环氧化物、二酮等化合物的细胞毒性较强。顾祖维[12]利用微核试验对苯并[a]芘、黄曲霉毒素、联苯胺、3-甲基胆蒽和N-甲基-N’-硝基-N-亚硝基胍等致癌物的遗传毒性进行研究发现,BALB/c 3T3细胞不加入代谢活化系统,其自身就能代谢这些物质而显现出明显的遗传毒性。Colacci等[13]研究了3-甲基胆蒽和苯并[a]芘的对BALB/c 3T3 A31-1-1细胞的“三致效应”,发现不需要加入代谢活化系统,2种化合物就有较强的致癌作用。因此,对芴的BALB/c 3T3细胞毒性效应评价时,不仅考虑芴的作用,还要考虑芴在细胞中发生代谢后产物的毒性作用。
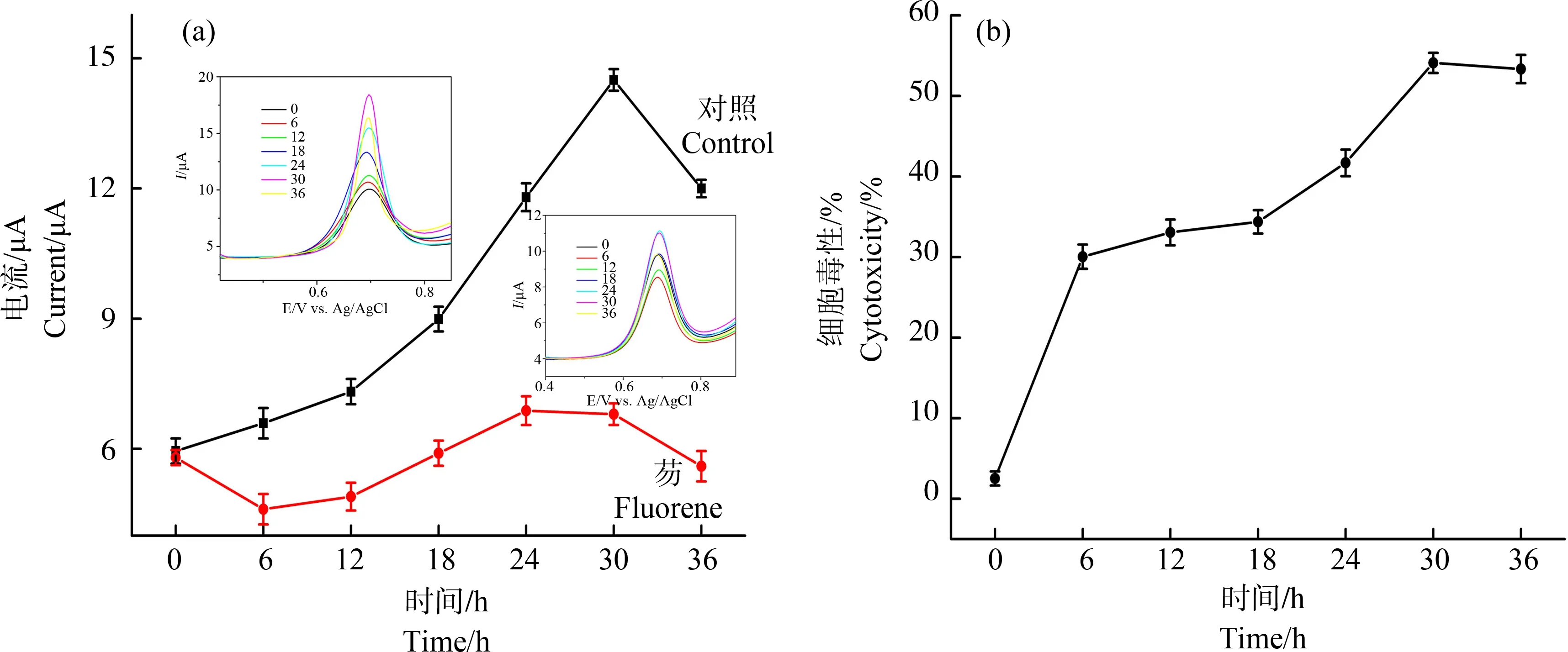
图4 芴作用时间对加药组和对照组细胞氧化峰电流的影响(a)及与V79细胞毒性的关系(b)注:嵌图为0、6、12、18、24、30和36 h对应的电化学曲线图,细胞接种浓度2.0×105 cells·mL-1。Fig. 4 Effect of culture time on cell oxidation peak currents in the drug group and control group (a) and relationship between fluorene action time and the cytotoxicity to V79 cells (b) Note: The inset diagram is the corresponding electrochemical curve at 0, 6, 12, 18, 24, 30 and 36 h; cell inoculation concentration is 2.0×105 cells·mL-1.

图5 不同剂量芴对V79细胞的氧化峰电流的影响(a)以及电化学法和MTT法检测芴对V79细胞的毒性比较(b)注:嵌图为0~1.5 mmol·L-1芴作用下对应的电化学曲线图;细胞接种浓度2.0×105 cells·mL-1;芴作用时间30 h。Fig. 5 Effect of fluorene at different doses on the oxidation peak currents of V79 cells (a), and cytotoxicity curves of fluorene acted on V79 cells by the electrochemical method and MTT assay (b)Note: The inset diagram is the corresponding electrochemical curve at 0~1.5 mmol·L-1 concentration of fluorene; cell inoculation concentration is 2.0×105 cells·mL-1; fluorene-treated time is 30 h.
2.4 芴作用时间对V79细胞的影响
考察不同作用时间下0.3 mmol·L-1芴对V79细胞G/X氧化峰电流的影响,进而得到相应的时间-效应关系。图4(a)为加药组和对照组细胞的G/X氧化峰电流随作用时间变化图,加药组细胞的G/X氧化峰电流均低于对照组,可能芴的存在抑制了细胞中G/X的产生。对照组细胞的G/X氧化峰电流随着培养时间的增加而增加,培养至30 h后开始降低,可能是培养基中的营养物质消耗殆尽;而加药组细胞的G/X氧化峰电流在初期呈下降趋势,6 h后随着培养时间的增加而增加,培养至30 h后开始降低,且加药组与对照组细胞的G/X氧化峰电流差值在30 h时最大。由加药组和对照组细胞的G/X氧化峰电流计算出芴在不同作用时间下的细胞毒性,如图4(b)所示,随着芴作用时间的增加细胞毒性增强,在30 h处达到最大值,为最佳作用时间。
2.5 芴作用剂量对V79细胞的影响
考察不同剂量芴对V79细胞G/X氧化峰电流的影响,并利用MTT法验证电化学法的准确性,得到芴的V79细胞剂量-效应关系。图5(a)为不同剂量芴作用下V79细胞G/X氧化峰电流的变化图,当芴的作用剂量为0.010 mmol·L-1时,细胞的G/X氧化峰电流明显下降,说明少量的芴便影响了细胞的嘌呤核苷酸代谢;随着芴作用剂量的增加,V79细胞的G/X氧化峰电流降低,说明随着细胞培养环境中芴剂量的增加,细胞的嘌呤核苷酸代谢被抑制,V79细胞的G/X含量减少。由不同剂量芴作用下V79细胞的G/X氧化峰电流变化得到对应的毒性曲线,IC50值为0.25 mmol·L-1。利用基于RGOQDs/GCE的细胞电化学法得到的毒性曲线与MTT法测得的毒性曲线趋势一致,如图5(b)所示,且电化学法测得的IC50值低于MTT法(0.86 mmol·L-1),说明电化学法的灵敏度高于MTT法。刘云岗等[14]在对青石棉的细胞毒性研究中发现,青石棉对V79细胞的毒性要强于BALB/c-3T3细胞。由于不同类型细胞的代谢途径不同,使得芴作用下2种细胞的IC50值有一定的差异,芴对V79细胞毒性的IC50值更小,说明芴对V79细胞的毒性更强。
3 讨论(Discussion)
本文研究了芴对BALB/c 3T3和V79这2种细胞毒性的时间-效应和剂量-效应,利用基于RGOQDs/GCE的细胞电化学法测得的IC50值为0.89 mmol·L-1和0.25 mmol·L-1,MTT法测得的IC50值为1.34 mmol·L-1和0.86 mmol·L-1。2种方法测得的BALB/c 3T3细胞的IC50值均大于V79细胞的IC50值,说明芴对V79细胞的毒性更强;电化学法测得的IC50值要小于MTT法测得的IC50值,说明电化学法的灵敏度要更高一些。p53基因具有基因调节作用并参与DNA修复、细胞周期阻滞、凋亡等,而具有基因毒性的PAHs类物质会激活细胞中的p53基因进而影响细胞周期。Chramostová等[15]通过研究PAHs对不同细胞的影响发现,由于细胞类型不同,在G1期阻滞、S期延长或细胞凋亡等方面有一定差异,所示不同细胞在代谢产物上也不同。
