十溴联苯醚(BDE 209)暴露对孕期大鼠和胎鼠甲状腺激素干扰效应研究
2021-12-07程莹李思思刘晓晖李亚晨邵静胡宏
程莹,李思思,刘晓晖,李亚晨,邵静,胡宏
1. 大连医科大学公共卫生学院,劳动卫生与环境卫生教研室,大连 116044 2. 大连医科大学附属第二医院检验科,大连 116027 3. 大连医科大学中山学院,大连 116085
阻燃剂是一类能够阻止聚合物材料引燃或抑制火焰传播的助剂,其种类繁多,但以溴系有机阻燃剂、尤其以多溴联苯醚(polybrominated diphenyl ethers, PBDEs)最具代表性。PBDEs与其产品以非共价方式结合,在使用及处理回收时,可通过挥发、燃烧或与空气污染物形成复合颗粒物等方式存在于环境中,并随环境介质远距离迁移,导致全球性环境污染[1]。目前育龄妇女的脂肪、血液、胎盘,哺乳期乳汁,以及胚胎肝脏和新生儿脐血中均已检出PBDEs多种同系物的存在;特别是胎盘PBDEs负荷远高于胚胎肝脏,且逐年增高,成为仅次于母血的PBDEs积攒地[2-5]。这提示PBDEs对胚胎发育可能产生潜在危害,日后发展为婴幼儿、儿童甚至是成人疾病的基础。
动物研究显示,PBDEs具有发育神经毒性[6],尽管目前人群流行病学调查证据有限,但仍显示出孕期PBDEs暴露与出生儿童的神经发育动作和智力障碍具有相关性[7-10]。当前,针对PBDEs发育神经毒性研究已得到相当规模的开展,结果也颇为一致,然而其毒作用机制仍需进一步探讨。孕期PBDEs暴露对子代也具有甲状腺激素(thyroid hormone, TH)干扰效应,结局表现为类似临床或亚临床甲状腺功能减退(甲减)[11]。而妊娠早期,即胎脑发生、发育的关键期,甲减会导致子代出现不可逆的脑损伤,表现为智力缺陷、活跃、认知障碍和适应能力下降等[12-13],这与孕期PBDEs暴露导致的子代神经发育毒性效应颇为相似。因此,有观点认为PBDEs发育神经毒性可能由TH干扰(甲减)所致,无疑为PBDEs发育神经毒性机制研究提出一个重要探索方向。
十溴联苯醚(BDE 209)是PBDEs家族中含溴原子数量最多的同系物,由于其阻燃效率高、添加量较少及急性毒性相对低等特点而应用最广[14]。我国BDE209污染情况较为严重[15]。且2015年的一项研究显示,BDE 209是我国松花江流域地表沉积物中PBDEs的主要同系物,占PBDEs总量的80%以上[16],提示其存在潜在危害。针对BDE 209孕期暴露对子代TH的干扰研究目前尚不深入,还需进一步研究。
目前对于PBDEs诱导的TH干扰效应已经在多种生物体系(细胞、动物甚至人)中得到证实[17-19]。然而,迄今多数研究是通过对出生时或出生后子代血循环TH水平的检测进行推论,我们尚未发现PBDEs对孕早期胚胎TH干扰表型的直接研究。而孕早期胚胎在TH来源和调节机制上具有特殊性,出生后结果并不能反映孕早期TH真实状态。而BDE 209对于出生后子代发育神经损伤效应,本课题组前期研究已发现三代小鼠BDE 209染毒能够影响子代发育,降低子代空间学习记忆能力和空间位置记忆能力;本课题组也曾评价孕中期女性羊水PBDEs水平及其与TH干扰的潜在关系,但尚未建立完整出生队列以确定对出生子代的发育损伤[20]。因此,本研究以大鼠为研究对象,建立大鼠孕期BDE 209暴露模型,着重观察BDE 209对孕早期大鼠胚胎和胎脑TH干扰表型,并检测胎脑组织形态学改变,为深入研究BDE 209的TH干扰效应提供基础依据,并为进一步探索孕期BDE 209暴露诱导的TH干扰效应与其发育神经毒性的内在联系提供研究基础。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:T100TM Thermal Cycler梯度PCR仪(Bio-RAD,美国);TP800实时PCR仪(TaKaRa,日本);3550酶标仪(Thermo,美国)。
试剂:BDE 209(纯度>99%,上海阿拉丁试剂公司,中国),Evo M-MLV RT Kit with gDNA Clean for qPCR(湖南艾科瑞生物工程有限公司,中国);RNAiso Plus、SYBR qPCR Master Mix(南京诺唯赞生物技术有限公司,中国);大鼠三碘甲状腺原氨酸(TT3)、总甲状腺激素(TT4)、游离甲状腺素(FT3)、游离甲状腺素(FT4)和促甲状腺素(TSH)免疫试剂盒(上海朗顿生物科技有限公司,中国);其他试剂均为分析纯,购于中国天津科密欧化学试剂有限公司。
1.2 方法
1.2.1 BDE 209孕期染毒大鼠模型建立及生物材料采集
(1)动物模型建立:实验动物均在大连医科大学重大疾病基因工程模式动物研究所维护及喂养。10周龄Wistar雌性大鼠24只,称取体质量后排序,按照随机数字表法随机分为3组(对照组、低剂量和高剂量组,每组8只),不同剂量组间母鼠体质量差异无显著性(P>0.05)。选择阶段合笼法与10周龄Wistar雄鼠按照雌∶雄=2∶1合笼交配,次日清晨检查阴道涂片,发现精子则记为妊娠第0天(GD0)。避光称取一定量BDE 209粉末溶于花生油中,涡旋摇匀。根据孕鼠体质量,按分组剂量染毒如下:对照组(花生油)、低剂量组(100 mg·kg-1bw)、高剂量组(300 mg·kg-1bw)[15]。染毒采用每天避光灌胃一次,最长至GD20(仔鼠出生前一天)。所有动物均自由进食、饮水;室内温度20~25 ℃、湿度40%~70%、光照按亮/暗12 h循环。
(2)生物样品采集:在GD15和GD20这2个时间点,4%水合氯醛麻醉母鼠,剖开子宫,小心吸取羊水(作为一个独立样本)至无菌管并放入液氮中速冻,标记后转入-80 ℃冰箱保存,用于羊水TH水平测定;记录每窝胚胎大鼠体质量;GD20胎鼠每窝断头后取血(作为一个独立样本),室温静置10 min后,2 500 r·min-1离心20 min,吸取上层血清,标记后转入-80 ℃冰箱保存,用于GD20胎鼠血清中TH水平测定;采集GD15和GD20胎脑组织,用于检测胎脑下丘脑-垂体-甲状腺素轴(hypothalamic-pituitary-thyroxine axis,HPT轴)功能变化;采集GD20胎脑,浸泡于4%多聚甲醛溶液中24 h,隔日换液,用作孕后期胎脑形态学检测。
1.2.2 RT-qPCR
本研究通过检测不同胚胎发育时期胚胎大鼠脑组织促甲状腺激素释放激素(thyrotropin-releasing hormone, Trh)的表达,观察孕期BDE 209暴露对胎脑HPT轴功能的影响,初步分析其在胎鼠循环和干扰胎脑组织TH中的作用。
(1)总RNA提取及质量控制:取出适量-80 ℃冻存组织,用500~1 000 mg·mL-1Trizol将称量质量后的组织置于4 mL无菌管中,高速研磨20 s。冰上静置10 min后转移至1.5 mL离心管中,4 ℃、2 500 r·min-1离心5 min。吸取上清至新的1.5 mL离心管中置于冰上。按照RNAiso Plus试剂盒(南京诺维赞公司,中国)说明书,提取总RNA,通过紫外吸收值A260/280进行质量控制。A260/280比值在1.8~2.0之间时,可进行后续实验。
(2)RNA反转录:按照Evo M-MLV RT Kit with gDNA Clean for qPCR试剂盒说明书常规操作,将总RNA反转录为cDNA,反转录条件为37 ℃ 15 min,85 ℃ 5 s,4 ℃ ∞。
(3)引物设计和合成:大鼠来源GAPDH和Trh引物系委托大连万泽贸易有限公司设计合成。名称和序列详见表1。
(4)PCR反应:根据SYBR qPCR Master Mix试剂盒配制20 μL体系上机反应。反应条件为预变性95 ℃ 30 s,95 ℃ 5 s、60 ℃ 30 s,共40个循环,95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。
(5)结果分析:应用TP800 v4.01软件,以GAPDH表达量对mRNA表达进行标准化。实验重复3次以上。
1.2.3 ELISA
从-80 ℃冰箱中取出组织样品,2 500 r·min-1离心20 min,上清转移至新1.5 mL离心管中,组别中上样量不足时吸取各组最低量后加入同等量三蒸水补齐。由4 ℃冰箱中取出试剂盒,置于室温平衡30 min以上。按照试剂盒说明书操作。在450 nm波长处测定各孔的OD值。根据标准品浓度及各孔OD值绘制标准曲线,将各样品孔OD值带入公式,计算样品浓度。实验重复3次。

表1 大鼠mRNA表达引物序列Table 1 Primer sequences for mRNA expression in fetal rats
1.2.4 HE染色
将固定好的GD20胎鼠脑组织取出后放入包埋盒中,按照分组情况以序号标记。从低浓度酒精(40%)开始向高浓度酒精依次脱水,再将其依次置于二甲苯Ⅰ、二甲苯Ⅱ中透明。将已透明的组织块用镊子小心夹取,大脑皮层朝上置于已溶化好的石蜡中,放入冷却箱中冷却。待石蜡完全凝固取下组织蜡块,固定在切片机载物台上,切片的厚度为3 μm。将切好的蜡片置于50 ℃温水中,待蜡片平展后,用防脱载玻片捞出,70 ℃烤箱烤片,干燥后可置于37 ℃恒温箱备用。染色时经二甲苯逐级脱蜡过酒精后清洗,经苏木素、伊红染色,逐级酒精脱水,用中性树胶封片,干燥后盖片,在光学显微镜下观察。
1.3 统计分析
本实验所有数据均来源于至少3次独立实验,所有结果以“均值±标准差”表示,统计分析软件为SPSS 13.0,统计分析方法采用方差分析(ANOVO)检验。按检验水准α=0.05,P<0.05差异有统计学意义。
2 结果(Results)
2.1 孕期BDE 209暴露对胚胎大鼠生长发育状况的影响
大鼠2月龄时性成熟,妊娠期(GD)通常为19~22 d。GD15为胎鼠甲状腺功能完全建立之前,GD20时胎鼠甲状腺功能基本达到高峰[21-22]。因此,本实验选取GD15和GD20这2个时间点进行相关生物样品采集和检测。由表2可知,GD15低剂量组胎鼠体质量与对照组差异不明显,高剂量组胎鼠体质量与对照组相比明显升高(P<0.01);GD20低剂量组胎鼠体质量相比对照组亦有下降趋势,但无统计学意义(P>0.05),高剂量组体质量则显著低于对照组(P<0.01)。
2.2 孕期BDE 209暴露对羊水和胎鼠血清TH水平的影响
在GD15和GD20采集孕鼠子宫羊水,并在GD20剥离胎鼠,断头取血。GD15仔鼠胚胎由于个体较小,无法采集其血液,故仅收集GD20胎鼠外周血液。对羊水和外周血TH的评价指标包括TT3、FT3、TT4、FT4和TSH。
2.2.1 孕期BDE 209暴露对GD15羊水TH的影响
如表3所示,GD15羊水中TT3含量有升高趋势,尤其低剂量组,但未见显著性差异;而FT3含量在低、高剂量组均有下降趋势,但与对照组无显著性差异。TT4和FT4含量在低、高剂量组均有升高趋势,尤其FT4差异具有统计学意义(P<0.05或P<0.01)。TSH在高剂量组水平上升,与对照组之间未见统计学差异。
2.2.2 孕期BDE 209暴露对GD20羊水和胚胎大鼠外周血TH的影响
GD20羊水TH水平由表4所示,BDE 209低剂量组TT3水平有增高趋势,但未见显著差异;FT3水平在BDE 209低、高剂量组均出现降低,且具有统计学意义(P<0.05)。TT4水平则与GD15时相反,与对照组相比略有下降趋势,但无统计学意义;FT4水平与GD15的表现一致,有上升趋势,在高剂量组有明显差异(P<0.05);而TSH水平明显增高,在低剂量组和高剂量组均有统计学意义(P<0.05)。
GD20胚胎大鼠外周血TH水平如表5所示,TT3水平在低剂量组虽然有所降低,但与对照组相比无显著差异;FT3水平与同时期羊水中的变化趋势一致(表4),具有下降趋势,尤其在低剂量时,但未见统计学意义。TT4和FT4具有下降趋势,但未见统计学意义。TSH水平逐渐升高,高剂量组具有统计学意义(P<0.05),这与同时期羊水中的情况类似。

表2 大鼠孕期BDE 209暴露对胚胎大鼠体质量的影响Table 2 Effect of BDE 209 exposure during pregnancy on the body mass of fetal rats
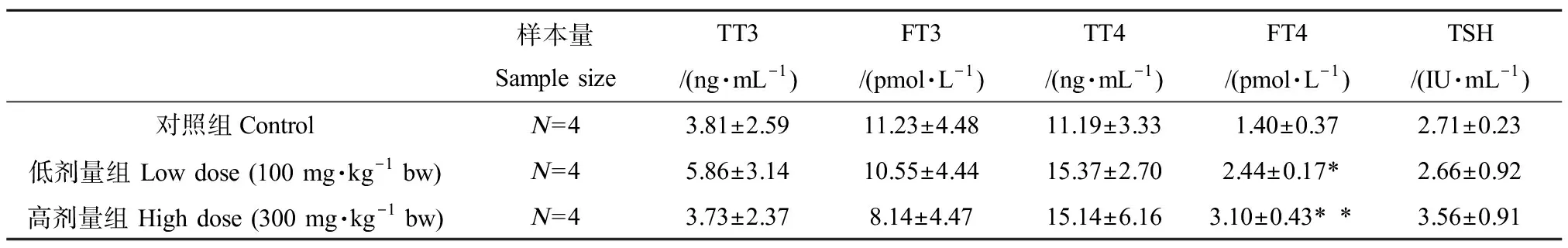
表3 大鼠孕期BDE 209暴露对GD15羊水甲状腺激素(TH)的影响Table 3 Effect of BDE 209 exposure during pregnancy on the amniotic fluid thyroid hormone (TH) level on GD15

表4 大鼠孕期BDE 209暴露对GD20羊水TH的影响Table 4 Effect of BDE 209 exposure during pregnancy on the amniotic fluid TH level on GD20
2.3 孕期BDE 209暴露对胚胎大鼠脑组织Trh基因表达的影响
通过观察孕期BDE 209暴露对不同胚胎发育时期胎脑Trh表达的影响,初步分析HPT轴功能损伤在PBDEs致胎鼠循环和胎脑组织TH干扰的可能作用。
GD15和GD20胎脑Trh基因表达如图1所示,正常胎脑(对照组)在孕期不同时期Trh基因表达相对稳定(表6);BDE 209孕期暴露可显著抑制胎脑Trh表达,且随着孕期进程,对Trh抑制程度加深。低剂量组TrhmRNA水平在GD15时是对照组的68.85%(P<0.05),在GD20时是对照组的57.53%(P<0.05);高剂量组TrhmRNA水平在GD15时是对照组的79.44%,在GD20时是对照组的62.17%(P<0.05)。这提示,孕期BDE 209持续暴露对Trh具有进行性抑制作用(表7)。
2.4 孕期BDE 209暴露对胚胎大鼠脑组织形态学的影响
由于GD15胎鼠胎脑较小且含水量较多,受HE染色时脱水等可操作条件的限制,检测GD15胎鼠脑组织发育形态学改变较为困难。因此,只选择GD20胎脑观察。如图2所示,对照组胎脑细胞较为完整,细胞形态正常,未见明显病理性改变。低剂量组胎脑与对照组相比也未见明显形态学改变。高剂量组胎脑与对照组相比,出现局域性脑细胞排列明显稀疏、核固缩和细胞间隙增大现象。可见,孕期BDE 209可引起胎鼠脑组织病理损伤,使孕末期胎鼠脑细胞结构发生变化,细胞数量减少,脑组织出现萎缩,可能影响后代学习和记忆能力。

图1 大鼠孕期BDE 209暴露对GD15和GD20 大鼠胎脑Trh mRNA表达的影响注:*P<0.05,与对照组相比。Fig. 1 Effect of BDE 209 exposure during pregnancy on the Trh mRNA expression in fetal brain on GD15 and GD20Note: *means P<0.05 compared with the control.

表5 大鼠孕期BDE 209暴露对GD20胚胎大鼠血清TH的影响Table 5 Effect of BDE 209 exposure during pregnancy on the serum TH level of fetal rats on GD20

表6 对照组胚胎大鼠脑组织Trh基因表达Table 6 Trh gene expression in the brain of control fetal rats

表7 大鼠孕期BDE 209暴露对胚胎大鼠脑组织Trh基因表达的影响Table 7 Effect of BDE 209 exposure during pregnancy on Trh gene expression in the fetal rat brain

图2 大鼠孕期BDE 209暴露对GD20胎脑发育形态学影响注:C对照组;L低剂量组(100 mg·kg-1 bw);H高剂量组 (300 mg·kg-1 bw);放大倍数100倍和200倍。Fig. 2 Representative morphological changes induced by BDE 209 exposure during pregnancy on GD20 fetal rat brainsNote: C represents control; L represents low dose group (100 mg·kg-1 bw); H represents high dose group (300 mg·kg-1 bw); magnifications is 100 or 200.
3 讨论(Discussion)
TH可调节大脑皮层海马区的胆碱能和多巴胺能系统的发育,对于促进机体正常新陈代谢,维持机体骨骼和神经系统的生长发育具有重要意义。而在孕早期(即胎脑发生发育关键期),TH对胎脑发育和成熟起着关键作用。大量研究显示,PBDEs具有TH干扰毒性效应,如损伤甲状腺形态、改变TH水平、高亲和力结合TH转运蛋白拮抗TH等[23-24]。而甲状腺功能的微小改变就可能对人体健康,特别是神经系统发育产生影响。
目前有关孕期PBDEs暴露对胎鼠TH干扰的评价,多是通过对出生子鼠循环TH水平的检测结果进行间接/回顾性推测[17,25],直接研究尚未见报道。有研究认为,羊水TH水平与脐血激素水平有一定的相关性,反映了胎儿TH的代谢,而与孕妇血激素浓度相关性不强。因此,羊水TH可能是反映胎儿甲状腺功能的较好指标[26]。在本实验中,孕早期(GD15)BDE 209暴露可导致羊水FT4显著升高,并有一定的剂量-效应关系,同时TT4水平也有升高的趋势,尽管与对照相比没有显著差异。这提示,BDE 209暴露可导致孕早期胚胎处于高TH状态(类T4甲亢)。而在孕末期(GD20),羊水FT4水平回降至与对照相比差别不大,虽然在高剂量组仍有显著升高;FT3水平在低、高剂量组均出现显著降低;TSH水平显著升高,这表明胎脑垂体对胚胎循环TH水平变化的抵抗。GD20胎鼠血清循环TH水平总体变化趋势与同时期羊水TH动态变化基本一致,TSH水平升高,孕末期羊水FT3水平明显降低,且在GD20胎鼠血清中也显著下降,可能由于BDE 209损伤中枢HPT轴,导致胎鼠甲状腺T3生成不足所致。结果提示,孕末期胎鼠可能处于中枢性甲状腺功能减退状态。文献报道,孕期BDE 209暴露(300 mg·kg-1bw)可导致出生子鼠出生后20 d(PND20)血清T3水平下降,TSH水平升高[27],这与本研究结果基本一致。孕早期胚胎在TH来源和调节机制上具有特殊性。在来源方面,孕(早)期胚胎甲状腺功能尚未建立完全,其主要依赖于母体循环TH;在调节机制方面,来自母体的高浓度TH需要胎盘脱碘酶3(Dio3)调节,将细胞外T3和T4灭活,以保证胎儿TH处于最佳生理水平[28]。我们在前期研究中发现,PBDEs可诱导小鼠胎盘Dio3表达下调,并可能与其发育神经毒性效应有关[11]。结合PBDEs在胎盘蓄积程度,我们推测,PBDEs可能通过抑制胎盘Dio3活性,干扰胚胎TH。而TH对胚胎发育过程和结局起关键作用,无论甲亢或甲减均可导致胚胎发育损害。在本实验中,BDE 209孕期高剂量暴露可导致GD15胎鼠体质量升高,而GD20胎鼠体质量降低,这可能因为BDE 209对孕早、晚期胚胎TH的干扰表型存在差异,同时可能也与BDE 209或其代谢产物在胎鼠体内持续蓄积有关,导致不同发育窗口对生长发育影响的结局不同。
胎儿下丘脑在其自身HPT轴发育、成熟的过程中发挥重要的作用,且在孕晚期,胎脑HPT轴发育基本成熟,对胚胎循环和胎脑TH调节也有重要作用[29]。因此,本研究通过检测不同时期胎脑促甲状腺激素释放激素(Trh)的表达,观察孕期BDE 209暴露对胎脑HPT轴功能的影响,分析其在胎鼠循环和胎脑组织TH干扰中的作用。研究结果显示,孕早期BDE 209暴露导致胎脑(GD15)Trh的表达显著下调,表明在孕早期胎鼠下丘脑功能已受损。在孕末期,胎鼠本身HPT轴的功能基本成熟,TH主要来自其自身甲状腺的分泌,循环TH水平可能取决于BDE209对中枢HPT轴功能的损伤程度。如果HPT轴功能失调,可能影响下丘脑Trh的生成和释放,抑制垂体对Trh的反应或TSH活性成熟过程,导致T3、T4生成不足而在血循环的水平下降,而TSH水平可能出现下降、不变或上升,这与Trh或Trh受体基因敲除小鼠的实验结果相似[30],也与上述孕末期羊水和胎鼠血清中的TH干扰的表型基本一致。
除了前述一系列功能指标,BDE 209对胎鼠脑组织形态学的改变,是评价其毒性效应不可或缺的指标。目前,针对PBDEs的TH干扰及发育神经毒性研究多数通过对出生子代神经行为、认知能力和学习记忆等损伤效应进行探讨,涉及体内胎脑的病理变化和分子通路的研究较少。本研究通过观察GD20胎鼠胎脑形态学的改变,发现孕期BDE 209暴露可引起孕后期胎鼠脑细胞结构发生变化,细胞数量减少,脑组织出现萎缩,从而影响出生子代神经行为、学习和记忆能力。日后,可对胎脑各功能区域细致分区,并检测胚胎脑组织TH信号传导分子表达,进一步探讨孕期BDE 209暴露对于后代的毒性效应。
目前对于PBDEs毒性作用研究还较为独立,而神经发育缺陷的重要机制之一即为TH水平不平衡,这提示,PBDEs诱导的TH干扰与发育神经毒性之间可能存在内在关联。孕期是生命的初始,与生命质量关系密切。因此,深入研究PBDEs毒性效应的内在联系,找出特异性作用靶点即生物标志物,对防治PBDEs造成的早期健康损害具有深远意义,是目前急需重视的研究方向。
