探索化学元素核外电子排布规律
2021-12-04方瑞士
方瑞士
芜湖市第四人民医院 安徽 芜湖 241002
1 引言
原子与原子之间究竟以什么方式构成分子?首先要解决的是电子在原子核外是以什么方式进行运动?为了解决这个问题,人们企图通过数学运算来达到这一目的,并且以波动方程式算出氢原子核外不同能级的电子在核外空间出现的几率密度,再把出现几率密度最高的部分所呈现的形态当作该能级电子的电子云形态。如氢的1S电子云是球形,2P电子云是双球形,3d电子云是四瓣梅花形等。但是,在多电子的原子中,由于电子之间相互影响,使计算变得异常繁杂而无从下手。于是,人们干脆把已经计算出来的氢的不同能级的电子云形态机械地搬到多电子原子中去,并以此去解释有机化学中的各种分子结构。须知,恰恰是这种机械思维方式,忽略了电子与电子之间最重要、最直接的相斥作用,阻碍了化学分子结构理论的发展.
化学理论落后于实践,这是公认的事实。无机化学中的电子配对成键,这种假说违反了电子绕核运动规则;有机化学中的电子云重叠成键,这种假说违反了电子相斥原理。另外,碳原子在无机化学中以电子配对成键,在有机化学中,又说它是以电子云重叠成键,相互矛盾,不能自圆其说。所以,它们都不可能真正解决分子结构问题。
原子波环结构中的环套环成键既不违反电子绕核运动规则,也不违反电子相斥原理。所以,它能完美地解释各种分子结构和化学反应。本文对化学元素核外电子的运动状态及分子成键的机理进行深入探索。并且,按照斥力最小原理,推导出化学元素核外电子的排布规则。
2 氢原子核外电子运动状态分析
日常生活中,当一个红色质点作快速圆周运动时,我们看到一个红色圆环。所以,在氢原子中,当单个电子超速绕核旋转时,由于电子轨道的角度和方向不断变化,在核外形成无数环。同时,因为电子具有波的特性,所以,这些环的大小、形态也不断变化。总之,无论它形成多少环,无论它的大小形态如何变化,皆由一环演变而来。在无数波环之间相互交叉重叠的密集区便是现代化学中所说的电子云。如,氢的1s,2p,3d电子云
当单个电子在同一个平面内,同一个能量层中高速进行无数次绕核运动时形成无数环,无数环相互叠加所展现的结果是一个致密的电子环,而绝不是什么球形、双球形之类。所以那种把氢的1S,2p,3d电子云形态简单的机械地搬到多电子原子中去的做法是极其错误的,氢的1s,2p,3d电子云只能在孤立的氢原子中存在。
3 多电子原子核外电子运动状态分析
在多电子原子中,电子如何运动呢?同一能级的两个电子在相互贴近且相互平行的两个平面内进行绕核运动时所产生的斥力最大,而在相互垂直相交的两个平面内绕核运动所产生的斥力最小。所以,按照斥力最小原理,氦原子核外的两个电子是在垂直相交的两个平面内进行绕核运动。
核磁共振的成功实现已经证明在化合物中的氢原子是一个小磁体,或者说,在氢核的周围是一个环形电子流,而不是球形电子云。因为电子具有波的特性,所以我们把这种环形电子流叫做电子波环,或简称为波环。当有3,4,5,6,7,8个电子波环相交时,为保持各波环之间斥力相等,每两个相邻波环之间的夹角分别为60、45、36、30、2⒌7、22。5度。
“路易斯结构”的八偶律与原子直径大小无关,与电子之间的角度有关。这里,已经披露原子波环结构的存在,换句话说,每两个相邻波环之间的角度不小于22。50.
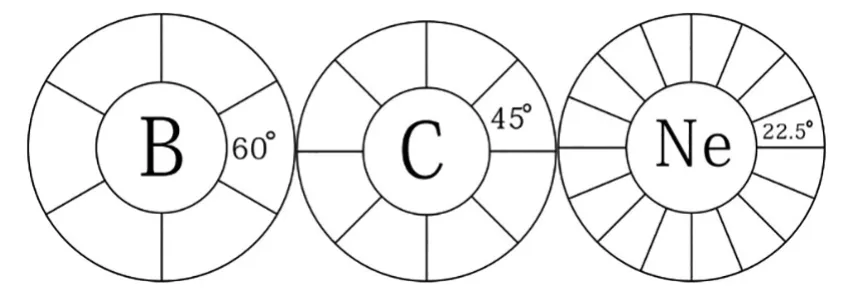
硼 碳 氖
上面的分析表明,在多电子原子中,它的电子云也是环形,而不是球形和哑铃形。也就是说,其电子也以波环的形式存在。关于共价键化合物的成键,首先,以氢原子为例,当两个氢原子结合成分子时,无数波环与无数波环之间发生交锁形成一个稳固的分子,即环套环成键 。相互交锁后,波环的运动范围受到限制,氢的电子云已不是球形。若一环不动,另一环只能绕该环运动。换言之,两波环相交锁,两个半球壳之间的波环运动几率密度增加。但是,它与电子云重叠成键在本质上是不同的。
4 共价键和离子键的波环结构式
4.1 氢分子的波环结构式
为了描述的方便,将无数环简化为一环,用符号“-R-”或“R-”代表波环,“R”代表元素。用符号“×”代表波环交锁(环套环),即共价键。用符号“R→”代表波环嵌入(离子键)。氢分子波环结构式展示如下:
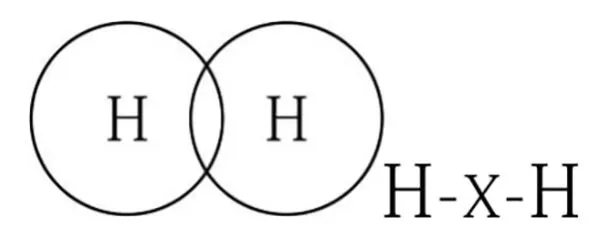
氢简化式 氢分子式
4.2 碳、甲烷和甲醇的波环结构式,(省去碳的符号”c”.)
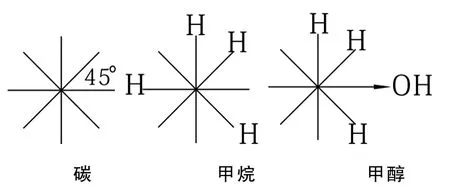
4.3 甲烷波环结构式分析
分析甲烷的正四面体结构。甲烷由一个碳原子和四个氢原子交锁而成,我们知道,碳原子外层有4个电子,即4
个电子波环。按照波环之间斥力均衡的原则,碳的4个波环将球壳分为8等份,相邻波环之间的夹角为450。因为是4个波环,所以,碳原子本身不能形成正四面体结构.当碳原子与4
个氢原子相交锁时,4
个氢原子之间为了保持斥力相等,必须保持距离相等.。另一方面,它们各自与碳核之间的距离也是相等的。换言之,4个氢原子波环与碳原子交锁时,既要保持相互之间的距离相等,也要保持与碳核之间的距离相等,为满足这些条件,它们与碳原子锁定的位置只能是正四面体的4个顶点。
4.4 苯波环结构式分析
关于苯分子的稳定结构,用波环结构式也能作出令人满意的解释。苯由6个碳原子和6个氢原子相交锁而成。每个碳原子只有1个波环与氢相交锁,剩下3个波环则碳碳相互交锁成环。
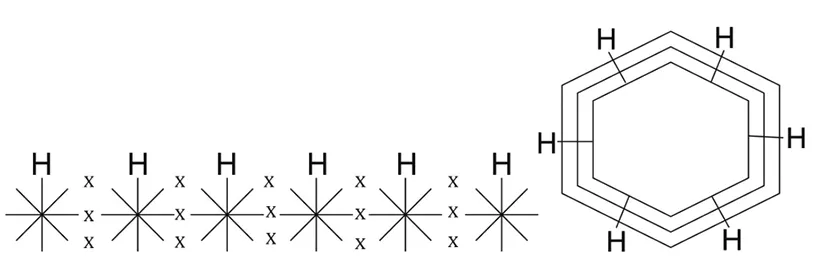
苯波环断成直链型 苯波环分子式
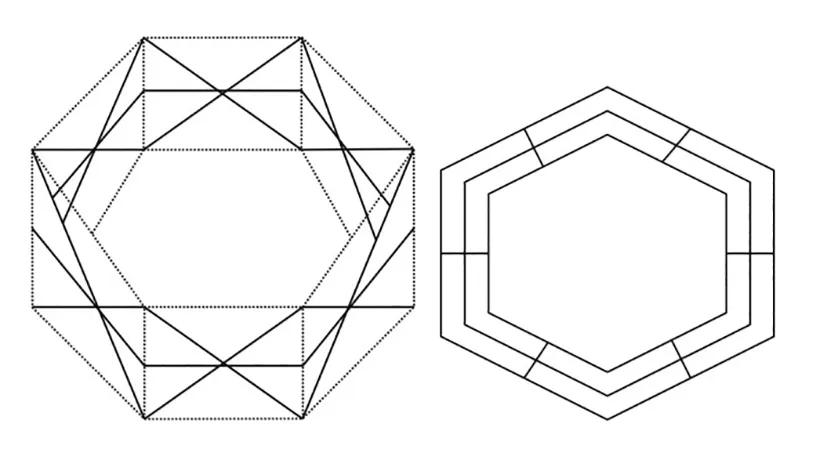
苯波环交锁框架 苯的简化式
在苯环中,碳原子位于6边形各边的中央,并不位于6个角的顶点。碳碳之间各以3个波环相互交锁,并不存在单键与双键。而且,这3个波环的两端都与相邻碳原子相交锁,所以,苯环是非常稳定的,不易被断开。
5 按照斥力最小原理,推理分析化学元素ZXY轴电子排布规则
5.1 原子波环结构的Z轴
氦原子的两个波环垂直相交,它的两个相交点便构成了氦原子的两极,即z轴.
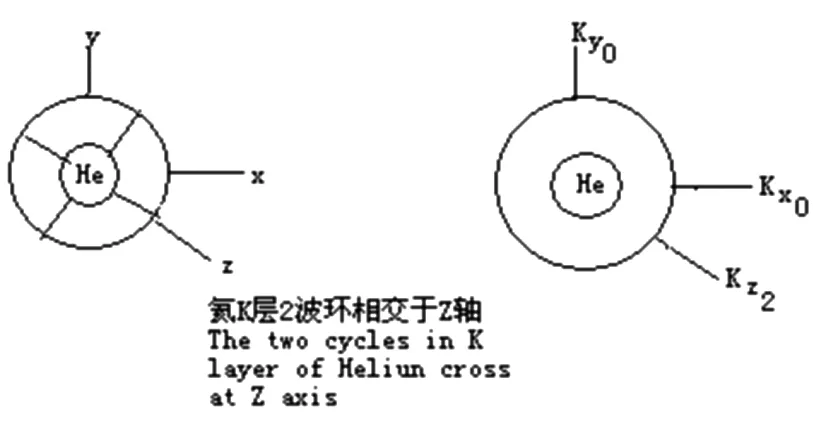
5.2 原子波环结构的X轴
对于氖原子来说,它内层的两个波环也是垂直相交的,也有它的两极,而它外层的8个波环也相交于两极。显然,按照斥力最小原理,内层波环的两极不能与外层8个波环的两极相重叠,假设内层2个波环相交于Z轴,那么,外层的8个波环只能相交于X轴
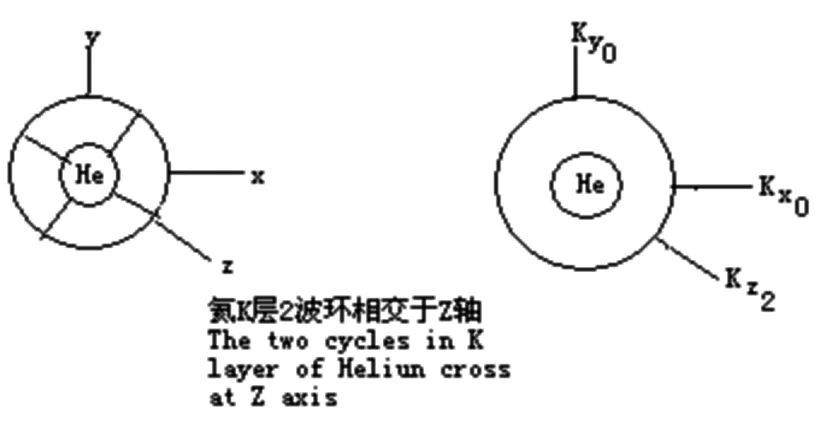
5.3 原子波环结构的Y轴
氩原子位于第三周期,多一个M层,M层的8个波环只能相交于Y轴。
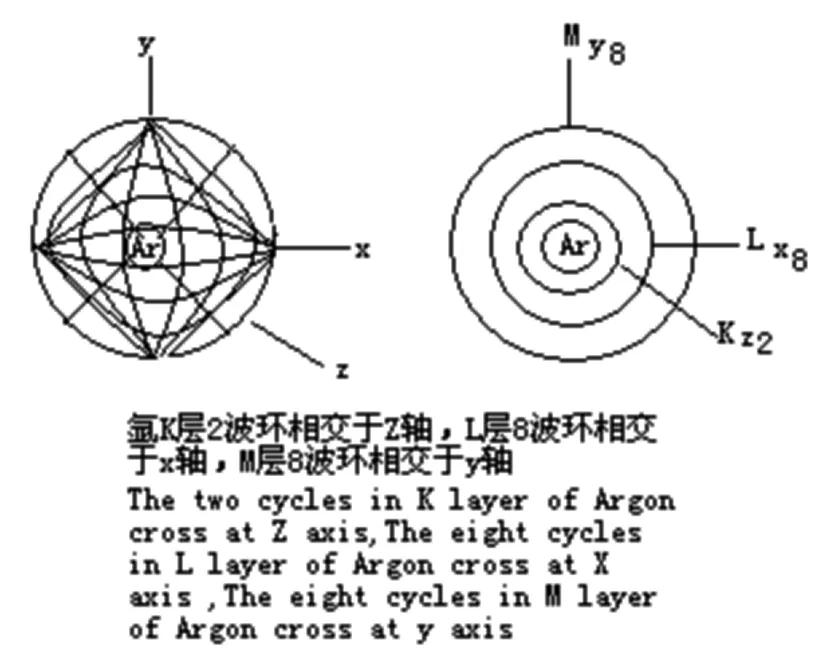
5.6 化学元素各周期轴电子排布情况
从氩原子各轴层波环的相交方式可以推测出原子核外电子填充的基本规律,即Z轴电子层最多只能填充2个电子,如果前一个主电子层填满Z轴,那么,后一个主电子层便从X轴开始填充电子,如果X轴也被填满8个电子,那么,便从Y轴开始填充电子。如果Z、X、Y轴都被填满,便又从Z轴开始,如此循环往复,原子就是这样不断地层层加固它的网状电子球壳。下面,列出化学元素各周期的轴电子排布情况:
第一周期:K层z2
第二周期:K层z2,L层x8
第三周期:K层z2,L层x8,M层y8
第四周期:K层z2,L层x8,M层y8…z2…x8,N层y8
第五周期:K层z2,L层x8,M层y8…z2…x8,N层y8…z2…x8,O层y8
第六周期k层z2,L层x8,M层y8…z2…x8,N层y8…x8…y8…x8,O层y8…z2…x8,P层y8
第七周期:k层z2,L层x8,M层y8…z2…x8,N层y8…x8…y8…x8,O层y8…x8…y8…x8…y8…z2…x8,P层y8…z2…x8,Q层y8
7.各周期化学元素最外轴层的电子数
下面,按照原子核最外轴电子层的电子数为序,将化学元素各周期的轴电子数排布情况展示如下:
第一周期:K层Z轴,H 1,He 2
第二周期:L层X轴,Li 1,Be 2,B 3,C 4,N 5,O 6,F 7,Ne 8
第三周期:M层Y轴,Na 1,Mg 2,Al 3,Si 4,P 5,S 6,Cl 7,Ar 8
第四周期:M层Z轴,K 1,Ca 2,
M层X轴,Sc 1,Ti 2,V 3,Cr 4,Mn 5,Fe 6,Co 7,Ni 8
N层Y轴,Cu 1,Zn 2,Ga 3,Ge 4,As 5,Se 6,Br 7,Kr 8
第五周期:N层Z轴,Rb 1,Sr 2
N层X轴,Y 1,Zr 2,Nb 3,Mo 4,Te 5,Ru 6,Rh 7,Pd 8
O层Y轴,Ag 1,Cd 2,In 3,Sn 4,Sb 5,Te 6,I 7,Xe 8
第六周期:N层Z轴,(无)
N层X轴,(Cs 1)(Cs 2)(Cs 3),Ba 4,La 5,Ce 6,Pr 7,Nd 8,
O层Y轴,Pm 1,Sm 2,Eu 3,Gd 4,Tb 5,Dy 6,Ho 7,Er 8,
O层Z轴,Tm 1,Yb 2
O层X轴,Lu 1,Hf 2,Ta 3,W 4,Re 5,Os 6,Ir 7,Pt 8
P层Y轴,Au 1,Hg 2,Tl 3,Pb 4,Bi 5,Po 6,At 7,Rn 8
第七周期:O层Z轴,(无)
O层X轴,(Fr 1)(Fr 2)(Fr 3),Ra 4,Ac 5,Th 6,Pa 7,U 8
O层Y轴,Np 1,Pu 2,Am 3,Cm 4,Bk 5,Cf 6,Es 7,Fm 8
O层Z轴,Md 1,No 2
O层X轴,Lr 1,Rf2,Db 3,Sg 4,Bh5,Hs 6,Mt7,Ds 8
P层Y轴,Rg1,Cn2,Uut3,Uug4,Uup5,Uuh6,Uus7,Uuo8
P层Z轴,(缺1—2)
P层X轴,(缺1—8)
Q层Y轴,(缺1—8)
第七周期各主电子层的轴电子排布是K 2,L 8,M18,N 32,O 50,P 18,Q 8;可以看出,第七周期的p主电子层的Z和X轴都是空的,Q层的Y轴也是空的,或者说,还有Z,X,Y共3个轴层的元素是空的,总共有18个元素有待人们去发现或人工合成。其中,第六、七周期的N层只有32个电子,按八偶律规则,只能安排两个X轴层和两个Y轴层,故各少一个Z轴层。同理,第七周期的O层也少一个Z轴层,恰好论证了镧系和锕系元素的直径缩小的真正原因。而那种把镧系和锕系元素提取出来单独排列的做法也是不妥的.从上面的排布规律来看,除了第一周期的Z轴层以外,其余各周期均能以X轴层或Y轴层的8个波环结束。各周期元素的数目之所以呈现出2,8,8,18,18…..这样的规律,就是因为它们是按照Z,X,Y轴层循环排布的结果。这也是证明原子波环结构正确性的重要证据之一。
7.总结与展望
本文以核磁共振的成功实现,证明氢在化合物中是一个小磁体,它的核外电子云是环形,而不是球形.并以斥力最小原理推导出多电子原子的核外电子云也是环形,而不是球形和亚铃形,论证了原子波环结构的存在。同时,指出<路易斯结构>的八偶律与原子直径大小无关,而与电子之间的角度有关,进一步证明了原子波环结构的存在。由原子的波环结构推导出化学元素核外电子的排布规律,指出还有18个元素有待人们去发现或人工合成.并制作完成<化学元素ZXY轴电子排布表>.这一探索是初步的,还有待人们进一步分析和研究.
