荧光光谱法探究pH值对咖啡酸β-苯乙醇酯与人血清蛋白相互作用的影响
2021-12-03范金波李孟雨吕长鑫励建荣
范金波,邢 莉,李孟雨,麻 奥,吕长鑫,励建荣
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013)
蜂胶是一类独特的黏合剂和树脂物质,具有多种生物学活性[1]。黄酮类与酚酸类化合物在其中大量存在,使其具备丰富的营养价值,然而目前只对少部分蜂胶活性成分进行过研究[2]。咖啡酸β-苯乙醇酯(caffeic acid phenethyl ester,CAPE)在蜂胶生物活性成分中占重要地位,具有免疫调节、抗癌、抗微生物、抗炎和抗氧化等一系列的生物活性,尤其在抗癌方面表现出很大的潜力[3-7]。目前已有研究者利用化学方法合成了CAPE,解决了从蜂胶中提取时提取率低的问题[8]。CAPE属于酚类衍生物,稳定性差,生物利用度低,常使用蛋白质作为载体实现保护作用[9-11]。
人血清蛋白(human serum albumin,HSA)是人血浆中浓度最高的载体蛋白,能和各种内源性与外源性的分子进行结合并递送,例如脂肪酸、营养素、类固醇以及许多常用药物如华法林和布洛芬等[12],成为了当前研究最为普遍的蛋白之一。HSA是单肽链的蛋白,由585 个氨基酸残基组合而成,17 个二硫键有助于维持其心形形状。HSA由3 个同源结构域构成(I、II、III),各结构域又可细分为A和B两个亚结构域,芳香族和杂环配体分子分别结合到亚结构域IIA(site I)和IIIA(site II)的疏水腔,具有特定的生理活性[13-14]。位于亚结构域IIA(Trp 214)的色氨酸残基,其荧光强度对小分子配体敏感,因此常被用作探针,监测该位点上配体与HSA的结合情况[15]。Li Hongliang等[16]采用多光谱和分子对接技术研究了CAPE与HSA的特异性结合作用,并与前人研究的蜂胶组分对比发现pH 7.4条件下,CAPE对HSA具有较强的内源性荧光猝灭作用,CAPE与HSA结合能力显著强于其他蜂胶活性成分。
目前,CAPE参与人体循环系统药代动力学过程的详细转运机制尚不清楚,CAPE与HSA生理条件下结合作用已有报道,但不同pH值对CAPE与HSA结合作用的影响鲜有报道。本实验拟通过荧光发射光谱探究pH值对CAPE与HSA结合行为的影响,通过同步荧光光谱分析CAPE结合对蛋白结构的影响,通过位点Marker实验确定两者的结合位点,实验结果为CAPE活性稳态化保持、靶向递送提供理论支撑。
1 材料与方法
1.1 材料与试剂
HSA(99%) 北京百灵威科技有限公司;CAPE(98%)、华法林(98%)、布洛芬(98%) 生工生物工程(上海)股份有限公司;柠檬酸、无水乙醇、磷酸氢二钠等均为分析纯,实验用水为超纯水。
1.2 仪器与设备
F-7000荧光分光光度计 日本日立高新技术公司;FE20实验室pH计 梅特勒-托利多仪器(上海)有限公司;Milli-Q Reference型超纯水机 德国默克密理博有限公司。
1.3 方法
1.3.1 储备液的配制
配制0.2 mol/L磷酸缓冲液(pH 3.0、5.0和7.4),并配制1.2×10-4mol/L的HSA储备液,以及浓度为7.2×10-4mol/L CAPE、华法林、布洛芬储备液。
1.3.2 CAPE与HSA相互作用的荧光光谱测定
荧光发射光谱:取7 支离心管,先加入不同pH值的缓冲溶液,再加入1.2×10-4mol/L HSA 30 μL,最后加入一定体积7.2×10-4mol/L CAPE,得到3 mL的混合溶液,使之充分反应20 min。最终HSA浓度为1.2 μmol/L,CAPE浓度为0~14.4 μmol/L。分别在298 K和310 K温度下,设置激发和发射光栅分别为2.5 nm和5 nm,激发波长为280 nm,以700 nm/min的扫描速率,对290~450 nm的发射光谱进行荧光发射光谱的测定。
同步荧光光谱:在298 K和310 K温度下,λEx和λEm的波长间隔分别设为Δλ=60 nm和Δλ=15 nm,激发光栅为2.5 nm和发射光栅为5 nm条件下,对波长250~350 nm的同步光谱进行测量。
1.3.3 CAPE与HSA的结合位点分析
参照1.3.2节方法,在加入CAPE前,先加入华法林/布洛芬充分摇匀反应20 min,使其浓度为6.0 μmol/L,后续操作与1.3.2节相同。并设置对照组。
1.4 数据统计分析
2 结果与分析
2.1 CAPE对HSA荧光强度的影响
如图1所示,在298 K时,3 种pH值条件下CAPE对HSA均产生荧光猝灭现象,随着CAPE浓度的增加(0~14.4 μmol/L)荧光强度呈规律性的减弱,峰形无显著变化。在pH 3.0时,HSA的荧光强度峰值降低了43%;pH 5.0时,HSA的荧光强度峰值降低了40%;pH 7.4时,HSA的荧光强度峰值降低了78%。不同pH值条件下,最大发射波长(λmax)出现不同的变化趋势,pH 3.0时发生微弱蓝移(327~326 nm),pH 5.0时发生微弱红移(338~339 nm),pH 7.4时发生红移(339~343 nm),可能是由于pH值和CAPE对HSA共同作用使荧光发色团附近的微环境发生了变化,红移使极性增强。由图1D所示,猝灭率随着CAPE浓度的增大而增大,其中pH 7.4时的猝灭率明显高于pH 3.0和pH 5.0,差异显著(P<0.05);而pH 3.0和pH 5.0相比,差异不显著(P>0.05)。

图1 298 K条件下pH值对CAPE与HSA结合荧光光谱的影响Fig.1 Effect of pH on fluorescence spectra of HSA bound to CAPE at 298 K
如图2所示,310 K时,在3 种pH值条件下CAPE对HSA均产生荧光猝灭现象,且峰形未发生明显变化。当pH 3.0、5.0和7.4时,HSA的荧光强度峰值分别降低了43%、62%和81%。pH值变化影响了λmax,pH 3.0、5.0和7.4时,随着CAPE浓度的增加λmax分别红移6 nm(325~331 nm)、红移8 nm(336~344 nm)和红移3 nm(337~340 nm)。这表示CAPE与HSA发生了相互作用,加之pH值的影响改变HSA的结构,使荧光基团附近的微环境产生变化,极性增强。由图2D可知,相同CAPE浓度下,猝灭率随着pH值的升高而增大,pH 7.4时最高,pH 3.0时最低,说明pH值影响了CAPE与HSA的结合作用。

图2 310 K条件下pH值对CAPE与HSA结合荧光光谱的影响Fig.2 Effect of pH on fluorescence spectra of HSA bound to CAPE at 310 K
2.2 荧光猝灭机理和结合常数
HSA与小分子之间的荧光猝灭类型主要分为静态和动态[17]。静态猝灭的过程是猝灭分子和HSA在基态形成了不发光的物质;动态猝灭是HSA的激发态分子和猝灭分子发生了碰撞,返回到基态,2 种方式均可以使HSA的荧光强度降低。静态猝灭的猝灭常数Ksv和温度呈反比,动态猝灭呈正比。本实验采用Stern-Volmer方程(1)和Acharya方程(2)分析荧光猝灭机理[18]。

式中:F0和F分别为未加和加入CAPE时荧光强度;[Q]为CAPE的浓度/(mol/L);Kq为双分子猝灭速率常数;τ0为荧光团的平均寿命,为10-8s;Ksv为猝灭常数;Ka为结合常数。
R2值越接近于1,证明数据越精确。根据方程(1),可计算不同条件下CAPE与HSA结合的猝灭常数Ksv。由表1可知,在pH 3.0、5.0、7.4条件下,Ksv均随温度上升而增大,但由于Kq均远大于2×1010L/(mol·s)(生物分子的最大散射碰撞猝灭常数),说明CAPE对HSA的猝灭类型是静态猝灭[19-20]。相同温度条件下(310 K)pH值变化影响了Ksv,且随着pH值的升高而出现增加趋势,pH 7.4时Ksv出现最大值,验证了图2的结果。结合常数Ka在不同条件下都为104~106数量级,证明二者的结合能力较强。pH值变化显著影响了结合常数,在生理条件(pH 7.4)下最大。

表1 CAPE与HSA相互作用常数Table 1 Interaction constants of CAPE with HSA
2.3 热力学性质和作用力类型
小分子和HSA之间主要基于氢键、范德华力、疏水相互作用和静电相互作用4 种作用力结合[21]。在298 K和310 K温度下通过Van’t Hoff方程(3)和热力学方程(4)计算热力学参数[22]:

式中:K1、K2对应T1(298 K)、T2(310 K)时的结合常数;ΔH为焓变/(kJ/mol);ΔG为结合反应的吉布斯自由能变化/(kJ/mol);ΔS为熵变/(J/(mol•K));R为气体常数(8.314 J/(mol•K));温差较小时,ΔH可作为常数[23]。
从理论上讲,当ΔH<0或ΔH≈0和ΔS>0时,静电相互作用扮演交互的主要力量;当ΔH>0,ΔS<0时,主要基于静电和疏水相互作用结合;ΔH<0,ΔS<0时,氢键与范德华力作为交互的主要力量;ΔH>0,ΔS>0时,疏水作用起主要作用[24-25]。由表2可知,ΔH<0,ΔG增加(ΔG<0),ΔS<0,说明CAPE与HSA之间的结合是熵减少,吉布斯自由能升高,自发进行的放热过程,二者间的作用力表现为氢键和范德华力。

表2 CAPE与HSA相互作用的热力学常数Table 2 Thermodynamic constants of interaction between CAPE and HSA
2.4 同步荧光光谱测定
在298 K和310 K温度下测定不同配体浓度的HSA同步荧光光谱。当λEx和λEm的波长间隔设定在15 nm时反映酪氨酸残基的光谱信息;设定在60 nm反映色氨酸残基的光谱信息[26-27]。酪氨酸和色氨酸残基的最大发射波长(λmax)均与附近微环境的极性相关,若λmax蓝移,则周围环境的疏水性增强;反之极性增强[28]。所以能够依据λmax的改变,判断CAPE的参与对蛋白质构象的改变[29]。
如图3所示,298 K温度下,无论Δλ=15 nm还是Δλ=60 nm,CAPE的参与对HSA都存在猝灭作用,而且随CAPE浓度逐步升高,HSA荧光强度逐渐降低。当Δλ=15 nm时,pH 3.0与pH 7.4条件下,对应的酪氨酸残基的吸收峰微弱蓝移1 nm和2 nm,pH 5.0时未发生位移;当Δλ=60 nm时,pH 5.0和pH 7.4条件下,色氨酸残基的吸收峰蓝移1 nm和6 nm,pH 5.0时未发生位移。且伴随pH值的增大,色氨酸最大吸收峰的降低趋势更加明显。表明CAPE的加入,加之pH值的影响,使色氨酸附近微环境的疏水性增强,极性减弱[30]。

图3 298 K及pH 3.0(A)、pH 5.0(B)、pH 7.4(C)时CAPE对HSA的同步荧光光谱的影响Fig.3 Effects of different pHs on synchronous fluorescence spectra of HSA bound to CAPE at 298 K
如图4所示,310 K温度下,伴随CAPE浓度的升高,酪氨酸与色氨酸残基内源荧光强度均呈现规律性地降低,与图3呈现出相似的规律。当Δλ为15 nm时,pH 5.0和pH 7.4条件下,对应酪氨酸残基的吸收峰微弱蓝移1 nm和2 nm,pH 3.0时未发生位移;当Δλ为60 nm时,pH 3.0和pH 7.4条件下,色氨酸残基的吸收峰蓝移1 nm和3 nm,pH 5.0时红移1 nm。由此能够推测,2 种氨基酸残基附近的微环境均产生了微弱的变化。且色氨酸最大吸收峰的降低趋势随pH值的增大更为明显,pH 7.4时最明显。综上所述,HSA中的酪氨酸残基与色氨酸残基比较,后者的荧光强度减弱的更显著。说明色氨酸残基可能比酪氨酸残基更接近于结合位点,CAPE的加入和pH值的共同影响改变了HSA的构象。
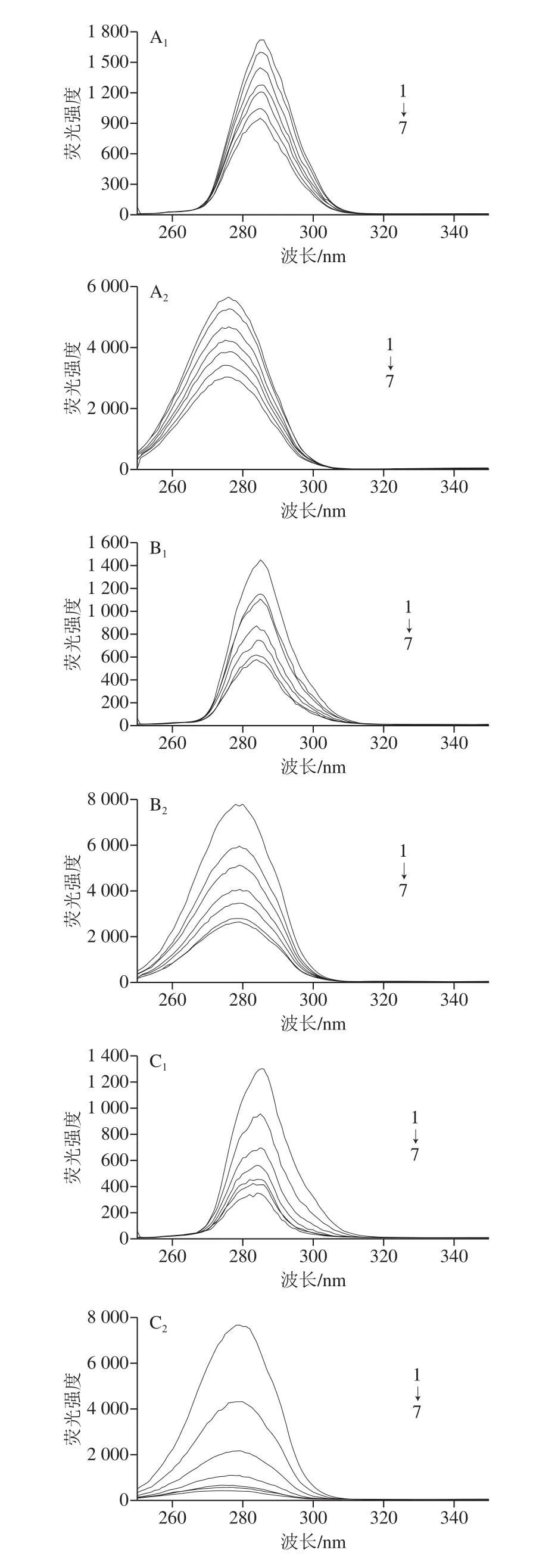
图4 310 K及pH 3.0(A)、pH 5.0(B)、pH 7.4(C)时CAPE对HSA的同步荧光光谱的影响Fig.4 Effects of different pHs on synchronous fluorescence spectra of HSA bound to CAPE at 310 K
2.5 CAPE与HSA结合位点的分析
华法林和布洛芬均能够特异性地与HSA结合,结合位点分别位于HSA的亚结构域IIA(Sudlow’s site I)和亚结构域III A(Sudlow’s site II)。本实验选择布洛芬和华法林作为位点Marker,通过比较位点Marker存在时猝灭率的变化判断CAPE与HSA的结合位点[31]。
由图5可以得出,二者的存在均显著降低了CAPE与HSA的结合,华法林存在时产生的荧光猝灭变化比布洛芬更显著。结果说明CAPE与HSA的结合位点位于亚结构域IIA和IIIA之间,更接近于Sudlow’s site I。


图5 298 K、pH 7.4布洛芬和华法林对CAPE与HSA结合的影响Fig.5 Effects of IBUP and WARF on binding between CAPE and HSA at 298 K and pH 7.4
3 结 论
本实验采用荧光光谱法研究CAPE与HSA在pH 3.0、5.0、7.4条件下的结合作用,经过分析计算出猝灭常数、猝灭类型、结合常数、作用力类型,再通过同步荧光探究3 种pH值条件下CAPE对HSA构象的影响,最后位点Marker实验确定结合位点。结果表明3 种pH值条件下CAPE对HSA均产生了荧光猝灭现象,类型为静态猝灭,pH 7.4时具有最强的猝灭作用,同时结合常数最大,说明生理条件下CAPE与HSA更容易结合;热力学参数表明CAPE与HSA主要通过范德华力和氢键作用结合;同步荧光表明CAPE和pH值的共同影响改变了HSA的构象;位点Marker实验表明,CAPE与HSA的结合位点位于Sudlow’s site I附近。实验结果证明,pH值的增加促进了CAPE与HSA的结合,这对于探究蜂胶生物活性成分在体内的转运,以及为蛋白基-CAPE载体的开发提供了理论依据。
