具有优异锂存储性能的蛋黄蛋壳结构FeS2@CFs薄膜电极
2021-11-26李海昌何燕孙洪冉徐常蒙李劢宋文明李慧芳王晓君刘治明
李海昌,何燕,孙洪冉,徐常蒙,李劢,宋文明,李慧芳,王晓君,刘治明
(青岛科技大学机电工程学院,山东省高性能碳材料制备与应用工程实验室,山东青岛266061)
引 言
锂离子电池具有环境友好、无记忆效应、循环寿命长等优点,已被广泛应用到各种可携带电子设备、电动汽车等领域[1-4]。随着经济的高速发展,对锂离子电池的性能提出了越来越高的要求。其中,负极材料作为锂离子电池重要部件之一,直接影响着电池的整体性能。目前,商业化的石墨负极材料,由于其较低的理论比容量(372 mAh·g-1),已经远远不能满足锂离子电池高能量密度的要求[5]。在大力发展绿色能源的背景之下,激励着科研工作者不断探索各种新型负极材料,如:过渡金属氧化物(硫化物、硒化物)[6-8]、硅基复合材料[9-10]和Sb 基复合材料[11]等。其中,过渡金属硫化物黄铁矿(FeS2)由于四电子氧化还原反应[12],具有较高的理论比容量(894 mAh·g-1),并且FeS2地球储量丰富、无毒、合成方法简单,近年来得到了研究者的广泛关注[5,13-14]。然而,FeS2转换反应的储能机理,导致充放电过程中伴有严重的体积变化,使材料因粉化而从集流体上脱落,造成实际容量的快速衰减;另外,FeS2有较低的电导率,这严重影响材料的循环稳定性和倍率性能[5,15]。为了解决上述问题,人们通常采用与碳材料复合的方法来提高材料的导电性和循环稳定性。如夏青等[16]利用阴离子置换获得了核壳结构的FeS2/C 纳米材料,碳壳在很大程度上缓解了FeS2的体积变化,在2 A·g-1的电流密度下,可逆比容量可达866 mAh·g-1。Jing 等[17]提出了一种有趣的双碳修饰策略,制备了具有蛋黄蛋壳层次结构的FeS2@C微盒以及互联的石墨烯框架。双碳保护效应和双通道的锂离子/电子传输优势,使得材料在20 A·g-1时表现出455 mAh·g-1的优越倍率性能。Yin 等[18]开发了一种将化学刻蚀与硫化铁基MOFs 牺牲模板相结合的简便方法,制备了FeS2@多孔八面体碳复合材料,多孔碳为硫化铁的体积膨胀预留了缓冲空间,提升了材料的循环性能(在0.1 A·g-1下循环100圈可逆容量为1071 mAh·g-1)。虽然已经取得了显著的成果,但一些合成方法较为复杂,受环境影响较大,导致合成成本偏高,不能大规模生产。另外,在原始的涂片工艺中,添加的导电剂、黏结剂经搅拌不仅会使材料的原始形貌遭到一定程度的破坏,而且会额外增加电极非活性组分的质量,使得电池能量密度降低。为了解决上述提到的问题,自支撑复合薄膜电极材料由于制备简单、不需导电剂和黏结剂、机械强度大、柔韧性好、可大量制备等优点,备受科研人员的关注。
本文利用廉价的Fe2O3纳米块为前驱体,基于简单的静电纺丝结合刻蚀和硫化工艺,成功制备了三维导电互联自支撑FeS2@空隙@碳纤维(FeS2@CFs)薄膜电极。该合成方法省去了集流体、导电剂和黏结剂,从而有效提升了活性材料占比;同时,聚丙烯腈(PAN)碳化后形成三维连续的导电碳网络,有利于电子的传输;另外,碳层与FeS2纳米颗粒之间的空隙为FeS2的体积膨胀提供了额外的缓冲空间,并能在外壳层形成稳定的固体电解质膜(SEI)。锂离子电池性能测试结果显示:在1 A·g-1的电流密度下,经过500 圈循环之后,容量能保持在590.8 mAh·g-1左右;在5 A·g-1的大电流密度下,容量仍能达到415.4 mAh·g-1,表明FeS2的电化学性能得到显著的提升。更重要的是,Fe2O3可以更换为其他的纳米材料,具有很强的扩展性,这为电极材料的制备提供了一种通用的设计思路。
1 实验材料和方法
1.1 实验材料
氢氧化钠(NaOH),阿拉丁;六水氯化铁(FeCl3·6H2O),阿拉丁;聚丙烯腈(PAN),阿拉丁;N,N-二甲基甲酰胺(DMF),阿拉丁;升华硫,阿拉丁;锂箔;电池壳;Celgard-2400 隔膜;电解液(LiPF6,多多化学)。所有试剂均直接使用,未经进一步处理。
1.2 材料制备
1.2.1 Fe2O3的制备 用文献报道的方法制备了Fe2O3亚微立方前驱体[19]。首先,将50 ml(5.4 mol·L-1)的NaOH 溶液 加入2 mol·L-1相 同体积的FeCl3·6H2O 中,在70℃下搅拌5 min之后倒入高压釜中,然后在100℃烘箱内保持4 d,自然冷却至室温,将红色产物离心收集,最后用去离子水和乙醇洗涤三次,在70℃下干燥12 h备用。
1.2.2 Fe3O4@CFs 的制备 首先,将PAN(0.3 g)溶解到DMF(2.7 g)中,在60℃下搅拌5 h,之后加入0.4 g Fe2O3纳米颗粒,继续搅拌10 h,形成均匀的纺丝溶液。然后将其吸到5 ml 的注射器中,采用20 号针头,电压15 kV,推胶速度为1 ml·h-1,针头到接收滚筒的距离为15 cm,通过静电纺丝得到Fe2O3/PAN 复合薄膜。先将复合薄膜在空气中250℃预氧化1 h(升温速率为2℃·min-1),之后转到500℃氩气气氛下煅烧3 h(升温速率为2℃·min-1),自然冷却到室温,得到Fe3O4@CFs复合薄膜。
1.2.3 FeS2@CFs 的制备 首先,将上述得到的Fe3O4@CFs 复合薄膜在5 mol·L-1的HCl 溶液中浸泡40 min,得到Fe3O4@空隙@CFs 复合薄膜。然后将其放在瓷舟中,加入过量硫粉,在通有氩气气氛的管式炉中500℃下煅烧3 h(升温速率为2℃·min-1),自然冷却到室温,将得到目标产物FeS2@CFs-40 复合薄膜。其他经过HCl 刻蚀0、20 和60 min 的三种复合材料作为对照样品,分别标记为FeS2@CFs-0、FeS2@CFs-20和FeS2@CFs-60。
1.3 材料表征
采用X 射线衍射光谱(XRD,Rigaku MiniFlex,D/max-2500)测试样品物相特征;通过扫描电子显微镜(SEM,SU-8010)及透射电子显微镜(TEM,TEM-2010F FEI Talos 200S)观察样品的结构形貌;使用热重(TGA,NETZSCH,TG-209F3)测试样品中的碳含量;通过X 射线光电子能谱(XPS,Thermo Fisher Scientific ESLAB 250Xi)分析样品的化学成分及成键状态。
1.4 扣式电池的组装及电化学性能测试
由于获得的最终样品是薄膜,可直接将其放在冲片机上压成直径为1 cm 的电极片,每片电极的活性物质约为1 mg·cm-2。然后在氩气气氛下的手套箱内(水浓度和氧浓度均小于0.01×10-6)组装成扣式电池。使用1.0 mol L-1的LiPF6[碳酸乙烯酯(EC)∶碳酸二甲酯(DMC)=1∶1(体积比)]作为电解液,按照负极壳、锂片、隔膜、电极片、垫片、弹片、正极壳的顺序组装。然后将组装好的扣式电池在室温下静置10 h。采用蓝电电池测试系统(CT2001, 中国武汉)在电压为0.01~3 V 的范围内对电池进行恒流充放电(GCD)及倍率性能测试;采用荷兰艾维电化学工作站(IVIUM,Vertex. One. EIS)对其进行循环伏安(CV)扫描分析,扫描速度为0.1 mV·s-1。
2 实验结果与讨论
2.1 复合材料的物相及微观形貌分析
首先,对前驱体Fe2O3及煅烧后得到的Fe3O4@CFs进行了XRD 测试[图1(a)],发现每个衍射峰都能与Fe2O3和Fe3O4的标准卡片(JCPDS NO.89-0573 和JCPDS NO.88-0866)一一对应,说明经过碳热还原之后Fe2O3已经完全转变为Fe3O4。在经过不同时间的刻蚀和硫化之后,对FeS2@CFs-0、FeS2@CFs-20、FeS2@CFs-40 和FeS2@CFs-60 四种样品进行了XRD测试,测试结果如图1(b)所示。将其与FeS2的标准XRD 卡片(JCPDS NO.71-0053)进行比对,在26°附近出现的面包峰是由碳纤维所引起的,其他的峰都能与标准卡片中的峰对应,没有发现任何的杂峰,表明Fe3O4经硫化后已经完全转变成黄铁矿FeS2,证实了 FeS2@CFs-0、FeS2@CFs-20、FeS2@CFs-40 和FeS2@CFs-60复合材料成功制备。
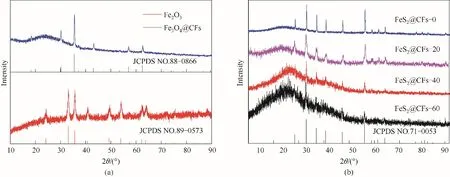
图1 Fe2O3、Fe3O4@CFs、FeS2@CFs-0、FeS2@CFs-20、FeS2@CFs-40和FeS2@CFs-60的XRD光谱Fig.1 XRD patterns of Fe2O3,Fe3O4@CFs,FeS2@CFs-0,FeS2@CFs-20,FeS2@CFs-40 and FeS2@CFs-60,respectively
利用扫描电子显微镜(SEM)和透射电子显微镜(TEM)对材料的微观形貌进行探索。合成的前驱体Fe2O3纳米方块尺寸(约500 nm)分布均匀[图2(a)],对后续均匀连续的纺丝过程是非常有利的。经过煅烧、刻蚀和硫化之后得到FeS2@CFs-40复合薄膜,从图2(b)中可以看出整体呈现出三维互联的网状结构,提供了全方位的电子传输网络;FeS2纳米颗粒均匀分布在CFs中,有利于保持复合材料的微观形貌。从放大图[图2(c)]中可以观察到CFs 的直径约为400 nm,并可以清晰地看出FeS2与碳壳之间存在足够的空隙,形成了独特的蛋黄蛋壳结构单元,这种结构的形成得益于硫化之前的盐酸刻蚀过程,为后续硫化及锂离子嵌入时产生的体积变化预留了额外的空间,更有利于保持复合材料的结构完整。而对于未刻蚀和刻蚀20 min 的对比样品(FeS2@CFs-0 和FeS2@CFs-20),由于硫化时大的体积变化,刻蚀产生的空腔不足以容纳Fe3O4硫化时发生的体积膨胀,造成部分FeS2颗粒暴露在碳纤维外部[图2(d)和(e)],导致活性材料直接与电解液接触。但是,可以看出样品FeS2@CFs-20暴露在碳纤维外部的FeS2颗粒明显减小。将刻蚀时间延长至60 min 时,再经过硫化之后,从图2(f)中可以看出碳纤维内部仅有少量的FeS2颗粒(圆圈圈出部分),FeS2颗粒与碳纤维之间存在较大的空腔,空腔的尺寸明显大于刻蚀40 min 的样品,这会使活性物质FeS2的含量显著降低,同时也会减小电极片的振实密度。基于上述分析,选择FeS2@CFs-0 和FeS2@CFs-40 两种样品作为主要研究对象,来说明蛋黄蛋壳结构之间合适的空腔尺寸对FeS2@CFs 电极整体性能提升的优势。TEM 图[图3(a)]进一步证实了硫化铁纳米颗粒与碳层之间存在一定空隙,这种蛋黄蛋壳结构可以为FeS2嵌锂时的体积膨胀提供额外的缓冲空间,并能在外面形成稳定的固体电解质膜(SEI),而且可以有效阻止FeS2纳米颗粒的团聚,充分发挥了蛋黄蛋壳结构单元与全方位三维CFs 导电网络之间的协同效应,有利于提升复合材料的电化学性能。EDX 图像[图3(b)]中除了均匀分布的C、Fe、S 三种元素之外,还可以看出N元素弥漫在整个CFs 中,N 元素的掺杂不仅可以进一步提高复合材料的导电性,还可以提供更多的反应活性位点,来容纳更多的锂离子,使材料的容量得到提升[5]。

图2 Fe2O3前驱体的SEM图(a);FeS2@CFs-40的SEM图[(b)、(c)];FeS2@CFs-0、FeS2@CFs-20和FeS2@CFs-60的SEM图[(d)~(f)]Fig.2 SEM image of Fe2O3 precursor(a);SEM images of FeS2@CFs-40[(b),(c)];SEM images of FeS2@CFs-0,FeS2@CFs-20 and FeS2@CFs-60[(d)—(f)]

图3 FeS2@CFs-40的TEM图(a);FeS2@CFs-40中Fe、S、N、C元素分布(b)Fig.3 TEM image of FeS2@CFs-40(a);Distribution of Fe,S,N,C elements in FeS2@CFs-40(b)
通过TGA 进一步测定了FeS2@CFs-40 和FeS2@CFs-0 复合材料中的碳含量(图4)。TGA 曲线(FeS2@CFs-40 和FeS2@CFs-0)在300 ~ 500℃之间出现了明显的质量下降,这与空气中碳的燃烧和FeS2分别转化为Fe2(SO4)3和Fe2O3有关;此后,在500 ~620℃温度范围内的质量丢失,可对应Fe2(SO4)3分解为Fe2O3[20-22]。计算结果表明:FeS2@CFs-40 和FeS2@CFs-0 中的碳含量分别约为37.84% 和31.96%。
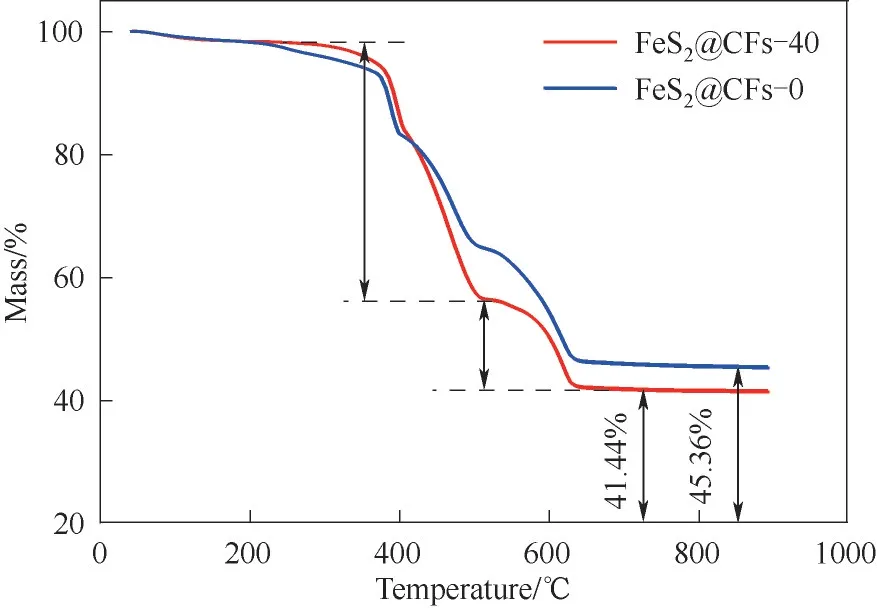
图4 FeS2@CFs-40和FeS2@CFs-0的TGA曲线Fig.4 TGA curves of FeS2@CFs-40 and FeS2@CFs-0
为了进一步研究材料的化学成分以及成键状态,对FeS2@CFs-40 进行了X 射线光电子能谱分析(XPS)。如图5(a)全谱所示,检测出Fe、O、C、N、S 的存在。图5(b)~(d)为Fe 2p、S 2p、N 1s 相应的XPS 精细谱。Fe 2p1/2和Fe 2p3/2的中心位置可以反卷积到位于约710.9、713.3、719.7、724.3 和727.6 eV 的五个峰,位于710.9 和724.3 eV 的峰表明Fe2+的氧化状态,在713.3 和727.6 eV 附近的峰证明Fe3+的存在,这是由材料表面轻微氧化造成的,719.7 eV 左右的峰归因于卫星峰。此外,由于在高温煅烧过程中有少量Fe3+和Fe2+被碳还原,从而出现了707.0 eV 处Fe0的峰[图5(b)][5,15]。如图5(c)所示,S 2p光谱可以分为四个峰,分别位于163.0、163.9、164.9 和168.7 eV。前两个峰对应的是与过渡金属和碳基体成键的S或短链有机硫化物S2-键;此外,结合能较高的峰,表明存在和SOx种类,这都是FeS2的典型特征[23-25]。N 1s[图5(d)]光谱分别被分解为吡啶-N、吡咯-N 和石墨-N[26],进一步证实了N原子被掺杂到CFs中。N元素的掺杂在CFs 中引入了大量的缺陷和Li+存储位点,并提高了材料整体的导电性[27-28]。
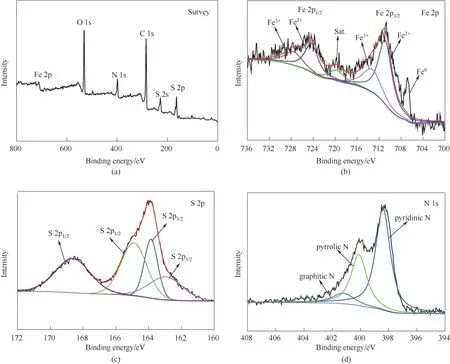
图5 FeS2@CFs-40的XPS全谱(a)及对应的Fe 2p(b)、S 2p(c)和N 1s(d)精细谱Fig.5 XPS full spectrum of FeS2@CFs-40(a)and corresponding fine spectra of Fe 2p(b),S 2p(c)and N 1s(d)
2.2 电化学性能测试
将复合材料作为锂离子电池负极材料组装成扣式半电池测试其电化学性能。首先,利用循环伏安法(CV)探究了其在锂离子电池中的储能机理。图6(a)是FeS2@CFs-40 在电压范围0.01~3 V(扫速为0.1 mV·s-1)时的前四圈CV 曲线,在第一圈放电过程中,出现了两个还原峰,分别位于0.6 和1.2 V 左右,根据大量的文献报道,两处的还原峰分别代表不可逆SEI 膜的生成和锂离子插入FeS2纳米颗粒中形成Fe0和Li2S(FeS2+ 2Li++ 2e-Li2FeS2;Li2FeS2+2Li++ 2e-Fe + 2Li2S)[12,29];在随后的充电过程中,有三个氧化峰与其对应,表示锂离子从FeS2中脱出的过程是多步进行的;在1.0 V 的电位下,首先会生成Li2FeS2(Fe + 2Li2S Li2FeS2+ 2Li++ 2e-),随着锂离子的进一步脱出,会逐渐生成Li2-xFeS2相(Li2FeS2Li2-xFeS2+ xLi++ xe-),在2.5 V 以后的氧化峰对应于FeSy及S 的产生[Li2-xFeS2FeSy+(2-y)S+(2-x)Li++(2-x)e-][30-32]。可以注意到,在随后的三个循环中,还原峰有一个向右偏移,三条曲线几乎重合在一起,表明在充放电过程中的氧化还原反应是可逆的,这一重要特征有利于材料的循环稳定性。图6(b)是FeS2@CFs-40 在0.1 A·g-1的前四圈充放电曲线,第一圈放电/充电容量高达1236.2/982.2 mAh·g-1,首圈库仑效率(ICE)约为79.45%,有部分容量不可逆的原因主要是在首次嵌锂过程中,产生了一些副反应并形成了不可逆的SEI 膜[5,33-34]。在随后的三个循环中,曲线重合度较好,表现出优异的电化学可逆性。进一步对两种样品的倍率性能进行测试,从图6(c)可以看出,当电流密度在0.1、0.2、0.5、1、2、5 A·g-1时,容量分别为945.9、870.6、767.6、683.4、578、415.4 mAh·g-1,在较大电流密度下,仍有415.4 mAh·g-1的容量保持,电流密度再次回到初始的0.1 A·g-1时,容量仍能回到908.4 mAh·g-1,仅有3.96%的容量损失,表明了FeS2@CFs-40 复合材料具有优异的倍率性能。从图中清晰观察到没有经过刻蚀的FeS2@CFs-0 样品表现出较差的倍率性能,在小电流密度下两者性能相差较小,但随着电流密度的增加,样品FeS2@CFs-40 的倍率性能优势越来越明显,这进一步说明了选择性刻蚀可进一步缩小FeS2纳米颗粒的尺寸,从而可缩短Li+的传输路径,加速其反应动力学。为了评估材料的实际比容量和循环稳定性,在较小电流密度(0.5 A·g-1)下进行循环性能对比测试[图6(d)]。从图中可以看出,样品FeS2@CFs-40 在前150 圈容量呈现上升的趋势,这是由于材料的活化以及电解液分解导致形成聚合物凝胶状膜,之后稳定循环到400圈,可逆容量约为977.9 mAh·g-1。最后,在较大电流密度(1 A·g-1)下对四种样品进行循环性能测试[图6(e)],可以看出FeS2@CFs-40 同样表现出优异的循环稳定性,在循环500圈之后,仍有590.8 mAh·g-1可逆容量,容量保持率约为76.8%。而未刻蚀和仅刻蚀20 min 的样品展现出较差的电化学性能,这是由于未刻蚀或刻蚀时间较短形成的FeS2颗粒暴露在碳纤维外部直接与电解液接触,不利于形成稳定的SEI 膜;同时,没有额外的空腔来缓解锂离子嵌入时FeS2颗粒大的体积膨胀,在循环过程中电极的整体结构遭到严重破坏,导致两种电极的循环稳定性较差。此外,相比于刻蚀20 min 的样品FeS2@CFs-20,未刻蚀的FeS2@CFs-0 中FeS2颗粒的尺寸更大且表面结构更致密,这不利于大电流密度下离子/电子的传输,导致在1 A·g-1的较大电流密度下活性材料利用率低,进而展现出较低的容量。而刻蚀60 min 的样品由于空腔过大,造成空腔体积浪费,虽然能提供优异的循环稳定性,但电极片活性物质FeS2的含量较低,导致实际容量偏低。目标样品FeS2@CFs-40之所以有着优异的电化学性能,得益于独特的蛋黄蛋壳结构,蛋黄蛋壳之间适当的空隙可以很好地缓解FeS2纳米颗粒在锂离子嵌入时的体积膨胀,有利于保持复合材料的结构稳定,从而提高了材料的循环稳定性。
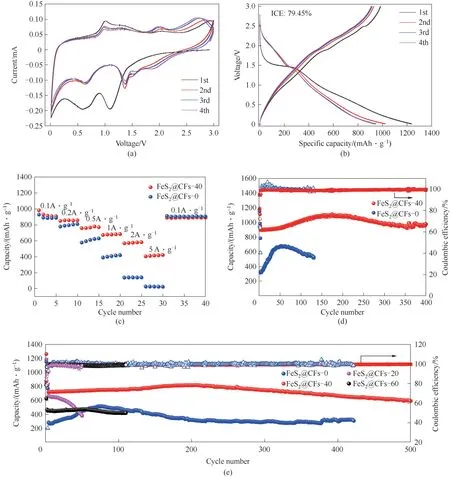
图6 FeS2@CFs-40在0.1 mV·s-1下的CV曲线(a);FeS2@CFs-40在0.1 A·g-1的前四圈充放电曲线(b);FeS2@CFs-40、FeS2@CFs-0的倍率性能(c);FeS2@CFs-40、FeS2@CFs-0在0.5 A·g-1时的循环性能(d);FeS2@CFs-0、FeS2@CFs-20、FeS2@CFs-40、FeS2@CFs-60在1 A·g-1时的循环性能(e)Fig.6 CV curve of FeS2@CFs-40 at 0.1 mV·s-1(a);FeS2@CFs-40 charge-discharge curve of the first four cycles at 0.1A·g-1(b);Rate performance of FeS2@CFs-40 and FeS2@CFs-0(c);Cycling performance of FeS2@CFs-40 and FeS2@CFs-0 at 0.5 A·g-1(d);Cycling performance of FeS2@CFs-0,FeS2@CFs-20,FeS2@CFs-40 and FeS2@CFs-60 at 1 A·g-1,respectively(e)
将本工作与之前报道的FeS2基负极材料用作锂离子电池负极时的电化学性能进行比较,如表1 所示,可以看出本工作制备的FeS2@CFs-40 无论是在循环稳定性方面还是在倍率方面都可以与先前报道的FeS2材料相媲美,进一步说明了本工作的设计思路具有一定的参考价值。
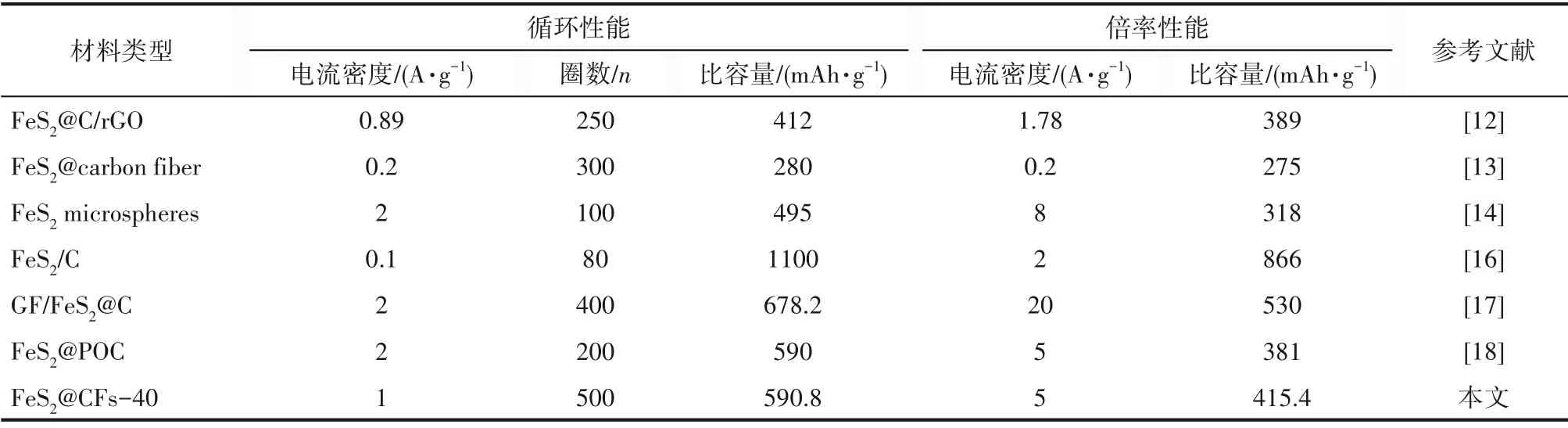
表1 FeS2负极材料用于锂离子电池的性能比较Table 1 Performance comparison of FeS2 anode materials for LIBs
3 结 论
本文通过简单的静电纺丝结合刻蚀和硫化工艺,制备了蛋黄蛋壳结构的FeS2@CFs复合薄膜电极材料。实验结果表明具有合适空腔结构的FeS2@CFs-40 样品表现出最优的电化学性能。一方面,三维互联的导电碳网络改善了材料的整体电导率,提高了电子传输速率,从而提升了材料的倍率性能(5 A·g-1:415.4 mAh·g-1)。另外,每个独特的蛋黄壳结构单元,能够缓解FeS2纳米颗粒的体积膨胀,很好地保持了复合材料的结构完整,赋予了电极材料杰出的循环稳定性能(0.5 A·g-1循环400 圈:977.9 mAh·g-1;1 A·g-1循环500 圈:590.8 mAh·g-1)。本文研究方法及理念可以为高容量柔性薄膜电极的设计提供一种思路。
