黄芩素衍生物对大鼠急性肝性脑病模型的干预*
2021-11-25范栢爽吴梓君刘世豪李思勤王丽莉何新
范栢爽 ,吴梓君 ,刘世豪 ,李思勤 ,王丽莉 ,何新 ,
(1.天津中医药大学,天津 301617;2.中国医学科学院/北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,北京 100050;3.广东药科大学,广州 510006)
肝性脑病又称肝昏迷,是由肝功能严重障碍和/或门静脉—体循环分流异常引起的脑功能障碍,表现为一系列从亚临床改变到昏迷程度不等的神经精神异常综合征,包括认知功能、情绪、行为和运动功能的异常改变[1-2]。临床上主要分为A、B、C 3型,其中A型是由于急性肝衰竭导致的肝性脑病,其特点为起病急、病程长、病死率高达80%[3]。目前肝性脑病的治疗主要为去除诱因、脱氨、人工肝及肝移植,已取得较好的治疗效果[4],但各有其局限性,因此探索新的预防及治疗方法有重要的现实意义。
黄芩素,是从中药黄芩Scutellaria baicalensis Georgi的干燥根分离出来的黄酮类单体化合物,是黄芩中最主要的活性成分之一,也是主要的药效物质基础[5-6]。现代研究表明黄芩素具有许多药理活性,如抗病毒、抗菌、清除自由基、抗过敏、治疗癌症等[7]。此外,黄芩素还具有较好的保肝和神经保护作用,有研究显示黄芩素对四氯化碳(CCl4)、药物等诱导的许多急慢性肝炎、肝纤维化和肝癌有良好的防治作用,对神经毒性有较强的神经保护作用[8-9]。但由于其生物利用度低、水溶性差,限制了其临床应用[10]。有报道,对黄芩素进行磺酸化改造后,应用到CCl4诱导的小鼠急性肝损伤实验中,结果与黄芩素相比,磺酸化黄芩素有更好的保肝效果,且增加其体内吸收量[11]。A型肝性脑病模型有多种,在药物诱导方法中,硫代乙酰胺(TAA)诱导的动物模型,具有可重复性、易观察分期、成功率高、与人类肝性脑病相似度高等优点[12]。故本研究采用TAA法诱导大鼠急性肝性脑病模型,探讨黄芩素衍生物二磺酸基黄芩素(DB)对急性肝性脑病大鼠的干预作用及其可能的作用机制,以期为肝性脑病的治疗提供实验依据。
1 材料
1.1 动物 SPF级Wistar雄性大鼠,72只,体质量220~240 g,购买于北京维通利华实验动物技术有限公司,许可证号[SCXK(京)2016-0006],动物批号1100112011037688,于中国医学科学院放射医学研究所饲养,动物实验室许可证号SYXK(津)2018-0008。饲养条件:温度20~25℃,湿度40%~60%,每日光照12 h,自由摄食饮水,均用标准饲料。所有大鼠适应性饲养1周后进行实验。所有实验符合天津中医药大学动物实验伦理学规定。
1.2 实验药物与试剂 DB(实验室自制,经核磁测定纯度高于98%[13]);硫代乙酰胺(上海生工生物工程股份有限公司,批号F514BA0026);乳果糖口服溶液(北京韩美药品有限公司,批号20050006);γ-氨基丁酸(GABA)试剂盒(美国MyBiosource公司,批号 36361656);谷氨酸(Glu)试剂盒(美国MyBiosource公司,批号20200929C);肿瘤坏死因子-α(TNF-α)试剂盒(美国 R&D Systems公司,批号 P219559);白介素-6(IL-6)试剂盒(武汉华美生物工程有限公司,批号X23014810);BCA试剂盒(北京索莱宝科技有限公司,批号20200817);β-肌动蛋白/β-Actin(内参)抗体,羊抗兔IgG二抗(北京博奥森生物技术有限公司,批号分别为AG07197903、BJ05217694);磷脂酰肌醇 3激酶(PI3K)抗体(万类生物科技有限公司,批号I05182196);磷酸化蛋白激酶B(p-AKT)抗体(美国Cell Signaling Technology公司,批号23)。
1.3 主要仪器 DB001 Morris水迷宫视频分析系统,北京智鼠多宝生物科技有限责任公司;NX10N快速血氨测定仪,日本Fujifilm公司;7020型全自动生化分析仪,日本Hitach公司;Microfuge-22R型高速离心机,美国Beckman公司;AX205型十万分之一天平,瑞士Mettler Toledo公司;GL-88B涡旋混合器,海门市其林贝尔仪器制造有限公司;PowerPac型电泳仪,美国Bio-Rad公司;VILBER Fusion FX5凝胶成像仪,北京五洲东方科技发展有限公司;FE28型FiveEasy Plus台式pH计,上海屹利科学仪器有限公司。
2 方法
2.1 分组、造模及给药 大鼠适应性饲养1周后,随机分为6组,每组12只,分别为对照组,模型组,DB 低、中、高剂量(6.25、25、100 mg/kg,给药剂量为前期的预实验结果)组和阳性药(乳果糖,6 g/kg)组。DB组和阳性药组每天灌胃给药1次,连续给药7 d,对照组和模型组均灌胃等体积生理盐水。于给药第6天开始造模,除对照组外,各组大鼠均腹腔注射硫代乙酰胺(TAA,300 mg/kg[14])1 次,连续 2 d,对照组腹腔注射等体积生理盐水。造模期间,为防止大鼠发生电解质紊乱等并发症,从首次腹腔注射TAA后,每12 h皮下注射3 mL 10%葡萄糖、2 mL生理盐水和20 μmol氯化钾的等量混合液。末次腹腔注射TAA后将全部大鼠禁食12 h,次日以10%水合氯醛麻醉,腹主动脉采血,于冰上迅速取肝、脑组织。
2.2 指标检测
2.2.1 大鼠一般状态、分期评分及死亡率 观察各组大鼠在造模前后精神状态、毛色、活动、死亡情况并记录。根据大鼠肝性脑病诊断标准[15],若大鼠出现嗜睡、反应迟缓,自主活动减少、共济失调、昏迷等症状之一,则可诊断为肝性脑病,并根据Zimmermann法[15]对大鼠肝性脑病分级进行评分,见表1。

表1 肝性脑病的分级评分标准Tab.1 Grading and scoring standards for hepatic encephalopathy
2.2.2 行为学检测 将水注入直径130cm、高50cm的圆形黑色内壁水池中,水深25 cm、水温(25±1)℃,水下1.5 cm处放置黑色平台(8 cm×8 cm),池壁上贴有不同颜色的 4 个数字:1、2、3、4,它们将水池平分为4个象限。测试前1 d将所有大鼠放入水池中自由游泳90 s。随后将所有大鼠每天训练4次,每次90 s,共训练5 d,将大鼠头朝向池壁依次从4个象限入水,当90 s已到或大鼠已找到平台,停止录像,并让大鼠在平台上休息20 s,记录大鼠寻找并爬上平台的时间(寻台潜伏期),未找到平台的大鼠记为90 s。于第6天,记录大鼠寻台潜伏期和撤掉平台后90 s内穿越原平台位置的次数(即穿环指数)。
2.2.3 血氨和结肠内容物pH测定 末次腹腔注射TAA 24 h后进行取眼眶血,应用快速血氨测定仪检测大鼠全血中氨的含量。取大鼠回盲肠后端结肠大约10 cm,采用pH计法检测结肠内容物pH值。
2.2.4 血清及肝生化指标测定 采用全自动生化仪检测血清中天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、总胆红素(TBiL)的浓度。通过酶联免疫吸附实验(ELISA)检测血清中TNF-α和IL-6水平。
2.2.5 肝组织病理检查 剪取肝组织左叶,置于4%多聚甲醛中固定,脱水、包埋和切片,进行苏木精-伊红(HE)染色,在光学显微镜下(×100)观察肝脏病理变化。
2.2.6 神经递质含量检测 称取大鼠前额叶皮质组织,制成10%的匀浆,按照试剂盒说明书测定前额叶皮质中GABA和谷氨酸含量。
2.2.7 蛋白免疫印迹法检测大鼠前额叶皮质中PI3K,p-AKT蛋白的表达 取各组大鼠前额叶皮质组织,加入细胞裂解液,裂解后离心取上清液,采用BCA定量试剂盒法进行蛋白测定。然后进行SDS凝胶电泳,转膜、封闭、一抗孵育4℃过夜,二抗室温孵育1 h后使用化学发光剂曝光,应用Image-Pro Plus 6.0软件进行结果计算。
2.3 统计学方法 应用GraphPad Prism 5.01统计软件进行统计学分析,结果用均数±标准差(±s)表示,多组间比较采用单因素方差分析,采用Tukey法进行组间两两比较。P<0.05为差异有统计学意义。
3 结果
3.1 对大鼠一般状态、分期评分及死亡率的影响对照组大鼠活动无异常,神经反射灵敏。模型组大鼠首次腹腔注射TAA 24 h后,出现食欲下降,行动减缓,皮毛疏松;第2次腹腔注射TAA 24 h后,大鼠体毛明显变黄,呼吸频率加快,步态不稳,共济失调,甚至昏迷。各给药组大鼠活动减少、行动迟缓、昏迷等情况较模型组有改善。与模型组相比,DB低、中、高剂量组均可显著改善肝性脑病大鼠分级评分(P<0.01),且可显著降低死亡率。见表 2。

表2 大鼠肝性脑病评分和死亡率比较Tab.2 Comparison of hepatic encephalopathy score and mortality of rats
3.2 对大鼠寻台潜伏期与穿环指数的影响 比较各组大鼠在造模0 h寻台潜伏期,差异无统计学意义(P>0.05),说明组间具有可比性。末次腹腔注射TAA 24 h后,发现与模型组相比,DB低、中、高剂量组均能明显降低大鼠寻台潜伏期(P<0.05);DB中、高剂量组能明显增加穿环指数(P<0.01 或 P<0.05)。可以推测DB可改善肝性脑病大鼠的学习和记忆能力,见表3。
表3 不同时间段各组大鼠寻台潜伏期和穿环指数比较(±s)Tab.3 Comparison of seeking latency and piercing index of rats in different periods(±s)
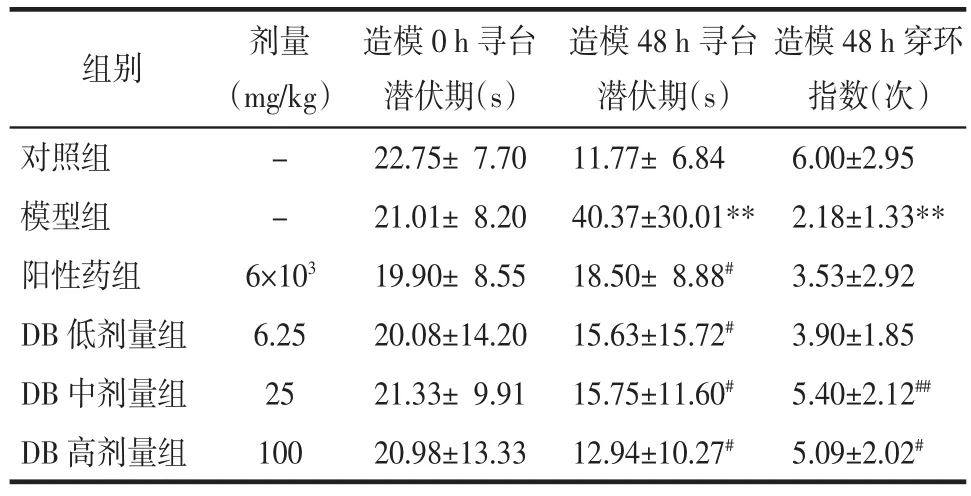
表3 不同时间段各组大鼠寻台潜伏期和穿环指数比较(±s)Tab.3 Comparison of seeking latency and piercing index of rats in different periods(±s)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
?
3.3 对血氨和结肠内容物pH的影响 与对照组相比,模型组大鼠血氨和结肠内容物pH水平均显著升高(P<0.01),说明 TAA 成功诱导大鼠急性肝性脑病。与模型组相比,DB中、高剂量组和阳性药组均能明显降低大鼠血氨水平(P<0.01 或 P<0.05);低、中、高剂量组和阳性药组均能明显降低大鼠结肠内容物pH值(P<0.01)。结果表明DB能降低大鼠体内氨的含量,具有改善肝性脑病作用。见表4。
表4 各组大鼠血氨和结肠内容物pH值的比较(±s)Tab.4 Comparison of blood ammonia and pH of colon contents of rats in each group(±s)

表4 各组大鼠血氨和结肠内容物pH值的比较(±s)Tab.4 Comparison of blood ammonia and pH of colon contents of rats in each group(±s)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与 DB 低剂量组比较,△P<0.05。
结肠内容物pH对照组 - 102.0±25.40 6.76±0.19模型组 - 228.7±68.33** 7.40±0.31**阳性药组 6×103 179.0±23.43# 6.75±0.24##DB 低剂量组 6.25 194.2±49.64 6.99±0.13##DB 中剂量组 25 145.5±25.56##△ 6.73±0.19##DB 高剂量组 100 156.5±25.73## 6.57±0.24##△组别 剂量(mg/kg)血氨值(μmol/L)
3.4 各组血清及肝生化指标测定结果 与对照组相比,模型组大鼠血清中 ALT、AST、TBiL、ALP 水平均显著升高(P<0.01),说明 TAA 诱导的急性肝性脑病模型大鼠出现严重肝脏损伤。与模型组相比,阳性药组可显著降低 ALT、AST、TBiL 水平(P<0.05 或P<0.01)。DB 中、高剂量组显著降低 ALT、AST、TBiL、ALP 水平(P<0.05 或 P<0.01);低剂量组可显著降低 ALT、TBiL 水平(P<0.01)。表明 DB 有较好的保护肝细胞、改善肝功能作用。与对照组相比,模型组大鼠血清中TNF-α和IL-6水平显著提高(P<0.01 或 P<0.05)。与模型组相比,DB 中、高剂量组能显著降低 TNF-α 水平(P<0.01);DB 低、中、高剂量组均能显著降低 IL-6 水平(P<0.05 或 P<0.01)。结果说明DB可通过抑制促炎细胞因子的表达来发挥对肝性脑病的干预作用。见表5。
表5 各组大鼠血清中 ALT、AST、TBiL、ALP、TNF-α、IL-6浓度(±s)Tab.5 Concentrations of AST,ALT,TBiL,ALP,TNF-α and IL-6 in serum of rats in each group(±s)
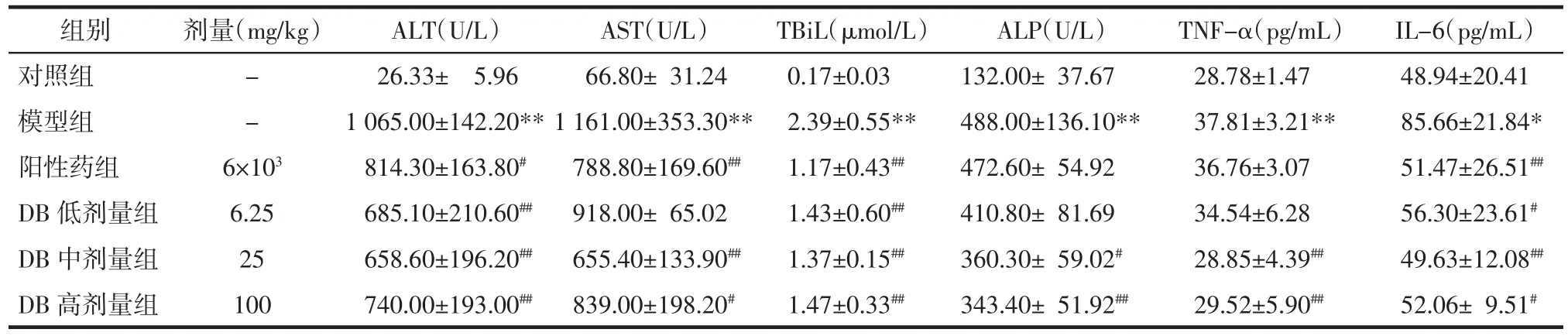
表5 各组大鼠血清中 ALT、AST、TBiL、ALP、TNF-α、IL-6浓度(±s)Tab.5 Concentrations of AST,ALT,TBiL,ALP,TNF-α and IL-6 in serum of rats in each group(±s)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别对照组模型组阳性药组DB低剂量组DB中剂量组DB高剂量组剂量(mg/kg) ALT(U/L) AST(U/L) TBiL(μmol/L) ALP(U/L) TNF-α(pg/mL) IL-6(pg/mL)-26.33± 5.96 66.80± 31.24 0.17±0.03 132.00± 37.67 28.78±1.47 48.94±20.41- 1 065.00±142.20**1 161.00±353.30** 2.39±0.55** 488.00±136.10** 37.81±3.21** 85.66±21.84*6×103 814.30±163.80# 788.80±169.60## 1.17±0.43## 472.60± 54.92 36.76±3.07 51.47±26.51##6.25 685.10±210.60## 918.00± 65.02 1.43±0.60## 410.80± 81.69 34.54±6.28 56.30±23.61#25 658.60±196.20## 655.40±133.90## 1.37±0.15## 360.30± 59.02# 28.85±4.39## 49.63±12.08##100 740.00±193.00## 839.00±198.20# 1.47±0.33## 343.40± 51.92## 29.52±5.90## 52.06± 9.51#
3.5 大鼠肝组织病理变化 光学显微镜下观察各组大鼠肝织病理切片,结果见图1。对照组大鼠肝小叶结构完整,未见肝细胞变性坏死,肝细胞排列整齐,肝索以中央静脉为中心呈放射状排列。模型组大鼠肝细胞水样变性明显,可见明显的肝细胞溶解、坏死,以小叶中心性坏死为主,桥接坏死多见,坏死区可见中重度炎细胞浸润(混合细胞浸润,以淋巴细胞为主),坏死及坏死后纤维组织增生明显,发生纤维化,小叶结构失常。与模型组相比,阳性药组肝细胞坏死及炎细胞浸润稍减轻。DB低、高剂量组水样变性减轻,炎细胞浸润减轻,坏死后肝纤维化为主;DB中剂量组炎细胞浸润,坏死,肝纤维化较模型组减轻,坏死后纤维组织增生较明显,小叶结构尚正常。
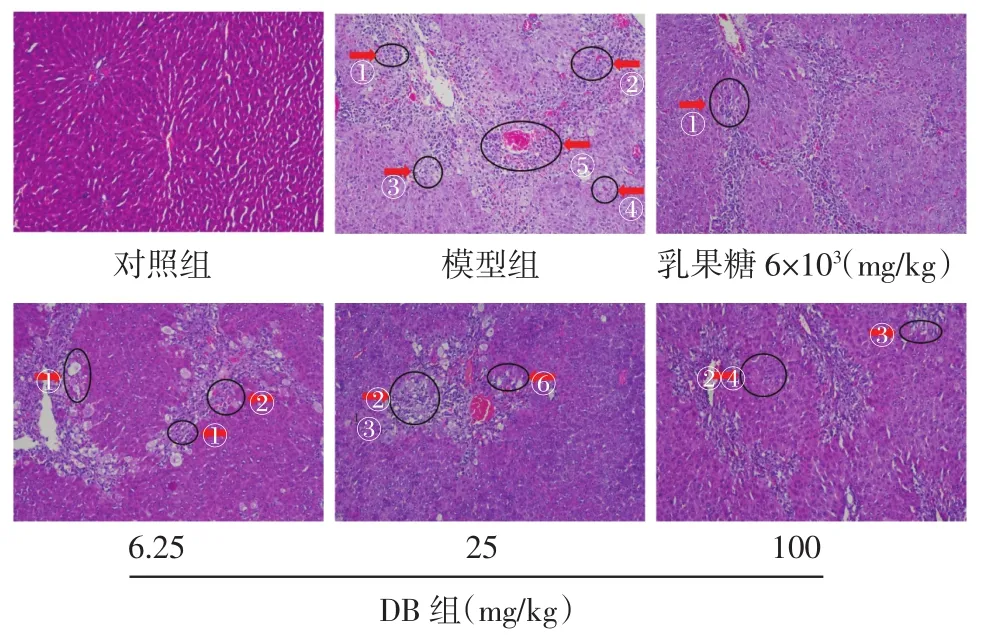
图1 DB对肝性脑病大鼠肝组织病理变化的影响(HE,×100)Fig.1 Effect of DB on pathological changes of liver tissue in hepatic encephalopathy rats(HE,×100)
3.6 对大鼠前额叶皮质中GABA和Glu浓度的影响 ELISA检测结果见表6。与对照组相比,模型组大鼠前额叶皮质中GABA水平显著增加(P<0.01)。与模型组相比,DB低、中、高剂量组和阳性药组均能显著降低 GABA 水平(P<0.05 或 P<0.01)。与对照组相比,模型组大鼠前额叶皮质中Glu水平出现下降趋势,各给药组大鼠Glu水平较模型组有升高趋势,但差异无统计学意义(P>0.05)。结果表明,DB 可以通过调节大鼠前额叶皮质中GABA及Glu的含量来发挥对肝性脑病的干预作用。
表6 各组大鼠前额叶皮质中GABA、Glu浓度(±s)Tab.6 Concentrations of GABA and Glu in the prefrontal cortex of rats in each group(±s)
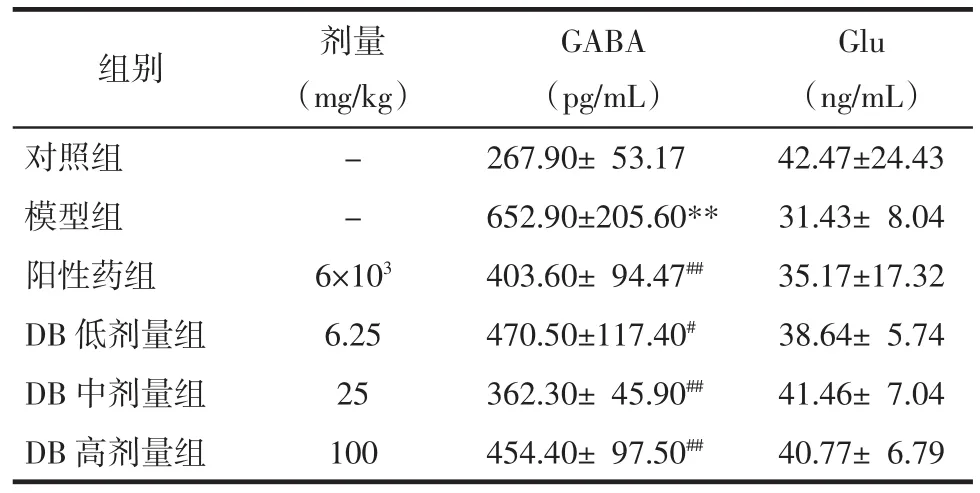
表6 各组大鼠前额叶皮质中GABA、Glu浓度(±s)Tab.6 Concentrations of GABA and Glu in the prefrontal cortex of rats in each group(±s)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
Glu(ng/mL)对照组 - 267.90± 53.17 42.47±24.43模型组 - 652.90±205.60** 31.43± 8.04阳性药组 6×103 403.60± 94.47## 35.17±17.32 DB 低剂量组 6.25 470.50±117.40# 38.64± 5.74 DB中剂量组 25 362.30±45.90## 41.46±7.04 DB高剂量组 100 454.40±97.50## 40.77±6.79组别 剂量(mg/kg)GABA(pg/mL)
3.7 对大鼠前额叶皮质中PI3K、p-AKT蛋白表达的影响 为进一步探讨DB的作用机制,利用Western blot技术对与肝性脑病相关的关键蛋白进行分析。与对照组相比,模型组大鼠前额叶皮质中PI3K 和 p-AKT 蛋白水平显著升高(P<0.05);与模型组相比,DB低、中剂量组可显著降低PI3K蛋白水平(P<0.01 或 P<0.05);DB 中、高剂量组可显著降低p-AKT 蛋白水平(P<0.05或 P<0.01)。说明 DB 可以通过调控前额叶皮质中PI3K和p-AKT的蛋白表达来发挥对肝性脑病的干预作用。见图2、表7。
表7 各组大鼠前额叶皮质中PI3K、p-AKT蛋白表达情况(±s)Tab.7 The expression of PI3K and p-AKT proteins in the prefrontal cortex of rats in each group(±s)

表7 各组大鼠前额叶皮质中PI3K、p-AKT蛋白表达情况(±s)Tab.7 The expression of PI3K and p-AKT proteins in the prefrontal cortex of rats in each group(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01。
组别 剂量(mg/kg) PI3K/β-actin P-AKT/β-actin对照组 — 0.337±0.027 0.155±0.098模型组 — 0.890±0.135* 0.609±0.173*阳性药组 6×103 0.144±0.098## 0.336±0.177 DB 低剂量组 6.25 0.233±0.254# 0.219±0.049 DB 中剂量组 25 0.181±0.099## 0.097±0.049##DB 高剂量组 100 0.442±0.373 0.143±0.140#
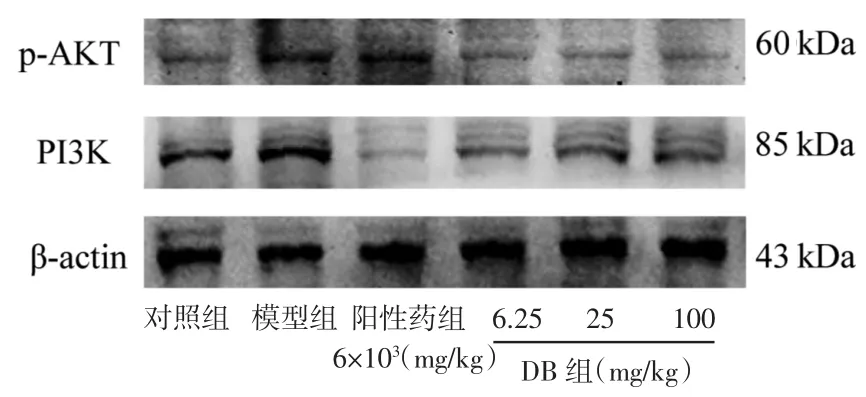
图2 大鼠前额叶皮质中PI3K、p-AKT蛋白表达情况Fig.2 Expression of PI3K and p-AKT in the prefrontal cortex of rats
4 讨论
本实验采用TAA诱导法建立急性肝性脑病大鼠模型,其机制为TAA被肝细胞内细胞色素P450氧化酶代谢,产生有毒的TAA-硫氧化合物,进而引起脂质过氧化、肝脏代谢紊乱等损伤,导致炎细胞浸润、肝细胞坏死及肝纤维化等改变,最终引起急性肝功能衰竭诱发A型肝性脑病[16]。该模型的3个判断标准为大鼠行为学,血氨值和肝功能指标的变化[17]。本实验发现TAA造模后,模型组大鼠行为学、血氨、肝生化指标与对照组相比,均有显著性改变,说明急性肝性脑病大鼠模型造模成功。
临床上评价药物治疗肝性脑病的效果时,主要观察指标为患者的认知功能、血氨水平和肝功能指标。本实验选择Morris水迷宫实验,它是研究动物空间学习和记忆能力常用的模型工具[18],通过测定寻台潜伏期来评价大鼠的空间学习能力、测定穿环指数来评价大鼠的空间记忆能力。结果显示,TAA造模后,与空白组相比,模型组大鼠寻台潜伏期出现显著延长,穿环指数显著减少;预防性给予DB治疗后,中、高剂量组可显著降低寻台潜伏期,增加穿环指数,说明DB可以改善肝性脑病大鼠的学习和记忆能力。此实验选择血氨和结肠内容物pH值这两个指标来反映肝性脑病大鼠体内氨水平。结果显示,DB中、高剂量组可显著降低肝性脑病大鼠血氨水平,且低、中、高剂量组均可降低结肠内容pH值,推测其发挥作用的方式可能为DB酸化肠道后,导致肠道内细菌产氨减少,同时减少氨分子的吸收,促进血氨渗入肠道排出[19]。故DB可有效降低肝性脑病大鼠体内氨含量。本研究选择ALT、AST、ALP、TBiL作为肝功能检测指标,其中ALT和AST是血清肝生物标志物,是早期急性肝损伤的主要生化指标[20],ALP和TBiL在肝损伤或胆汁淤积时会出现升高[21]。实验结果显示,与对照组相比,模型组上述肝功指标出现显著升高,说明模型组大鼠肝损伤严重,DB中、高剂量组可显著降低上述4个指标,说明其有较好的保护肝细胞、改善肝功能作用。此外,由于急性肝性脑病有死亡率高的特点[3],故本研究考察了各组大鼠死亡情况,发现DB可以显著降低急性肝性脑病大鼠的死亡率,其原因与改善上述提及的指标有关。
炎症反应在肝性脑病的病理过程中发挥着重要作用,当肝脏损伤后,体内出现严重的炎症反应,大量的炎症介质与高血氨协同对大脑产生影响,其中TNF-α和IL-6能增加脑血管内皮细胞的通透性、破坏血脑屏障功能,从而引发中枢神经系统内的炎症反应。此实验结果显示,与模型组相比,DB中、高剂量组可显著降低血清中TNF-α和IL-6水平,说明DB可通过减少促炎细胞因子的表达来发挥对肝性脑病的干预作用。
神经递质异常在肝性脑病发病机制中的作用愈受关注,Jones[22]指出肝性脑病的发生是因为抑制性神经递质如GABA和兴奋性神经递质如谷氨酸功能失衡[23]。肝性脑病发生时,GABA入脑增多,影响肝性脑病大鼠学习、记忆[24]。Glu,作为兴奋性神经递质,对突触可塑性的维持、神经发育、神经元回路的形成和学习过程起重要作用[25]。本实验结果显示,DB能显著降低肝性脑病大鼠前额叶皮质中GABA含量,增加前额叶皮质中谷氨酸水平,表明DB可以通过调节大鼠前额叶皮质中GABA和谷氨酸含量,起到改善肝性脑病的作用。
为进一步研究DB对急性肝性脑病大鼠的干预作用机制,结合文献研究表明,黄芩素可通过调节PI3K/AKT通路来发挥神经保护作用[26-27]。本实验结果显示,模型组大鼠前额叶皮质中PI3K和pAKT蛋白表达较对照组显著上升,DB中剂量组可显著降低PI3K和pAKT蛋白表达,说明DB可能通过调节PI3K/Akt通路发挥神经保护作用,起到改善肝性脑病作用。
综上所述,DB能够改善TAA诱导的急性肝性脑病大鼠的学习记忆能力和肝功能,降低体内氨水平,抑制炎症因子表达,调节前额叶皮质中神经递质(GABA和谷氨酸)水平,其作用机制可能与调控PI3K/AKT信号通路有关。
