非甾体类抗炎药相关小肠损伤的研究进展
2021-11-25朱兰平赵经文王邦茂
罗 洋,朱兰平,雷 月,赵经文,王邦茂,陈 鑫
罗洋,朱兰平,雷月,赵经文,王邦茂,陈鑫,天津医科大学总医院消化内科 天津市 300052
0 引言
自从1899年阿司匹林被合成以来,非甾体类抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)成为世界上使用最广泛的解热、镇痛和抗炎药之一,一直在临床中被广泛运用[1].由于阿司匹林的抗血小板特性,使得心血管疾病的死亡风险大大降低[2].近年来,研究发现阿司匹林也对某些癌症具有防治作用,包括乳腺癌[3]、结直肠癌[4]等.虽然NSAIDs给患者带来了很多益处,但它们也可以引起许多并发症,其中以胃肠道并发症最常见.NSAIDs可引起严重的胃肠道损伤,如出血、穿孔和溃疡等[5],这往往限制了这些药物的使用.一直以来,人们对NSAIDs引起的十二指肠远端损伤的关注较少,但随着视频胶囊内窥镜检查(video capsule endoscope,VCE)[6]和气囊辅助内窥镜检查(double-balloon enterosocope,DBE)[7]的引入,人们观察到NSAIDs也可对小肠造成损伤[8],而且其死亡率高于NSAIDs所引起的上消化道损伤[9].本文就NSAIDs所致小肠损伤的流行病学、临床表现、诊断、危险因素、发病机制和治疗作一综述,为NSAIDs的使用及其并发症的防治提供参考.
1 流行病学
NSAIDs很容易被人们获得,并且在没有规范指导的情况下被随意使用.据估计,在全世界范围内,每天大约有3000万人在服用NSAIDs[10].2010年美国全国健康访谈调查(National Health Interview Survey,NHIS)显示,约有4300万成年人(19.0%)每周至少服用三次阿司匹林,且服用时间超过3个月.而超过2900万成年人(12.1%)长期服用NSAIDs.与2005年相比,阿司匹林的使用人数增加了57%,NSAIDs的使用人数增加了41%[1].除此之外,通过胶囊内窥镜观察到在长期服用NSAIDs的患者中,有50%-70%的患者出现了小肠损伤[11],这比NSAIDs引起的胃损伤更为常见[12],这些患者有时甚至会引发出血和穿孔等更严重的并发症[13].但目前人们在临床工作中对NSAIDs相关小肠损伤重视度仍不够,由于在长期服用NSAIDs的患者中,60%-70%的患者的小肠损伤都处于亚临床阶段,无明显的症状,当出现了严重并发症后才会被识别[14].
2 诊断NSAIDS相关肠病
在内窥镜引入之前,NSAIDs相关肠病是通过小肠通透性和炎症的测定诊断的.51Cr标记的乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)对小肠的通透性的测定相对特异,是诊断NSAIDs相关肠病的最常用的方法[15,16].111铟(In)标记白细胞进行闪烁显像可以用于检测小肠炎症[17].此外,钙卫蛋白可用作小肠的炎症标记物,通过粪便钙卫蛋白定量,可以评估NSAIDs引起的小肠损伤[18].
VCE和DBE能够使小肠损伤的定位更精确.与DBE相比,VCE对小肠出血诊断率更高,可以更好地评估NSAIDs引起的小肠损伤[19].因此,这些诊断方法可以更好地发现NSAIDs引起的小肠损伤.
3 临床表现
NSAIDs相关肠病发生率很高,但大多数患者并无典型临床表现[20].60%-70%表现出非特异性症状,如缺铁性贫血、低白蛋白血症、维生素B12吸收不良、腹泻和急性腹痛.严重者可能出现大出血、狭窄和穿孔等并发症[21].
3.1 消化道出血 NSAIDs引起的小肠损伤,即使程度较轻,也会导致持续性出血和缺铁性贫血.研究发现47%的小肠溃疡患者,每天有2-10 mL的失血量[21-23].临床上,明显的出血相对罕见,多由溃疡和糜烂引起(图1).
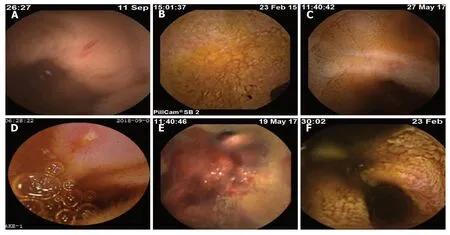
图1 NSAIDs相关小肠损伤的胶囊内镜图片.A:空肠黏膜片状发红;B:空肠肠黏膜明显粗糙伴糜烂;C:回肠黏膜充血水肿,表面糜烂;D:回肠黏膜小溃疡;E:回肠黏膜出血;F:回肠肠腔狭窄.NSAIDs:非甾体类抗炎药.
3.2 蛋白质丢失 长期使用NSAIDs引起的肠黏膜炎症常导致低白蛋白血症[8].以往,蛋白质的丢失被认为是继发于出血,但研究发现[22],在部分伴有蛋白丢失的肠病患者中,未发现肠道内出血病变.因此,肠病引起的蛋白质丢失可以在没有糜烂或溃疡等病变的情况下发生.
3.3 穿孔和梗阻 NSAIDs引起的小肠穿孔相对罕见.仅在使用高剂量吲哚美辛治疗患者时有穿孔相关的病例报道[21,22].此外,研究显示[21],NSAIDs引起的慢性溃疡会导致肠道纤维化和隔膜样狭窄,有17%的NSAIDs诱导的小肠溃疡患者会发生小肠梗阻.这可能与药物剂量和持续时间有关[22].
4 危险因素
危险因素评估对管理NSAIDs引起的小肠损伤是非常重要的,与NSAIDs引起上消化道损伤相比,对NSAIDs所致小肠损伤的危险因素的研究有限,以下是对相关研究的归纳.
4.1 抑酸药 质子泵抑制剂(proton pump inhibitors,PPIs)和H2受体拮抗剂,可明显减少NSAIDs导致的胃和十二指肠的溃疡和出血.然而,研究表明[24-26],这些药物对小肠没有保护作用,甚至抑酸药会明显加重NSAIDs引起的小肠损伤和出血.一项研究表明,奥美拉唑有降低微生物多样性、操作分类单元(operational taxonomic units,OTU)、菌群丰度指数(Chao1指数)和菌群多样性指数(Shannon指数)的趋势.同样地,Wang等人[27]的研究表明,PPI是低剂量阿司匹林引起的小肠损伤的独立危险因素.此外,有研究发现[28],雷贝拉唑会增加健康志愿者服用塞来昔布后小肠损伤的发生率.这些结果提示,PPI可导致小肠微生物多样性丧失,这可能是PPI加重NSAIDs所致小肠损伤的重要原因.
4.2 小肠细菌过度生长 小肠细菌过度生长(small intestinal bacterial overgrowth,SIBO)是一种菌群失调,表现为小肠中细菌过多,空肠中细菌大于105个单位/毫升个菌落,并出现症状或吸收不良[29].十二指肠抽吸术(duodenal aspiration,DA)和乳果糖呼气试验(lactulose breath test,LBT)常用于诊断SIBO.一项评估SIBO与小肠损伤之间关系的研究显示[30],通过LBT诊断,SIBO是NSAIDs和长期低剂量阿司匹林使用者发生严重小肠损伤的独立危险因素.此外,解剖异常[31]、小肠动力障碍[32]等都可能会导致SIBO.
4.3 其他 研究发现,联合使用非阿司匹林类NSAIDs比单独使用阿司匹林对小肠的粘膜损伤程度更重[33].一项临床研究调查显示[34],在服用消炎痛后,男性的肠道通透性高于女性,且微生物多样性低于女性.这些变化在停药后可恢复正常.在NSAIDs引起的小肠损伤中,老年人群中的发病率更高[35],并且随着年龄的增长,每年可增加4%的发病风险[36].此外,心理应激会引起肠道微生物群和通透性的变化,从而加剧NSAIDs引起的小肠损伤[37].另外,食用含乳化剂聚山梨酯-80(polysorbate 80,p80)的食品可导致回肠菌群失调,增强了NSAIDs诱导的小肠损伤[38].这些针对危险因素的研究只涉及少数患者,因此,还需要进行大规模的临床研究来进一步证实.
5 NSAIDS相关小肠损伤机制
与NSAIDs引起上消化道损伤的机制不同,NSAIDs相关小肠损伤的发病机制尚未明确.目前,普遍认为NSAIDs诱导的肠病是一个多因素、多步骤协同导致的病理损伤.
5.1 环氧合酶抑制与局部损伤效应 在小肠中,环氧合酶1(cyclo-oxygen-ase-1,COX-1)负责黏膜前列腺素的合成,前列腺素E2(prostaglandin E2,PGE2)是小肠中主要的前列腺素,负责粘液和碳酸氢盐的合成和分泌,以及调节黏膜血流和上皮细胞增殖,而NSAIDs可抑制环氧化酶的活性.最初,NSAIDs相关肠病的发病机制认为只与COX-1受到抑制有关.然而,Hotz-Behofsits等人[39]证明了选择性COX-1抑制不会导致小肠损害,联合抑制COX-1和环氧合酶2(cyclo-oxygen-ase-2,COX-2)或抑制COX-2会导致肠局部损伤,这表明,NSAIDs肠病可以在没有COX-1抑制的情况下发生,COX-1介导产生的PGE2不足以保护NSAIDs引起的局部肠损伤.
NSAIDs可以抑制肠内前列腺素的合成,但缺乏前列腺素并不一定会导致小肠损伤[40].NSAIDs局部损伤作用是通过非环氧化酶依赖途径,是药物在肠腔内与黏膜接触的结果[41,42],主要涉及NSAIDs对肠上皮细胞内线粒体的影响.在实验中发现[43],NSAIDs可以解除离体大鼠肝线粒体的氧化磷酸化,并抑制了偶联线粒体的呼吸作用.NSAIDs的解偶联活性作用主要是由于线粒体膜上转换孔(mitochondrial permeability transition pore,mPTP)的开放,PTP是由连接线粒体膜内外的蛋白质组成[44-46].mPTP的开放与线粒体功能障碍有关[47].mPTP的开放可以诱导细胞色素c从线粒体基质释放到细胞质中,从而导致细胞死亡.因此,线粒体损伤可能引起黏膜屏障功能紊乱和小肠通透性升高,并且在NSAIDs引起的小肠损伤的早期过程中起着重要的作用[42].
5.2 胆汁因素 胆汁在小肠损伤的发病机制中起着重要作用.熊去氧胆酸加重了吲哚美辛引起的大鼠肠道炎症,在一项肠道鼠肠上皮细胞(intestinal epithelial cell-6,IEC-6)的体外研究中,胆汁和吲哚美辛的联合使用增加了细胞膜的通透性,并且比单独使用这些药物细胞毒性更强.另一项研究发现,给大鼠服用NSAIDs会增加了胆汁中次级胆汁酸的浓度[48],次级胆汁酸对肠上皮细胞毒性比初级胆汁酸更强.初级胆汁酸向次级胆汁酸的转化依赖于肠道细菌酶,因此,NSAIDs可能通过改变了肠道微生物从而改变胆汁的细胞毒性.虽然胆汁酸损伤小肠的确切机制尚不清楚,但某些胆汁酸,如牛磺脱氧胆酸和脱氧胆酸,已被证实在IEC-6细胞中能诱导促炎因子IL-8的产生,并激活NF-κΒ信号通路[49,50].另外,有研究显示,鹅去氧胆酸等胆汁酸可以打开PTP通道从而引起肠上皮细胞死亡[51].
胆汁介导的小肠损伤可能有两种机制.首先,包括胆汁酸在内的胆汁成分是NSAIDs所致肠病发病的主要侵袭性因素.其次,肠-肝循环在小肠损伤的发病机制中起着至关重要的作用.许多NSAIDs具有羧酸结构,在肝脏中与酰基葡萄糖醛酸结合后分泌到胆汁中.这些偶联物经小肠管腔中的细菌β-葡萄糖醛酸酶酶解后被重新吸收.这种肠-肝循环可导致肠粘膜长期和反复暴露于NSAIDs,导致肠道损伤.未经过肠-肝循环的NSAIDs则没有引起明显的小肠溃疡[52,53].
5.3 肠道细菌因素 肠道细菌在NSAIDs引起的小肠溃疡中起着至关重要的作用.Robert等人[54]报道,用吲哚美辛治疗的无菌大鼠未出现肠溃疡,而暴露于大肠杆菌的无菌大鼠,大肠杆菌对小肠产生了严重的损伤.研究发现[55,56],在NSAIDs引起小肠损伤的发生过程中,革兰氏阴性细菌数量增加.而在给予氨苄青霉素后,能显著抑制NSAIDs诱导的小肠损伤[57].尽管肠道细菌侵入粘膜的机制目前尚不清楚,但研究表明[58-60],在吲哚美辛治疗后,粘液分泌的减少可能是导致损伤的原因之一.粘液在抵抗肠道病原体和刺激物中起着重要的作用,粘液分泌的减少可能会削弱肠道屏障,导致细菌入侵.一项研究发现[60],氯索洛芬降低了小肠MUC2mRNA的表达,MUC2是一种重要的粘蛋白,在分泌型粘蛋白的二聚化过程中起主要作用,这是胃肠道粘液形成的关键步骤[61].综上,肠道细菌损伤肠粘膜是通过多种因素实现的,包括肠道运动亢进和诱导型一氧化氮合酶/一氧化氮的上调[40].
5.4 肠道内先天免疫的激活 肠道内先天免疫的激活,主要是通过肠道细菌和其他因素触发了炎症级联反应.
Toll样受体(toll-like receptors,TLR)家族在针对微生物病原体的先天免疫应答以及随后的适应性免疫应答中起着至关重要的作用.TLR能识别微生物病原体的特定分子模式-病原体相关分子模式(pathogen-associated molecular patterns,PAMPs).这些外源性配体与TLR结合激活下游信号通路,包括核因子κB(NF-κB)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和Ⅰ型干扰素(IFN-I)通路,诱导促炎细胞因子和趋化因子产生,加重肠道损伤.TLR除了识别PAMPs之外,也能够识别内源性配体-危险相关分子模式(danger-associated molecular patters,DAMPs).高迁移率族蛋白盒-1(high mobility group box-1 protein,HMGB-1),从损伤的上皮细胞释放,通过TLR2和晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)以及TLR4发挥促炎作用[62].有研究发现[63],在NSAIDs诱导的肠病中,重组HMGB-1也可以通过激活NF-κB和MAPK通路加重肠道损伤.
NSAIDs引发的炎症信号还能够激活NLR家族[样受体家族3(NOD-like receptors,NLRP3)]的炎症体[64],NLRP3可以识别细胞内外产生的应激源信号,触发炎症小体的组装,导致半胱氨酸天冬氨酸蛋白酶-1(caspase-1)原的激活[65].Caspase-1被激活后,可以促进白介素-1β前体(Pro-IL-1β)和白介素-18前体(Pro-IL-18)的加工,使它们变成活性形式.白介素-1β(IL-1β)可以加重NSAIDs引起的肠道损伤.此外,研究发现[64],NLRP3和caspase-1基因缺陷型小鼠的小肠损伤严重程度减轻,同时成熟的IL-1β的合成水平降低,提示NLRP3衍生的IL-1β介导了炎症级联反应和损伤.
6 防治
6.1 保守治疗 对于NSAIDs引起的复杂肠病,一项回顾性研究显示,停用NSAIDs后,71%的患者,在随访15.9个月后,经内窥镜检查,仅有4.3%出现并发症[8].故可先行保守治疗,如出现并发症,采用药物治疗干预.
6.2 药物治疗 预防NSAIDs相关肠病最有效的方法是停用NSAIDs,然而,某些心血管疾病患者,禁止停用NSAIDs.因此,通过药物防治是安全使用NSAIDs的主要措施(表1).

表1 NSAIDs相关小肠损伤的干预治疗
6.2.1 黏膜保护剂:米索前列醇:前列腺素(prostaglandinum,PG)在黏膜保护中起着重要作用.在多项研究中,合成的PG类似物米索前列醇可以降低NSAIDs引起的肠道通透性增加[35,66].尽管米索前列醇对NSAIDs引起的肠病有治疗效果,但它也会引起许多胃肠道不良反应,如恶心、消化不良、腹痛和腹泻[12].这些副作用可能限制其在临床上的应用.
瑞巴派特:瑞巴派特是一种粘膜保护药物,已在临床上用于治疗胃炎和消化性溃疡[67].临床证据表明[68],瑞巴派特对NSAIDs引起的小肠损伤有保护作用.瑞巴派特不仅可以通过上调COX-2的表达和β-catenin的合成来改善小肠的屏障结构[69],还可以增加小肠粘液分泌从而减轻NSAIDs对小肠的损伤[70].此外,有研究显示[71,72],瑞巴派特可以通过调节肠道菌群,抑制吲哚美辛诱导的小肠损伤.因此,在临床上,瑞巴派特可能有助于减轻服用NSAIDs的患者的小肠损伤.
替普瑞酮:替普瑞酮是一种副作用较小的粘膜保护剂,在亚洲地区广泛用于治疗胃炎和胃溃疡.已有报道[73,74],替普瑞酮不仅对NSAIDs引起的胃粘膜损伤有保护作用,而且对小肠粘膜损伤也有保护作用.有研究发现[75],替普瑞酮可以通过减轻黏膜的自由基损伤以及促进小肠中血管内皮生长因子的合成,改善阿司匹林导致的小肠黏膜损伤.
6.2.2 益生菌:益生菌对NSAIDs诱导的肠病的防治十分重要.研究显示[76,77],干酪乳杆菌和加氏乳杆菌对长期低剂量阿司匹林使用者的肠病有显著的保护作用.口服短双歧杆菌Bif195可降低健康志愿者使用阿司匹林所引起的小肠肠病的风险[78].但这些益生菌的保护机制尚不清楚.NSAIDs联合PPI的使用促进了阿克曼菌的生长并抑制了双歧杆菌的生长,引起小肠中的杯状细胞数量减少,使粘液层变薄,引起小肠损伤,而双歧杆菌G9-1可以通过减轻这种损伤来保护小肠[79].除了对肠道细菌的直接作用外,益生菌代谢物的抗炎特性也有助于抑制NSAIDs诱导的小肠损伤.研究发现[80],这与干酪乳杆菌菌株Shirota(LcS)产生的乳酸阻止了脂多糖触发巨噬细胞中NF-κB和MAPK的激活有关.青春型双歧杆菌,因其有分泌高水平乳酸的能力,在治疗萘普生引起的小肠溃疡和出血中非常有效[81].另外,在吲哚美辛相关肠病中,益生菌(干酪乳杆菌CRL431、副干酪乳杆菌CNCM I-1518)通过增强抗菌活性和增加潘氏细胞数量,增强了肠道屏障功能,同时,促进了调节性T细胞分泌IL-10,抑制肠道炎症,避免了NSAIDs诱导的小肠损伤[82].另有研究显示[83],口服植物乳杆菌TIFN101和WCFS1可以下调小肠的抗原呈递途径,防止了由NSAIDs引起的小肠的免疫应激.此外,双氯芬酸诱导大鼠肠道损伤时,联合使用乳铁蛋白与双歧杆菌BB536可以降低肠道损伤,并恢复髓过氧化物酶(myeloperoxidase,MPO)和血红蛋白水平,这些可能是通过调节TLR-2/-4/NF-κB途径而实现的[84].因此,益生菌是治疗小肠损伤的一种很有前途的方法.
6.2.3 抗生素:甲硝唑与NSAIDs联合使用可有效减轻NSAIDs所致肠病[85].甲硝唑减轻了NSAIDs引起的肠道炎症和失血,但不影响肠道渗透性.甲硝唑的保护作用不是通过抑制肠道内细菌,而是通过抑制肠上皮细胞线粒体中的氧化磷酸化来实现的[12].利福昔明也可以用于治疗NSAIDs相关小肠损伤,其不仅可以直接抗菌,还可以减少细菌毒力,减少细菌对上皮细胞的黏附力、调节肠道免疫信号[86].有研究显示[87],利福昔明可以抑制吲哚美辛引起的大鼠小肠中MPO的活性升高和TNF-α的表达,并调节肠道菌群.此外,研究发现[88],利福昔明对健康志愿者服用两周双氯芬酸后引起的肠道损伤具有预防保护作用.
6.2.4 新型组胺H2受体拮抗剂:拉夫替丁作为一种新型组胺H2受体拮抗药,不仅能持久地抑制胃酸分泌,还能通过激活辣椒素敏感传入神经(capsaicin-sensitive afferent neurons,CSAN),促进降钙素基因相关肽和生长抑素释放,增加胃黏膜血流量,促进黏膜上皮再生,增强消化道黏膜屏障[89,90].有研究发现[60],拉夫替丁可以通过介导CSN,增加小肠Muc2的表达和黏液的分泌,抑制细菌入侵和诱导型一氧化氮合酶表达,从而保护NSAIDs对小肠的损害.拉呋替丁既能抑制胃酸分泌保护胃黏膜,又可通过激活CSN保护小肠黏膜,有望成为理想的“NSAIDs伴侣”,但仍需进一步的临床研究验证[91].
6.2.5 营养干预:营养治疗与药物治疗相比,药理风险相对较低.谷氨酰胺是一种非必需氨基酸,作为肠粘膜细胞的能量来源,据报道[92],短期服用NSAIDs后,谷氨酰胺可有效预防肠粘膜通透性增高.加工过的芦荟凝胶(processed Aloe vera gel,PAG)在临床上有很多益处,如促进伤口愈合、抗癌、抗氧化、抗菌作用.研究发现[93],PAG可以通过ERK依赖途径,调节小肠细胞中粘蛋白的表达,从而减轻NSAIDs所致小肠溃疡.牛初乳中含有大量的生长因子,如胰岛素样生长因子、各种免疫球蛋白和抗菌肽.食用牛初乳可有效减少短期使用NSAIDs引起的肠道损伤和细菌移位[94,95].此外,重组人乳铁蛋白具有杀菌、抗炎和抗氧化作用,可减轻NSAIDs诱导的小肠通透性增加[94,96].通过细胞实验和动物实验发现[97],鸡蛋可以促进细胞增殖,减轻NSAIDs引起的小鼠小肠绒毛损伤.太平洋鳕鱼分解物可以减少NSAIDs引起的小鼠小肠细胞凋亡[98].木瓜提取物通过调节肠道组织内质网应激来预防NSAIDs对小鼠小肠黏膜的损伤[99].
6.2.6 其他药物:TLR2激动剂可以通过抑制TLR4信号传导,减轻吲哚美辛诱导的回肠炎[100].云母可以通过ERK信号通路抑制NSAIDs引起的小肠损伤[101].柚皮苷可以促进生长素释放肽的分泌和GSH-R的表达,并抑制TNF-α的释放,从而修复肠黏膜[102],这些药物将有希望成为防治NSAIDs相关肠病的新方法.
7 展望
NSAIDs所致的小肠损伤已成为临床上的一个重要问题.其具体损伤机制尚未明确,虽然目前发现一些药物可以对NSAIDs相关小肠损伤起保护作用,但还没有确切的临床试验支持.因此,仍需要对服用NSAIDs的患者进行长期研究,加强对NSAIDs相关小肠损伤的防治.
