子宫内膜异位症间质细胞中蛋白激酶Cβ1对MEK1/2表达及细胞增殖侵袭性的影响
2021-11-17商丽红杨玉娥哈春芳
商丽红,杨玉娥,王 芳,哈春芳
(1.宁夏医科大学,银川 750004;2.宁夏医科大学总医院,银川 750004;3.宁夏医科大学生育力保持重点实验室 750004)
子宫内膜异位症(endometriosis,EMs)是指子宫内膜组织(腺体或间质)出现在子宫腔以外的部位所引起的激素依赖性疾病,在育龄期妇女中的患病率约为10%[1]。研究发现,患有EMs的妇女患不孕症、卵巢癌、子宫内膜癌、乳腺癌、黑色素瘤、哮喘及自身免疫性和心血管疾病的风险更高[2]。目前EMs的发病机制仍不清楚。已有研究发现,EMs中MEK/ERK信号通路在调节细胞增殖、凋亡和迁移中起重要作用,MEK/ERK的过度激活促进了EMs内膜基质细胞的增殖和迁移,抑制细胞凋亡[3]。蛋白激酶C(protein kinase C,PKC)是一类典型的丝氨酸/苏氨酸激酶。既往研究证实,PKC参与糖尿病肾病等多种疾病的发生,并能激活MEK/ERK信号通路[4-5]。PKCβ1是蛋白激酶家族的成员之一,研究发现PKCβ1有助于RAS/MEK/ERK信号通路的完全激活[6]。PKCβ1有助于ERK1/2的激活[7]。ERK1/2被认为MEK/ERK信号通路的焦点,而ERK1/2是MEK1/2已知的唯一底物[8]。然而在EMs中PKCβ1是否作用于MEK1/2,进而影响间质细胞的增殖侵袭性尚不清楚。本研究通过沉默PKCβ1,探讨其对MEK1/2的表达及对EMs间质细胞增殖侵袭性的影响,从机制上探讨EMs发生的原因。
1 资料与方法
1.1 标本来源 标本来源于2019年6月至2020年12月在宁夏医科大学总医院行“腹腔镜下卵巢囊肿剥除术”,于术中获取在位及异位子宫内膜组织,术后经病理科诊断为“卵巢子宫内膜异位囊肿”的EMs患者30例。患者年龄25~35岁,月经规律,近3个月未接受激素类药物治疗,无生殖道炎症及其他妇科疾病等。同期因良性卵巢肿瘤行手术治疗的患者30例作为对照组。另取10例EMs患者获取在位子宫内膜组织。该研究通过宁夏医科大学总医院伦理委员会批准并签署知情同意书。
1.2 主要试剂 PKCβ1抗体,MEK1/2抗体,lipofectamine 2000转染试,DAB显色试剂盒,蛋白提取试剂盒,蛋白定量试剂盒。
1.3 实验方法
1.3.1 免疫组化 组织标本由病理科证实为EMs后,于10%甲醛溶液中浸泡过夜,4%甲醛固定,脱水、石蜡包埋,3~4μm厚度连续切片,65℃烘片1~2h,经脱蜡、抗原修复、一抗孵育(PKCβ1,MEK1/2,4℃过夜)、37℃复温1h、二抗37℃孵育1h、DAB显色、梯度酒精脱水、二甲苯透明等后用中性树胶封片,PBS作为阴性对照,应用Image pro plus进行数据处理。
1.3.2 原代细胞培养 术中获取新鲜在位子宫内膜组织放于培养液,30min内转运至细胞间,用PBS(磷酸盐缓冲液)清洗,眼科剪剪成约1mm3大小组织,加胶原酶Ⅳ消化吹打10min,静置后取上清移入新离心管,1∶1比例加培养基终止消化,800r/min离心,吸取上清,种于60mm培养皿,37℃ 5% CO2培养箱培养。次日观察间质细胞生长情况并进行细胞换液,待细胞长到90%以上时进行细胞传代。
1.3.3 间质细胞鉴定 细胞融合达90%以上时,0.25% EDTA胰酶消化种于6孔板。次日待细胞融合50%~60%时,PBS清洗6孔板,4%多聚甲醛固定30min,PBS清洗3次,每次5min,加过氧化物酶阻断剂,室温30min;PBS清洗3次,每次5min;加山羊血清工作液,室温30min;一抗孵育(波形蛋白抗体1∶500,角蛋白1∶50,阴性对照用PBS),室温2h;一抗回收,PBS清洗3次,每次5min;二抗孵育室温1h;PBS清洗3次,每次5min;DAB显色约5min;自来水冲洗,苏木素染色20s;自来水清洗,95%乙醇脱水1~2s,显微镜下观察。
1.3.4 siRNA 转染细胞 生长良好的子宫内膜间质细胞,转染前24h使用无血清无双抗培养基重悬细胞接种于60mm培养皿,置于37℃ 5%CO2培养箱,次日进行siRNA转染。将8μL转染试剂Lipofectamine 2000加500μL Opti-MEM无血清培养基,轻轻吹吸3~5次,混匀,将8μL siRNA加至500μL Opti-MEM无血清培养基,轻轻吹吸3~5次,混匀,室温放置5min。混合转染试剂和siRNA稀释液,轻轻吹吸3~5次混匀,室温放置20min,将转染混合物加至含2mL无血清无双抗培养液培养皿,转染4~6h后可更换新鲜培养基(带血清培养基)。
1.3.5 Western blot siRNA转染子宫内膜间质细胞72h左右时,用预冷PBS冲洗细胞3次,按凯基蛋白提取试剂盒说明进行蛋白提取,用BCA蛋白检测试剂盒检测蛋白浓度,置于沸水中10min使蛋白变性。用10%SDS-PAGE分离蛋白,转移至PVDF膜,5%脱脂牛奶室温封闭2h,一抗孵育4℃过夜,次日回收一抗,TBST冲洗3遍,每次10min,二抗室温下摇床1h,TBST冲洗3遍,每次10min,最后将PVDF膜置于BIO-RAD成像仪,加ECL工作液反应1min(A液∶B液=1∶1),最后根据曝光结果,运用Image J计算光密度比值。
1.3.6 CCK-8实验 siRNA转染后的细胞,重新消化,加无双抗培养基重悬细胞,进行细胞计数,按5×104细胞/mL接种于96孔板,每组设置5个复孔,周围均用PBS填充。配置10% WST-8溶液,于24、48、72h,以细胞换液方式每孔加100μL配置好的10% WST-8溶液,每组多加一组空白对照,37℃ 5%CO2培养箱孵育1h,检测450nm波长处各孔OD值,用实验组OD值减去空白孔OD值计算各组A值,绘制细胞增殖曲线。
1.3.7 Transwell实验 将基质胶和200μL枪头提前一天放入4℃冰箱预冷,将基质胶用无血清培养基按1∶8比例稀释,在Transwell小室上室中加80μL稀释好的基质胶,在37℃ 5%CO2培养箱放置6h。将转染siRNA的细胞重新消化,加无血清无双抗培养基重悬细胞,进行细胞计数2.5×104细胞/mL,上室中加200μL(5000细胞/孔),下室中加含20%血清的培养基500μL,置37℃ 5%CO2培养箱。48h后取出小室,弃小室培养基,用PBS冲洗5遍,室温下4%多聚甲醛固定30min,用PBS冲洗5遍,0.2%结晶紫染色1h,PBS冲洗5遍,弃多余水分,在显微镜下观察拍照,每个小室选5个视野进行计数,计算平均值,比较各组的侵袭细胞数。

2 结 果
2.1 PKCβ1、MEK1/2蛋白在各组内膜组织中的表达 EMs在位内膜组、异位内膜组中PKCβ1、MEK1/2表达均高于正常子宫内膜组,且在异位内膜组中的表达高于在位内膜组,差异有统计学意义(FPKCβ1=224.90,FMEK1/2=450.15,P<0.05)。相关性分析发现,PKCβ1、MEK1/2在EMs在位内膜、异位内膜中的表达呈正相关(rEMs在位内膜=0.88,P=0.00,rEMs异位内膜=0.91,P<0.05)。见图1~2及表1。

图1 PKCβ1、MEK1/2在3组内膜组织中的表达

图2 PKCβ1、MEK1/2的相关性分析

表1 PKCβ1,MEK1/2在各组内膜组织中的表达
2.2 EMs在位内膜间质细胞分离与鉴定 通过差速离心法分离培养原代子宫内膜间质细胞,通过细胞免疫化学法进行细胞鉴定,其中波形蛋白染色阳性,角细胞染色阴性为子宫内膜间质细胞。显微镜下可观察到在位内膜间质细胞呈长梭形,核圆居中,波形蛋白组间质细胞细胞核和细胞质染成棕黄色,而角蛋白组细胞核和细胞质均未见染色与PBS组染色一致,即我们所取细胞为子宫内膜间质细胞,见图3。

图3 EMs在位内膜间质细胞鉴定(×100)
2.3 PKCβ1 siRNA转染后PKCβ1、MEK1/2蛋白表达情况 Western blot法检测结果显示,PKCβ1 siRNA转染后PKCβ1、MEK1/2蛋白表达均降低(FPKCβ1=85.54,P=0.00;FMEK1/2=86.83,P=0.00),差异有统计学意义(P<0.05)。见表2及图4。

表2 PKCβ1 siRNA转染后PKCβ1、MEK1/2蛋白表达

图4 PKCβ1 siRNA转染后PKCβ1、MEK1/2蛋白表达
2.4 PKCβ1 siRNA转染后细胞增殖性变化 CCK8检测结果显示,PKCβ1 siRNA组较si-NC组、空白组间质细胞增殖性明显下降(F24h=6.44,F48h=21.51,F72h=13.26,P<0.05),差异有统计学意义(P<0.05)。见图5。2.5 PKCβ1 siRNA转染后细胞侵袭性变化 Transwell检测在位内膜间质细胞PKCβ1 siRNA转染后间质细胞侵袭性变化,PKCβ1 siRNA组较si-NC组、空白组侵袭细胞数明显下降(37.0±5.35,83.6±2.28,83.4±2.25,F=165.09,P=0.00),差异有统计学意义(P<0.05)。见图6。

图5 PKCβ1 siRNA转染后细胞增殖性变化
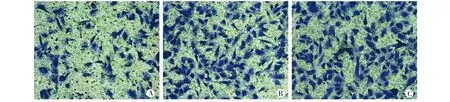
图6 PKCβ1 siRNA转染后细胞侵袭性变化(×200)
3 讨 论
3.1 PKCβ1与EMs EMs是一种慢性妇科疾病,是受多种基因、表观遗传和环境因素影响的可遗传疾病,确切原因尚不清楚。EMs中激素、免疫和炎症状态的异常,细胞凋亡、黏附、血管生成、增殖、免疫和炎症过程,缺氧反应,类固醇生成途径和激素信号转导等参与了EMs的发病机制。EMs的病因非常复杂,目前还未完全阐明[9]。癌细胞的增殖、迁移和侵袭能力在肿瘤的转移和复发中起着重要作用,抑制肿瘤细胞的增殖、侵袭和转移可有效减少癌症的发展和复发。EMs在形态上呈良性表现,但在临床行为学上类似恶性肿瘤,具有种植、侵袭和远处转移的能力,因此抑制异位细胞的增殖和侵袭可能有助于内异症的治疗。蛋白激酶C(PKC)是一种重要的丝氨酸/苏氨酸激酶,由多种亚型组成,PKC作为重要的信号转导酶,将细胞表面配体-受体相互作用产生的信号传递到细胞核。在对卵巢癌的研究中发现,透明细胞卵巢癌子宫内膜间质细胞中PKC表达高于正常子宫内膜间质细胞,卵巢癌细胞依赖于PKC的过表达来维持细胞活力[10]。PKC亚型参与许多生物学过程的信号转导,如增殖、存活、血管生成、转移和肿瘤发生。PKCβ1是PKC的一种,参与多种疾病的发生发展。Shu等研究发现,PKCβ1的缺失可防止非酒精性脂肪变性的发生;蛋白激酶Cβ1的下调可使小鼠从头脂肪生成和甘油三酯合成减少;肝脏蛋白激酶Cβ1的表达增加导致脂肪合成增加,从而导致肝脏甘油三酯的过度积聚[11]。Hu等[12]研究结果表明,PKCβ1通过促进翻译增加而促进肿瘤向骨的转移,在异种移植模型中,PKCβ1的激活导致骨肉瘤细胞翻译的整体上调,从而增强体内的转移。用PKC抑制剂可减弱整体翻译上调,并降低这些细胞在体内转移的可能性。Marquina-Sánchez等[13]在对胶质母细胞瘤的研究中也发现,激活PKCβ1可增加人胶质母细胞瘤细胞的迁移和侵袭能力,表明PKCβ1的异常表达与细胞的增殖和侵袭性相关。在对EMs在位和异位子宫内膜差异基因表达的研究中发现,PKCβ1在EMs中的表达明显增高,且在异位内膜中的表达高于在位内膜[14-15]。
3.2 MEK1/2与EMs MEK1/2是一种双特异性蛋白激酶,属于丝氨酸/苏氨酸蛋白激酶家族,能催化ERK1/2的选择性苏氨酸和酪氨酸残基的磷酸化。MEK1/2具有高度狭窄的底物特异性,ERK1/2是其唯一已知的下游靶点[16],是细胞增殖和存活所必需的转录因子。ERK1/2激酶在正常和致癌信号转导中都在介导MEK1/2激活的下游效应中起着关键作用[17]。已有研究发现,MEK-ERK通路是胃癌细胞生物活性的关键信号,抑制MEK/ERK通路,抑制了胃癌细胞的增殖、迁移和侵袭,相反,MEK/ERK过表达促进了胃癌的进展。体内成瘤实验也表明,MEK/ERK轴参与了胃癌肿瘤细胞的生长[18]。在对胰腺癌的研究中发现,MEK/ERK信号通路被激活,促进胰腺癌细胞增殖、迁移、侵袭,诱导细胞凋亡和G0/G1期阻滞。抑制MEK/ERK信号通路则抑制了细胞的增殖、迁移和侵袭[19]。在对转移性黑色素瘤的研究中发现,MEK/ERK信号通路发挥重要作用,MEK/ERK的级联激活促进黑色素瘤的增殖、存活、侵袭和血管生成。抑制MEK1/2可减少突变的人黑色素瘤细胞在体外的增殖和侵袭,同时减少体内肿瘤的生长[20]。在非小细胞肺癌(non-small-cell lung cancer,NSCLC)中发现了MEK/ERK信号通路的异常激活,促进肿瘤细胞的增殖、分化和凋亡。MEK抑制剂已用于非小细胞肺癌患者的治疗。MEK抑制剂与化疗、免疫检查点抑制剂、表皮生长因子受体酪氨酸激酶抑制剂联合应用对提高临床疗效、延缓耐药发生具有重要意义[21]。Zhou等采用多重免疫分析法对EMs腹腔液的检测中发现,MEK1/2、ERK1/2等信号因子在EMs中表达增高,通路分析显示MEK1/2、ERK1/2与血管生成、细胞增殖、迁移和炎症相关[22]。Liu等[23]也发现,在EMs中MEK/ERK信号通路异常表达,MEK/ERK信号通路的激活促进细胞增殖、迁移和侵袭能力的增强。用MEK抑制剂U0126处理后,子宫内膜间质细胞的增殖、迁移和侵袭作用减弱。
3.3 PKCβ1、MEK1/2与EMs 课题组前期通过表达谱芯片检测EMs在位、异位内膜基因表达差异发现,PKCβ1、MEK1/2、NF-KB等因子显著上调,但其相互之间的具体调节机制尚不清楚。本研究结果表明,PKCβ1、MEK1/2在EMs在位和异位内膜组织中的表达高于正常子宫内膜组织,且在异位和在位内膜组织中两者呈正相关,表明两者之间可能存在相互作用。研究发现,PKCβ1可通过负调控下游MEK1/2和ERK1/2信号转导通路,在胆结石的形成中发挥重要作用,PKCβ1通过调节肝脏MEK1/2的活性来调节细胞胆固醇的生物合成、吸收和降解,是正确处理高膳食脂肪和胆固醇的适应性反应中的关键环节[24]。同样,Noh等在对乳腺癌的研究中也发现,PKC可抑制MEK1/2信号的激活。基质金属蛋白酶-9(matrix metalloprotein -9,MMP-9)是促进多种肿瘤细胞侵袭的主要成分,PKC可抑制MMP-9的表达,从而抑制乳腺癌细胞的侵袭[25]。Tokuda等[26]研究发现,PKCβ1是MEK1/2的上游调节因子,刺激成骨细胞中血管内皮生长因子的合成。当PKCβ1被激活时,PKCβ1从胞浆转移到质膜,激活MEK1/2进而刺激血管内皮生长因子的合成。在对帕金森病的研究中也发现,PKC和MEK异常表达增加了帕金森病运动障碍的易感性,而减弱PKC和MEK的表达则可改善帕金森病的行为功能障碍[27]。在对小鼠黑色素瘤细胞的研究中发现,抑制蛋白激酶C可抑制MEK1/2的表达,抑制PKC/MEK/ERK通路,进而抑制小鼠黑色素瘤细胞的迁移、侵袭和转移。此外MEK1/2抑制剂U0126可抑制肿瘤细胞的迁移、侵袭、转移,以及基质金属蛋白酶的表达[28]。因此推测在EMs中PKCβ1也可能通过调节MEK1/2的表达,影响间质细胞的增殖和侵袭性。本研究结果显示,通过转染siRNA沉默间质细胞PKCβ1表达后,MEK1/2表达明显降低,间质细胞的增殖和侵袭性明显降低。表明PKCβ1可能是调节MEK1/2表达的上游信号因子,通过影响异位细胞的增殖和侵袭活性影响EMs的发生与发展。
综上所述,PKCβ1在EMs的发生发展中发挥重要作用,该作用可能是通过调节MEK1/2表达引起的,但具体调节机制还有待进一步研究。EMs是一种多病因引起的具有恶性肿瘤行为的良性疾病,对其发病机制有待进一步研究。
