转录组测序揭示激素介导的信号通路参与甜菜低温应答
2021-11-16龙佳丽吴则东
龙佳丽,邹 奕,邳 植,吴则东
(1黑龙江大学生命科学学院,哈尔滨 150080;2黑龙江大学现代农业与生态环境学院,哈尔滨 150080)
0 引言
低温是植物生长发育过程中经常遇到的非生物胁迫,是限制作物产量和地理分布的主要环境因素之一[1]。低温胁迫可引起植物膜通透性改变,破坏酶系统,引起代谢异常,减少能量供应,抑制光合作用,促进有毒物质的积累[1]。在严重的情况下,低温胁迫甚至可能导致植物死亡[1]。甜菜是世界上最重要的产糖作物之一,约占全球产糖量的30%[2-3]。在中国集中栽种在内蒙古、新疆、黑龙江等地[4]。甜菜种子萌发起始温度为4~5℃,最适温度为25℃[5]。当甜菜种子或幼苗在早期发育阶段暴露于冷冻温度时,种子的发芽率、植株的存活率以及成熟植株的蔗糖产量均会受到低温的严重限制[6]。甜菜幼苗冻害初期主要表现为叶片直硬,进而呈水渍状。温度回升后,叶片萎蔫、退绿褐化,甚至变黑死亡。因此,研究低温在甜菜生长发育中的调节以提高甜菜低温耐受性是非常有必要的。
植物激素作为一种信号分子,参与调节许多生长发育代谢进程,并在抵抗非生物胁迫中起着重要作用[7-8]。在低温胁迫下,生长素在调节植物生长和发育中起着至关重要的作用[9]。在拟南芥中,冷应激同时影响生长素的运输和信号传递过程,长期冷应激分别导致Aux/IAA和ARF蛋白家族的协调下调和上调[9]。脱落酸(ABA)常被称为胁迫反应激素,在根形态建成和非生物胁迫防御中起着关键作用[10-11]。当植物受到环境胁迫时,植物体内ABA水平升高,进而激活ABA介导的抗性途径,从而促进气孔关闭,增强植物抗旱能力[12]。在水稻中,过表达ABA受体基因OsPYL10可以显著增强籼稻的耐旱性与耐寒性[13]。在赤霉素(GA)信号途径中,赤霉素受体蛋白GID1与GAs相互作用,降解DELLA蛋白,促进GA反应。而DELLA蛋白SLR1的编码基因OsSLR1在低温条件下被显著上调,以抑制GA反应[14]。此外,油菜素内酯(BR)也是植物生长发育所必需的激素,通过激活细胞表面受体(BRI1和BAK1)激酶活性,并导致一种抑制BRI1的新蛋白BKI1的分离,进而诱导BZR1和BZR2 2个关键转录因子去磷酸化来调节基因表达[15]。然而,这些植物激素在甜菜中如何参与低温应答仍未可知。
随着转录组测序技术的发展,人们对植物耐低温的分子机制进行的转录组分析结果已成功的应用于水稻[16]、玉米[17]、小麦[18]等植物的研究。为了进一步探究甜菜对低温应答的分子机制,本研究对低温处理后甜菜叶片转录组变化进行测定。利用比较转录组学分析策略探索甜菜低温应答的分子机制,研究植物激素调控的信号通路是否参与甜菜低温胁迫防御。
1 材料与方法
1.1 试验材料及处理方法
本研究选用KWS9442作为材料,于2019年4月份在黑龙江大学呼兰校区将种子播种于方形花盆(12 cm×12 cm×10 cm)。发芽后,于温度(25±2)℃,光照强度为140 μmol/(m2s),光周期14 h/10 h培养箱中培养4周。随后,将幼苗转移到4℃光照培养箱中进行低温处理,光照条件保持不变。分别剪取低温处理0、3、6、12、24、36、48 h后甜菜叶片,液氮速冻后-80℃冰箱保存。每个处理共设3次重复。使用TRIzol Reagent提取叶片总RNA。所有RNA样品用于qRT-PCR分析,0 h和24 h RNA样品还用于RNA-seq。
1.2 文库构建和RNA-seq
对RNA浓度、纯度及完整性进行检测后,参照Illumina Truseq RNA sample prep Kit标准流程进行文库构建。随后,对文库进行定量和质量检测。最后,使用Illumina高通量测序平台对cDNA文库进行测序。
1.3 RNA-seq数据分析
对raw reads中低质量、接头污染以及未知碱基N含量过高的reads进行过滤后获得clean reads,计算GC含量、Q20和Q30。使用HISAT2将clean reads比对到甜菜参考基因组RefBeet-1.2.2,并计算比对率。检测转录组测序饱和度评估测序数据量是否满足后续分析。采用Stringtie软件计算每个基因在样本中的FPKM值,根据样本所有基因的FPKM值计算组内及组间的Pearson相关性系数。通过比对NR、Swiss-Prot、Pfam、STRING、GO和KEGG数据库进行功能注释。
1.4 显著地差异表达基因的筛选
采用DESeq方法筛选对照组与低温处理组之间的DEGs。首先,对原始的基因表达量进行标准化处理。随后,通过统计学模型进行假设检验概率(P-value)的计算,并进行多重假设检验校正获得FDR值。以低温处理组与对照组的表达量变化倍数大于2倍且错误发现率FDR值小于0.05为阈值筛选DEGs。
1.5 功能注释与富集分析
为研究DEGs的生物功能和参与代谢途径,将所有DEGs映射到GO和KEGG数据库,对DEGs进行GO富集分析和KEGG代谢通路分析。
1.6 qRT-PCR验证
2个BvDREBs和12个参与脱落酸和生长素信号通路的DEGs被挑选,检测其在低温应答过程表达模式。qRT-PCR引物设计及定量方法参照Pi等[19]的方法,引物序列详见表1。采用PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa,中国大连)将RNA逆转录为cDNA。以GAPDH为内参基因,使用TB Green premix Ex Taq(TaKaRa,中国大连)试剂进行荧光定量PCR。每个样品3次重复,按2-ΔΔCT相对定量法计算相对表达量。
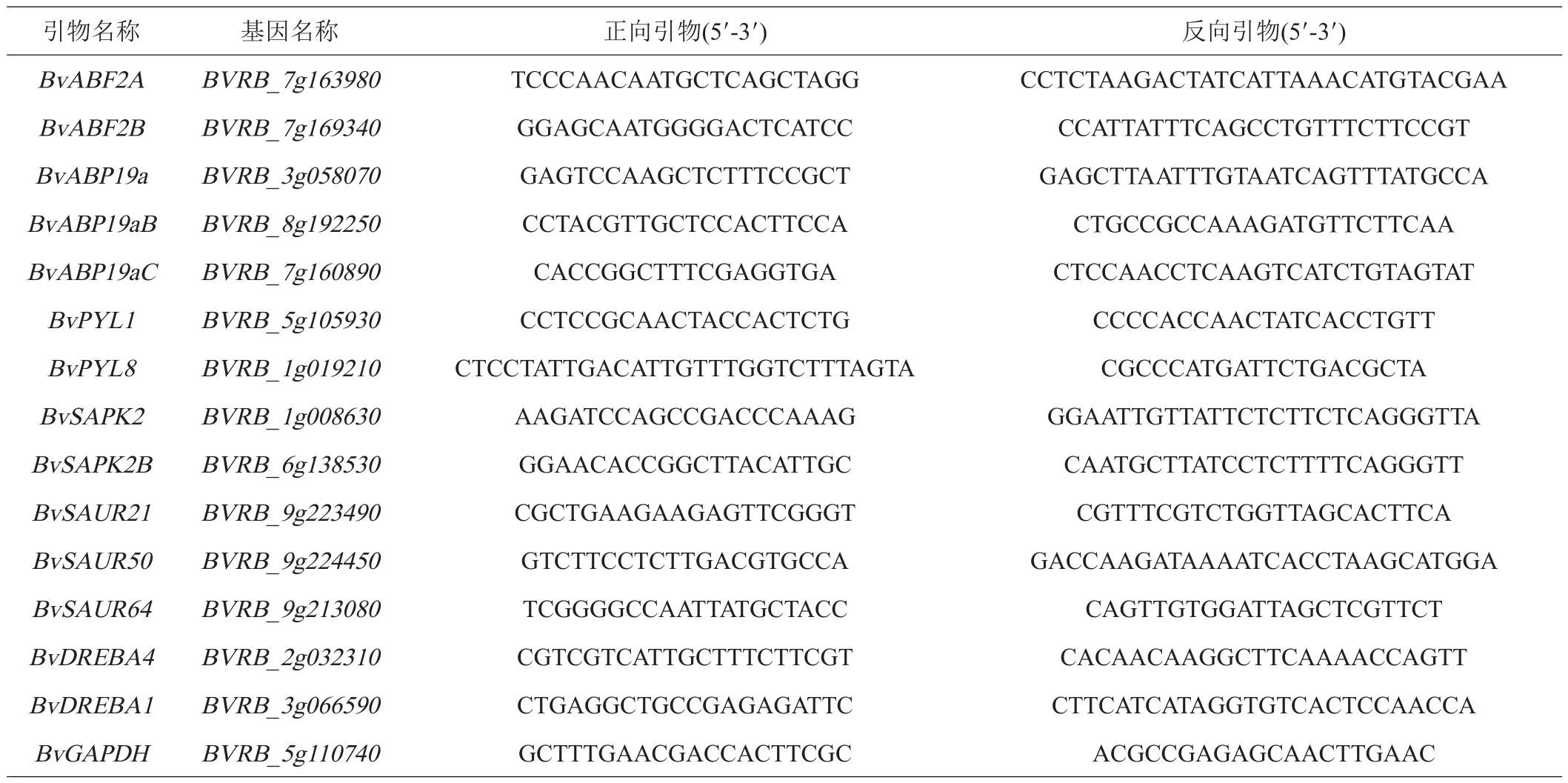
表1 本研究用于qRT-PCR的引物
1.7 数据处理
使用IBM SPSS Statistics 26进行数据处理。
2 结果与分析
2.1 低温胁迫下BvDREBs表达模式分析
前期研究表明甜菜‘KWS9442’是低温抗性较强的品种[20]。对生长4周的甜菜幼苗进行4℃低温处理24 h后,甜菜表型并无萎蔫、叶斑、黄化等明显变化。为确定甜菜对低温的响应过程,选择植物低温应答中已知的关键转录因子BvDREBs作为标记基因。BvDREBA1和BvDREBA4的表达水平在低温过程中均表现出先上升后下降的趋势(图1)。BvDREBA1在低温处理24 h后表现出显著上调,上调倍数超过300倍。BvDREBA4基因表达水平在低温处理24 h后达到峰值,上调倍数约为10倍。低温处理36 h后,这些基因表达水平均随着低温持续逐步下调。BvDREBs受低温诱导24 h后表达水平达到峰值,说明此时甜菜低温应答被激活。

图1 低温胁迫过程中BvDREBs表达模式
2.2 转录组数据质控分析
转录组测序共获得269609790原始读数,去除低质量、接头污染以及未知碱基N含量过高的reads后获得269237926过滤读数(表2)。GC含量在43.60%~44.28%之间,Q20含量均在98.2%以上,Q30的值均在94.8%以上,测序错误率均在0.03%以下。利用HISAT2软件,将clean reads比对到甜菜参考基因组RefBeet-1.2.2上,比对率91.747%~92.098%(表2)。为评估不同测序量的条件下各基因的表达检测是否准确,对每个样品进行了饱和度分析。结果显示,各样品中高(FPKM>15)、中(0.6<FPKM<15)、低表达基因(FPKM<0.6)饱和曲线均达到平台期,说明本次测序的深度足够。
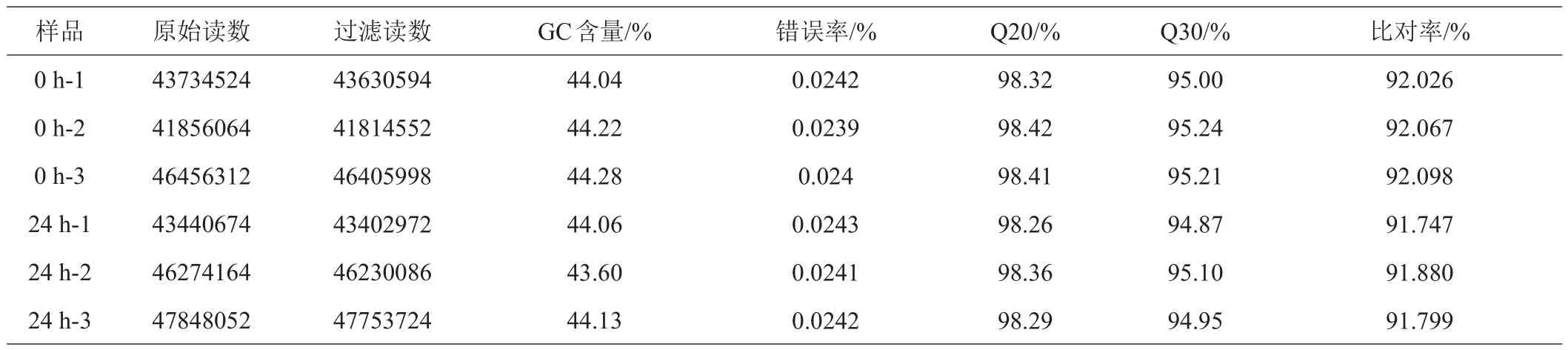
表2 测序读数比对到参考基因组的基本统计
为评估样品之间的重现性,计算了各样品的Pearson相关系数。结果显示,对照组3个重复间的相关系数在0.939~0.945之间,低温处理组3个重复间相关系数在0.915~0.936之间,说明本次试验结果具有较好的重现性。此外,对照组与处理组样品间相关系数在0.814~0.874之间。组间相关系数低于组内相关系数,暗示24 h低温处理引起部分蛋白发生变化。综合以上质控分析结果,测序数据质量满足后续基因表达分析要求。
2.3 功能注释与筛选DEGs
经过比对参考基因组共鉴定基因27964个,分别检索NR、Swiss-Prot、Pfam、STRING、GO和KEGG数据库对基因功能进行注释。共有26720个基因功能被成功注释,占全部基因的95.5%。为筛选甜菜中低温应答基因,使用DESeq软件以基因变化倍数大于2倍且FDR小于0.05为阈值筛选DEGs。共获得3061个DEGs,其中上调表达1363个、下调表达1698个(图2)。
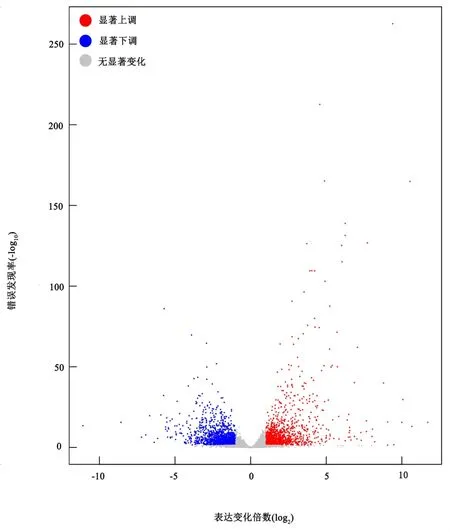
图2 对照组与低温处理组间DEGs火山图
2.4 显著地差异表达基因的功能注释及富集
对鉴定到的DEGs进行GO富集分析发现,共有49个GO term被显著富集,包括生物学过程22个GO term、分子功能13个GO term、细胞组分14个GO term。根据GO term富集显著程度(FDR值)及有向无环图中的上下级关系,挑选出12个与低温应答相关的GO term(图3A)。在生物过程方面,激素响应(GO:0009725)、含氧化合物响应(GO:1901700)、酸性化合物响应(GO:0001101)、激素介导的信号通路(GO:0009755)等方面被显著富集。其中,激素响应(GO:0009725)最显著,FDR值为3.73×108。同时,激素介导的信号通路(GO:0009755)也被显著富集,FDR值为0.00014。在分子功能方面,DNA结合转录因子活性(GO:0003700)和蛋白激酶活性(GO:0004672)等信号转导相关GO terms被显著富集。细胞组分方面富集结果反映出这些DEGs编码蛋白主要分布于核小体(GO:0000786)、细胞周边(GO:0071944)、细胞膜系统(GO:0016021和(GO:0031225)。说明激素调控的信号通路在低温应答中具有重要作用。

图3 甜菜低温处理DEGs的GO富集分析
对参与激素响应(GO:0009725)和激素介导的信号通路(GO:0009755)的DEGs进一步分类(图3B~C)发现,激素反应(GO:0009725)总共包含233个DEGs,117个上调表达,116个下调表达。这些DEGs所响应的激素种类包括生长素(auxin)、ABA、乙烯(ETH)、水杨酸(SA)、BR、GA、茉莉酸(JA)、细胞分裂素(CTK)。其中,ABA和auxin响应基因最多,分别为65个和59个基因,占28%和25%。激素介导的信号通路(GO:0009755)共涉及125个DEGs,包括59个上调表达基因和66个下调表达基因。这些基因可分为8类,与激素响应(GO:0009725)结果相似。其中,参与auxin和ABA介导的信号通路的基因最多,分别为51个和27个,占41%和22%。
2.5 DEGs的KEGG功能注释及富集
利用KEGG数据库对DEGs参与的代谢通路进行功能注释,这些DEGs涉及293个代谢通路。其中,植物激素信号转导、MAPK信号通路、淀粉和糖代谢等8条通路被显著富集。与GO富集结果一致,植物激素信号转导(ko04075)富集程度最为显著,FDR值为0.00017。该通路中DEGs主要参与auxin、ABA、ETH、GA、BR、CTK、JA 和 SA 信号通路(图4)。其中,PP2C、PYL、ABF和SAPK2均受低温处理影响转录水平发生显著变化,它们编码的蛋白相互作用参与ABA信号转导。Auxin信号通路中,编码auxin响应蛋白SAUR和IAA的基因也受低温处理影响。此外,低温胁迫还会导致编码DELLA、JAZ、BZR等其他激素信号通路关键蛋白的基因发生显著变化。
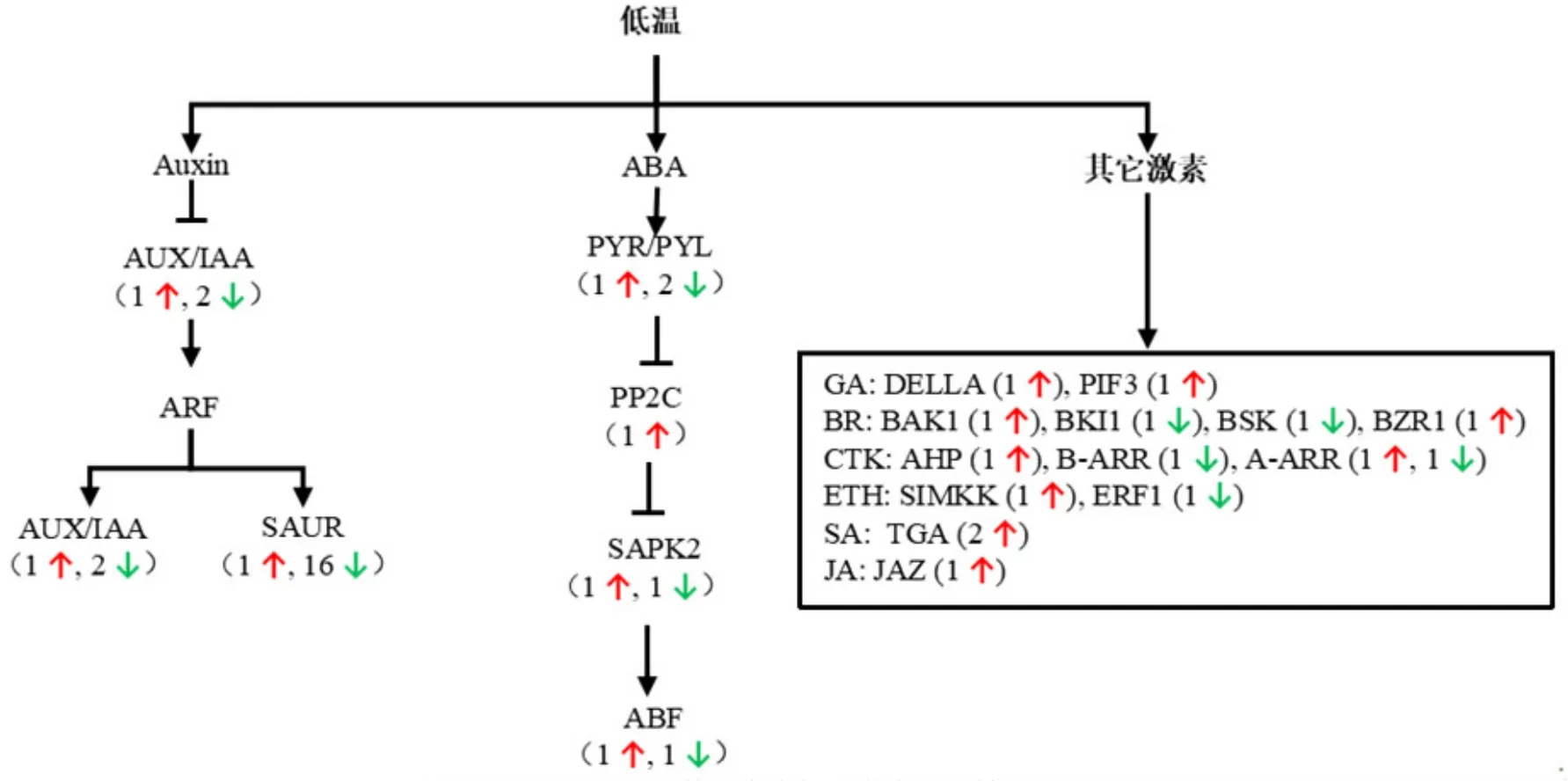
图4 参与植物激素信号通路的低温应答DEGs
2.6 荧光定量PCR分析DEGs
为验证转录组测序结果的准确性,挑选2个BvDREBs和12个auxin和ABA响应DEGs比对qRTPCR和RNA-seq定量结果。由图5和图6可知,2种方法检测到的基因表达模式结果基本一致。RNA-seq同样检测到BvDREBA1和BvDREBA4在低温处理24 h后表达量显著上调,变化倍数分别为159倍和19倍。在auxin介导的信号通路中,分别挑选了3个SAUR和ABP19a进行基因表达模式的测定。这些基因的表达趋势与转录组测序结果相符。BvSAUR21、BvSAUR50和BvSAUR64均在低温处理3 h内表现出显著下调,变化倍数4.8~7.2倍,且在低温处理48 h基因表达水平进一步降低。3个BvABP19a基因则受到低温诱导表达,基因水平在处理24 h后达到最大值,上调倍数超过20倍。在ABA响应通路中,编码ABA受体蛋白的PYL1和PYL8基因表达均受低温处理显著抑制,并且随着低温持续基因表达水平逐渐降低。然而,位于PYL下游的基因则对低温处理表现出不同的响应。BVRB_1g008630和BVRB_6g138530均编码蛋白激酶SAPK2,在低温处理后12 h内基因水平分别显著下调8倍和上调2.9倍。相似地,BVRB_7g163980和BVRB_7g169340均编码转录因子ABF2,低温处理24 h后基因水平分别下调11.6倍和上调2.6倍。

图5 qRT-PCR和RNA-seq检测低温胁迫过程中BvDREBs表达模式
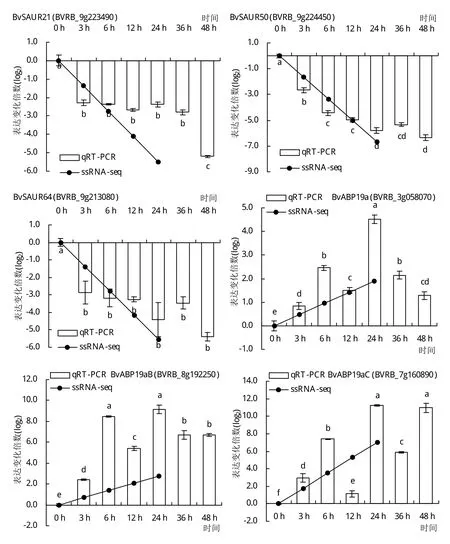
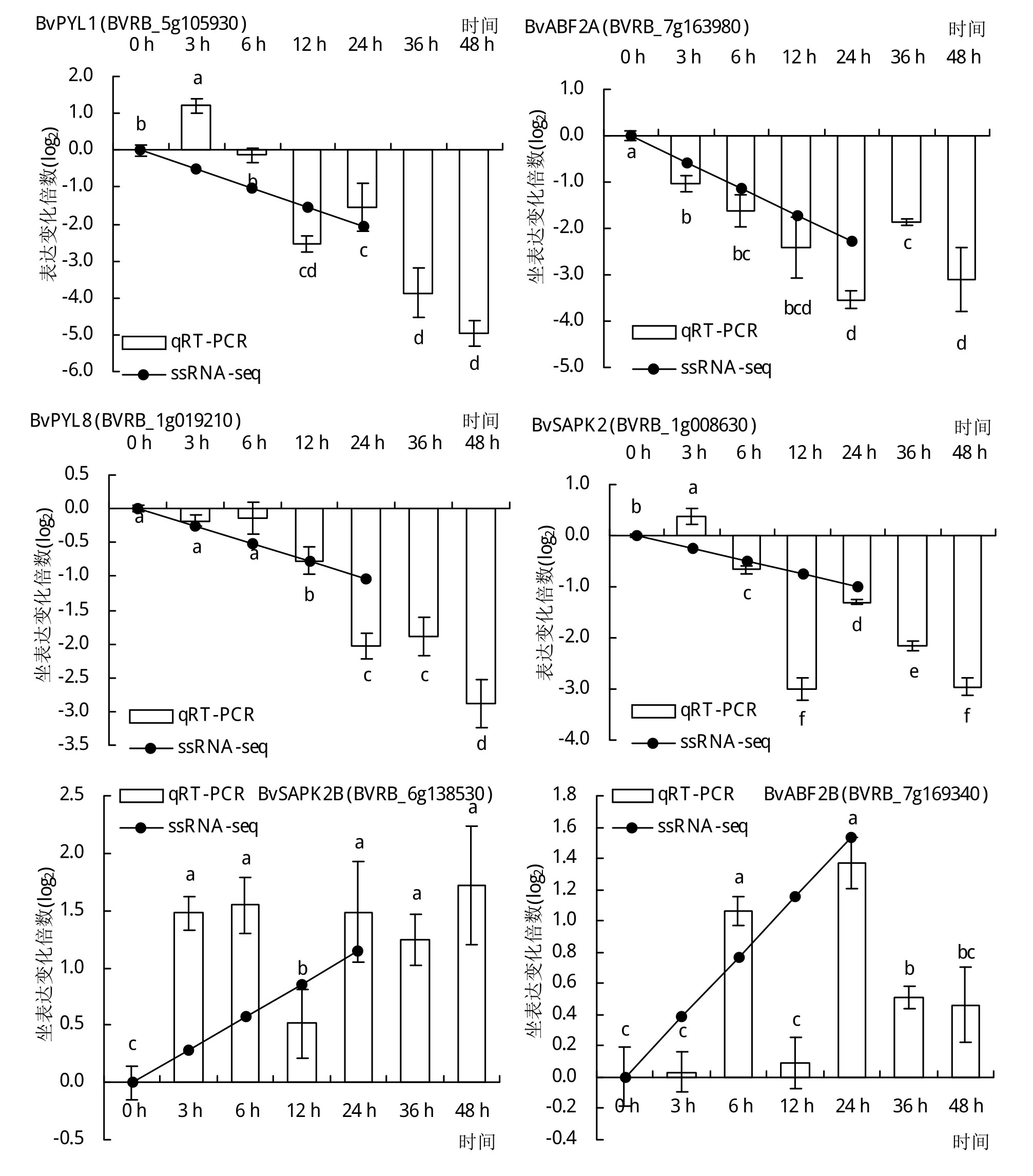
图6 qRT-PCR和RNA-seq分析低温胁迫下参与auxin和ABA信号通路的DEGs表达模式
3 讨论
CBF/DREB途径是植物低温应答中保守的主效途径[21]。AtDREBs受低温诱导后,数小时内表达量就会达到顶峰,并随着低温持续表达水平逐渐下调。通过对cbf突变体研究表明,AtDREBs参与Ca2+、激素信号、碳代谢等途径基因的激活与抑制[22]。本研究结果表明,BvDREBs基因表达模式与拟南芥AtDREBs表达模式相似。低温诱导24 h后表达量达到峰值,表明此时甜菜低温应答被激活。进一步利用RNA-seq分析甜菜KWS9442品种在低温处理前后的基因表达变化,从分子水平探究基因在调控甜菜低温应答具有的重要作用。基于DEGs表达变化、GO富集和KEGG功能富集发现,auxin和ABA等激素介导的信号通路是甜菜响应低温的重要方式。
Auxin主要在幼芽、幼叶、茎尖等具分生能力的组织中合成,作为植物必需的激素广泛参与调控细胞分裂与大小、向光性、向地性等生长和发育过程[23]。ABP是一种能够在酸性条件下结合auxin的糖蛋白,被认为是细胞质膜上的auxin受体,调控细胞伸长与分裂。过表达AtABP1或者外源施加ABP1纯化蛋白和C-末端多肽均能激活auxin信号通路,增加叶片细胞大小[24]。相反,RNAi突变体细胞大小则显著低于野生型[25]。在拟南芥中异源过表达OsABP57后,突变体在干旱胁迫和盐胁迫条件下鲜重和根长均显著高于野生型[26]。而在水稻中原位过表达OsABP57可以显著促进水稻不定根形成,有助于水稻适应涝害引起的根系缺氧[27]。本研究低温处理3 h后,分别有3个和2个BvABP19a基因水平发生显著上调和下调。这暗示低温环境能够影响甜菜auxin信号通路,从而调控植株生长。此外,笔者检测到16个BvSAUR基因表达受到低温显著抑制。SAUR作为最大的auxin早期应答基因家族,可以与PP2Cs相互作用并抑制其磷酸酶活性,从而激活促进细胞延伸,促进叶片的扩张和开放,增强下胚轴的伸长[28]。过表达AtSAUR19、AtSAUR41等多个SAURs基因均能够促进细胞延伸生长,使细胞大小出现显著变化[29-30]。一些研究还表明SAURs还与非生物胁迫防御相关。过表达AtSAUR19基因会延缓气孔关闭,加速叶片失水[29]。拟南芥中异源转化TaSAUR78后,突变体对盐胁迫和干旱胁迫表现出更强的抗性,叶片中活性氧积累较野生型更低[31]。本研究共发现16个BvSAUR在低温处理后显著下调,其中BvSAUR50、BvSAUR64、BvSAUR21等变化倍数超过40倍。此外,BvPID、BvBG、BvIAA等多个参与auxin信号通路的基因表达也在低温处理后受到抑制。这些基因的显著下调暗示低温条件下auxin信号通路可能调控甜菜生长以适应低温环境。
ABA常被称为胁迫反应激素,在根形态建成和非生物胁迫防御中起着关键作用[10-11]。通过对小麦[32]、水稻[33]、玉米[34]、葡萄[11]等的研究发现,低温胁迫下外源ABA可以改变作物内源激素水平,使内源ABA含量增加,从而提高植物的抗寒性。这与低温胁迫下外源ABA能够提高甜菜抗氧化防护系统,从而增强甜菜抗逆性的研究结果一致[10]。PYR、PYL和RCAR家族成员被认为是ABA的主要受体,与ABA结合后构象发生变化[35]。随后,识别PP2Cs并抑制其去磷酸化活性,导致蛋白激酶SAPK2被磷酸化[36]。磷酸化的SAPK2激酶活性被激活,催化转录因子ABFs发生磷酸化修饰,激活ABFs转录活性,促进启动子区中含有ABRE元件的基因表达[37]。在水稻中,共有10个ABA信号通路基因在低温处理后表现出显著变化。其中,除1个PYR/PYL同源基因下调表达外,5个PP2C、2个SnRK2以及2个ABF同源基因均上调表达[38]。在胡萝卜中,ABF1基因同样受低温诱导,表达水平在低温处理24 h时达到峰值,上调5.47倍[39]。而在牛皮杜鹃中,12个PP2Cs基因在低温处理后表现出相反的表达模式。同时,5个SnRK2s基因在低温处理后显著上调,1个表现出下调模式[40]。与这些结果相似,BvPYL、BvSAPK2、BvPP2C、BvABF基因表达水平均受到低温显著影响,说明ABA信号通路是甜菜响应低温胁迫的主要信号通路之一。同时,本研究也发现这些基因对低温响应并不一致。如在2个低温应答的BvSAPK2中,BVRB_1g008630在低温处理后基因表达受到显著抑制,而BVRB_6g138530基因表达水平则显著升高。相似地,2个BvABF2基因分别在低温处理后表现出相反的表达模式。根据这些结果推测甜菜中可能存在由不同同源基因构成的多个ABA信号通路,甜菜通过激活与抑制不同ABA信号通路激活低温胁迫防御。这些不同ABA信号通路在甜菜生长发育与低温胁迫防御中具体调控哪些生物过程仍值得进一步研究。
4 结论
本研究对低温处理前后甜菜转录组变化进行分析,鉴定到3061个低温应答的DEGs。对这些DEGs功能富集发现,激素介导的信号通路在甜菜低温应答中具有重要作用。其中,auxin和ABA信号通路与低温胁迫密切相关。在auxin信号通路中DEGs主要为BvABP19a和BvSAUR,而在ABA信号通路中BvPYL、BvSAPK2、BvABF响应低温胁迫。这些基因对甜菜低温胁迫防御的调控作用值得进一步研究。本研究结果将为进一步解析甜菜响应低温胁迫的分子机制提供重要信息。
