可可加工中黄烷醇物质组成变化及抗氧化活性分析
2021-11-08房一明李瑞贺书珍朱自慧赵溪竹
房一明 李瑞 贺书珍 朱自慧 赵溪竹


摘 要:本研究采用高效液相色谱、酶标检测技术,确定可可豆加工过程中黄烷醇类物质组成变化趋势,分析抗氧化活性。在发酵及焙炒阶段检测黄烷醇物质儿茶素(C)、表儿茶素(EC)、表没食子儿茶素(EGC)、表儿茶素没食子酸酯(ECG)、原花青素B1(PC B1)、原花青素B2(PC B2)。结果表明:经7 d发酵各成分含量分别为EGC(8.521~ 3.017 mg/g)、C(15.521~6.633 mg/g)、EC(19.615~3.142 mg/g)、ECG(0.236~0.084 mg/g)、PC B1(19.152~10.774 mg/g)、PC B2(4.254~2.083 mg/g),发酵使得可可豆中儿茶素及低聚物含量大量减少;135 ℃不同时间焙炒下,各物质含量分别为EGC(3.079~2.221 mg/g)、C(8.611~5.143 mg/g)、EC(3.956~0.982 mg/g)、ECG(0.111~0.070 mg/g)、PC B1(10.987~ 8.223 mg/g)、PC B2(2.385~1.534 mg/g)。可可豆在高温焙炒时,DPPH、ABTS自由基清除率呈下降趋势,降低了可可抗氧化活性。研究结果为可可加工提供相关保健功能性的依据。
关键词:可可;发酵和焙烤;黄烷醇物质组成;抗氧化活性
中图分类号:TS274 文献标识码:A
Analysis of Flavanol Compounds Changes and Antioxidant Activity of Cocoa Bean During Processing
FANG Yiming1,2,3,4, LI Rui1,2,3,4, HE Shuzhen1,2,3,4, ZHU Zihui1,2,3,4, ZHAO Xizhu1,2,3,4*
1. Spice and Beverage Research Institute, Chinese Academy of Tropical Agriculture Science, Wanning, Hainan 571533, China; 2. National Center of Important Tropical Crops Engineering and Technology Research, Wanning, Hainan 571533, China; 3. Key Laboratory of Processing Suitability and Quality Control of the Special Tropical Crops of Hainan Province, Wanning, Hainan 571533, China; 4. Hainan Provincial Engineering Research Center of Tropical Spice and Beverage Crops, Wanning, Hainan 571533, China
Abstract: In this study, high-performance liquid chromatography and enzyme-labeled detection technology were used to determine the changing trend of flavanols and analyze the antioxidant activity during the processing of cocoa beans. The content of catechin (C), epicatechin (EC), epigallocatechin (EGC), epicatechin gallate (ECG), proanthocyanidin B1 (PC B1), proanthocyanidin B2 (PC B2) during fermentation and roasting were assayed. The content of for EGC, C, EC, ECG, PC B1, PC B2 was 8.521?3.017 mg/g, 15.521?6.633 mg/g, 19.615?3.142 mg/g, 0.236?0.084 mg/g, 19.152?10.774 mg/g, 4.254?2.083 mg/g, respectively during 7 days fermentation. The content of catechins and oligomers greatly reduced in cocoa beans during fermentation. The content of EGC, C, EC, ECG, PC B1, PC B2 was 3.079?2.221 mg/g, 8.611? 5.143 mg/g, 3.956?0.982 mg/g, 0.111?0.070 mg/g, 10.987?8.223 mg/g, 2.385?1.534 mg/g, correspondingly roasted at 135 ℃ for different times. The clearance rates of DPPH and ABTS+? showed a downward trend during high-temperature roasting of cocoa beans. The antioxidant activity has reduced of cocoa bean. This would provide a theoretical basis for related health care functionality on cocoa processing.
Keywords: cocoa bean; fermentation and roasting; flavanol composition; antioxidant activity
DOI: 10.3969/j.issn.1000-2561.2021.09.035
可可种子富含油酸、亚油酸、硬脂酸、有机物、矿物质、多聚体单宁、可可碱、黄酮类化合物、膳食纤维等活性成分,研究表明可可具有控制食欲、美肤美容、降脂护心、清口固齿、抗氧化益寿等功效[1],可可制品有“世界零食之王”的美誉,是制作高级饮品、巧克力、糖果、糕点和冰淇淋的主要原料[2-3]。
可可富含多酚,包括低聚体类黄酮物质,其中主要有黄烷醇低聚体–原花青素和单体儿茶素,黄烷醇在可可豆中的含量较其他大多数食物高。主要以EC和C两种单体形式存在,这些单体通过C4和C8键的连接可形成聚合体,这些聚合物称之为原花青素,常见的原花青素以EC聚合为主[4-5]。黄烷醇类化合物是一类广泛存在于天然植物中的多元酚化合物,其中儿茶素(C)和培儿茶素(GC)是具有代表性的黄烷醇类化合物。Kongor等[6]研究发现多酚在发酵和干燥过程中也被多酚氧化酶氧化,从而降低了豆的涩味和苦味,增强了可可豆的风味。汤雯[7]建立了可可多酚总酚含量和各类多酚的检测方法,表明PC类物质具有很高的抗氧化活性,可可多酚具有清除自由基能力。谷风林等[8]通过正交试验确定可可豆中多酚类物质的最优萃取条件,并对不同提取条件下的可可多酚类化合物进行定量分析,发现其中儿茶素含量最多。易桥宾等[9]采用HPLC方法检测,发现在105~145 ℃的温度焙烤下可可中没食子酸含量变化明显。
目前对于可可豆在发酵与焙烤过程中黄烷醇类物质组分的变化趋势及抗氧化能力变化趋势分析尚不完全,因此对可可加工中黄烷醇类物质组分演变规律、抗氧化能力变化趋势分析的研究尤为重要,需要对其进行深入系统分析。该研究对可可生产措施、质量控制具有借鉴和指导意义,可对可可加工提供相关保健功能性的依据。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 可可鲜果,品种为‘热引4号,采摘于中国热带农业科学院香料饮料研究所内,采摘时生长期为5个月,果皮为黄色、淡红色的成熟鲜果。
儿茶素(C)、表儿茶素(EC)、表没食子儿茶素(EGC)、表儿茶素没食子酸酯(ECG)、表没食子儿茶素没食子酸酯(EGCG)、原花青素(B1)、原花青素(B2)、Trolox标准品(以上均为标准品,纯度≥98%,购于维克奇公司);DPPH(纯度≥98%,购于阿拉丁)、ABTS(纯度≥98%,购于美国西格玛);乙腈(色谱级,购于美国Fisher公司),乙酸、甲醇、无水乙醇、过硫酸钾、磷酸、30~60 ℃沸程石油醚,均为分析纯。
1.1.2 仪器与设备 CBR-101烘焙机,韩国Gene Café;AL104分析天平,美国Mettler-Toledo;SHZ-C水浴恒温振荡器,上海博迅;CT18RT高速离心机,上海天美;Master-s-plus UVF全自动超纯水机,中国和泰;Specord 250 Plus紫外可见分光光度仪,德国耶拿;1260高效液相色谱仪,美国安捷伦;MA112快速水分测定仪,美国METTLER TOLEDO;SynergyH1酶标仪,美国BioTek;SB-5200DT超声波清洗仪,宁波新芝。
1.2 方法
1.2.1 材料制备 可可果实成熟后采收下来,手工剖开果壳,取出可可鲜豆。可可湿豆倒入木箱中,木箱四周有缝隙,底部有孔,以便于可可发酵液流出,顶部盖好箱盖,每天定时翻动1次,连续7 d,并取箱子中部可可豆样品1 kg(样品依次标记为 F0、F1、F2、F3、F4、F5、F6、F7),将样品可可湿豆清洗脱胶,40 ℃电热鼓风干燥箱干燥,密封备用。取发酵完成的可可豆焙烤,不同焙烤时间条件:温度设定为135 ℃分别焙烤 0、5、10、15、20、25、30、35 min,焙烤样品标记为T-0、T-5、T-10、T-15、T-20、T-25、T-30、T-35。为了确定可可豆中的黄烷醇在焙烤过程中的组成成分变化,每个焙烤时间下的样品进行独立取样。可可豆经焙烤、去皮、研磨,过60目筛密封避光保存待用。准确称取可可粉加入30~60 ℃沸程的石油醚,料液比为1∶25,索氏抽提脱脂10~12 h,脱脂可可粉于30 ℃下避光烘干,4 ℃密封避光贮藏备用。水分测定采用快速水分测定仪测定(以干基计)。
1.2.2 样品的提取 准确称取1 g脱脂样品于10 mL离心管中,加入5 mL 70%甲醇提取液,2000 r/min渦旋5 min后置于20 ℃水浴超声30 min,离心管取出后放于4 ℃的离心机中,以8000 r/min的转速,运行15 min。取上层提取液用0.22 μm过滤膜过滤,待测样品4 ℃条件下避光保存备用[10-11]。
1.2.3 黄烷醇类物质儿茶素单体标准曲线的绘制及样品检测 准确称取C、EC、ECG、EGC、EGCG 5种标准品各10 mg,用70%甲醇溶液溶解定容至10 mL,得到1 mg/mL标准储备液,于4 ℃冰箱中避光保存备用。配制浓度分别为25、50、100、200、300、400、500 μg/mL工作液,经0.22 μm过滤膜过滤,待测。色谱柱:Agilent C18(4.6 mm× 150 mm,3.5 ?m),用100%乙腈溶液A和0.1%乙酸水溶液B做流动相,检测方法:0~8 min,45%~60% A;8~10 min,60%~20% A。检测波长为280 nm,进样体积为10 ?L,流速为1.0 mL/min,柱温为25 ℃[7, 12-13]。
1.2.4 黄烷醇类物质原花青素低聚物标准曲线的绘制及样品检测 准确称取PC B1、PC B2 2种标准品各10 mg,用70%甲醇溶液溶解定容至10 mL,得到1 mg/mL标准储备液,于4 ℃冰箱中避光保存备用。配制浓度分别为25、50、100、200、300、400、500 μg/mL工作液,经0.22 μm过滤膜过滤,待测。色谱柱:Agilent C18(4.6 mm× 150 mm,3.5 ?m),用100%乙腈溶液A和0.1%乙酸水溶液B做流动相,分析方法:0~15 min,15%~40% A;15~20 min,40%~20% A。检测波长为280 nm,进样体积为10 ?L,流速为1.0 mL/min,柱温为25 ℃[13]。
1.2.5 可可豆加工过程中抗氧化活性变化趋势研究 样品提取:准确称取1 g脱脂可可粉于50 mL离心管中,加入20 mL 90%乙醇提取液,2000 r/min渦旋5 min后置于50 ℃水浴超声60 min,4000 r/min离心10 min,收集上清液,残渣再在相同条件下提取2次,合并上清液,旋转蒸发浓缩后用90%甲醇定容至25 mL,4 ℃冰箱中避光保存待测[14-15]。
(1)DPPH自由基清除能力测定。称取DPPH粉末0.0039 g,用无水乙醇溶解并定容至50 mL棕色容量瓶,即配制成0.2 mmol/L DPPH溶液,4 ℃冰箱中避光保存。分别取2.0 mL不同浓度的待测样品溶液,加入2.0 mL 0.2 mmol/L DPPH溶液,混匀后在室温下避光反应30 min,于517 nm下测定吸光度值Ai。以等体积无水乙醇溶液代替DPPH溶液测定吸光度值At,用等体积的无水乙醇溶液代替样品溶液测定吸光度值A0,实验设置3次重复,以Trolox作为阳性对照[16-18]。根据公式计算DPPH自由基清除率:
(2)ABTS自由基清除能力测定。采用酶标仪法,称取0.0384 g ABTS,蒸馏水定容至10 mL,得浓度为7 mmol/L ABTS水溶液,称取0.0066 g过硫酸钾,蒸馏水定容至10 mL,得2.45 mmol/L过硫酸钾溶液。将以上两种现配溶液按1∶1(V/V)混合,在室温下黑暗中放置12~16 h,以生成ABTS+·(ABTS溶液现用现配)[19]。ABTS+·溶液用无水乙醇稀释,直到其在734 nm的吸光度为0.7±0.02。取3.9 mL稀释后的ABTS+·溶液,加入100 μL不同浓度的待测样品溶液浓度并涡旋混合。室温下避光反应10 min, 734 nm处检测其吸收峰。以不同质量浓度Trolox(6.25、12.5、25、50、100、200、400 μg/mL)为标准品,绘制标准曲线,结果表示为每克干物质的Trolox当量(mg/g)[20]。
1.3 数据处理
采用Origin 2017软件作图,用SPSS 16.0软件进行单因素方差分析(ANOVA)。
2 结果与分析
2.1 可可豆加工过程中黄烷醇类物质组成及含量分析
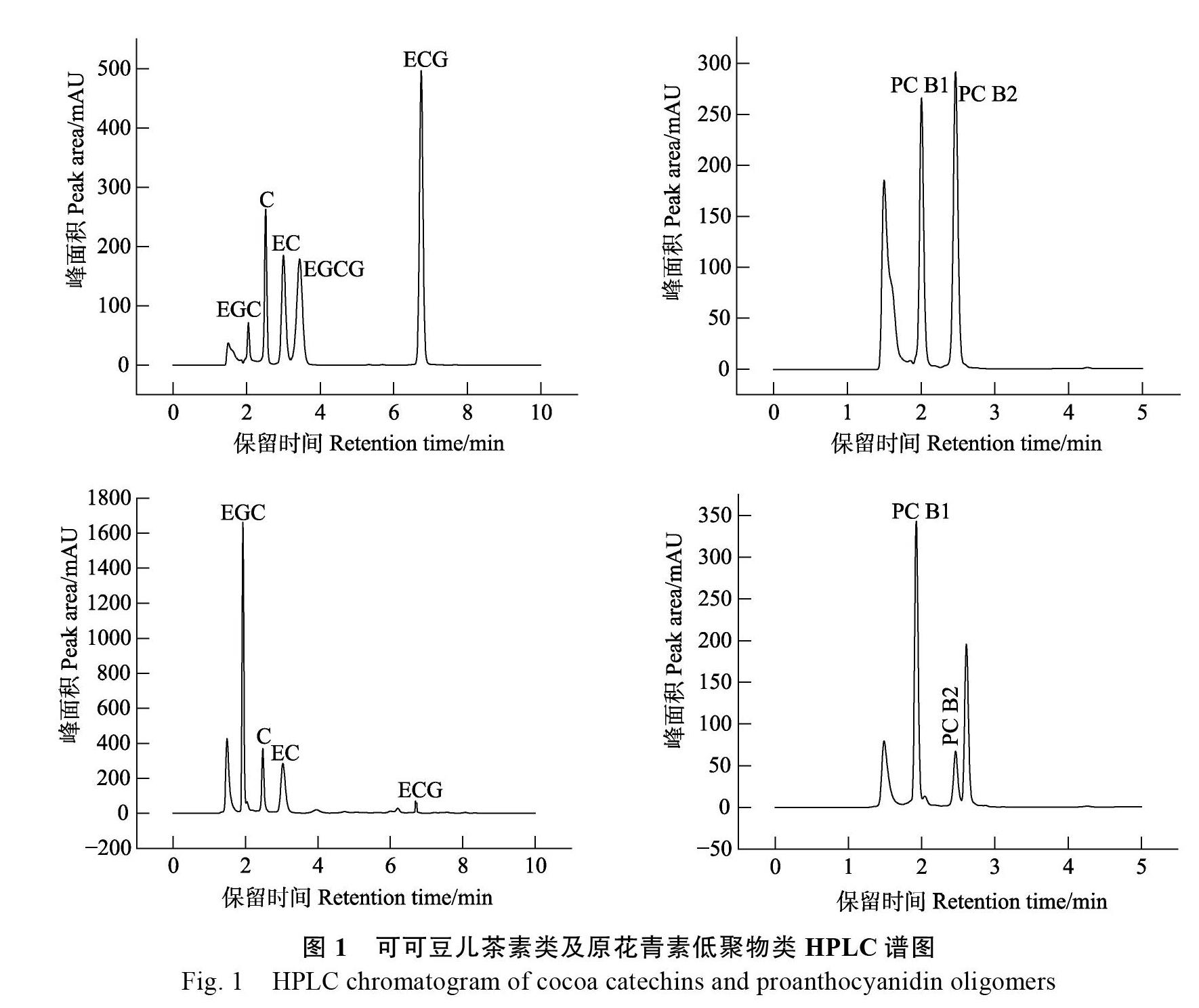
2.1.1 6 种标准品标准曲线和色谱图 在0.025~ 0.5 mg/mL 含量范围与所测峰面积的相关系数均在0.99以上,线性关系良好,因此可用各标准曲线对可可样品中的各单体儿茶素及低聚物原花青素进行定量,结果如表1。
由图1 HPLC色谱图可以推测,黄烷醇4种单体分别为C、EC、EGC、ECG,2种原花青素单体为PC B1、PC B2,在发酵及焙炒阶段都可以检测到这6中化合物。
2.1.2 发酵阶段可可豆黄烷醇单体及低聚物变化趋势 由图2可知,发酵可可豆各物质含量分别为EGC(8.521~3.017 mg/g)、C(15.521~ 6.633 mg/g)、EC(19.615~3.142 mg/g)、ECG(0.236~0.084 mg/g)、PC B1(19.152~10.774 mg/g)、PC B2(4.254~ 2.083 mg/g),发酵使得可可豆中黄烷醇单体儿茶素及原花青素低聚物含量大量减少,在初始发酵阶段,各组成物质含量下降较快。本研究所测含量低于汤雯[7]所测定范围,结果有差异可能与可可豆品种、发酵方式、发酵程度有关;C降解趋势比EC略微平缓,C经氧化、水解、聚合和转化后,含量降低[21];EGC降解趋势缓慢,ECG少量存在可可豆中,含量变化小,趋势不明显。后发酵阶段含量变化逐渐稳定,各物质受外界影响因素较小;PC B1含量极高,降解速度比PC B2快。
2.1.3 焙炒阶段可可豆黄烷醇单体及低聚物变化趋势 由图3可知,经135 ℃在不同时间下焙烤可可豆,各化合物含量分别为EGC(3.079~ 2.221 mg/g)、C(8.611~5.143 mg/g)、EC(3.956~ 0.982 mg/g)、ECG(0.111~0.070 mg/g)、PC B1(10.987~8.223 mg/g)、PC B2(2.385~ 1.534 mg/g),6种化合物的初始含量在初始阶段有所增加,可能短时间焙炒使一些物质发生氧化,处于中间氧化态的酚类化合物使其含量升高,之后由于大量热空气进入,物质被完全氧化,转变成其他物质,导致含量降低。其中EC逐渐降解,在各化合物中降解速度较快,受温度和时间影响,EC的降解也可能是在焙烧条件下发生的脱脂反应的结果[22]。C降解速度略为缓慢,焙炒过程中C的升高可能是由于EC转化的结果,C浓度较高的原因还在于原花青素降解为游离黄酮-3-醇单体,如儿茶素和表儿茶素[10]。EC、EGC在前10 min内已经发生降解,可可豆焙烧过程中PC B1、PC B2缓慢降解。由此可知时间对黄烷醇儿茶素单体及原花青素低聚物影响较小。
2.2 可可豆加工过程中抗氧化活性变化趋势分析
2.2.1 DPPH自由基清除能力测定 DPPH在有机溶剂中是一种稳定的自由基,在517 nm处有较强吸收峰,当清除剂存在时,孤对电子被配对,吸收消失或减弱,通过测定吸收减弱程度,可评价自由基清除剂的活性。半数抑制浓度(IC50)是衡量DPPH·法测定结果的指标,指造成50% DPPH活性损失的浓度[7]。本文采用清除DPPH·自由基体外抗氧化模型,研究可可豆发酵及焙炒阶段抗氧化活性变化趋势,结果见图4。
由图4A可知,在可可豆焙炒阶段,相同样品浓度下,在0~5 min抗氧化能力增强,之后呈现缓慢下降趋势;在不同焙炒阶段,如图4B所示,以Trolox作为阳性对照,分别计算各样品的IC50值为152.931、146.809、186.893、286.361、311.606、318.893、325.159、354.355 μg/mL,对照品Trolox半抑制浓度最低,其次是焙炒5 min低于原料豆,之后所需量依次递增,即DPPH自由基清除能力总体上随焙烤时间增加,可可DPPH清除自由基能力逐渐下降。热处理过程中产生美拉德反应,使细胞基质释放结合的酚类化合物形成新的抗氧化剂,使自由基清除活性增加[23],即在焙炒0~5 min这一阶段DPPH清除能力增加。由图可看出,在15~35 min内,可可清除DPPH自由基变化不明显,易桥宾等[9]在20~40 min焙烤时间内,时间因素对多酚含量的影响有限,引起的含量变化较小,结果一致。
2.2.2 ABTS自由基清除能力测定 ABTS+·经活性氧氧化后生成稳定的蓝绿色阳离子自由基ABTS+·,向其中加入待测物质,若样品中存在抗氧化成分,则该物质会与ABTS+·发生反应而使反应体系褪色,在最大吸收波长下(一般选择734 nm)检测吸光度的变化,与Trolox对照品比较,换算出被测物质总的抗氧化能力,结果表示为每g测试物质相当的抗氧化能力所需要的Trolox的微摩尔数[7]。本论文采用清除ABTS+·自由基体外抗氧化模型,研究可可豆发酵及焙炒阶段抗氧化活性变化趨势,结果见图5。
由图5A可知,在可可豆焙炒阶段,相同样品浓度下,在0~15 min ABTS+·清除率有上升趋势,随着焙炒时间的延长可可豆ABTS+·清除率总体呈缓慢下降趋势,其变化趋势总体上与DPPH清除能力相似。如图5B所示,以Trolox作为阳的IC50值,0~35 min分别为0 min(39.986 mol/g)、5 min(47.375 mol/g)、10 min(45.600 mol/g),15 min(41.115 mol/g)、20 min(30.459 mol/g)、25 min(23.720 mol/g)、30 min(16.996 mol/g),35 min(15.491 mol/g),对照品Trolox半抑制浓度最低,焙炒阶段可可ABTS+·清除率总体呈下降趋势。在热处理后,ABTS+·自由基清除活性随着焙烧温度从120 ℃升高至150 ℃而逐渐降低[16]。80 ℃下预烘烤10 min和130~160 ℃下烘焙15 min,可可提取物对水溶性稳定性具有较低的清除活性[24]。本研究结果与之一致。
3 讨论
黄烷醇是可可多酚的主要成分,多酚是有益健康特性的抗氧化剂,可可中的多酚不仅赋予可可涩味和苦味,还赋予其卓越的抗氧化活性。可可的发酵导致可溶性多酚的大量减少,黄烷醇含量降低可能会导致豆类的抗氧化能力下降。在发酵过程中,由于水分的释放,多酚化合物的进一步氧化和缩合,豆中的多酚浓度降低[25]。同时,伴随温度升高的焙炒处理显著降低了包括原花青素在内的多酚含量[26]。
可可黄烷醇中检测到4种单体分别为C、EC、ECG、EGC,原花青素低聚物为PC B1、PC B2,可可中C、EC、EGC、PC B1含量相对较高。在发酵阶段,黄烷醇单体及低聚物含量减少,其中EC、PC B1减少趋势明显,经7 d发酵使得可可豆中儿茶素及低聚物含量大量减少,ECG、PC B2含量低,在这一阶段变化不明显。黄烷醇变化是由O-C键断裂后C环的打开/闭合引发的热异构化过程引起的立体化学结果。(-)(2R,3R)表儿茶素可以通过此加热过程转化为(2S,3R)(-)儿茶素,而(+)(2R,3S)儿茶素可以转化为(2S,3S)(+)表儿茶素[26]。经135 ℃在不同焙炒时间下,单体及低聚物在初始阶段含量短暂升高,可能与焙炒时物质发生氧化有关,处于中间氧化态的化合物使其含量升高。在10 min内发生显著降解,EC降解快,C速度平缓。DPPH与ABTS测得焙炒阶段可可提取物抗氧化活性,DPPH清除自由基能力强于ABTS。5 min内出现抗氧化能力提升现象,之后开始降低,这可能与多酚受高温发生美拉德反应有关,时间对抗氧化能力影响小,下降趋势平缓。135 ℃不同时间焙炒下C(8.611~5.143 mg/g)和PC B1(10.987~8.223 mg/g)的含量仍较高。可可豆在高温焙炒时,DPPH,ABTS+?清除率呈下降趋势,降低了可可抗氧化活性,结果与Gültekin- ?zgüven等[27]研究一致。可可豆需通过发酵、焙炒才可促进其巧克力风味的形成,经发酵加工可可抗氧化能力虽然降低,但相较于其他原料,加工后的可可豆仍然含有较高含量的抗氧化活性物质,仍是一个很好的抗氧化化合物来源。此结果为可可加工提供相关保健功能性的理论依据。
参考文献
[1] 赵谋明, 董红竹, 林恋竹. 八种水果多酚的定量分析与抗氧化活性研究[J]. 现代食品科技, 2017, 33(10): 225-236.
[2] 房一明, 谷风林, 初 众, 等. 发酵方式对海南可可豆特性和风味的影响分析[J]. 热带农业科学, 2012, 32(2): 71-75.
[3] Fayeulle N, Vallverdu-Queralt A, Meudec E, et al. Characterization of new flavan-3-ol derivatives in fermented cocoa beans[J]. Food Chemistry, 2018, 259: 207-212.
[4] Ramiro-Puig E, Castell M. Cocoa: antioxidant and immunomodulator[J]. British Journal of Nutrition, 2009, 101(7): 931-940.
[5] Holt Roberta R, Lazarus Sheryl A, Sullards M Cameron, et al. Procyanidin dimer B2 [epicatechin-(4β-8)- epicatechin] in human plasma after the consumption of a flavanol-rich cocoa[J]. American Journal of Clinical Nutrition, 2002, 76(4): 798-804.
[6] Kongor J E, Hinneh M, de Walle D V, et al. Factors influencing quality variation in cocoa (Theobroma cacao) bean flavour profile: A review[J]. Food Research International, 2016, 82: 44-52.
[7] 汤 雯. 可可多酚主要成分鉴定及其体外抗氧化活性评价[D]. 杭州: 浙江大学, 2012.
[8] 谷风林, 房一明, 徐 飞, 等. 发酵方式与萃取条件对海南可可豆多酚含量的影响[J]. 中国食品学报, 2013, 13(8): 268-273.
[9] 易桥宾, 谷风林, 那治国, 等. 发酵和焙烤对可可豆多酚、黄酮和风味品质的影响[J]. 食品科学, 2015, 36(15): 62-69.
[10] Oracz J, Nebesny E, ?y?elewicz D. Changes in the flavan-3-ols, anthocyanins, and flavanols composition of cocoa beans of different Theobroma cacao L. groups affected by roasting conditions[J]. European Food Research and Technology, 2015, 241: 663-681.
[11] Ioannone F, Di Mattia C D, De Gregorio M, et al. Flavanols, proanthocyanidins and antioxidant activity changes during cocoa (Theobroma cacao L.) roastingas affected by temperature and time of processing[J]. Food Chemistry, 2015, 174(174): 256-262.
[12] Yang J, Ou X, Zhang X, et al. Effect of different solvents on the measurement of phenolics and the antioxidant activity of mulberry (Morus atropurpurea Roxb.) with accelerated solvent extraction[J]. Journal of Food Science, 2017, 3(82): 605-612.
[13] 易橋宾. 发酵、焙烤工艺对可可豆品质影响及可可果酱的研制[D]. 哈尔滨: 黑龙江东方学院, 2015.
[14] Okiyama D C G, Soares I D, Cuevas M S, et al. Pressurized liquid extraction of flavanols and alkaloids from cocoa bean shell using ethanol as solvent[J]. Food Research International, 2018, 114: 20-29.
[15] Xi W, Zhang Y, Sun Y, et al. Phenolic composition of Chinese wild mandarin (Citrus reticulata Balnco.) pulps and their antioxidant properties[J]. Industrial Crops & Products, 2014, 52: 466-474.
[16] Oracz J, Nebesny E. Antioxidant properties of cocoa Beans (Theobroma cacao L.): Influence of cultivar and roasting conditions[J]. International Journal of Food Properties, 2016, 19(6): 1242-1258.
[17] 王 炬, 张秀玲, 高 宁, 等. 老山芹全株及其不同部位酚类物质含量及抗氧化能力分析[J]. 食品科学, 2019, 40(7): 54-59.
[18] Almeida M L B, Freitas W E D, de Morais P L D, et al. Bioactive compounds and antioxidant potential fruit of Ximenia americana L.[J]. Food Chemistry, 2016, 192: 1078-1082.
[19] Schinella G, Mosca S, Cienfuegos-Jovellanos E, et al. Antioxidant properties of polyphenol-rich cocoa products industrially processed[J]. Food Research International, 2010, 43(6): 1614-1623.
[20] Summa C, Raposo F C, McCourt J, et al. Effect of roasting on the radical scavenging activity of cocoa beans[J]. European Food Research and Technology, 2006, 222: 368-375.
[21] 侯 丹, 邵胜荣, 陈小强, 等. 儿茶素稳态化及其应用研究进展[J]. 食品工业科技, 2017, 38(22): 325-330.
[22] ?y?elewicz D, Krysiak W, Oracz J, et al. The influence of the roasting process conditions on the polyphenol content in cocoa beans, nibs and chocolates[J]. Food Research International, 2016, 89 (2): 918-929.
[23] Suazo Y, Davidov-Pardo G, Arozarena I. Effect of fermentation and roasting on the phenolic concentration and antioxidant activity of cocoa from Nicaragua[J]. Journal of Food Quality, 2014, 37(1): 50-56.
[24] Summa C, McCourt J, C?mmerer B, et al. Radical scavenging activity, anti-bacterial and mutagenic effects of cocoa bean Maillard reaction products with degree of roasting[J]. Molecular Nutrition & Food Research, 2008, 52(3): 342-351.
[25] Nazaruddin R, Seng L K, Hassan O, et al. Effect of pulp preconditioning on the content of polyphenols in cocoa beans (Theobroma cacao) during fermentation[J]. Industrial Crops and Products, 2006, 24(1): 87-94.
[26] Bonaldo F, Guella G, Mattivi F, et al. Kinetic investigations of sulfite addition to flavanols[J]. Scientific Reports, 2020,10(1): 12792.
[27] Gültekin-?zgüven M, Berkta? I, ?z?elik B. Change in stability of procyanidins, antioxidant capacity and in-vitro bioaccessibility during processing of cocoa powder from cocoa beans[J]. LWT-Food Science and Technology, 2016, 72: 559-565.
責任编辑:崔丽虹
