直接竞争化学发光酶免疫法检测氟喹诺酮类药物方法的建立
2021-11-04曹敬政辛思培孙卫东
曹敬政 ,安 静 ,蒋 蔚 ,辛思培 ,宋 斌 ,李 思 ,王 权 ,孙卫东
(1.中国农业科学院上海兽医研究所,上海 200241;2.新疆农业科学院农业质量标准与检测技术研究所,乌鲁木齐 830000;3.南京农业大学动物医学院,南京 210095)
氟喹诺酮类药物(FQs)属于第三类喹诺酮类药物,是一类人工合成的含有4-喹诺酮母核结构[1],C-6位上连接氟原子,C-7位有哌嗪环的一类广谱抗菌药物[2]。该类抗生素相比于其他喹诺酮类药物抗菌谱更广,对革兰氏阴性菌和部分革兰氏阳性菌均有明显的抑制作用[3-4],已被广泛应用于畜禽和水产动物疾病,其杀菌作用主要是通过靶向抑制细菌促旋酶和拓扑异构酶Ⅳ的合成来抑制细菌DNA的复制[5-6]。该类药物大剂量摄入可导致动物急性中毒,长期低剂量摄入可导致动物机体对该药产生耐药性;其不合理使用或滥用会引发药物残留,进而通过食物链危害人类的健康,所以国家对于动物性食品中氟喹诺酮类药物残留的检测与控制非常重视。
我国规定对不同氟喹诺酮类药物的最高残留限量(MRLs)为10 μg/kg~1000 μg/kg,在2292号公告中已经规定自2016年12月31日开始停止诺氟沙星、洛美沙星、培氟沙星和氧氟沙星4种氟喹诺酮类药物在食品动物中的使用和经营[7]。目前对于氟喹诺酮类药物残留检测方法主要有微生物法[8]、高效液相色谱法[9]、色谱-质谱联用法[10-12]、高效毛细管电泳法[13]、免疫分析法[14-15]。其中微生物法检测限过低,灵敏度不高;色谱-质谱法的检测灵敏度及精确度比较高,但是用于检测的仪器设备价格比较昂贵,而且样品的前处理费时费力,不适用于对样品的大量、快速的筛选。免疫分析法以其灵敏度高,特异性强,检测快速简单而广泛的应用于药物残留的检测中,主要有酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)[16]、免疫层析试纸法(immuno-chromatographicassay,ICA)[17-19]、放射免疫法(radio immunoassay,RIA)[20]、化学发光酶免疫法(chemiluminescent enzyme immunoassay,CLEIA)[14]。其中CLEIA是一种与ELISA较为相似的酶免疫分析方法[21]。由于其具有灵敏度高、检测时间短、检测数值范围宽、光信号持续时间长等优点[22-23],并且克服了仪器检测法所用仪器昂贵和对操作人员的专业性要求较高的缺点,逐渐成为免疫学检测的重要发展方向之一。
由于同一类抗生素开发的品种越来越多,同类抗生素需进行残留监测品种也越多。单一抗生素残留的快速检测技术通常难以满足实际检测的需要。因此,发展同一类抗生素药物总或多残留快速检测技术是当前国内外动物源性产品质量安全研究领域的前沿和发展趋势之一。
广泛应用的氟喹诺酮类药物(FQs)药物达十几种之多,如果针对每一种FQs药物都建立一种检测方法,费时费力。本文通过制备针对FQs母环结构相似结构药物诺氟沙星的宽谱特异性的单克隆抗体,将抗体识别药物的广谱性与CLEIA的高灵敏性结合起来,建立了一种能够检测多种氟喹诺酮类药物(FQs)的CLEIA法。
1 材料与方法
1.1 材料 诺氟沙星、培氟沙星、环丙沙星、洛美沙星、那氟沙星、恩诺沙星、依诺沙星、氧氟沙星、麻保沙星、达氟沙星、沙拉沙星、二氟沙星等氟喹诺酮类药物购自阿拉丁试剂有限公司;牛血清白蛋白、N-羟基琥珀酸亚胺购自Sigma公司;辣根过氧化物酶购自中国科学院上海生物化学研究所;1-(3-二甲氨基丙基)-3-乙基碳二亚胺、二甲基甲酰胺购自国药集团化学试剂有限公司;胎牛血清购自GIBCO公司;DMEM培养基购自Hyclone公司;HiTrapTMPro-tein G纯化柱购自美国GE Healthcare公司;化学发光底物购自湖州英创生物技术有限公司;超高性能化学发光检测仪购自Bio-Tek公司。
1.2 完全抗原的制备与鉴定
1.2.1 半抗原的改造 参考Li等[24]的方法,选择半抗原药物NOR(诺氟沙星)进行改造,将三颈烧瓶中的8 mL水加热至80℃,加入320 mg NOR(1 mmol/L),滴加0.1 mol/L的氢氧化钠溶液至NOR溶解,再将80 mg 2-氯乙胺(1 mmol/L)缓慢加入,继续搅拌反应30 min,反应过程中不断滴加0.1 mol/L的氢氧化钠溶液使pH值保持在8.0。反应结束,待温度降至60℃,用0.1 mol/L盐酸将溶液pH调节至6.0以析出沉淀。将沉淀物抽滤,并用50 mL水洗涤,最终干燥后得到目的产物,命名为半抗原NOR-1,反应过程见图1。
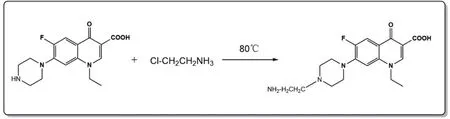
图1 半抗原NOR改造为NOR-1的反应过程Fig.1 The process of hapten NOR transformation to NOR-1
1.2.2 完全抗原的制备与鉴定 将10 mg NOR-1溶解于3 mL二甲基甲酰胺中作为A液,再将20 mg BSA溶解于3 mL的PBS中作为B液。将A液与B液混合,加入30 μL 25%戊二醛,在4℃条件下混匀搅拌4 h,再加入1 mL 15 mg/mL的硼氢化钠,4℃避光搅拌2 h,反应产物透析3 d(透析袋分子量为8000~14 000 kDa),得到免疫原(NOR-1-BSA)。按照同样的方法,以OVA作为蛋白载体,进行包被抗原(NOR-1-OVA)的制备,最终在220~400 nm范围内,使用紫外扫描鉴定是否偶联成功。制备过程见图2。

图2 NOR-1-BSA完全抗原的合成过程Fig.2 The synthesis process of complete antigen NOR-1-BSA
1.2.3 抗FQs 单克隆抗体(McAb)的制备 选择经完全抗原免疫的小鼠中血清效价及对药物的半数抑制量(half maximal inhibitory concentration,IC50)俱佳的小鼠进行单克隆抗体的制备。在无菌条件下取小鼠脾脏,获取脾细胞与骨髓瘤细胞SP2/0进行细胞融合,制备杂交瘤细胞。以NOR-1-OVA作为包被原,应用间接ELISA的方法,根据效价及IC50筛选出阳性杂交瘤细胞,并扩大培养。将扩大后的细胞注射入小鼠腹腔内,以体内诱生腹水瘤法,制备单克隆抗体。将腹水离心取上清液,用HiTrapTMProtein G纯化柱纯化抗体,测定纯化后抗体效价及IC50。
1.4 抗FQs的McAb-HRP的合成与鉴定 参考熊挺等[25]方法,采用改良过碘酸钠法合成抗FQs单克隆抗体辣根过氧化物酶标记物。称取3 mg HRP溶解于0.6 mL去离子水中,再加入200 μL NaIO4溶液(0.1 mol/L),混匀,室温避光反应20 min。将反应后的混合液使用NaAc溶液(1 mmol/L,pH4.4)透析过夜,透析后的HRP溶液用CBS(碳酸盐缓冲液0.2 mol/L,pH9.5)调节至pH9.5作为A液。取3 mg FQs-McAb(氟喹诺酮类药物单克 隆抗体)溶于CBS(0.01 mol/L,pH9.5)中作为B液,将A液与B液混合,室温避光轻微振荡反应2 h。将40 μL NaBH4溶液(4 mol/L),混匀,室温避光反应1.5 h。将最终反应产物以PBS溶液(0.01 mol/L, pH7.4)于4℃透析3 d,与等体积甘油混合保存于-20℃。取部分产物在220~400 nm范围进行紫外扫描鉴定是否偶联成功。
1.5 dc-CLEIA检测步骤 包被:用CBS(pH9.6,0.05 mol/L)将包被原NOR-1-OVA稀释加入化学发光板中100 μL/孔,4℃孵育过夜,1×PBST洗板3遍,间隔5 min。封闭:封闭液200 μL/孔,37℃孵育1.5 h,1×PBST洗板3遍,间隔5 min。加抗体及竞争物:洗板后加入50 μL稀释好的标准品(或样品)和50 μL FQs酶标抗体,置于37℃孵育1 h,1×PBST洗板3遍,间隔5 min。显色:加入100 μL/孔的化学发光的底物液(A液:B液=1∶1),5 min内以检测仪读取相对光单位值(relative light unit,RLU),检测流程示意图见图3。

图3 直接竞争化学发光酶免疫法检测流程示意图Fig.3 Schematic diagram of dc-CLEIA reaction
1.6 dc-CLEIA的建立
1.6.1 dc-CLEIA的条件优化 采用棋盘法对包被原浓度和酶标抗体稀释度进行初步选择。以NOR-1-OVA作为包被原,将包被原和酶标抗体进行梯度稀释,选择RLU值在1.0×105的抗原包被浓度和酶标抗体稀释浓度为初步选择的浓度。在初步选择的包被抗原浓度及抗体浓度上下范围内,选择3个包被浓度及3个抗体稀释浓度进行二因子交叉试验,以20、10、5、2.5、1.25、0.625和0 ng/mL NOR作为竞争标准品进行竞争反应,按1.5的检测步骤进行操作,每组试验重复3次。根据测定结果计算出各组合条件下的IC50,选出最佳包被原浓度和酶标抗体稀释度。
通过控制单因素变量试验来确定最佳包被方法、封闭液种类、竞争时间。分别设置3组包被条件:37℃ 2 h、37℃ 4 h、4℃过夜;分别设置3组不同的封闭条件:1%脱脂乳、1%明胶、1%牛血清蛋白(BSA);分别设置3组竞争时间:30 min、60 min、90 min。按照1.2.4中所述的方法进行竞争化学发光操作,测定RLU值,每个条件重复3次,计算各条件下的IC50和RLUmax。根据测定的条件绘制标准曲线,以IC50和RLUmax/IC50作为依据,RLUmax/IC50比值越大,IC50越小,则在该条件下灵敏度越高,越符合试验的最佳要求[26]。
1.6.2 NOR的dc-CLEIA建立
1.6.2.1 标准曲线 根据上述优化后的最佳反应条件,将药物标准品用0.01 mol/L的PBS(pH7.4)梯度稀释为20、5、1.25、0.3125、0.07 825 ng/mL的系列浓度的标准品和PBS稀释液作空白对照进行竞争抑制,测定RLU值,每个浓度做3组平行重复。根据测量的结果,以Log(C)为横坐标,以B/B0(%)为纵坐标,建立标准曲线。
1.6.2.2 特异性试验 选取12种氟喹诺酮类药物,对药物进行梯度的稀释,以优化后的条件进行dc-CLEIA,根据结果拟合抑制曲线计算IC50,并计算出抗体对于氟喹诺酮类药物的交叉反应率(CR):

1.6.2.3 精密性试验 以不同浓度的NOR标准品进行竞争抑制时酶标抗体与抗原结合率的批内误差和批间误差来评价该方法的精密度。同一次试验中每一浓度标准品做3次重复测定,以其批内变异系数(CV)表示批内精密度。在不同时间进行3次连续试验,以其批间变异系数表示批间精密度。
1.6.2.4 最低检出限试验 用CLEIA方法测定20个标准空白孔(50 μL PBS+50 μL酶标物),计算出20个标准空白孔的RLU的平均值()和标准差(SD),代入公式Z=-3SD,根据标准曲线计算出Z值对应的NOR浓度,即为最低检出限。
1.7 其他FQs的dc-CLEIA主要参数 选择NOR广谱特异性抗体能够识别的除NOR以外的FQs,参照1.6.2.1分别对各药物梯度进行稀释,测定dc-CLEIA,建立各药物标准曲线。此外进行最低检出限试验,并汇总能够被NOR广谱特异性抗体识别的FQs的dc-CLEIA主要参数。
1.8 样品处理 取1 mL待检牛奶样品于15 mL离心管中,加入乙腈-10%三氯乙酸溶液4 mL,超声5 min,于4℃、4000 ×g离心10 min取上清液[17]。为消除基质效应对试验结果的影响,将上清液以PBS为稀释液稀释20倍后用于dc-CLEIA的测定。
1.9 添加回收率试验 选取与本试验制备抗体交叉反应率较高的十种氟喹诺酮类药物,分别向经色谱检测的阴性牛奶样品其中添加药物,使各药物终浓度20、10 ng/mL,每个浓度设 3 个平行。按照1.8中对牛奶样品处理的方法,用直接竞争 CLEIA 方法测定样品中药物浓度,并计算回收率和变异系数。回收率(%)=(实际浓度的平均值/添加浓度)×100%,变异系数CV(%)=(实际浓度的标准差/实际浓度的平均值)×100%。
2 结果
2.1 完全抗原的鉴定 取NOR-1、NOR-1-BSA、BSA,以PBS溶液溶解,在200~400 nm范围进行紫外扫描,确定各物质的最大吸收峰,紫外扫描结果见图4。NOR-1波长在272 nm处及323 nm处分别有吸收峰,BSA在277 nm处有最大吸收峰,偶联后产物NOR-1-BSA在279 nm及324 nm处有最大吸收峰,偶联后产物吸收峰相对于NOR-1及BSA最大吸收峰发生了偏移,且NOR-1-BSA同时具备了NOR-1及BSA的峰值特征,可以确定NOR-1与蛋白载体BSA偶联成功。
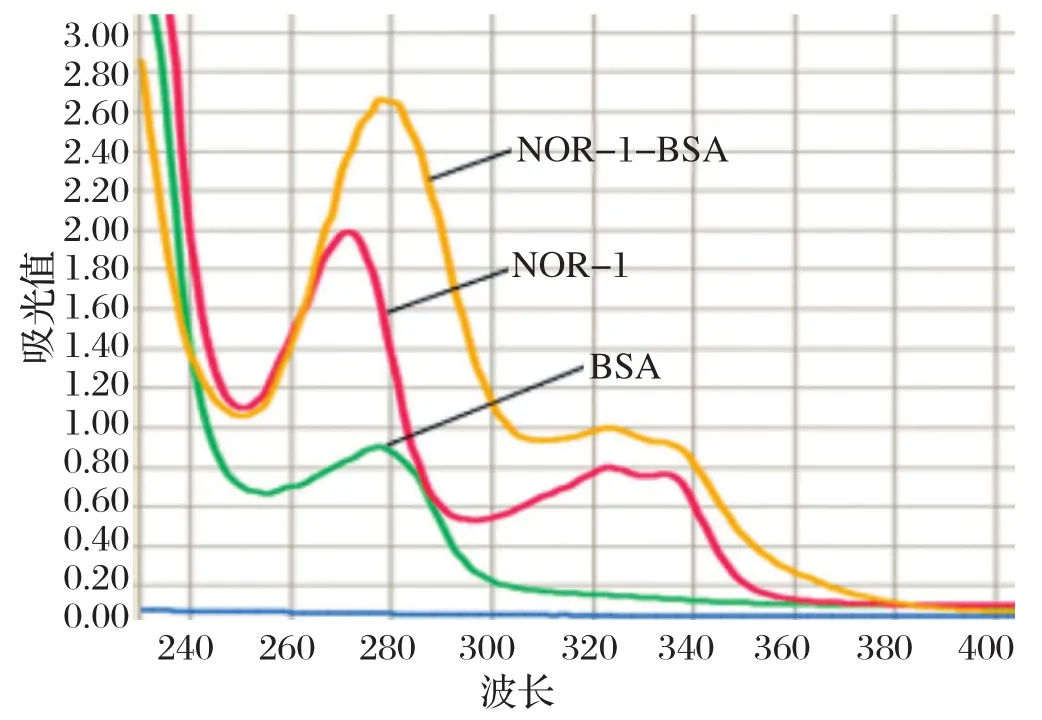
图4 NOR-1-BSA完全抗原紫外扫描图谱Fig.4 Completed antigen UV spectra of NOR-1-BSA
2.2 酶标抗体McAb-HRP的鉴定 由图5可见FQs-McAb的特征吸收峰在276 nm,HRP的特征吸收峰在403 nm,McAb-HRP在278 nm和402 nm处分别存在吸收峰,兼具FQs-McAb和HRP的特征,且与FQs-McAb和HRP的特征峰值相比,吸收峰发生了偏移,说明McAb-HRP偶联成功。

图5 抗FQs的McAb-HRP紫外鉴定扫描图谱Fig.5 McAb-HRP UV identification scanning map of anti-FQs
2.3 抗FQs广谱特异性单克隆抗体的制备 对融合后的阳性孔,以药物NOR作为竞争标准品,以间接竞争ELISA对细胞株进行二次筛选,选择效价高且对于药物抑制效果好的细胞进行3次亚克隆,最终筛选出的阳性细胞株7B6所制备的抗体效价达到了1∶4.0×105,对于药物(NOR)的IC50为1.4 ng/mL。
2.4 最佳反应条件的确定
2.4.1 包被原与酶标抗体稀释度的确定 通过棋盘法初步选择RLU值在1×105的包被原浓度及抗体稀释浓度,然后在上下范围内选择包被原浓度为0.6、0.3、0.15 μg/mL,选择酶标抗体的浓度为1∶6000、1∶8000、1∶10 000进行竞争反应。由表1可见,当包被原为0.3 μg/mL,酶标抗体稀释度为1∶8000时,其IC50最小为2.13 ng/mL,表示该稀释度配比下的竞争反应最为灵敏,故选择包被原为0.3 μg/mL,酶标抗体稀释度为1∶8000为最优组合。
表1 不同稀释度包被原和酶标抗体反应的IC50Table 1 The IC50 values of different dilutions of coating antigen and enzyme-labeled antibody
2.4.2 包被条件的确定 由图6可见,在3种包被条件下,IC50逐步升高,RLUmax/IC50逐步降低。第三组(4℃过夜)的IC50最低,而RLUmax/IC50最高,表明将包被原在4℃过夜的情况下,可使抗原包被的更加均匀、完全,同时可以使检测的灵敏度提高。最终选择4℃过夜为最佳的包被条件。
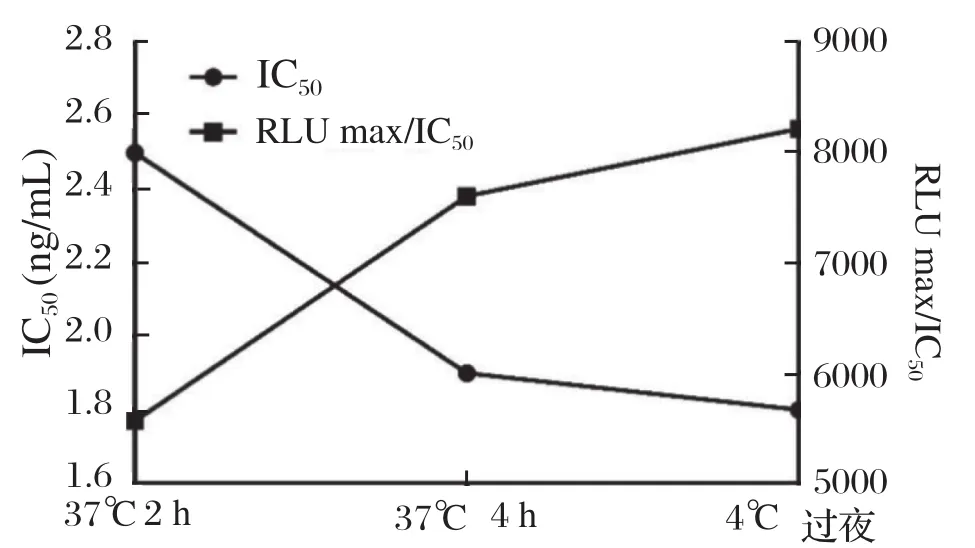
图6 NOR CLEIA包被条件优化Fig.6 Optimization of coating conditions for dc-CLEIA of NOR
2.4.3 封闭液的确定 由图7可见,1%BSA封闭时的IC50最低,其中1%BSA和1%明胶封闭的IC50接近,但1%BSA封闭时的RLUmax/IC50最高。因此综合考虑IC50和RLUmax/IC50,最终选择1%BSA为最佳封闭条件。

图7 封闭液种类的优化Fig.7 Optimization of the type of blocking buffer
2.5 NOR的dc-CLEIA建立
2.5.1 建立标准曲线 通过对梯度稀释的不同浓度NOR,进行dc-CLEIA,以LgC(NOR)为横坐标,以B/B0为纵坐标建立标准曲线如图8,得出LgC与B/B0呈线性关系,方程为y= -0.2554x+0.542,R2=0.9933,IC50=1.46 ng/mL。
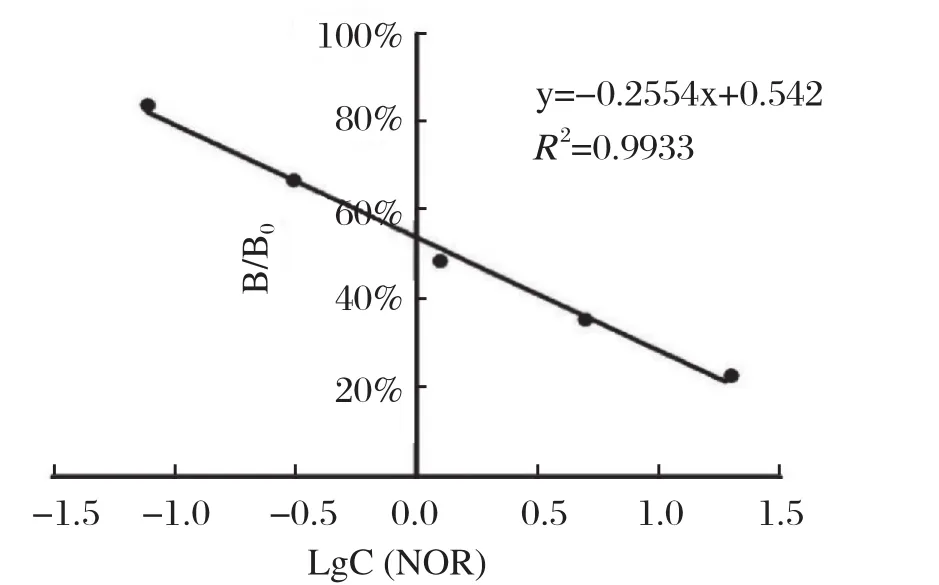
图8 NOR药物的标准抑制曲线Fig.8 Standard inhibition curve of NOR
2.5.2 竞争时间的确定 由图9可见,随着竞争反应时间的增加,IC50先降低后升高,在反应时间为1 h时最低;对于RLUmax/IC50,随着时间的增加,其数值先升高后降低,1 h时达到最高。由此选择1 h作为竞争反应时间。
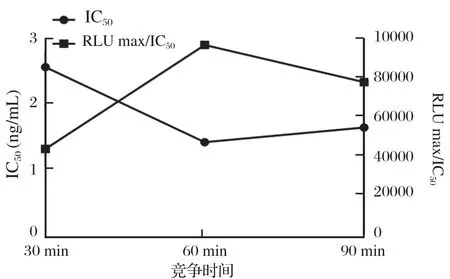
图9 竞争时间的优化Fig.9 Optimization of competitive reaction
2.5.3 特异性试验 以dc-CLEIA法,求出各药物的IC50,得出该方法对10种氟喹诺酮类药物的灵敏度。由表2可知,NOR广谱特异性抗体对10种氟喹诺酮类药物的有较好的交叉反应,其交叉反应率范围为12.6%~118.9%,但对二氟沙星、沙拉沙星的交叉反应均小于1%,与其他非喹诺酮类药物的无交叉反应率。
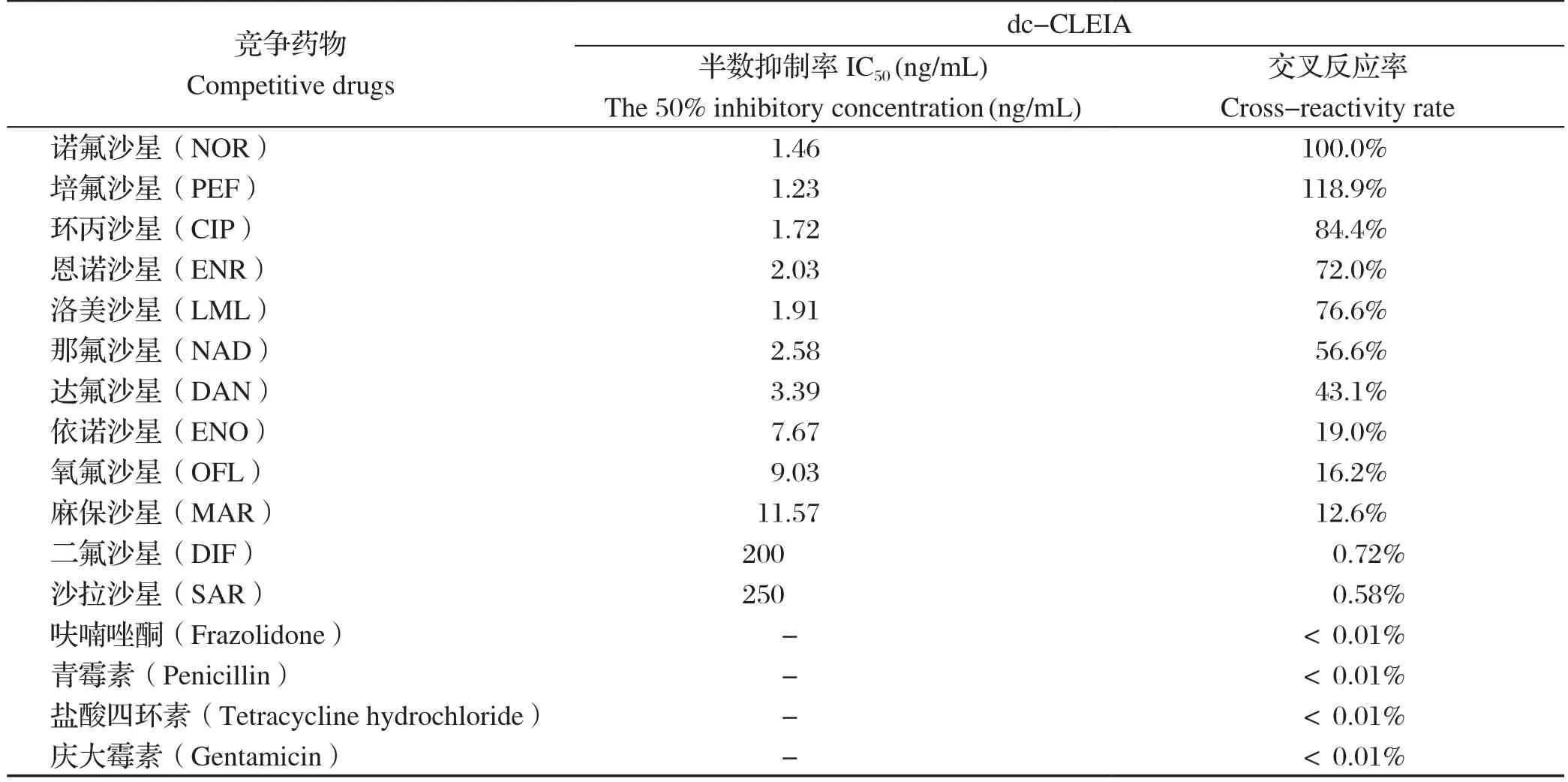
表2 dc-CLEIA法测定对FQs药物的交叉反应性Table 2 Cross-reactivity of FQs by dc-CLEIA
2.5.4 精密性试验 以批内和批间变异系数表示CLEIA的精确度,NOR标准品的各浓度的结合率和变异系数见表3。按照检测方法的变异系数公式CV(%)=[SD的平均值/(1.414×平均结合率)]×100%进行计算。CLEIA的批内变异系数为:CV(%) = [3.9/ (1.414×51.7)]×100%=5.33%,CLEIA的批间变异系数为CV(%)= [4.5/ (1.414×50.4)]×100%=6.31%。由批内和批间变异系数均低于10%可知,本方法重复性好。
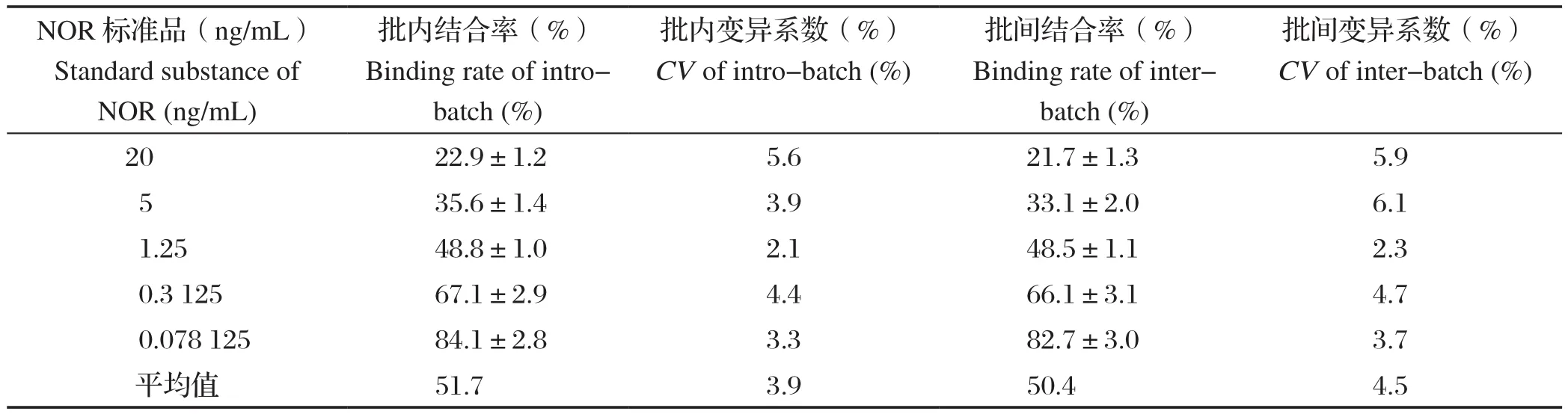
表3 dc-CLEIA精密性试验结果Table 3 The precision experiment results of dc-CLEIA
2.5.5 最低检测限 由表4可知,20个空白孔平均值为145 055.45,SD为8025.42,代入公式Z=-3SD,Z=120 979.19,计算B/B0,经标准曲线方程y=-0.2554x+0.542推算得知NOR最低检测限为0.0719 ng/mL。其他FQs的dc-CLEIA主要参数见表5。
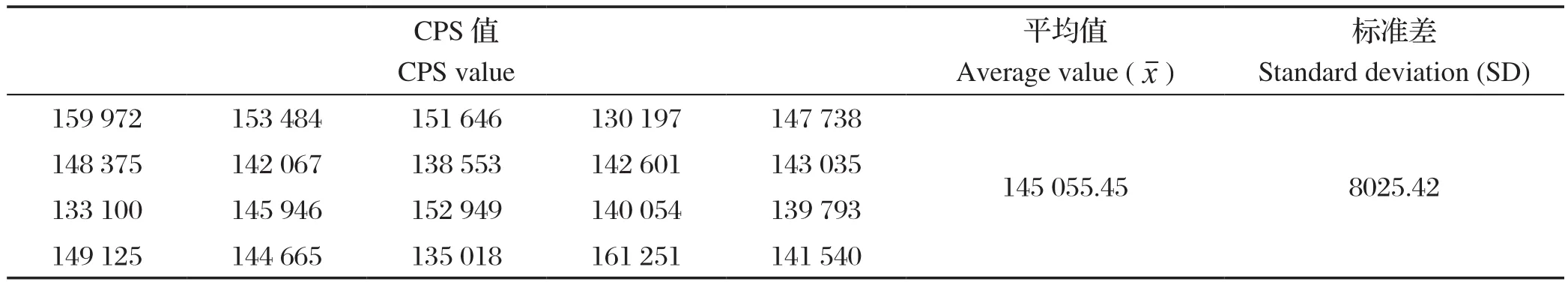
表4 空白样品检测结果Table 4 The results of blank sample by CLEIA
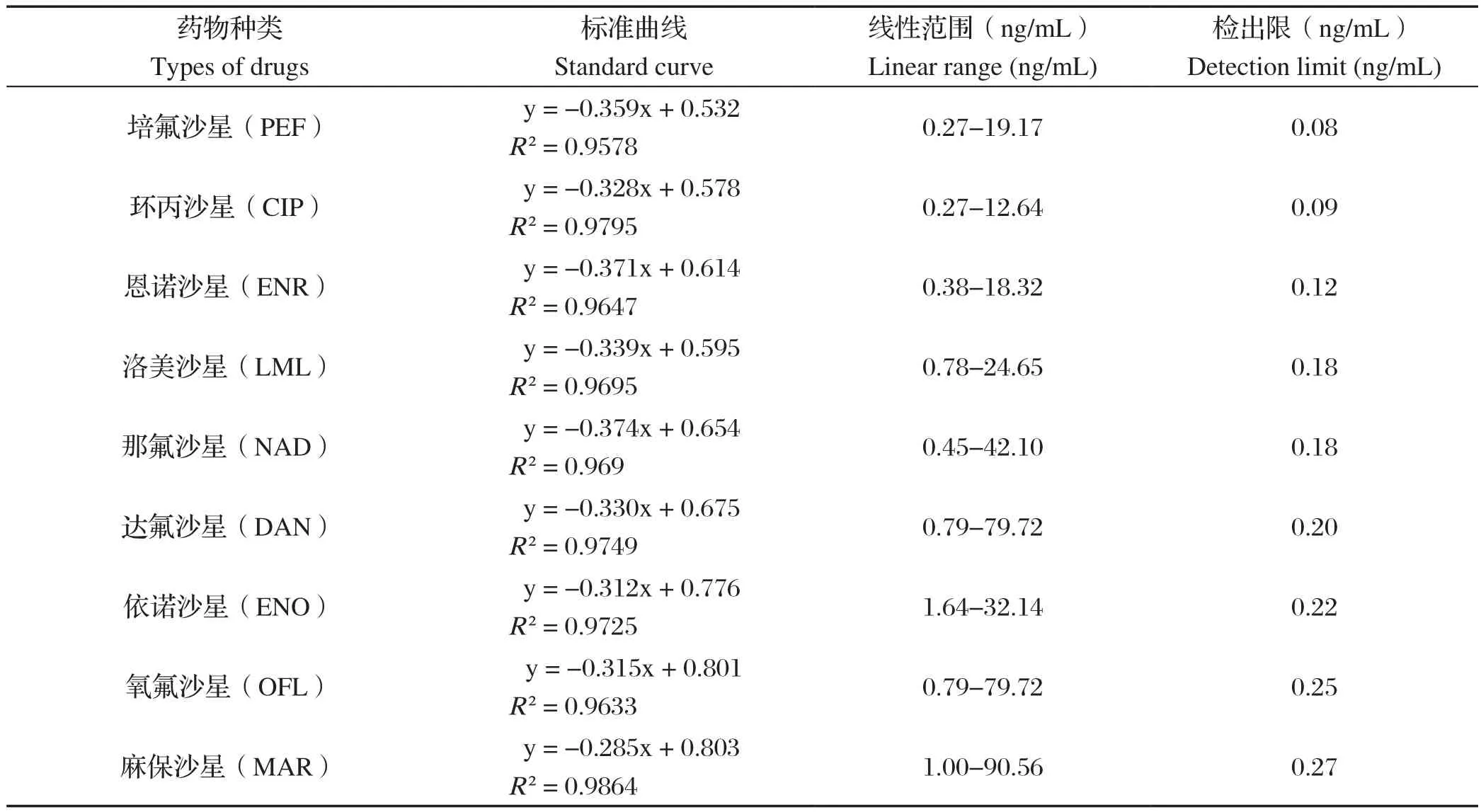
表5 dc-CLEIA法测定对FQs药物的交叉反应性Table 5 Cross-reactivity of FQs by dc-CLEIA
2.5.6 回收率试验 通过在牛奶中的添加回收试验,分别加标浓度为20、10 ng/mL,以dc-CLEIA法分别求出加标浓度下的光度值RLU,每组进行3次重复取平均值,通过对于各种药物建立的标准曲线,得出牛奶的回收浓度,求出样品回收率为73.3%~103.1%。详细结果见表6。
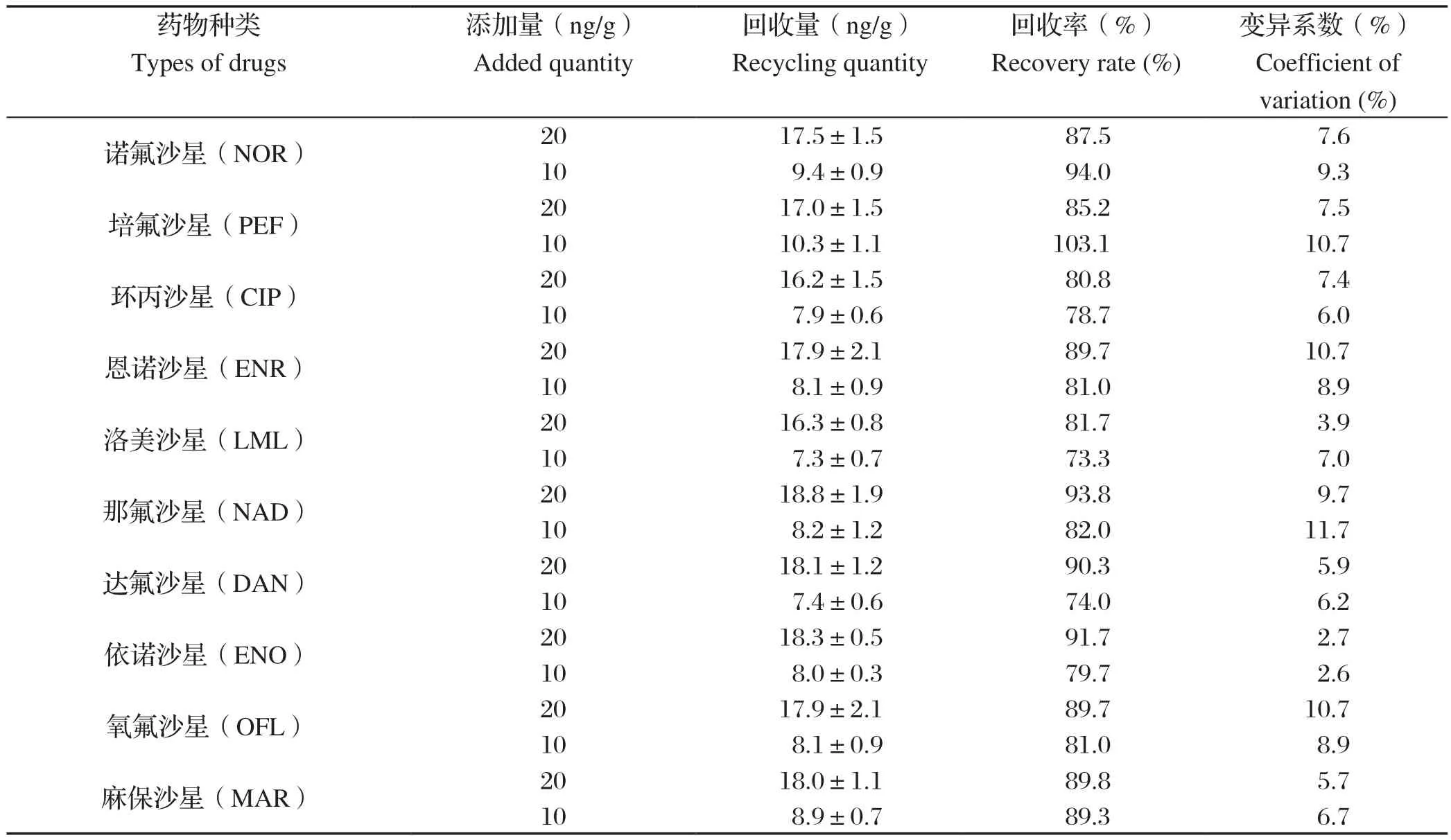
表6 dc-CLEIA的添加回收率试验Table 6 Recovery experimentof dc-CLEIA
3 讨论
本研究成功建立了一种能够检测10种氟喹诺酮类药物残留的化学发光酶免疫方法,该方法可以实现对10种氟喹诺酮类药物的高通量检测。制备具有氟喹诺酮类药物(FQs)广谱特异性的单克隆抗体是建立该方法的关键,故本研究设计选择与FQs母核结构较为相似的药物诺氟沙星(NOR)来进行完全抗原的制备,通过在NOR的哌嗪环上连接一个碳链,再由碳链与蛋白载体进行连接,使得蛋白载体在空间上远离药物的母核结构,既充分暴露母核结构,又保证了母核结构的完整性。经测定发现,以完全抗原NOR-1-BSA免疫小鼠制备的单克隆抗体对氟喹诺酮类药物具有广谱特异性和较高的灵敏性。
为了弥补广谱特异性的单克隆抗体应用于检测时灵敏度的不足,本研究选择了较传统ELISA方法更为灵敏的化学发光酶联免疫法,通过对包被原与酶标抗体稀释倍数、封闭液种类、竞争时间等条件进行优化建立了dc-CLEIA方法,将化学发光的灵敏性与单克隆抗体的特异性结合起来,可以实现对于氟喹诺酮类药物残留更高灵敏度的检测[27],其中该方法对于10种药物的灵敏度(IC50)在1.46~11.57 ng/mL,检测限在0.07~0.27 ng/mL之间。Jang等[28]建立的ELISA方法,可检测13种氟喹诺酮类药物,其检测限为2.4 ng/mL;Barreto等[29]建立的液相色谱-质谱串联的方法能够检测9种FQs药物,其检测限为5 ng/mL;Zhu等[17]建立的氟喹诺酮类药物的胶体金检测技术的检测限为25 ng/mL。综上,本研究建立的方法在检测限上可达到甚至优于与其他检测方法。
dc-CLEIA方法无需孵育酶标二抗,简化了操作步骤,而且经过酶和发光两级放大效应使得检测范围更宽。在模拟样本检测中,本方法对于10种氟喹诺酮类药物的检测回收率为73.3%~103.1%,且对这些药物的检测限均在国家规定的最高残留限度之下,说明该方法具有较强的可靠性及实际应用价值,可满足10种氟喹诺酮类药物残留的高通量检测需求。
