猪盖他病毒IgG抗体间接ELISA检测方法的建立
2021-11-04夏银河王新卫李永涛史姿聪刘红英常洪涛王川庆
夏银河,周 峰,陈 陆,王新卫,李永涛,史姿聪,刘红英,常洪涛,杨 霞,王川庆
(河南农业大学动物医学院,郑州 450002)
盖他病毒(Getah virus,GETV)为单链正股RNA病毒,属于披膜病毒科甲病毒属成员,1955年由美国陆军医学研究部门从马来西亚的雪背库蚊(C.gelidus)中分离并命名,原型株为MM2021[1-2]。自发现以来,在欧洲、亚洲、大洋洲的不同动物中均发现GETV的存在,其传染性和致病性受到广泛关注;目前国内已在哺乳动物(猪、狐狸、马和牛)中分离到多株GETV毒株[3-6],且在商品化动物疫苗以及公猪精液中也有发现[4,7]。然而其在猪群中的流行态势和危害程度尚不明确,目前国内还没有针对该病毒的血清学诊断和调查的商品化的抗体检测试剂盒。因此建立一种特异有效、可用于大面积快速检测的ELISA检测方法对于该病毒的研究具有重要意义。
GETV病毒颗粒呈球形,有囊膜和纤突,直径约70 nm[8];基因组大小为11 000~12 000 bp,含有两个开放阅读框(open reading frame,ORF),编码4个非结构蛋白(NSP1、NSP2、NSP3、NSP4)和5个结构蛋白,包括Cap、E3、E2、6K、E1蛋白,其中Cap蛋白是病毒粒子形成和存活所必须的元件[5,9]。
近年来,我国多数地区均检测到盖他病毒感染并呈上升趋势,病毒分离地几乎跨越我国全境(从北纬19°至46°18')。宿主范围不断扩大(我国流行宿主新增猪、狐狸、马和牛),对我国的养殖业形成潜在威胁。目前虽尚无人类临床发病的报道,但在健康人和发热病人血清中均检测到盖他病毒中和抗体[10-11],一般认定其为人兽共患病病毒[12]。结合全球流行趋势和我国的流行情况,该病毒近年在我国存在暴发的可能性。因此,本文对Cap蛋白序列进行扩增,原核表达Cap融合蛋白,将其作为包被抗原,建立了检测GETV IgG抗体的间接ELISA方法,旨在为我国猪群内GETV流行情况的检测和疫苗免疫效果的评判提供技术支撑。
1 材料和方法
1.1 主要试剂和样品来源 GETV HNJZ-SI株、病毒RNA提取试剂盒(DP315-R)购自天根生化科技(北京)有限公司;SanPrep柱式质粒DNA小量抽提试剂盒和PCR产物纯化试剂盒购自生工生物(上海)股份有限公司;Gel-Extraction Kit(D2500-02)购自美国Omega Bio-Tek公司;HiScript Ⅱ 1st Strand cDNA Synthesis Kit反转录试剂盒购自南京诺唯赞生物科技股份有限公司;pMDTM18-T Vector Cloning Kit、DL1000 DNA marker均购自TaKaRa公司;2×RapidTaqMaster Mix购自南京诺唯赞生物科技有限公司;DH5α感受态细胞购自北京全式金生物有限公司;羊抗猪IgG-HRP抗体购自武汉三鹰生物技术有限公司;TMB底物显色液购自北京索莱宝科技有限公司;BCA蛋白浓度测定试剂盒购自博士德生物工程有限公司;预染蛋白Marker购自赛默飞世尔科技(中国)有限公司;Gel-Extraction Kit(D2500-02)购自美国Omega Bio-Tek公司;DNA marker购自TaKaRa公司;CSFV、PRRSV、FMDV、Mhp和PCV2阴性、阳性血清由本实验室制备保存。119份临床血清样品来源于陕西省、河南省、山东省等猪场,由本实验室收集保存(其中含有20份已由中和试验判定为GETV抗体阳性的血清样品);大肠杆菌BL21感受态细胞购自北京全式金生物有限公司;Thermo MULTISKAN GO全波长酶标仪为赛默飞世尔科技(中国)有限公司产品。
1.2 Cap蛋白原核表达质粒的构建 参考GenBank中猪源毒GETV(HNJZ-SI, KY363862.1)Cap基因,使用Primer Premier5.0软件设计引物,并插入酶切位点EcoRⅠ和XholⅠ,F:5'-CGCgaattcATGAATTACA TTCCAACT-3';R:5'-CTCctcgagCCATTCTTCTG TTCCTTC-3';以HNJZ-S1毒株的cDNA为模板进行PCR扩增,PCR产物经纯化后,与pET-28a载体进行双酶切连接,构建原核重组表达质粒pET28a-Cap。重组质粒进行酶切鉴定,同时送生工生物工程(上海)股份有限公司测序鉴定。
1.3 GETV Cap蛋白的制备与鉴定 将重组质粒pET28a-Cap转化至大肠杆菌BL21(DE3)感受态细胞,挑取阳性菌落在LB培养基扩大培养,取适量菌液1∶100接菌,菌液培养至OD600为0.6~0.8时,用终浓度为0.1 mmol/L的IPTG进行诱导表达,经Ni-Agarose His标签蛋白纯化试剂盒纯化蛋白,Western blot鉴定并测定蛋白浓度后保存备用。
1.4 间接ELISA方法的建立与反应条件的优化 采用方阵滴定法,确定间接ELISA的Cap蛋白最佳抗原包被浓度(10 μg/mL、5 μg/mL、2 μg/mL、1 μg/mL、0.5 μg/mL、0.25 μg/mL、0.125 μg/mL、0.0625 μg/mL),最佳血清稀释度(1∶50、1∶100、1∶200、1∶4 0 0),最佳二抗稀释度(1∶1 0 0 0、1∶2000、1∶4000、1∶8000),最佳包被液为0.05 mol/L碳酸盐缓冲液(CBS、PBS、Tris、咪唑、生理盐水),封闭时间(1 h、1.5 h、2 h、2.5 h),孵育时间(30 min、45 min、60 min、75 min、90 min),显色时间(5 min、10 min、15 min、20 min)。
1.5 临界值的确定 利用IFA方法筛选阴性血清30份,按优化后的间接ELISA方法检测阴性血清,并设立阴性对照和阳性对照。将每份血清间接ELISA的OD450值转换为抗体效价(S/P),即(待检血清OD450值-阴性血清OD450值)/(阳性血清OD450值-阴性血清OD450值),计算抗体效价的平均值和标准方差SD。当样品S/P值<+2SD时,判为阴性;当样品S/P值>+3SD时,判为阳性;介于二者之间,判为疑似,需进行再次检验,如果S/P值仍小于+3SD时则判为阴性。
1.6 特异性试验 利用建立的间接ELISA方法对本实验室制备的CSFV、PRRSV、FMDV、TGEV和PCV2阳性血清进行检测,并设立GETV阳性、阴性血清对照,每份样品设3个重复。利用酶标仪检测OD450值,依据阴、阳性临界值,判定其阴性和阳性,评估该方法的特异性。
1.7 敏感性试验 将GETV阳性血清倍比稀释(1∶50、1∶100、1∶200、1∶400、1∶800、1∶1600),按已建立的间接ELISA方法操作,利用酶标仪检测OD450值,依据阴性、阳性临界值进行判定,评估该方法的敏感性。
1.8 重复性试验 使用同批表达纯化的Cap蛋白包被酶标板,按已建立的间接ELISA方法操作。随机选取阳性血清8份,每份血清重复6孔,进行批内重复性试验;以不同批次表达纯化的Cap蛋白作为包被抗原,对此8份血清进行批间重复性试验,对结果进行统计学分析。
1.9 符合性试验 利用本试验建立的间接ELISA方法与金标准IFA方法对来源于陕西省、河南省、山东省等地119份猪血清样品进行检测,计算两种方法的符合率。
2 结果
2.1 重组质粒pET28a-Cap的鉴定 对构建的重组质粒pET28a-Cap分别采用PCR、EcoRⅠ/XholⅠ双酶切和EcoRⅠ单酶切鉴定,PCR结果显示出1条约804 bp的特异性条带,双酶切结果出现两条特异性条带,分别为5369 bp和804 bp。单酶切结果显示,特异性条带约为6317 bp,均与预期片段大小一致;经测序结果正确,表明重组质粒pET28a-Cap正确构建。
2.2 Cap蛋白的鉴定 以PCR扩增获得Cap基因后构建重组质粒pET28a-Cap,转化至BL21(DE3)细胞诱导表达,纯化Cap蛋白与载体标签形成的融合蛋白约为35 kDa,蛋白浓度为724 μg/mL(图1)。
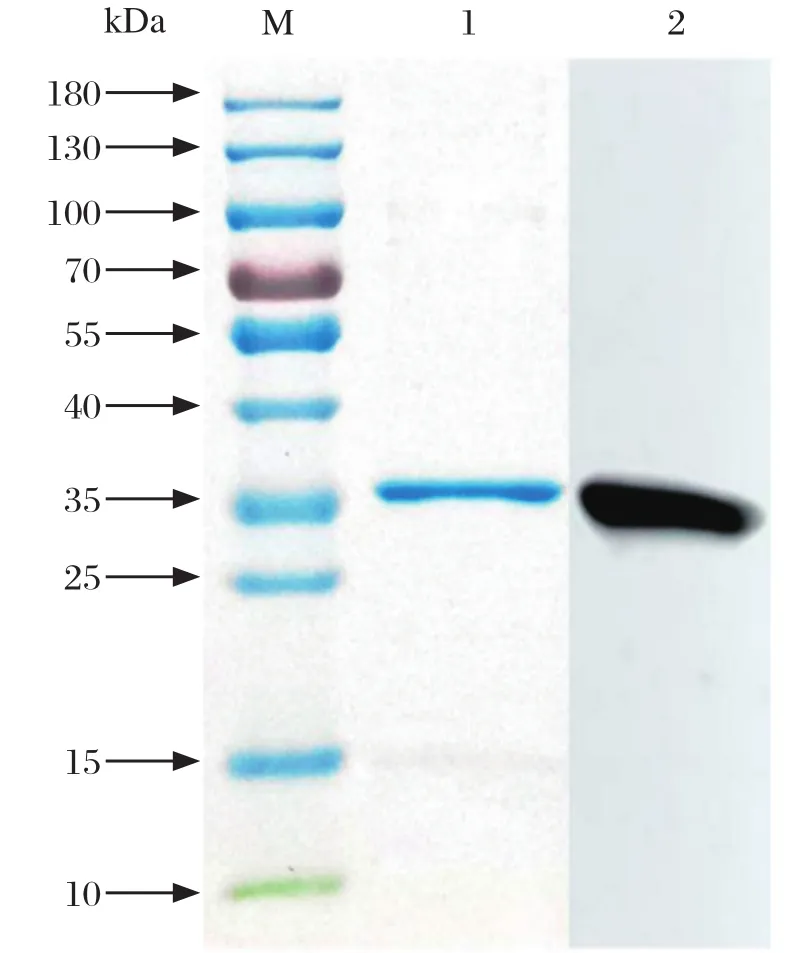
图1 Cap蛋白纯化的SDS-PAGE及Western blot鉴定Fig.1 SDS-PAGE and Western blot analysis of purification of GETV Cap
2.3 间接ELISA检测方法的最佳反应条件 矩阵试验结果显示,Cap蛋白最佳包被浓度为2 μg/mL,血清最佳稀释倍数为100倍,抗原最佳包被条件为CBS 4℃包被过夜,37℃条件下IgG-HRP(1∶2000)最佳反应时间为反应1 h,TMB底物最佳作用时间为15 min(表1)。

表1 间接ELISA检测方法最佳反应条件Table 1 Optimized conditions of indirect ELISA
2.4 临界值的确定 使用优化后的反应条件检测40份GETV阴性血清样品,按照公式:血清样本抗体效价(S/P)=(OD450样品-OD450阴性)/(OD450阳性-OD450阴性)确定每份样品的抗体效价。分别计算其平均值X为0.0698和标准方差SD为0.0492,故阳性临界值为0.2173,阴性临界值为0.1681(图2)。
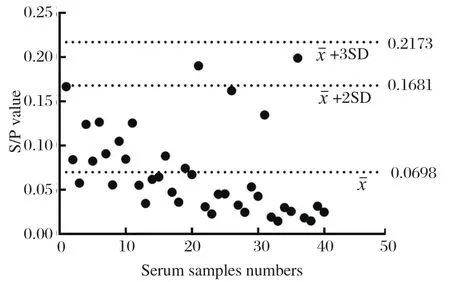
图2 临界值的确定Fig.2 Determination of critical values
2.5 特异性良好 利用建立的间接ELISA方法对CSFV、PRRSV、FMDV、TGEV和PCV2阳性血清进行检测。结果显示,其S/P值均低于阳性临界值0.2173,该方法的诊断抗原Cap蛋白仅能与GETV阳性血清发生反应,与其他几种病毒阳性血清无交叉反应(图3)。表明本研究建立的间接ELISA方法具有良好的特异性。
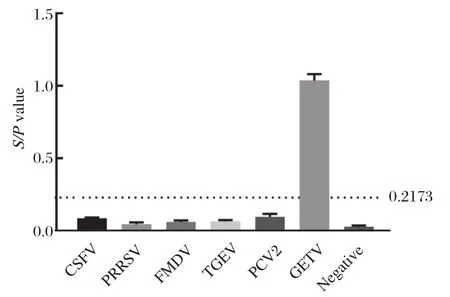
图3 间接ELISA特异性试验Fig.3 specificity test of indirect ELISA
2.6 敏感性较高 利用建立的间接ELISA方法对倍比稀释的GETV阳性血清进行检测。结果显示,当血清640倍稀释时S/P值仍大于0.2173,判定为阳性(图4)。说明所建立的ELISA方法敏感性良好。

图4 敏感性试验结果Fig.4 The results of sensitivity test
2.7 具有可重复性 利用建立的IgG抗体间接ELISA方法,选取8份不同效价的血清分别进行批内和批间重复性试验,对结果进行统计学分析。结果显示,批内变异系数为0.96%~6.09%,批间变异系数为4.43%~11.76%,均小于12%(表2)。表明本研究建立的间接ELISA方法具有良好的重复性。

表2 间接ELISA 方法与IFA 符合性试验结果Table 2 Results of compliance test of ELISA and IFA
2.8 与IFA检测结果的符合性较高 分别用建立的ELISA方法和IFA对陕西省、河南省、山东省等地的119份猪血清样品进行检测,以IFA为标准,计算间接ELISA与IFA的符合率。结果显示,IFA检出79份阳性,间接ELISA方法检出76份阳性;IFA检出40份猪盖他病毒阴性,间接ELISA方法共检出43份阴性。经计算,间接ELISA方法和IFA的阳性符合率为96.2%,阴性符合率为100%,总符合率为97.5%。表明本研究建立的间接ELISA方法可用于临床样品检测。
3 讨论
当前GETV在猪群的流行情况尚未完全明确,有研究表明,猪群在GETV的传播过程中发挥重要作用[13-14]。自1964年在我国海南第一次发现GETV至今[15],历经56年的流行和演变,其宿主范围不断扩大,传播区域越来越广,进一步增加了该病毒暴发流行的可能性,对我国的养殖业和公共安全均造成严重威胁。当前已报道检测GETV在猪群内流行的血清学方法虽然较多,例如血凝抑制试验(haemagglutination inhibition assay,HI)、中和试验(serum neutralization test,SNT)及间接免疫荧光(indirect immunofluorescence assay,IFA)[16-17]等,这些方法虽然可靠,但均无商品化产品可供使用,而且这些方法操作繁琐,耗时较长,且灵敏度和特异性尚有不足。因此,临床生产上亟需一种操作方便,特异性好,灵明度高,稳定可靠的方法来进行猪群中GETV的流行病学调查和抗体水平的检测,这将对开展GETV在我国的流行和分布,以及疫苗的研究具有重要意义。
甲病毒衣壳蛋白是形成病毒粒子中包裹病毒基因组的蛋白壳的元件,与病毒的形态结构和感染性密切相关,而衣壳蛋白的构象也决定了病毒包膜的装配以及与包膜蛋白的相互作用,是主要的补体固定抗原,与病毒的复制和存活密切相关[9,18]。自然状态下,GETV可引起妊娠母猪繁殖障碍和仔猪震颤、腹泻、后肢麻痹、体表发红等症状,严重者出现神经症状或呈犬坐姿势,甚至导致死亡[19-21]。疫苗免疫是临床中应对病毒性疾病的主要防控手段,IgG抗体是动物机体抵抗外部感染的主要抗体,在血清中含量最高,在机体的再次免疫应答中发挥重要作用,是反映机体免疫水平的重要指标。间接ELISA方法因其耗时短、敏感性高、操作简便、无需特殊仪器设备,且可用于特异性抗体检测的特点,在临床上广泛使用[22-23]。因此,本研究以Cap蛋白为诊断抗原建立特异性IgG抗体间接ELISA检测方法,为有效监测猪群中GETV的感染情况和临床中疫苗免疫效果的评测提供技术手段。成功构建pET28a-Cap重组质粒,利用原核表达系统获得融合蛋白,并通过镍柱进行亲和层析纯化获得高浓度、高纯度的目的蛋白;Western blot和活性检测结果显示,该蛋白特异性好、生物活性高,为ELISA检测方法的建立奠定基础。由于His标签的存在,因此所获得的蛋白大小略高于预期。
本研究以纯化的Cap蛋白为包被抗原,以羊抗猪lgG-HRP为二抗,采用矩阵法对间接ELISA反应条件进行优化,最终确定最佳反应条件,成功建立了检测GETV血清IgG抗体的间接ELISA方法。各项试验结果表明,该方法不仅特异性强,而且有良好的敏感性和可重复性,可用于猪群中GETV IgG抗体的检测,为临床上猪群GETV的抗体水平检测和疫苗免疫效果评价提供了有效的检测手段。对陕西省、山东省、河南省等119份送检样品进行检测(含20份经RT-PCR方法[17]检测阳性的样品)。结果显示,间接ELISA方法与IFA总符合率高达97.5%,略高于孟锦昕等[24]建立的灭活病毒检测方法。另外,20份经RT-PCR检测阳性的样品中,IFA检测结果全部为阳性,间接ELISA结果也全部为阳性,符合率为100%;其余送检样品中检出阳性样品59份,阳性率达59.6%,远高于文献报道的临床样品的阳性检出率,分析原因发现,本研究抽取的临床样品均为2018年7-9月的送检样品,为当年蚊虫最活跃的季节,也是GETV的高发季节,而样品选取存在偶然性,因此阳性率较高。本研究结果提示,GETV在猪群中的流行和感染情况不容乐观,猪场等养殖单位有必要采取相应措施减少猪群与蚊虫接触的机会,同时,研制出有效的疫苗也是控制GETV感染的关键。
