一株血清3型鸭甲型肝炎病毒的鉴定及致病性分析
2021-11-04提金凤李志杰毛红彦
提金凤,李志杰,毛红彦
(山东畜牧兽医职业学院,潍坊 261061)
鸭病毒性肝炎是雏鸭的一种急性、高度致死性传染病,该病传播速度快、病程短、病死率高[1]。临床上,3周龄以内的雏鸭多发,尤其是1周龄以内雏鸭更易感,其发病率、死亡率可达90%~100%,给养鸭业的发展造成严重危害[2]。
鸭病毒性肝炎的传统分型中,该病有3种不同血清型的病原引起,分别是血清1型鸭肝炎病毒(DHV-1)、2型鸭肝炎病毒(DHV-2)和3型鸭肝炎病毒(DHV-3)[3]。随着鸭病毒性肝炎的发生及新毒株的出现,关于鸭病毒性肝炎的分型有了新标准。2007年,Tseng等[4-5]分别在中国台湾和韩国分离出与DHV-1没有抗原相关性的新型DHV,命名为中国台湾新型鸭肝炎病毒和韩国新型鸭肝炎病毒。2008年,Wang等[6]依据病毒的VPl、VP0、VP3基因序列及3D基因的部分序列,将DHV分为A、B、C3个基因型,分别对应DHV-1、中国台湾新型和韩国新型。根据国际病毒分类委员会(ICTV)第九次分类报告[7],DHV-1、中国台湾新型鸭肝炎病毒、韩国新型鸭肝炎病毒分别定名为1型鸭甲型肝炎病毒(Duck hepatitis A virus 1,DHAV-1)、DHAV-2和DHAV-3,其同属于小RNA病毒目、小RNA病毒科、禽肝炎病毒属成员。而原来传统分型中的DHV-2和DHV-3则属于鸭星状病毒。流行病学调查显示,2013年以来,DHAV-3已经成为我国流行的主要血清型,由于该病毒引起的发病率和死亡率高,给集约化养鸭生产造成了严重的经济损失[8-9]。DHAV-3已成为影响我国养鸭业发展最主要的病原之一[10]。
本研究从山东潍坊某鸭场采集发病鸭病料进行鸭病毒性肝炎病原的分离鉴定及致病性试验,以明确病原的种类、流行变化趋势及致病特点,为临床上更有效的防控该病提供理论依据和数据支撑。
1 材料与方法
1.1 鸡胚、实验动物及试剂 9日龄SPF鸡胚购自山东省农科院SPF鸡场,9日龄SPF鸭胚购自中国农业科学院哈尔滨兽医研究所,5日龄非免疫樱桃谷鸭购自山东潍坊某种鸭场。RNAsimple总RNA提取试剂盒(DP419)、质粒快速提取试剂盒等购自天根生化科技(北京)有限公司,PCR mix、ddH2O等购自北京索莱宝科技有限公司,PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒、DNA凝胶纯化试剂盒、SYBR Premix ExTaq、pMD18-T试剂盒、Random Premier等购自宝生物工程(大连)有限公司。其他试剂均为分析纯。
1.2 病毒分离 采集临床发病雏鸭肝脏,称重后按1∶4比例加无菌生理盐水于匀浆器中匀浆,匀浆后的组织液冻融1~2次,12 000×g离心10 min,收集上清液。上清液经0.22 μm细菌滤器过滤,滤液经尿囊腔途径接种9~11日龄SPF鸡胚或鸭胚,0.2 mL/枚,对照组接种无菌生理盐水。病毒在鸡胚或鸭胚中盲传3代,鸡胚或鸭胚死亡时间稳定在3~5 d,收集死亡鸡胚或鸭胚尿囊液,-80℃储存备用。
1.3 病毒RT-PCR鉴定 根据GenBank中发布的DHAV-3 VP1基因序列(GenBank登录号:KC191688.1)设计引物,上游引物为:5'-TACGCCAGCCACTCTCATCT-3',下游引物为:5'-TGGTCAGGCACTGGCAAAT-3',扩增片段大小为400 bp,由生工生物工程(上海)股份有限公司合成。采用RNAsimple总RNA提取试剂盒提取尿囊液中病毒总RNA,采用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒反转录,再进行PCR扩增。PCR扩增条件为:95℃预变性4 min;95℃变性30 s,55℃退火30 s,72℃延伸40 s,30个循环;最后72℃延伸10 min。1.0%琼脂糖凝胶电泳对PCR产物进行鉴定,胶回收产物送生工生物工程(上海)股份有限公司进行测序。采用NCBI BLAST对测序结果分析比对。
1.4 VP1基因序列测定及分析 根据GenBank中发布的DHAV-3全基因序列和VP1基因序列(GenBank登录号分别为MH752744.1、KC191688.1)设计扩增VP1蛋白全基因序列的引物,上游引物为:5'-AGGATTTTCAGTTTACAGCTC-3',下游引物为:5'-CATTTCGAGATTGGTCTGAT-3',扩增片段大小为798 bp,引物由生工生物工程(上海)股份有限公司合成。将RT-PCR产物回收送测序。测序结果采用软件DNAStar(version 7.10)、MEGA5.0与GenBank中发布的30株来自不同年代、不同地区的DHAV-3 VP1基因序列进行同源性分析和系统发育进化树分析。
1.5 病毒滴度测定 无菌PBS稀释病毒,按照10倍梯度有限稀释,每个稀释度接种5枚9日龄SPF鸡胚,观察接种1~7 d鸡胚的死亡情况,做好记录,Reed-Muench法计算病毒的半数胚致死量(median embryo lethal dose,ELD50)。
1.6 动物试验 20只5日龄SPF雏鸭平均分成2组,每组10只。A组为试验组,采用滴鼻方式(模拟自然感染)接种DHAV-3病毒液,每只接种剂量为50 μL(该接种剂量通过预试验确定);B组为阴性对照组,每只接种50 μL无菌磷酸盐缓冲盐水。攻毒后3 d后,每组随机选择3只雏鸭安乐死,收集肝脏和脾脏,一部分组织样品在10%缓冲福尔马林溶液中固定,用于组织学检查;另一部分贮存于-80℃冰箱中。
1.7 组织病理学检查 组织样品在10%福尔马林溶液中固定48 h,经不同浓度乙醇脱水,再经二甲苯透明,使组织变硬、变脆。透明的组织块在熔化的石蜡中停留1.5 h,再进行石蜡包埋,待蜡块冷却变硬后进行修整,放冰箱内冷却。组织块经切片机切成4 μm厚的切片,并按照染色程序采用苏木精-伊红(HE)染色,最后用中性树脂封固镜检。
1.8 组织器官病毒载量的测定 取0.5 g冷冻组织匀浆,提取RNA。利用RNAsimple总RNA提取试剂盒提取各组织样品的总RNA。通过分光光度计测定每个样本总RNA的OD260和OD280值,确定RNA的浓度,利用反转录试剂盒合成1000 ng RNA的cDNA。利用SYBR GreenⅠ实时荧光PCR测定不同组织样品中的病毒载量。该检测方法以樱桃谷鸭β-actin基因为内参基因,DHAV-3 VP1基因为目的基因来测定DHAV-3 RNA在不同组织中的相对转录水平[11]。根据内参基因β-actin(GenBank登录号:EF571597)的基因序列设计引物,上游引物为:5'-CCATATACGAGGGCTACGC-3',下游引物为:5'-AATGTCACGCACGATTTCC-3',扩增片段大小为139 bp[11]。目的基因VP1(GenBank登录号:KC191688.1)的上游引物为:5'-TATATCTG GACGCAATCAGG-3',下游引物为:5'-TAAGTCT CAAACAGAAGCGAA-3',大小为232 bp。两对引物利用Oligo 7.0软件进行设计。荧光定量PCR采用25 μL反应体系:12.5 μL 2×SYBR Green I Premix,2 μL cDNA模板,引物各0.5 μL(10 μmol/L),9.5 μL ddH2O。反应条件为:94℃预变性5min;94℃变性15 s,59℃退火60 s,35个循环。每个样品重复3次。
1.9 数据分析 试验数据表示为平均值±标准偏差(±S),组织病毒载量采用单向方差评估,利用SPSS 19.0和Graphpad Prism 5软件进行t检验与单项方差分析。
2 结果
2.1 病毒的分离 病毒在SPF鸡胚中生长良好,一般在接种病毒4~5 d死亡,死亡胚体水肿,头部和颈部皮肤出血明显,有的胚体肝脏颜色变黄,肝脏上有出血点或黄白色坏死斑块(图1)。

图1 病毒接种后死亡的鸡胚Fig.1 Chicken embryos died inoculation with DHAV-3
2.2 病毒的RT-PCR检测 收集死亡鸡胚的尿囊液,提取总RNA后进行RT-PCR扩增,采用1.0%琼脂糖凝胶电泳检测。结果显示在400 bp左右的位置出现目的条带(图2)。PCR产物回收测序,在GenBank中进行序列比对,结果该序列与GenBank中发布的DHAV-3序列同源性在99.0%以上,确定该病毒为DHAV-3,并命名为DHAV-3-SDWF株。
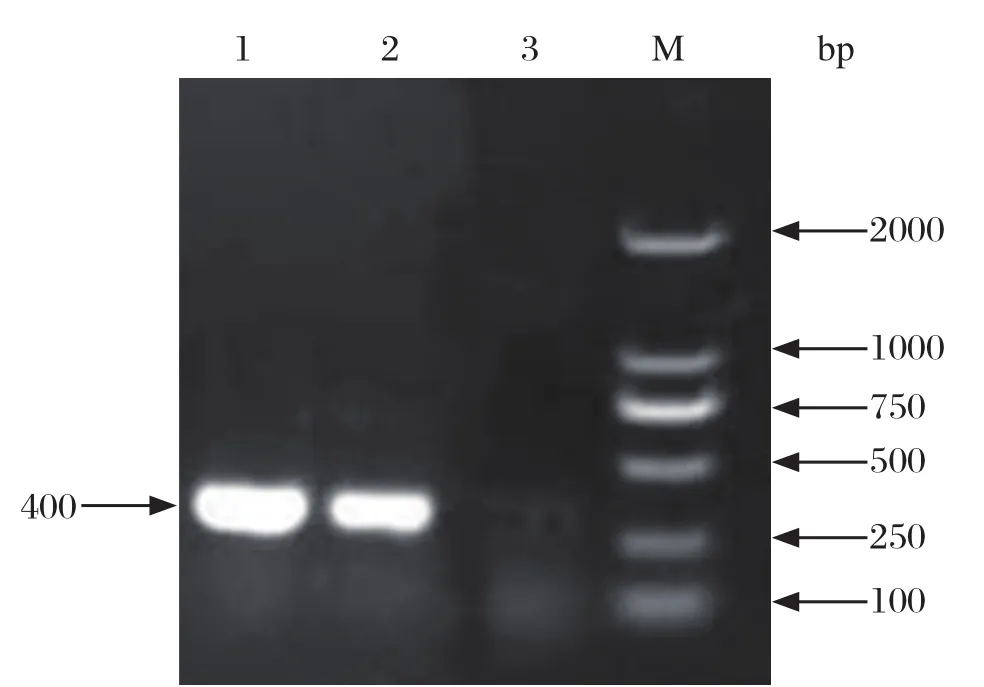
图2 病毒的RT-PCR鉴定结果Fig.2 The identification of RT-PCR about the virus
2.3 DHAV-1 VP1基因序列分析 采用Oligo 7.0软件对DHAV-3-SDWF VP1基因的测序结果与GenBank上发布的25株分离自不同年代、不同国家和地区的DHAV-3 VP1基因序列进行比对分析,绘制系统发育进化树(图3)。从进化树上可以看出:2007~2020年分离鉴定的DHAV-3主要形成2大分支,也就是2种基因型,基因Ⅰ型和基因Ⅱ型,其中基因Ⅰ型又形成2个分支,即Ⅰa亚型分支和Ⅰb亚型分支。我国不同年代、不同地区出现的DHAV-3主要集中分布在基因Ⅰ型分支上,尤其是2012年以后DHAV-3分离株亲缘性强,主要集中分布在Ⅰa亚型分支上;2012年以前分离的DHAV-3亲缘性较强,主要集中分布在Ib亚型分支上。DHAV-3分离株在地域上没有明显的亲缘性。DHAV-3系统发育进化树的分析,为实际生产中DHAV-3弱毒苗或灭活苗的研制提供理论依据。本研究中的分离株DHAV-3-SDWF属于基因亚型Ⅰa分支,这与系统发育进化树的分析结果一致。
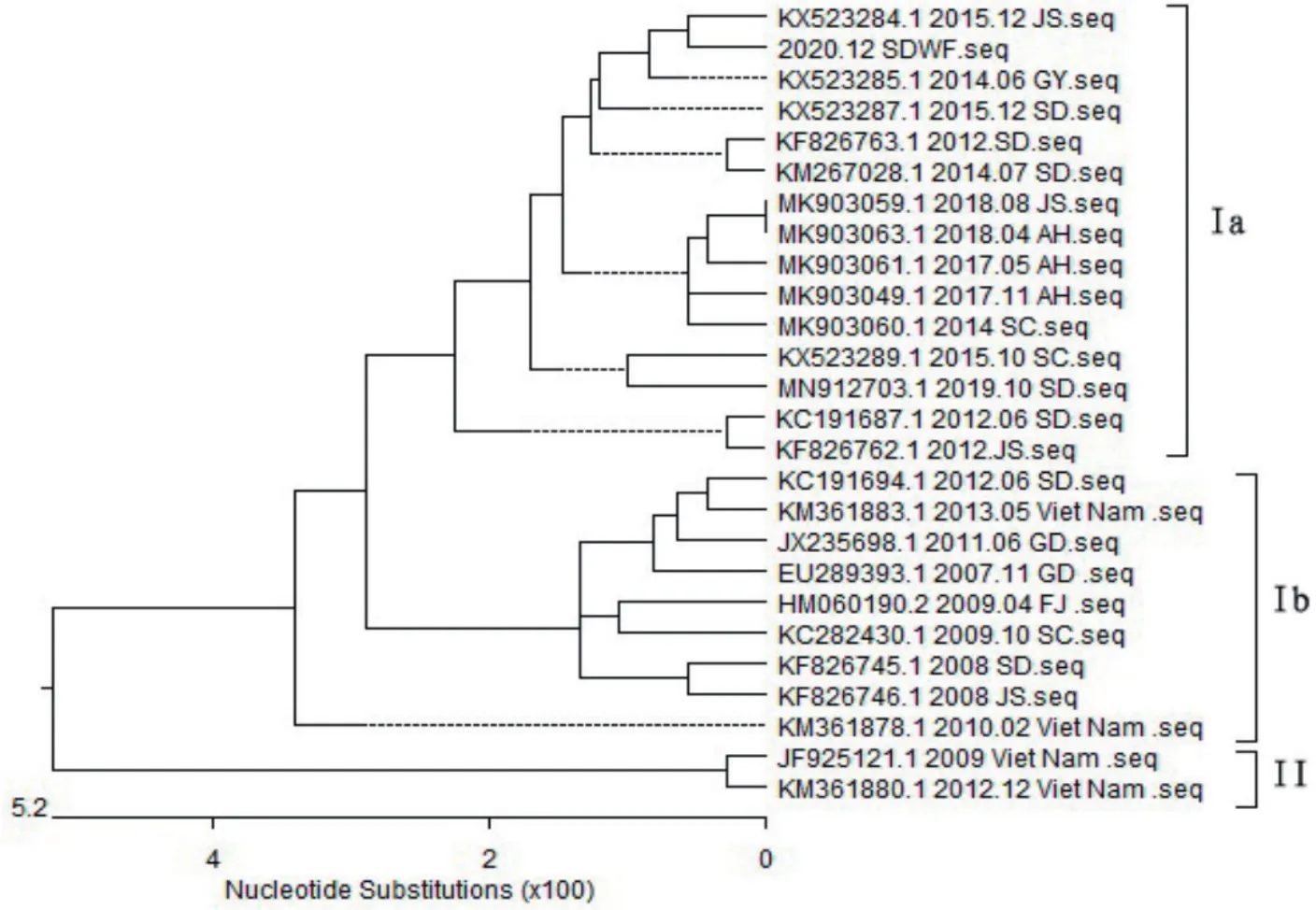
图3 DHAV-3系统发育进化树Fig.3 Phylogenetic evolutionary tree of DHAV-3
不同年代、不同国家和地区分离的DHAV-3 VP1核苷酸同源性为90.1%~100%,同源性高。尤其是DHAV-3-SDWF分离株与基因亚型Ⅰa分支中DHAV-3核苷酸同源性更高,均在97.8%以上。
2.4 动物试验剖检和组织病理学检查 通过有限稀释法测得病毒DHAV-3-SDWF的鸡胚半数致死量为104.5ELD50/ 0.2 mL。试验攻毒组雏鸭肉眼病变主要表现为肝脏肿胀、色黄,表面斑点状出血明显;脾脏肿胀、出血,有灰白色坏死斑点,红白斑驳;肾脏肿胀、出血(图4)等。其他器官剖检变化不明显。

图4 攻毒组鸭的剖检变化Fig.4 Dissection changes of ducks in the challenge group
组织病理学观察结果显示:雏鸭感染DHAV-3后,肝细胞崩解坏死、减少、水泡变性,淋巴细胞浸润明显;脾淋巴细胞崩解、坏死;肾小管管腔变窄,上皮细胞脱落,间质充血、淋巴细胞浸润(图5)。
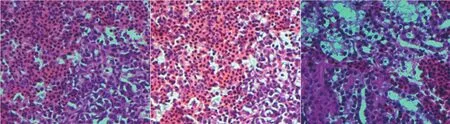
图5 攻毒组鸭组织病理变化Fig.5 Histological changes of ducks in challenge group
2.5 不同组织病毒载量的检测 采用SYBR GreenⅠ实时荧光PCR法检测攻毒后雏鸭不同组织的病毒载量,结果如图6所示。从图中可以看出,雏鸭攻毒后3 d,其心脏、肝脏、脾脏、肺脏、肾脏、脑、小肠、法氏囊、胰脏等组织均可检测到DHAV-3的载量,尤其是肝脏中病毒转录水平最高,与其他组织病毒的转录水平相比差异显著(P<0.05);脾脏、肾脏、心脏的DHAV-3载量也较高,高于肺脏、小肠、法氏囊,但低于肝脏;肺脏、小肠、法氏囊胰等的DHAV-3载量,虽然与对照组差异显著(P<0.05),但病毒载量较低;脑中未检测到DHAV-3。对照组没有检测到病毒的转录。
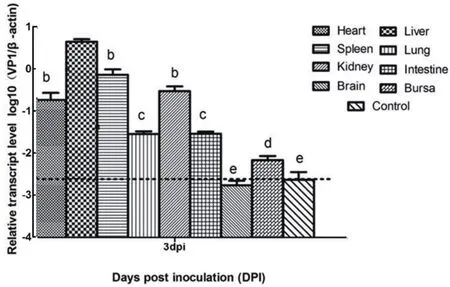
图6 各组织的病毒载量Fig.6 The virus loads of different tissues
3 讨论
我国水禽养殖发展迅速,疫病的发生对养鸭业的发展危害严重,鸭病毒性肝炎一直是危害我国雏鸭养殖的重要传染病之一。由于该病血清型多,不同血清型之间几乎不存在抗原交叉性[12-13],因此鸭群常出现免疫失败,对鸭病毒性肝炎优势血清型病原的分离、鉴定及致病性分析可为进一步制定全面有效的防控措施奠定基础。
随着我国养鸭业的迅猛发展,鸭病毒性肝炎在鸭群中也呈现新的流行趋势。本研究从山东潍坊某发病鸭场分离并鉴定1株DHAV-3,该病毒能在鸭胚和鸡胚中增殖,在胚体中盲传几代,胚体死亡时间稳定在3~5 d,这与DHAV-1的传代特点是一致的。
对分离的病毒进行VP1基因测序,采用MEGA5软件与GenBank中发布的25株分离自不同年代、不同国家和地区的DHAV-3 VP1基因序列进行核苷酸分析。结果显示,2007-2020年分离的DHAV-3主要进化形成了2个分支,1分支又进化出2个小分支Ⅰa和Ⅰb。我国不同年代、不同地区出现的DHAV-3主要分布在分支Ⅰ上,核苷酸同源性高。Ⅰa分支上主要集中分布2012年以后DHAV-3分离株,Ⅰb分支上主要集中分布2012年以前分离的DHAV-3,而分支Ⅱ上主要是越南的2株2012年以前的分离株。可见,Ⅰ分支是DHAV-3的主要进化方向,而分支Ⅱ有可能会随着病毒的变异逐渐消失。DHAV-3的进化有一定的时间亲缘性,与分离地区的关系不大。这与已经报道的DHAV-3的进化与分离年份关系密切是一致的[3]。
用分离鉴定的DHAV-3对雏鸭进行攻毒试验,雏鸭感染3 d,剖检病变主要表现为肝脏、脾脏、肾脏肿大、出血,尤其肝脏病变最严重,其他组织器官病变不明显,这与组织病理学病变的严重程度是一致的。而且,肝脏中病毒RNA转录水平最高,其次是脾脏和肾脏,其他组织病毒RNA转录水平较低,这些数据表明,雏鸭的肝脏是DHAV-3的主要靶器官,其次是脾脏和肾脏[14-15]。
随着养鸭业的快速发展,新病不断出现,老病仍在流行,鸭病的发生变得复杂。DHAV-3对雏鸭危害严重,一旦感染,发病率、死亡率极高[16-18],本研究通过病毒分离、RT-PCR鉴定、动物攻毒试验等,鉴定病毒为DHAV-3,该病毒与近年来分离的DHAV-3毒株同源性高,对雏鸭的致病性强,这些研究数据为今后鸭病毒性肝炎的综合防治提供理论参考。
