牛磺熊去氧胆酸对DSS诱导大鼠溃疡性结肠炎的治疗作用及可能机制*
2021-11-03蔡达兴黄思付房太勇
蔡达兴 黄思付 房太勇
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性非特异性肠道炎症性疾病,随着国民生活方式日趋西化,近年来我国UC的发病率呈明显上升趋势[1]。但其病因和发病机制尚不明确,目前多认为该病的发生是由遗传、环境、微生物和免疫等多种因素相互作用所致。而近年来,越来越多研究发现,内质网应激(endoplasmic reticulum stress,ERS)在UC的发生发展中起着重要作用[2]。目前临床上治疗UC的常用药物为氨基水杨酸制剂、糖皮质激素、免疫抑制剂及单克隆抗体。然而这些药物存在着不良反应多、价格昂贵等缺点,使临床应用受到限制。国外文献[3]报道,牛磺熊去氧胆酸能够减轻肠道炎症反应和氧化应激,抑制类似炎症性肠病的肠炎。本实验采用牛磺熊去氧胆酸(TUDCA)干预DSS诱导的溃疡性结肠炎大鼠,比较疾病活动指数(disease activity index,DAI)评分、结肠组织损伤指数(histological index,HI)评分,评判疗效。研究ERS相关指标的变化,探讨其可能机制,现报道如下。
1 材料与方法
1.1 一般材料
健康成年雄性Sprague-Dawley(SD)大鼠30只,清洁级,体重300~350 g,购自上海斯莱克实验动物有限责任公司[许可证号:SCXK(沪)2012-0002],饲养于泉州医学高等专科学校实验动物中心[实验动物使用许可证号:SYXK(闽)2016-0001]。
葡聚糖硫酸钠(Dextran Sulphate Sodium,DSS)购自美国MP biomedicals公司(批号Q8356),牛磺熊去氧胆酸(Tauroursodeoxycholic Acid,TUDCA)购自美国 Sigma公司(批号102382735),GRP78、PERK、eIF2α、ATF4、CHOP、GAPDH一抗、羊抗兔二抗购自美国Abcam公司(批号ab20735、ab229742、ab182412、ab21735、ab176813、ab9536、ab160047)。
1.2 方法
健康成年雄性SD大鼠30只,称重编号,随机均分为正常组、模型组、治疗组,每组10只。正常组自由饮水,其余两组大鼠自由饮用5%DSS溶液,7 d建立大鼠实验性溃疡性结肠炎模型。
造模后,正常组、模型组予0.9%氯化钠注射液灌胃,治疗组予用200 mg/kg TUDCA灌胃,药物溶于0.9%氯化钠注射液中,1次/d,连续7 d。第8天深度麻醉处死大鼠,留取结肠标本。
1.3 观察指标及评价标准
1.3.1 一般情况及DAI评分 每天固定时间观察大鼠一般情况,包括饮食、活动、体质量改变、大便性状、便血情况等,并在第7天根据Wirtz等[4]的标准行DAI评分,具体为,(1)体质量下降:无、<5%、5%~10%、11%~15%分别记分为0、1、2、3、4分;(2)大便形状:正常大便、不成形松散大便、糊状大便分别记分为0、2、4分;(3)便血情况:无、隐血便、肉眼血便分别积分为0、2、4分。DAI=(体质量下降分数+大便性状分数+便血分数)/3。
1.3.2 病理表现及HI评分 取病变最明显处结肠组织,10%甲醛溶液固定,脱水,石蜡包埋,切片,常规HE染色,参考Dieleman等[5]的标准行HI评分,具体为,(1)溃疡:无溃疡、小溃疡<3 mm、大溃疡>3 mm分别记分为0、1、2分;(2)炎症:无、轻度、重度分别记分为0、1、2分;(3)肉芽肿:无、有分别记分为0、1分;(4)病变深度:无、黏膜下层、肌层、浆膜层分别记分为0、1、2、3分;(5)纤维化:分别记分为0、1、2分。HI=各分值总和。
1.3.3 结肠组织 GRP78、PERK、eIF2α、ATF4、CHOP基因蛋白水平检测 Western-blot检测大鼠结肠组织GRP78、PERK、eIF2α、ATF4、CHOP基因蛋白水平。所得蛋白条带经扫描所得灰度值经内参基因标准化后所得灰度比值。
1.4 统计学处理
本研究数据采用SPSS 19.0统计学软件进行分析和处理,符合正态分布的计量资料以(±s)表示,组间比较,采用LSD检验,计数资料以率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 三组大鼠一般情况比较
正常组大鼠饮食、活动正常,体质量逐步增加,肛周无黏液便、肉眼血便。模型组大鼠在造模后第2~3天症状达高峰,饮食、活动明显减少,伴毛发稀疏凌乱,体质量下降,部分大鼠肛周出现黏液便、肉眼血便。治疗组大鼠在药物干预后第2天开始,饮食、活动逐步增加,体质量逐步回升,大便由黏液便逐渐变为软便,无肉眼血便。
2.2 三组大鼠结肠组织大体形态、病理表现比较
正常组大鼠结肠黏膜面光滑,无糜烂、溃疡。光镜下,结肠黏膜上皮细胞排列整齐,腺体完整,隐窝结构正常,杯状细胞丰富,无炎性细胞浸润。模型组大鼠结肠糜烂、溃疡,部分增厚粘连,肠管变形。光镜下,黏膜各层大量中性粒细胞、淋巴细胞等炎性细胞浸润,腺体破坏,隐窝结构缺失,杯状细胞明显减少。治疗组大鼠糜烂、溃疡基本愈合。光镜下,腺体排列较规则,见少到中量炎性细胞浸润,隐窝结构及杯状细胞较模型组明显增多,见图1、图 2。

图1 三组大鼠结肠大体标本
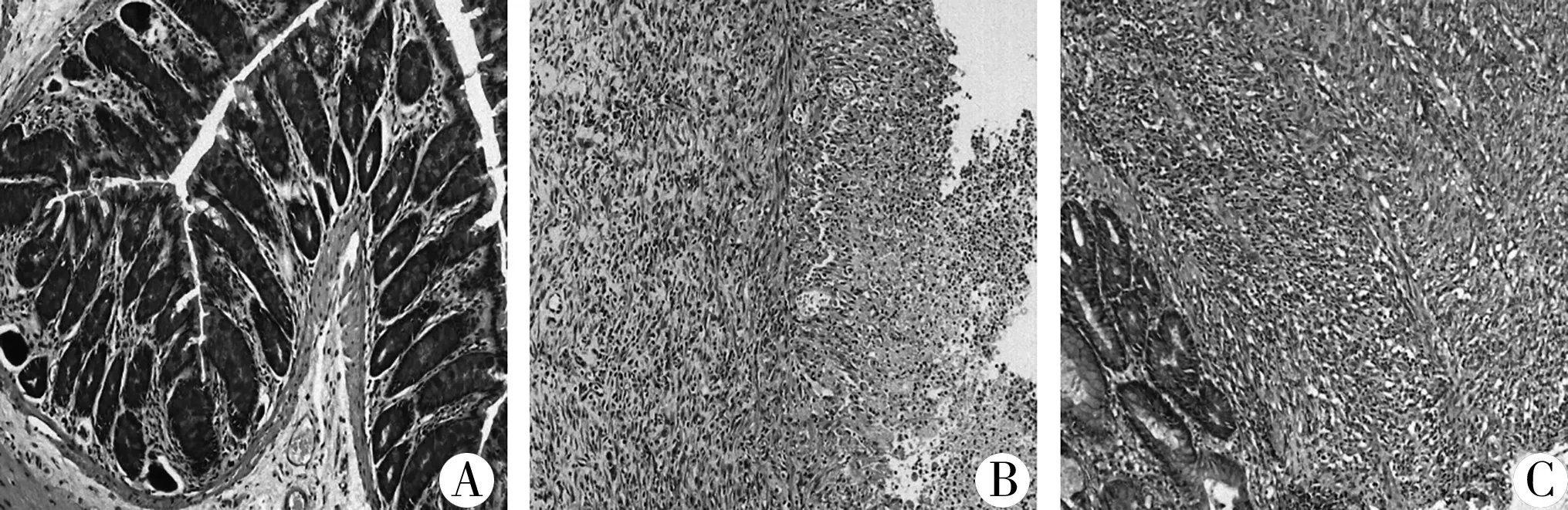
图2 三组大鼠结肠组织HE染色(×100)
2.3 三组DAI评分及HI评分比较
模型组、治疗组DAI评分均明显高于正常组(P<0.05),而治疗组低于模型组(P<0.05)。模型组、治疗组HI评分均明显高于正常组(P<0.05),而治疗组低于模型组(P<0.05),见表1。
表1 三组DAI评分及HI评分比较 [分,(±s)]

表1 三组DAI评分及HI评分比较 [分,(±s)]
*与正常组比较,P<0.05;#与模型组比较,P<0.05。
组别 DAI评分 HI评分正常组(n=10) 0.00±0.00 0.00±0.00模型组(n=10) 2.87±0.65* 6.90±1.52*治疗组(n=10) 1.13±0.39*# 3.10±1.37*#
2.4 三组大鼠结肠组织GRP78、PERK、eIF2α、ATF4、CHOP基因蛋白水平表达
模型组、治疗组结肠组织GRP78、PERK、eIF2α、ATF4、CHOP蛋白表达水平均明显高于正常组(P<0.05);而治疗组低于模型组(P<0.05),见图3、表 2。
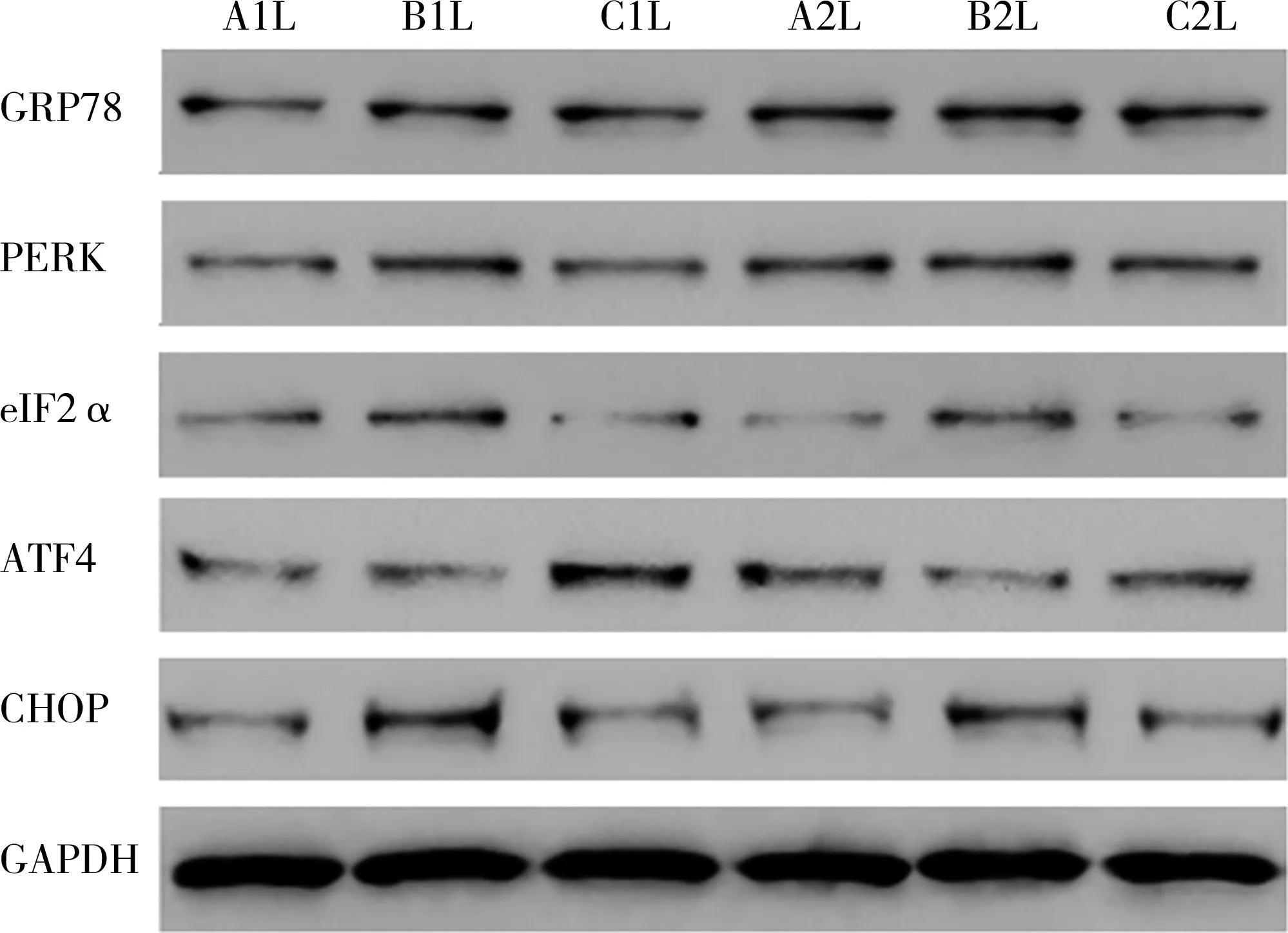
图3 三组大鼠结肠组织GRP78、PERK、eIF2α、ATF4、CHOP蛋白表达
表2 三组大鼠结肠组织GRP78、PERK、eIF2α、ATF4、CHOP蛋白表达 (±s)
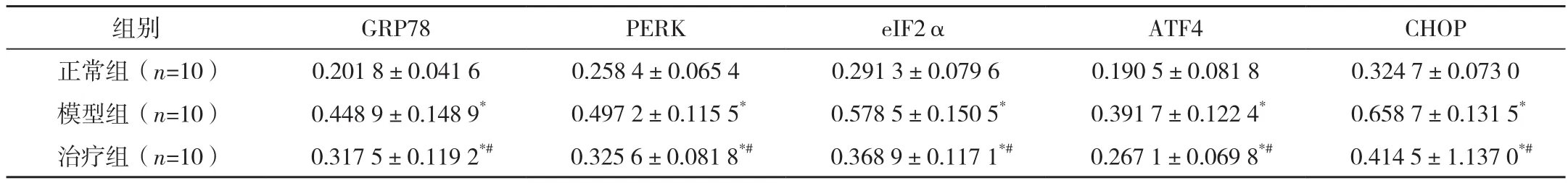
表2 三组大鼠结肠组织GRP78、PERK、eIF2α、ATF4、CHOP蛋白表达 (±s)
*与正常组比较,P<0.05;#与模型组比较,P<0.05。
组别 GRP78 PERK eIF2α ATF4 CHOP正常组(n=10) 0.201 8±0.041 6 0.258 4±0.065 4 0.291 3±0.079 6 0.190 5±0.081 8 0.324 7±0.073 0模型组(n=10) 0.448 9±0.148 9* 0.497 2±0.115 5* 0.578 5±0.150 5* 0.391 7±0.122 4* 0.658 7±0.131 5*治疗组(n=10) 0.317 5±0.119 2*# 0.325 6±0.081 8*# 0.368 9±0.117 1*# 0.267 1±0.069 8*# 0.414 5±1.137 0*#
3 讨论
ERS是指细胞受到内外因素的刺激时,如缺血、低氧、毒素等,内质网形态、功能的平衡状态受到破坏后发生分子生化的改变,蛋白质加工运输受阻,内质网内累积大量未折叠或错误折叠的蛋白质,细胞会通过一系列信号转导途径,对其进行应答,缓解内质网压力,促进内质网正常功能的恢复。如果内质网功能紊乱持续,细胞将最终启动Caspase-12依赖的细胞凋亡程序,这些反应被统称为未折叠蛋白质反应(unfolded protein response,UPR)。UPR主要包括跨膜蛋白内质网跨膜蛋白激酶-1α(inostitol requiring enzyme 1,IRE-1α,又称核酸内切酶)、激活作用转录因子(activating transcription factor 6,ATF6)和胰真核细胞翻译起始因子2激酶(pancreatic elF-2 kinase,PERK)在转录及翻译水平的三条不同信号通路。当细胞处于稳态时,这三种应激感受蛋白都与葡萄糖调节蛋白78(glucose reg- ulatory protein 78,GRP78)结合。ERS出现时,GRP78从这三种感受器上解离而去结合错误折叠的蛋白,GRP78表达升高,因而GRP78被广泛地用作ERS激活的标志物[6]。而这三条信号通路中,PERK所启动的PERK-eIF2α-ATF4-CHOP通路是十分重要的凋亡信号转导途径。与GRP78解离后的PERK通过同源二聚化而磷酸化激活自身,随后催化底物真核翻译起始因子2α发生磷酸化,eIF2α磷酸化后一方面抑制蛋白质的翻译和合成,减轻内质网压力;另一方面选择性的诱导转录活化因子4(the activating transcription factor 4,ATF4)的翻译表达,最终激活ERS独特的凋亡标志蛋白CHOP的基因转录,后者通过调控死亡受体途径和线粒体途径两大经典方式激活凋亡效应子Caspase-3执行细胞凋亡发生[7]。
近年来,越来越多的证据支持ERS对炎症性肠病(IBD)的介导地位。Cao等[8]的研究发现,在DSS诱导的小鼠结肠炎实验中,野生型结肠炎小鼠发生ERS,GRP78、ATF4、CHOP表达增加。Hino等[9]的研究也发现,DSS诱导的结肠炎小鼠肠上皮细胞中,ERS标记蛋白GRP78和CHOP表达明显增加,提示小鼠肠炎中存在着ERS。除动物模型外,在人体研究中也发现了ERS与UC联系的相关证据。一项研究表明,UC患者的结肠标本中,eIF2α通路控制蛋白质的翻译和细胞应激反应[10]。
本研究选用GRP78作为ERS的标志蛋白,用于检测ERS的程度。研究显示,与正常组相比,DSS诱导溃疡性结肠炎模型组结肠组织中GRP78蛋白水平明显升高,提示溃疡性结肠炎模型结肠组织中存在ERS。并且,模型组大鼠结肠组织较正常组PERK、eIF2α、ATF4、CHOP蛋白水平明显升高,提示PERK通路与UC的发生发展可能存在相关性。这说明DSS诱导的大鼠溃疡性结肠炎模型中ERS起着重要作用。
TUDCA是一种天然胆汁酸酰胺化合物,在体内是熊去氧胆酸(UDCA)与牛磺酸结合形成的一种亲水性胆汁酸。同时TUDCA是细胞凋亡的抑制剂,通过干扰细胞凋亡的线粒体上游通路,抑制氧自由基的产生,减少内质网的应力,稳定未折叠蛋白反应[11]。已被证明TUDCA在肥胖,外伤性脑损伤、心脏病、急性肾损伤中是潜在的治疗靶点[12-15]。
最近的相关研究证实,作为分子伴侣,TUDCA可以起到降低体外培养IESs的ERS的作用,而且在动物实验中,通过TUDCA干预可以改善IBD小鼠模型的肠黏膜炎症,其机制之一正是由于TUDCA对ERS的调节[16]。
本研究通过DSS诱导大鼠溃疡性结肠炎模型,予TUDCA进行药物干预,结果显示,治疗组大鼠一般情况明显优于模型组,其组织病理严重程度明显减低,DAI、HI评分降低,并且治疗组大鼠结肠组织PERK、eIF2α、ATF4、CHOP蛋白水平较模型组明显降低,证明TUDCA对DSS诱导的大鼠溃疡性结肠炎模型具有治疗作用,其机制可能是通过抑制PERK-eIF2α-ATF4-CHOP通路发挥分子生物学作用,这对于临床使用TUDCA治疗溃疡性结肠炎具有重要指导意义。
综上所述,TUDCA能够改善DSS诱导的大鼠溃疡性结肠炎,其机制可能是通过抑制PERK-eIF2α-ATF4-CHOP通路发挥分子生物学作用。这为其临床应用价值提供一定的理论依据,但仍需进行大量临床试验以进一步证实。
