咽立爽口含滴丸对慢性咽炎家兔免疫细胞亚群及NF-κB信号通路的影响
2021-11-02喻国冻何星辰
唐 燚,喻国冻,何星辰,王 佳,张 田
[1.长沙市中医医院(长沙市第八医院)耳鼻咽喉头颈外科,长沙410100;2.贵州医科大学附属医院耳鼻咽喉头颈外科,贵阳550004;3.贵州医科大学,贵阳550025]
慢性咽炎(chronic pharyngitis,CP)是多见于成年人的耳鼻喉科常见疾病,可由细菌、病毒、酗酒、过度使用声音、吸烟等引起,主要特征表现为咽部轻微疼痛、灼热、干痒、吞咽困难、咳嗽、有异物感等症状,易反复发作[1]。根据2015年流行病学数据,全世界至少有20%的成年人患有慢性咽炎,严重影响着患者的生活及工作[2]。慢性咽炎是黏膜下、咽黏膜及淋巴组织的慢性炎症。炎性反应能够激活核转录因子κappa B(nuclear factorκappa B,NF-κB)。NFκB的持续激活能够增强一些细胞因子及黏附因子的表达,使炎性反应细胞产生活性氧,损伤咽黏膜周围上皮细胞,引起咽黏膜组织的炎性损害[3]。
在慢性咽炎的各种治疗策略中,抗炎药物通常被用来减轻喉部肿胀,调节病理生理过程,改善患者的舒适度[4]。研究表明,咽立爽口含滴丸(pharyngeal refreshing pills)对慢性咽炎有显著的治疗效果[6]。咽立爽口含滴丸的主要成分为艾纳香草、薄荷素油、天然冰片和薄荷脑,其中艾纳香草经蒸馏升华提制的艾纳香油具有较强的抗菌、抗炎、消肿、解毒、疏散风热和止痛的作用[4]。然而,咽立爽口含滴丸对慢性咽炎的作用机制尚不清楚。本研究拟探究咽立爽口含滴丸对家兔慢性咽炎的影响及其抗炎机制,以期为慢性咽炎的治疗提供思路。
1 材料与方法
1.1 实验动物
健康普通级新西兰白兔42只(雌雄各半),体质量为2.0~2.5 kg,购于成都达硕实验动物有限公司[SCXK(川)2020-030]。家兔饲养于贵州医科大学动物实验中心[SYXK(黔)2021-0007],环境温度为20~25℃,湿度为(50±5)%,自由饮水。研究方案经贵州医科大学实验动物伦理委员会批准(IACUC 2001325),并按照实验动物使用3R原则给予人道关怀。
1.2 主要试剂与仪器
阳性对照药物慢严舒柠清喉利咽颗粒(批号:Z20053117)购自山西桂龙医药有限公司;咽立爽口含滴丸(批号:Z20025286)购自贵州黄果树立爽药业有限公司;FACSCalibur流式细胞仪购自美国BD公司;检测白细胞介素-6(interleukin-6,IL-6)(ZC-52826)、白细胞介素-1(interleukin-1,IL-1)(ZC-52815)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)(ZC-52984)、C反应蛋白(C-reactive protein,CRP)(ZC-36085)、总抗氧化能力(total antioxidant capacity,T-AOC)(ZC-37662)用ELISA试剂盒购自上海茁彩生物科技有限公司;IL-6(sc-57315)、IL-1(sc-52012)、TNF-α(sc-52746)、NF-κB p65(sc-8008)、核转录因子-κB抑制因子(nuclear factor-kappa B inhibitor,IκB-α)(sc-1643)相关抗体购自美国Santa Cruz公司;TRIzol试剂和RNA提取试剂盒(14105)购自美国Invitrogen公司;PCR扩增试剂盒(AK9906)购自日本TaKaRa公司;PCR引物用Primer Premier 5.0软件设计,由北京擎科科技有限公司合成;实时定量PCR仪购自美国Bio Rad公司。
1.3 慢性咽炎家兔模型构建
家兔适应性饲养7 d后,随机分为7组(每组6只):空白组(Con),模型组(CP),慢严舒柠清喉利咽颗粒组(CP+MYS),咽立爽口含滴丸低剂量组(CP+Pha L)、中剂量组(CP+Pha M)、高剂量组(CP+Pha H)、雾化组(CP+Pha A)。除Con组外,其余各组采用氨水松节油复合因素造模方法刺激咽部,诱导造慢性咽炎家兔模型[7]。操作方法:Con组第1~15天用蒸馏水喷咽部;其余各组每天2次(总共600μL)将2.5%氨水喷入家兔的咽部黏膜,持续15 d,在第8天开始将0.5 mL松节油注入家兔的咽黏膜中,操作完成后30 min禁止饮水。观察家兔口部抓痕、喷喉后半小时饮水、口咽部分泌物量及每天的食量变化情况,并于第15天在硬性鼻内镜下观察造模组家兔的咽部黏膜情况。家兔搔抓口部频繁、饮水量及频次明显下降、口腔分泌物黏稠,咽部黏膜呈暗红色,光泽度欠佳,说明造模成功。
1.4 给药方法
造模成功后,连续给药7 d。CP+MYS组:每日按2.5 g/kg将慢严舒柠清喉利咽颗粒置于家兔口腔。CP+Pha L组、CP+Pha M组和CP+Pha H组:将咽立爽口含滴丸研磨成粉末状,每日分别以相当于成人剂量2.5、5、10倍的咽立爽口含滴丸粉末(0.025 g/kg、0.05 g/kg、0.1 g/kg)置于家兔口腔。CP+Pha A组:每日捻磨咽立爽口含滴丸(0.025 g/kg)成粉末状,与灭菌生理盐水5 mL配制为悬浊液,置于雾化机内用于雾化治疗。Con组和CP组:每日以与低剂量用药组等量的蔗糖(0.025 g/kg)(具有高渗透性,作为对照)置于家兔口腔。以上给药量均以人∶兔为1∶5~1∶10计算,参照苗明三[8]主编的《实验动物与动物实验技术》。
1.5 样本采集
治疗结束后,各组家兔均采集耳中央动脉血4 mL。其中3 mL血静置后经3 000 r/min低温离心15 min,取血清,-80℃冰箱保存;另1 mL血加入抗凝管后,立即进行后续流式细胞检测。采血结束后,于家兔腹腔注射1%戊巴比妥钠,采用CO2吸入法处死家兔,迅速解剖家兔口咽部,取出咽喉壁黏膜组织,用预冷的生理盐水迅速冲净,分成两份,一份经质量分数为4%的多聚甲醛溶液固定,另一份于-80℃低温保存。
1.6 家兔一般情况观察
从造模第3天开始,每天观察家兔行为、肛温、状态、摄食、饮水量和大小便等情况,观察咽喉壁局部情况有无肿胀、色泽、分泌物及搔抓颈部等。
1.7 组织病理观察
将固定的咽喉壁黏膜按常规方法制备石蜡切片,然后进行苏木精染色,盐酸乙醇分化,50℃温水或弱碱性水溶液返蓝,85%乙醇溶液脱水,伊红染色,梯度乙醇溶液脱水,二甲苯透明,中性树胶封固,镜检观察具体病变。按以下标准进行病变程度分级:正常结构为“-”;咽部充血,炎症较轻为“+”;咽部炎症局限,有钉突形成为“++”;咽部炎症较弥漫,上皮下钉突明显为“+++~++++”。
1.8 血液相关因子检测
取抗凝血100μL加入流式测定管中,分别加入5μLAPC标记的CD3 McAb、5μL FITC标记的CD4 McAb、5μL PE标记的CD8 McAb后混匀,避光孵育约20 min;加2 mL溶血素,避光孵育约10 min,1 200 r/min离心5 min,弃上清液;加PBS洗2遍,弃上清液,用PBS缓冲液,调 整 细 胞 密 度 至1×106个 细 胞/mL,用FACSCalibur流式细胞仪检测CD3+、CD4+、CD8+细胞所占百分比,计算CD4+/CD8+比值。
ELISA试剂盒测定血清IL-6、IL-1、TNF-α、CRP、T-AOC水平,具体操作按照试剂盒说明进行。
1.9 蛋白质印迹法检测
提取咽喉壁黏膜组织样本蛋白,进行10%SDS-PAGE凝胶电泳。将目的蛋白条带转印至PVDF膜,用5%脱脂奶粉封闭后,分别加入一抗IL-6、IL-1、TNF-α、NF-κB p65、IκB-α(均按1︰500稀释)和β-actin,4℃振荡孵育过夜,TBST洗涤3次。然后加入二抗,室温孵育1 h,TBST洗涤3次,膜上加入ECL化学发光试剂。取出PVDF,化学发光法获得胶片后进行图像采集,目标条带的A值采用Quantity One凝胶图像软件分析,以目标条带与β-actin条带的A值的比值反映活性IL-6、IL-1、TNF-α、NF-κB p65、IκB-α的相对表达水平。
1.10 实时荧光定量PCR法检测
依据组织RNA提取试剂盒说明提取咽喉壁黏膜组织总RNA,反转录合成cDNA。采用SYBR Green 1 real-time PCR方法检测mRNA的相对表达量,β-actin作为内参。NF-κB p65上游引物序列为5'-GGCAGCACTCCTTATCAAC-3',下游引物序列为5'-GGTGTCGTCCC-ATCGTAG-3';IκB-α上游引物序列为5'-CATGAAGAGAAGACACTGACCATGGAA-3’,下游引物序列为5'-TGGATAGAGGCTAAGTGTAGACACG-3';β-actin上游引物序列为5'-ATGGATGAC GATATCGCTGC-3',下游引物序列为5'-CTTCTGACCCATACCCACCA-3'。用实时定量PCR仪进行实时荧光定量PCR检测,PCR反应条件:95℃预变性3 min);94℃变性10 s,55℃退火10 s,72℃延伸15 s,40个循环。记录Ct值,并采用2-ΔΔCt法分析咽喉壁黏膜组织中NFκB p65、IκB-αmRNA相对表达水平。
1.11 统计学方法
2 结果
2.1 各组家兔一般情况
造模第3天起,大部分家兔逐渐出现精神疲乏、饮水纳食减少、口腔分泌物增多、搔抓颈部、咽部呈现充血及微肿胀等情况;局部注射松节油后,上述症状加重且分泌物较黏稠;造模15 d后,上述症状越加明显。Con组实验动物未见异常。
2.2 各组家兔咽喉壁黏膜的病理组织学观察
HE染色结果(表1、图1)显示,Con组咽喉壁黏膜组织未见明显病变;CP组黏膜上皮细胞增生明显,且增生形成指状突起,细胞排列较为紊乱,黏膜固有层见较多腺体分布,固有层结缔组织内轻度出血,有炎细胞浸润,钉突形成,红细胞溢出血管分布于固有层内;CP+MYS组黏膜上皮层结构较完整,排列较规则,黏膜固有层偶见中性粒细胞浸润、局部轻微出血,可见红细胞溢出血管;CP+Pha L组和CP+Pha M的病变基本相同,黏膜上皮层结构较完整,黏膜上皮细胞点状坏死,可见胞核固缩、碎裂、轻度炎细胞浸润、局部轻微出血,比模型组炎性反应明显减轻。

表1咽立爽口含滴丸治疗后家兔咽喉黏膜病变程度分级Table1 Grading degree of laryngopharyngeal mucosa lesionsof rabbitsafter treatment with pharyngeal refreshing pills(n)
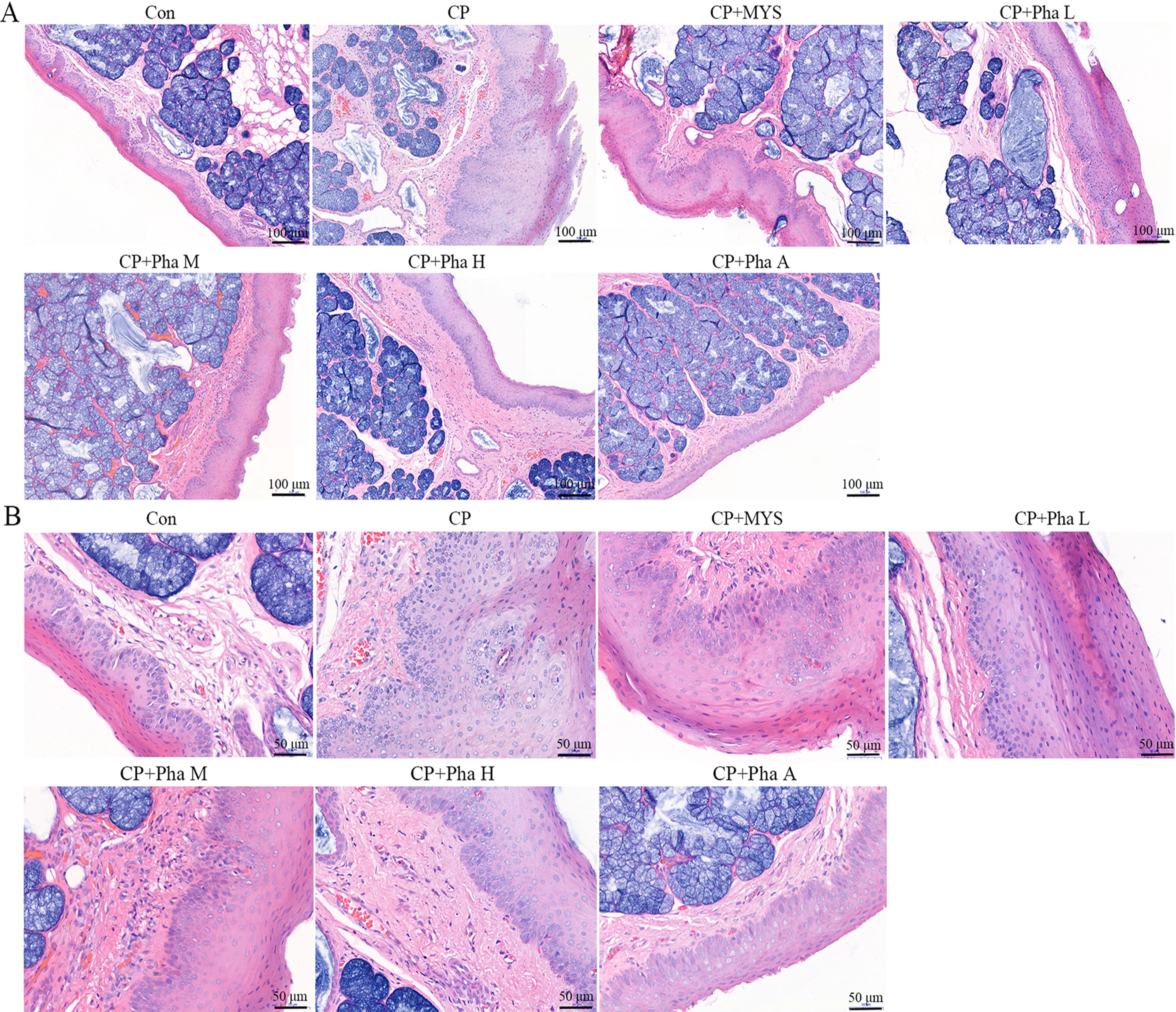
图1光学显微镜下家兔咽喉壁黏膜组织病理学改变Figure1 Pathological examination of theposterior pharyngeal wall mucosa of rabbitsunder a light microscope
CP+Pha H和CP+Pha A组的病变基本相同,咽部黏膜表面上皮组织未见明显变性及炎性病变,固有膜内见轻度慢性炎细胞浸润,黏膜下层及肌层均未见明显病理变化。另外,CP+Pha H和CP+Pha A组咽喉部病变程度明显好于模型组。
2.3 各组家兔血液CD3+、CD4+、CD8+、CD4+/CD8+水平
流式细胞法检测结果(表2)显示:与Con组比较,CP组CD3+、CD4+、CD4+/CD8+细胞所占百分比明显降低,CD8+细胞所占百分比明显升高(P<0.01);与模型组比较,CP+Pha M、CP+Pha H和CP+Pha A组的CD3+、CD4+细胞所占百分比和CD4+/CD8+比值均明显升高,CD8+细胞所占百分比明显降低(P<0.05)。
2.4 各组家兔血清IL-6、IL-1、TNF-α、CRP、TAOC水平
ELISA法检测结果(表3)显示:与Con组比较,CP组IL-6、IL-1、TNF-α、CRP水平明显升高,T-AOC水平明显降低(P<0.01);与CP组比较,CP+Pha H组及CP+Pha A组IL-6、IL-1、TNF-α、CRP水平明显降低,T-AOC水平明显升高(P<0.05)。
2.5 各组家兔咽喉壁黏膜IL-6、IL-1、TNF-α、NF-κB p65、IκB-α水平
蛋白质印迹法检测结果(图2)显示:CP组的IL-6、IL-1、TNF-α、NF-κB p65、IκB-α水平较Con组明显升高,差异有统计学意义(P<0.01);与CP组比较,CP+Pha H组和CP+Pha A组的IL-6、IL-1、TNF-α、NF-κB p65、IκB-α水平明显降低,差异有统计学意义(P<0.01)。
表2各组家兔血液CD3+、CD4+、CD8+、CD4+/CD8+水平比较Table 2 Levels of CD3+,CD4+,CD8+,and CD4+/CD8+in the blood of rabbits in each group(%,±s,n=6)
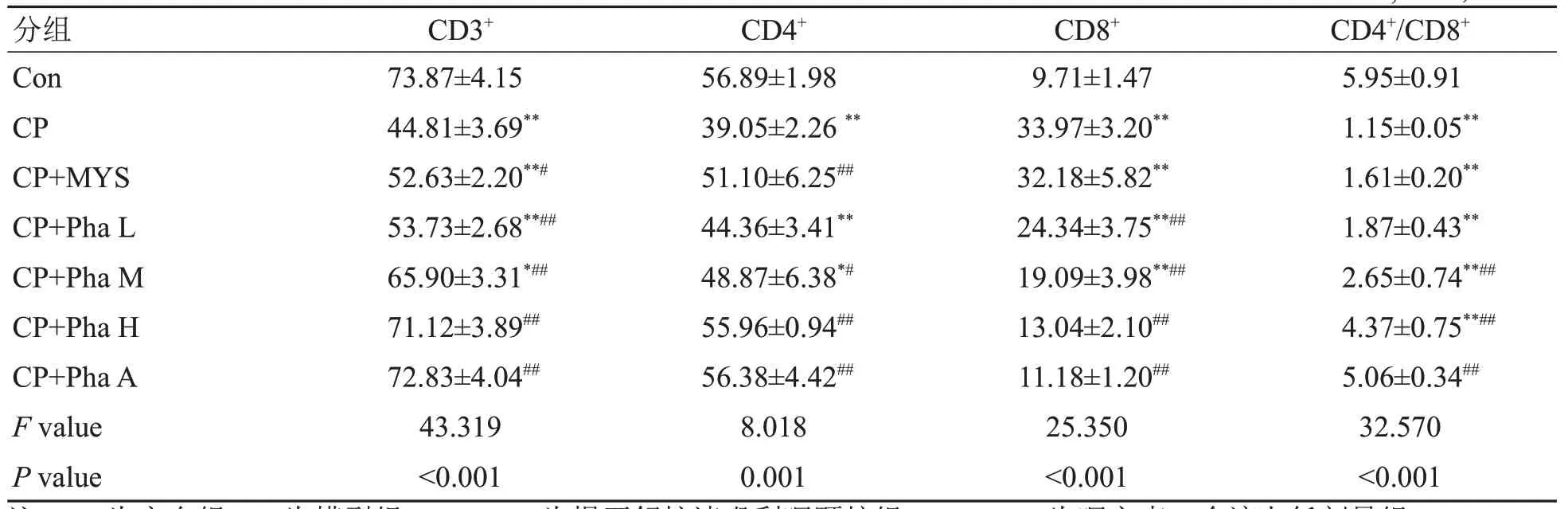
表2各组家兔血液CD3+、CD4+、CD8+、CD4+/CD8+水平比较Table 2 Levels of CD3+,CD4+,CD8+,and CD4+/CD8+in the blood of rabbits in each group(%,±s,n=6)
注:Con为空白组;CP为模型组;CP+MYS为慢严舒柠清喉利咽颗粒组;CP+Pha L为咽立爽口含滴丸低剂量组;CP+Pha M为咽立爽口含滴丸中剂量组;CP+Pha H为咽立爽口含滴丸高剂量组;CP+Pha A为咽立爽口含滴丸雾化组。其余组与空白组比较,**P<0.01,*P<0.05;治疗组与模型组比较,##P<0.01,#P<0.05。
分组Con CP CP+MYS CP+Pha L CP+Pha M CP+Pha H CP+Pha A F value P value CD3+73.87±4.15 44.81±3.69**52.63±2.20**#53.73±2.68**##65.90±3.31*##71.12±3.89##72.83±4.04##43.319<0.001 CD4+56.89±1.98 39.05±2.26**51.10±6.25##44.36±3.41**48.87±6.38*#55.96±0.94##56.38±4.42##8.018 0.001 CD8+9.71±1.47 33.97±3.20**32.18±5.82**24.34±3.75**##19.09±3.98**##13.04±2.10##11.18±1.20##25.350<0.001 CD4+/CD8+5.95±0.91 1.15±0.05**1.61±0.20**1.87±0.43**2.65±0.74**##4.37±0.75**##5.06±0.34##32.570<0.001
表3各组家兔血清IL-6、IL-1、TNF-α、CRP、T-AOC水平比较Table3 Levelsof IL-6,IL-1,TNF-α,CRP,and T-AOC in theserum of rabbitsin each group(±s,n=6)
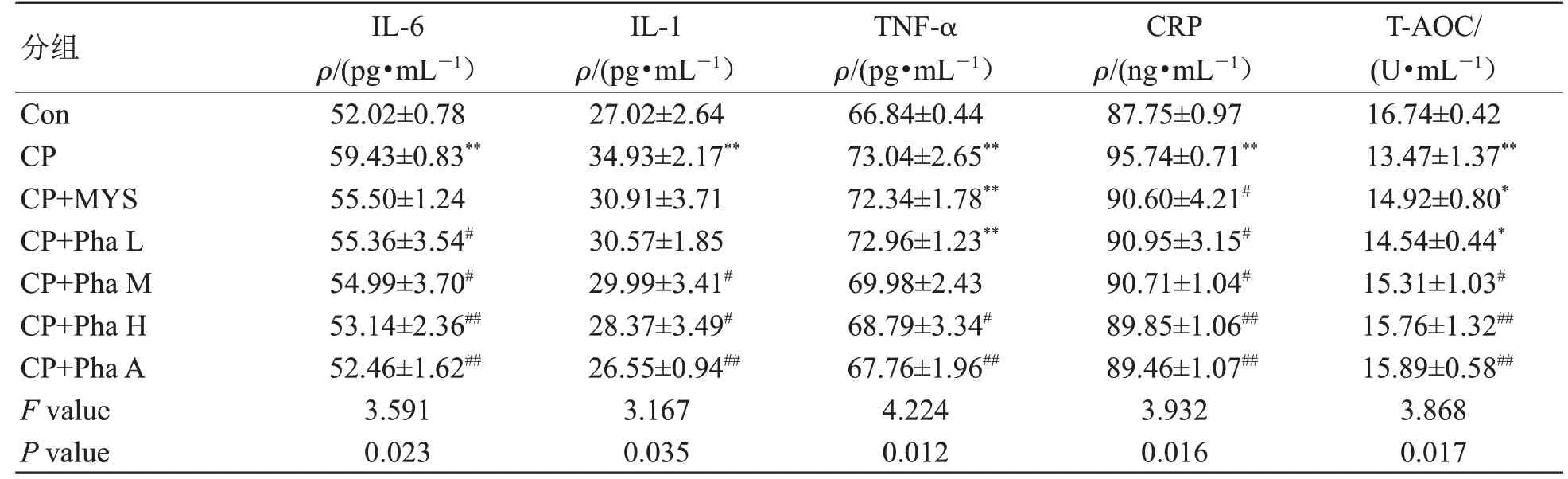
表3各组家兔血清IL-6、IL-1、TNF-α、CRP、T-AOC水平比较Table3 Levelsof IL-6,IL-1,TNF-α,CRP,and T-AOC in theserum of rabbitsin each group(±s,n=6)
注:Con为空白组;CP为模型组;CP+MYS为慢严舒柠清喉利咽颗粒组;CP+Pha L为咽立爽口含滴丸低剂量组;CP+Pha M为咽立爽口含滴丸中剂量组;CP+Pha H为咽立爽口含滴丸高剂量组;CP+Pha A为咽立爽口含滴丸雾化组。其余组与空白组比较,**P<0.01,*P<0.05;治疗组与模型组比较,##P<0.01,#P<0.05。
分组Con CP CP+MYS CP+Pha L CP+Pha M CP+Pha H CP+Pha A F value P value IL-6 ρ/(pg·mL-1)52.02±0.78 59.43±0.83**55.50±1.24 55.36±3.54#54.99±3.70#53.14±2.36##52.46±1.62##3.591 0.023 IL-1 ρ/(pg·mL-1)27.02±2.64 34.93±2.17**30.91±3.71 30.57±1.85 29.99±3.41#28.37±3.49#26.55±0.94##3.167 0.035 TNF-α ρ/(pg·mL-1)66.84±0.44 73.04±2.65**72.34±1.78**72.96±1.23**69.98±2.43 68.79±3.34#67.76±1.96##4.224 0.012 CRP ρ/(ng·mL-1)87.75±0.97 95.74±0.71**90.60±4.21#90.95±3.15#90.71±1.04#89.85±1.06##89.46±1.07##3.932 0.016 T-AOC/(U·mL-1)16.74±0.42 13.47±1.37**14.92±0.80*14.54±0.44*15.31±1.03#15.76±1.32##15.89±0.58##3.868 0.017
2.6 各组家兔咽喉壁黏膜NF-κB p65、IκB-α mRNA水平
实时荧光定量PCR检测结果(表4)显示:与Con组比较,CP组NF-κB p65、IκB-αmRNA水平明显升高,差异有统计学意义(P<0.01);与CP组比较,CP+Pha H组和CP+Pha A组NFκB p65、IκB-αmRNA水平明显降低,差异有统计学意义(P<0.01)。
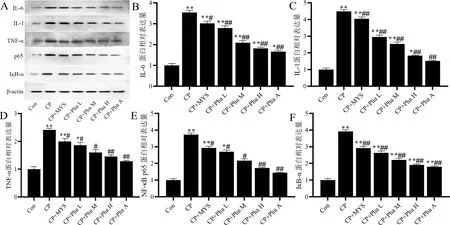
图2各组家兔咽喉壁黏膜IL-6、IL-1、TNF-α、NF-κBp65、IκB-α蛋白表达Figure 2 Expression of IL-6,IL-1,TNF-α,NF-κB p65,and IκB-αat the protein level in the pharyngeal mucosa of rabbitsin each group
表4各组家兔咽喉壁黏膜NF-κB p65、IκB mRNA水平比较Table 4 Expression of NF-κB p65 and IκB at the mRNA level in theposterior pharyngeal wall mucosa of rabbits in each group(±s,n=6)
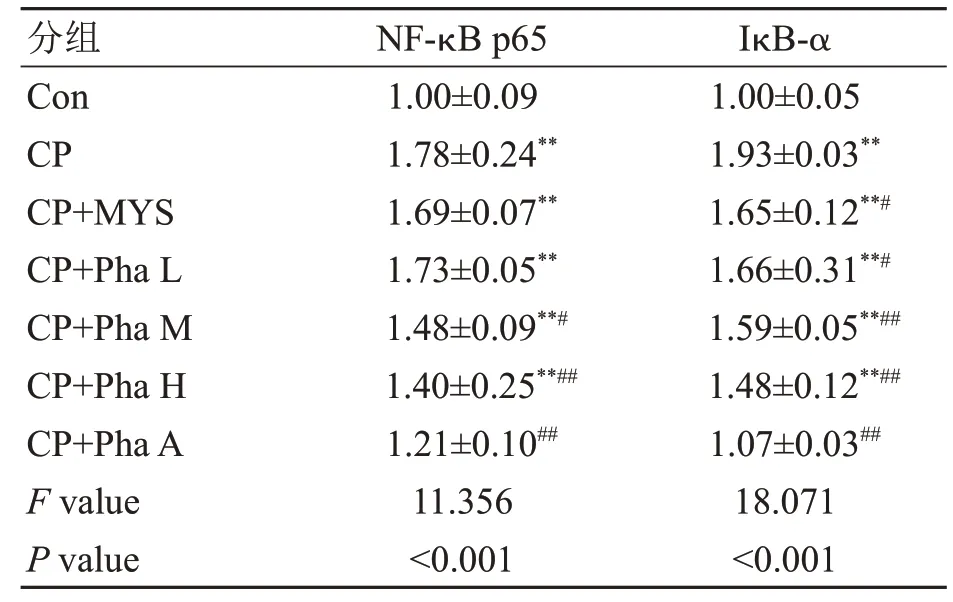
表4各组家兔咽喉壁黏膜NF-κB p65、IκB mRNA水平比较Table 4 Expression of NF-κB p65 and IκB at the mRNA level in theposterior pharyngeal wall mucosa of rabbits in each group(±s,n=6)
注:Con为空白组;CP为模型组;CP+MYS为慢严舒柠清喉利咽颗粒组;CP+Pha L为咽立爽口含滴丸低剂量组;CP+Pha M为咽立爽口含滴丸中剂量组;CP+Pha H为咽立爽口含滴丸高剂量组;CP+Pha A为咽立爽口含滴丸雾化组。其余组与空白组比较,**P<0.01,*P<0.05;治疗组与模型组比较,##P<0.01,#P<0.05。
分组Con CP CP+MYS CP+Pha L CP+Pha M CP+Pha H CP+Pha A F value P value NF-κB p65 1.00±0.09 1.78±0.24**1.69±0.07**1.73±0.05**1.48±0.09**#1.40±0.25**##1.21±0.10##11.356<0.001 IκB-α 1.00±0.05 1.93±0.03**1.65±0.12**#1.66±0.31**#1.59±0.05**##1.48±0.12**##1.07±0.03##18.071<0.001
3 讨论
不良的生活环境及工作压力增大会导致CP发病率增加。目前,医药干预是治疗CP的主要方法[9]。研究表明,氨水+松节油建立的CP模型与临床CP相似,符合CP动物模型的生物学特征[10]。咽立爽口含滴丸的主要成分为艾纳香草蒸馏升华提制的艾纳香油,以及天然冰片、薄荷素油和薄荷脑,具有消肿止痛的作用[11]。郭裕[6]用咽立爽口含滴丸超声雾化治疗急性单纯性咽炎,发现超声雾化吸入治疗有效可行。慢严舒柠清喉利咽颗粒可用于急慢性咽炎、扁桃体炎、咽喉发干、声音嘶哑等咽部症状的治疗,临床疗效明显,可作为阳性对照药物[12]。由此,本实验建立CP家兔模型,并使用咽立爽口含滴丸干预模型,以期寻找CP的潜在治疗药物。结果显示:与CP模型组比较,咽立爽口含滴丸各干预组家兔咽黏膜上皮结构较完整,排列较规则,偶见中性粒细胞浸润和局部轻微出血。另外,咽立爽口含滴丸高剂量与雾化组家兔咽黏膜上皮组织未见明显变性及炎性病变,黏膜下层及肌层均未见明显病理变化。上述结果表明,咽立爽口含滴丸能减轻慢性咽炎家兔咽部黏膜组织病理损伤,缓解病情进展,可能对CP发挥防治作用。
慢性咽炎患者咽部黏膜炎性反应强烈,多数炎性因子处于高表达状态,如血清TNF-α、IL-6等。TNF-α是由T淋巴细胞分泌的细胞因子,生物活性较为广泛,可参与其他生物因子协同作用,在炎性反应中发挥重要作用。IL-6是由成纤维细胞、活化T细胞分泌的细胞因子,属于趋化因子,可在感染引发的炎性反应中诱导炎性反应相关反应蛋白的合成与分泌,进而促进炎性反应[13]。此外,T淋巴细胞亚群主要包括辅助性T细胞和抑制性T细胞,CD4+增多表示机体清除病毒、细菌的能力及机体免疫功能增强,而CD8+增多往往表示机体清除病毒、细菌的能力及免疫功能受到抑制[14-15]。慢性咽炎患者病情进展过程中,CD3+、CD4+、CD4+/CD8+的降低可刺激B细胞的分泌,从而增强体液免疫,诱发产生免疫复合物的黏附与沉积,使病情加重[16-17]。本研究结果显示:与空白组比较,模型组CD3+、CD4+、CD4+/CD8+水平,明显降低;咽立爽口含滴丸高剂量及雾化组CD8+水平明显降低,CD3+、CD4+、CD4+/CD8+水平明显升高。这些结果提示咽立爽口含滴丸影响免疫细胞亚群,进而影响咽炎病情进展。
NF-κB信号通路能调控大量炎性细胞因子的生物学活动,广泛参与炎性反应、细胞增殖及免疫调节等病理生理过程。已有研究证实,未激活的NF-κB通常与IκB家族成员结合成无活性细胞质复合物而存在,当强烈的外界信号(如TNFα、IL-6、IL-1)诱导刺激细胞时,NF-κB p65与IκB相分离致使NF-κB信号通路激活,诱导大量炎性因子转录,发挥转录调控作用[18]。研究显示,用卵清蛋白刺激可选择性抑制NF-κB活化的IκB-α基因突变小鼠,制造变应性气道疾病模型,发现突变小鼠变应性炎性反应较对照组明显减轻,气道嗜酸性粒细胞及黏液分泌减少,血清IgE水平及促炎性反应的细胞因子表达也有所下降,表明NF-κB在气道变应性炎性反应中起到重要调节作用[19]。高斐宏等[20]也通过动物实验发现,鼻炎大鼠鼻黏膜中NF-κB高表达可使促炎性因子TNF-α、IL-6表达上升。其中TNF-α作为多功能炎性细胞因子,能介导黏附分子表达及细胞因子释放,促进炎性细胞的浸润和活化。以上研究结果提示,NF-κB可激发多种炎性因子表达,同时也受相关炎性因子的反激活,是促使炎性效应进一步放大的关键。
CP是咽黏膜、黏膜下及淋巴组织的慢性炎性反应,炎性反应过程能够激活NF-κB p65,持续激活的NF-κB p65能够增强一些细胞因子(如IL-1β、TNF-α)和一些黏附因子(如VCAM-1、ICAM-1)的表达,使炎性反应细胞产生活性氧,损伤咽黏膜周围上皮细胞,引起咽黏膜组织的炎性损害[21]。因此,抗炎作用的一个解释可能是抑制NF-κB的激活,从而降低炎性标志物的水平。本研究显示,与空白组比较,模型组IL-1、IL-6、TNF-α、CRP表达及NF-κB p65、IκB-α蛋白和mRNA表达明显升高,T-AOC表达明显降低;而咽立爽口含滴丸雾化组和高剂量组IL-1、IL-6、TNF-α、CRP表达及NF-κB p65、IκB-α蛋白和mRNA表达明显降低。这些研究结果提示,咽立爽口含滴丸可有效抑制NF-κB炎性通路活性及促炎因子表达,增强机体的抗氧化能力,从而抑制慢性咽炎的炎性反应。
综上所述,咽立爽口含滴丸具有较好的抗炎及增强免疫作用,可影响NF-κB信号通路,有效缓解慢性咽炎症状。
