利用COMPASS和MYP培养基检测雪茄烟叶中蜡样芽胞杆菌
2021-11-02叶长文罗凯玉李青常
叶长文,罗凯玉,陈 宸,贾 楠,李 栋,李青常,范 黎,贺 琛*
1.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号450001 2.河南农业大学烟草学院,郑州市金水区农业路63号 450002
芽胞杆菌属细菌因其具有抗性强、耐高温、生长快以及对营养要求不高等特点,在烟叶发酵和醇化过程中一直以优势菌群存在[1-2]。张鸽等[3-4]、杜佳等[5]采用传统的分离培养鉴别法,分别对雪茄烟叶叶面、茄衣发酵过程中细菌多样性及演替进行了试验,均证实芽胞杆菌属为雪茄烟叶发酵过程中绝对优势细菌群,并在国内外雪茄外包皮中分离鉴定出了枯草芽胞杆菌(Bacillus subtilis)、巨大芽胞杆菌(Bacillus megaterium)、蜡样芽胞杆菌(Bacillus cereus)、蕈状芽胞杆菌(Bacillus mycoides)和解淀粉芽胞杆菌(Bacillus amyloliquefa⁃ciens)等细菌。其中蜡样芽胞杆菌为食源性条件下的致病菌,广泛存在于土壤、水、空气和动植物体中,当蜡样芽胞杆菌量大于1×105CFU/g时,该菌能产生大量腹泻型肠毒素和致呕吐型肠毒素,从而引起人或动物中毒[6-8]。而目前有关雪茄烟叶中蜡样芽胞杆菌的研究尚鲜见报道。因此,有必要建立有效的检测方法对雪茄烟叶蜡样芽胞杆菌进行准确检测。
国内外食品和饲料行业出台了蜡样芽胞杆菌的相关标准检测方法,如ISO 7932∶2004[9]、GB 4789.14—2014[10]和美国FDA官方检测方法[11]等,这些方法均采用甘露醇卵黄多黏菌素琼脂(MYP)培养基对蜡样芽胞杆菌进行初步分离鉴定,然而芽胞杆菌属为雪茄烟叶菌群中的优势菌属,蕈状芽胞杆菌、枯草芽胞杆菌和巨大芽胞杆菌等同属细菌的形态特征、生理生化特征与蜡样芽胞杆菌相似,其具有极高的DNA同源性[12]。而MYP培养基选择性不强,易受到能产生卵磷脂酶或发酵甘露醇的其他芽胞杆菌和葡萄球菌等背景菌的干扰,且卵磷脂沉淀环易发生扩散重叠和交连,给计数和鉴定造成一定困难[13-15]。一般情况下需再进行分离培养、镜检观察、生化鉴定等,整个过程至少需要3~5 d,操作复杂且费力,不能满足微生物快速准确检测的需要[15]。随着微生物检测技术的发展,显色培养基利用目标菌中特异性酶水解培养基中显色底物使菌落体显色,较传统选择培养基的特异性和选择性更强,被广泛应用于微生物的快速检测[16]。张淑红等[13]和滕昆仑等[15]分别研制了蜡样芽胞杆菌显色培养基,并对食品中蜡样芽胞杆菌检测效果进行了初步评价。然而,烟叶基质和菌群结构与食品差异较大,显色培养基的适用性需进行验证。为此,采用一种新型的蜡样芽胞杆菌显色培养基——COMPASS®显色培养基[17],验证其在雪茄烟叶中蜡样芽胞杆菌检测的适宜性,并对比分析COMPASS培养基和传统MYP培养基的选择性、特异性和灵敏度,评价COMPASS显色培养基法和ISO 7932两种方法对雪茄烟叶样品中蜡样芽胞杆菌的检测效果,旨在找到一种快速分离和培养出雪茄烟叶中蜡样芽胞杆菌,并能进行准确计数的方法。
1 材料与方法
1.1 样品来源
24份雪茄烟叶原料样品分别来自5个国家,其中1#~3#、7#、11#和12#产地国为古巴,4#、15#和16#的产地为多米尼加,5#、8#~10#、13#、14#和19#产地为印度尼西亚,17#和18#产地为巴西,其他样品产地为中国。
目标菌株:蜡样芽胞杆菌[CMCC(B)63303];非目标菌株:短小芽胞杆菌[Bacillus pumilus,CMCC(B)63202]、解淀粉芽胞杆菌(AS1.892)、枯草芽胞杆菌(ATCC 6633)、苏云金芽胞杆菌(Bacillus thuringiensis,AS1.788)、蕈状芽胞杆菌(ATCC 6462)、巨大芽胞杆菌(ACCC 11107)、大肠杆菌(Escherichia coli,ATCC 25922)、金黄色葡萄球菌(Staphylococcus aureus,ATCC 6538)、铜绿假单胞菌(Pseudomonas aeruginosa,ATCC 27853)、肠道沙门氏菌肠道亚种鼠伤寒血清型[Salmonella entericasubsp.entericaserovar Typhimurium,ATCC 14028]、多黏类芽胞杆菌(Paenibacillus polymyxa,ATCC 7047)、屎 肠 球 菌(Enterococcus faecium,ATCC 19434)、塞 氏 柠 檬 酸 杆 菌(Citrobacter sedlakii,ATCC 51115)、鲍 曼 不 动 杆 菌(Acinetobacter baumnnii,ATCC 19606)、阴沟肠杆菌(Enterobacter cloacae,ATCC 13047)、缓慢葡萄球菌(Staphylococcus lentus,ATCC 700403)、弗氏柠檬酸杆菌(Citrobacter freundii,ATCC 43864)、表皮葡萄球菌[Staphylococcus epidermidis,CMCC(B)26069]共18株标准菌株;蜡样芽胞杆菌冻干定量质控菌株(广东环凯微生物科技有限公司,Q-Strain103系列,菌含量110~1 100 CFU/瓶)。
1.2 培养基
甘露醇卵黄多黏菌素琼脂即用型平板(MYP)、胰酪胨大豆羊血琼脂即用型平板(TSSB)(广东环凯微生物科技有限公司);COMPASS显色培养基基础、COMPASS显色培养基补充剂(法国Biokar公司);营养琼脂、硫酸锰营养琼脂、蜡样芽胞杆菌干制生化鉴定试剂盒(北京陆桥技术股份有限公司);革兰氏染色试剂盒(广东环凯微生物科技有限公司)。
1.3 试验方法
1.3.1 特异性和选择性试验
取1株蜡样芽胞杆菌和18株非目标菌的标准菌株复苏后,用1μL接种环取1环划线接种至MYP和COMPASS平板上,按产品说明书[17]进行制备,观察各试验菌株在平板上的菌落颜色和形态特征,并比较两种培养基的特异性。
依据标准GB 4789.28—2013[18]进行培养基的选择性验证,将19株复苏后的标准菌株在MYP和COMPASS平板进行半定量划线,每种培养基2个平行试验,在恒温恒湿培养箱中36℃培养24 h。培养后观测,若每条划线均有较稠密菌落生长则生长指数(G)为1;仅一半的划线有菌落稠密生长,G为0.5;划线上没有菌落生长、生长量低于划线的一半或菌落生长微弱,G为0。计算每个平板的得分总和,求得平均值后即得到G值。
1.3.2 灵敏度试验
在蜡样芽胞杆菌冻干定量质控菌株中添加1.1 mL复苏液,振荡使充分溶解混匀,得到100~1 000 CFU/mL的菌悬液。取该菌悬液0.1 mL并加入到0.9 mL无菌磷酸盐缓冲液中混匀,得到10~100 CFU/mL的菌悬液。再将这两种菌悬液分别取0.1 mL涂布至营养琼脂(NA)、MYP和COMPASS平板上,每种培养基3次平行试验。在恒温恒湿培养箱中36℃培养24 h,观察并记录菌落数量和形态。
1.3.3 人工污染样品检测
纯阳性标准菌株人工污染样品检测:准确称取25 g经121℃、20 min灭菌处理的雪茄烟叶样品于均质袋中,加入225 mL无菌磷酸盐缓冲液进行均质处理,得到无菌样品均质液。取1 mL 100~1 000 CFU/mL的蜡样芽胞杆菌悬液加入到9 mL的无菌均质液内,得到10~100 CFU/mL菌悬液,再将其稀释至5~50 CFU/mL,然后分别取1 mL接种至MYP和COMPASS培养基中,每种培养基3次平行试验。在恒温恒湿培养箱中36℃培养24 h。
混合菌液人工污染样品检测:将蜡样芽胞杆菌和至少在1种培养基中可生长的6株代表性非目标菌株(短小芽胞杆菌、枯草芽胞杆菌、蕈状芽胞杆菌、金黄色葡萄球菌、铜绿假单胞菌和屎肠球菌)复苏后,各用1μL接种环取1环加入至9 mL无菌样品均质液中,充分研磨摇匀,按10倍浓度梯度稀释至1×10-3、1×10-4、1×10-5,取各梯度稀释液1 mL接种至MYP和COMPASS培养基上。每个稀释度3次平行试验,于恒温恒湿培养箱中36℃培养24 h。观察目标菌的检出和非目标菌的干扰情况。
1.3.4 雪茄烟叶样品检测
无菌操作条件下准确称取25 g雪茄烟叶样品至均质袋中,加入225 mL无菌磷酸盐缓冲液后进行均质,将样品匀液依次稀释并制成1×10-2、1×10-3梯度稀释液,分别采用ISO 7932方法和COMPASS方法进行检验。每个稀释度3次平行试验,并置于30℃条件下培养24 h,见图1。其中ISO 7932方法计数典型菌落数后,需挑取计数平板上5个典型菌落(小于5个则全选)进行纯培养,再划线接种至TSSB培养基上进行确证,观察溶血反应,在MYP平板上典型菌落呈现微粉红色,周围有白色至淡粉红色沉淀环。而COMPASS方法无需进行纯化和确证实验,直接计数直径大于1 mm(涂布接种)或大于0.5 mm(倾注接种)的绿色菌落。
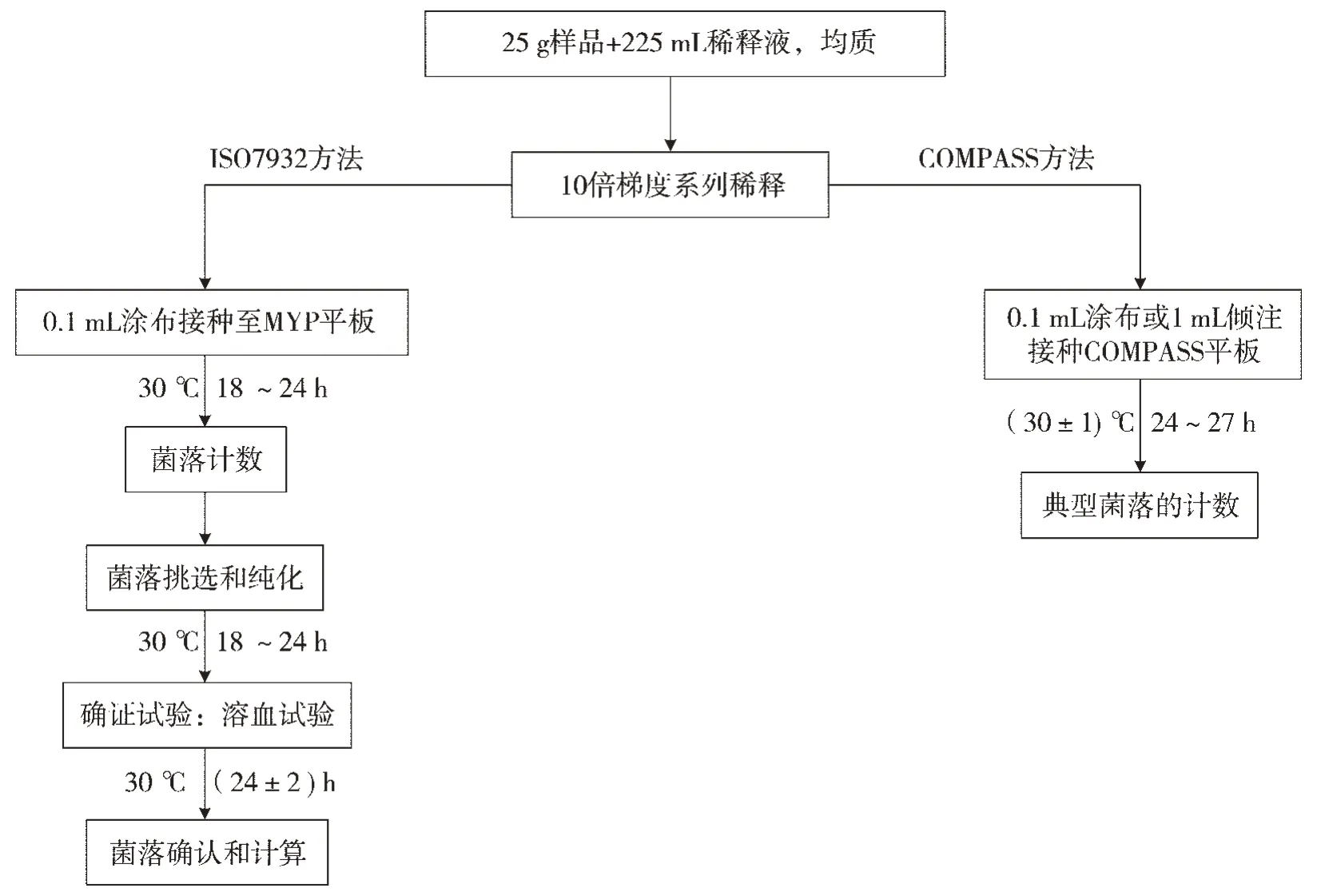
图1 ISO 7932和COMPASS方法的检验程序Fig.1 Detection procedures of the ISO 7932 method and the COMPASS method
1.3.5 鉴定确证
1#~7#雪茄烟叶样品检测过程中从每个MYP和COMPASS平板上至少挑取5个菌落(少于5个全选)划线接种至营养琼脂平板进行纯培养后,挑取纯培养的单个菌落,依据文献[19]的方法,采用革兰氏染色镜检、动力、硝酸盐还原、甘露醇产酸、溶菌酶耐性、V-P反应、葡萄糖利用(厌氧)、根状生长、溶血(羊红细胞)和蛋白质毒素结晶等试验进行鉴定。
1.3.6 数据分析
采用SPSS 22软件对典型菌落计数结果进行均值t检验。
2 结果与讨论
2.1 特异性分析
试验菌株在两种培养基上的形态描述和图片分别见表1和图2,菌株在两种培养基上呈现出不同的菌落形态和颜色。在MYP培养基上,蜡样芽胞杆菌、苏云金芽胞杆菌和蕈状芽胞杆菌呈现粉红色或淡粉红色,周围皆有白色至淡粉红色沉淀环,三者较难区分。短小芽胞杆菌、枯草芽胞杆菌、解淀粉芽胞杆菌、多黏类芽胞杆菌、巨大芽胞杆菌、金黄色葡萄球菌、铜绿假单胞菌、表皮葡萄球菌和屎肠球菌共9株细菌皆能生长,且能产生黄色或乳白色沉淀环,这可能与其含有葡萄糖苷酶有关[14],但与蜡样芽胞杆菌典型菌落颜色和形态特征存在明显区别。大肠杆菌、沙门氏菌、塞氏柠檬酸杆菌、弗氏柠檬酸杆菌、缓慢葡萄球菌、鲍曼不动杆菌和阴沟肠杆菌共7株细菌在MYP培养基上均不能生长。而在COMPASS培养基上,2株蜡样芽胞杆菌呈直径大于1 mm的绿色菌落,苏云金芽胞杆菌与蜡样芽胞杆菌形态和颜色特征相似,绿色显色物质沉淀在菌落上未发生扩散,较容易观察计数。而屎肠球菌的形态和颜色与蜡样芽胞杆菌有明显区别,其他16株非目标菌无菌落生长。可见,与MYP培养基相比,COMPASS培养基特异性更强。
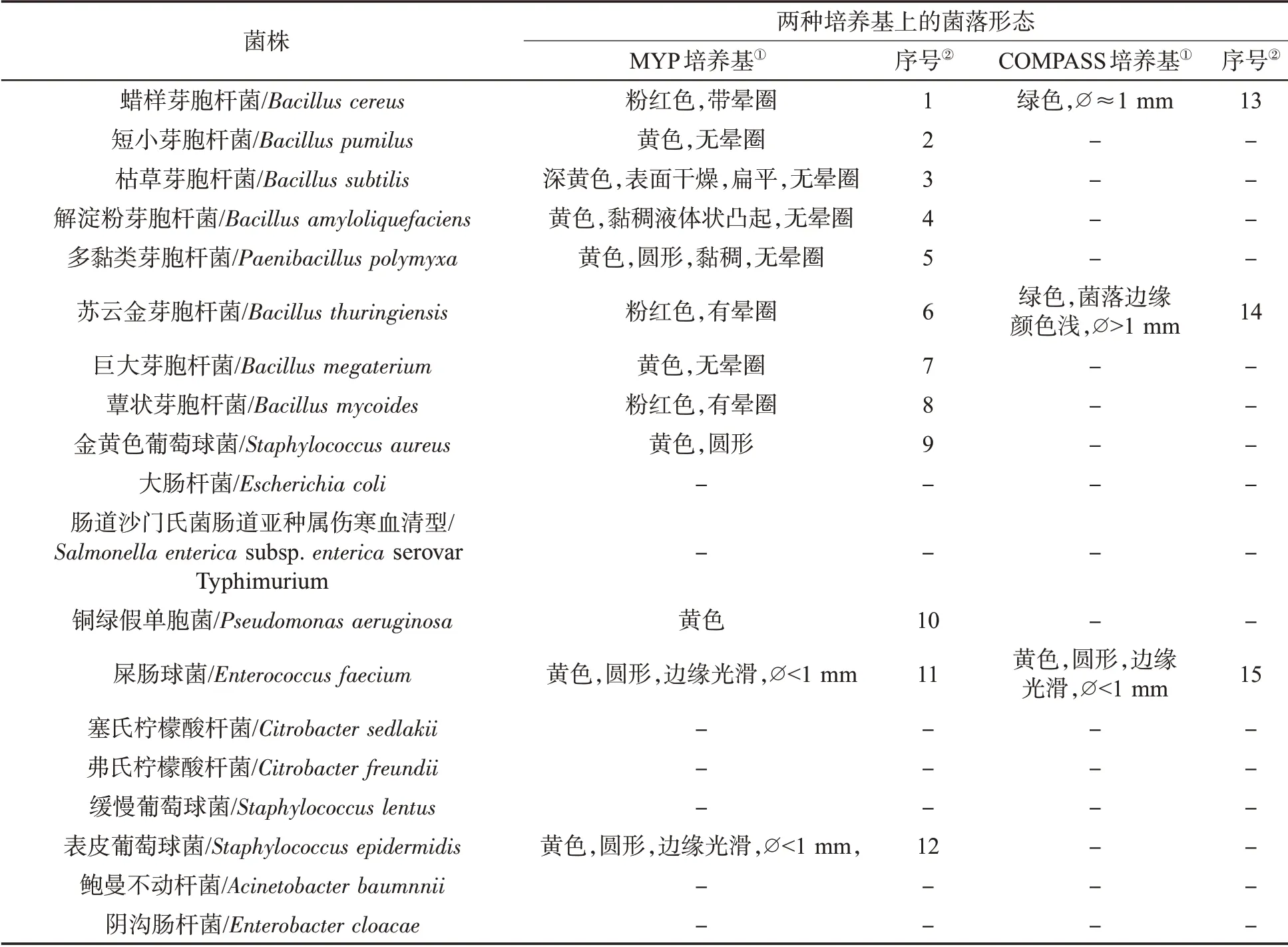
表1 两种培养基上的菌落形态比较Tab.1 Colony morphologies of tested strains in two media
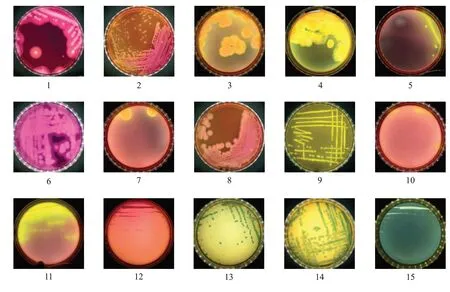
图2 两种培养基上的菌落形态比较Fig.2 Colony morphologies of tested strains in two media
2.2 选择性分析
两种培养基的选择性结果见表2,COMPASS培养基选择性优于MYP培养基。目标菌株在两种培养基上的生长指数(G值)均大于6,且呈现典型的生长形态,根据GB 4789.28—2013[18]这两种培养基是可以接受的,而18种非目标菌株在COMPASS和MYP培养基的G值均不大于6,说明其在两种培养基上生长受到不同程度的抑制。在COMPASS培养基上,除苏云金芽胞杆菌和屎肠球菌以外,其他16种非目标菌株皆被完全抑制(G=0),抑制率达88.9%(16/18)。对于MYP培养基,G值为0的非目标菌株仅占38.9%(7/18),而6株非目标芽胞杆菌的G值均大于0,其中解淀粉芽胞杆菌的G值为6.0,说明未被完全抑制。可见,COMPASS培养基的选择性明显优于MYP培养基。

表2 试验菌株在两种培养基上的选择性比较Tab.2 Selectivity of tested strains in two media
2.3 灵敏度分析
MYP、COMPASS和NA培养基3种平板上接种10~100 CFU和1~10 CFU两个水平的菌落数见表3。t检验结果表明,在同一接种量水平下,MYP、COMPASS和NA平板上生长的菌落数量差异不显著(P>0.05),说明MYP和COMPASS两种选择性培养基不会影响目标菌的菌落数量。同时,从1~10 CFU接种水平来看,3种培养基之间的灵敏度相当,检测灵敏度都可达到1~10 CFU。
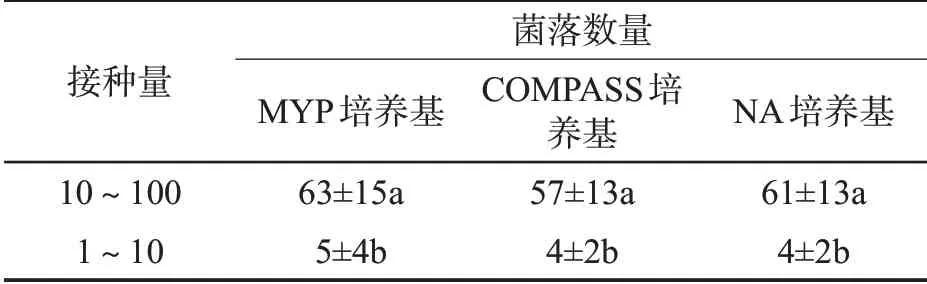
表3 试验菌株在3种培养基上的灵敏度比较①Tab.3 Sensitivities of tested strains in three media(CFU)
2.4 人工污染样品检测分析
2.4.1 纯阳性标准菌株人工污染样品
经纯阳性标准菌株人工污染处理后的雪茄烟叶样品,在两种培养基上的菌落形态见图3。在COMPASS培养基上,菌株呈典型生长,菌落呈圆形或近似圆形,不透明绿色,似熔蜡状,直径大于1 mm;在MYP培养基上,均呈微粉色带晕圈,说明雪茄烟叶基质颜色未影响蜡样芽胞杆菌的典型菌落形态特征。两种培养基上菌落计数和统计分析结果见表4,在同一接种水平和雪茄烟叶基质环境下,MYP和COMPASS培养基目标菌落数量差异不显著(P>0.05),说明雪茄烟叶成分未能抑制MYP和COMPASS培养基目标菌落的生长。

表4 阳性标准菌株人工污染样品在两种培养基上的菌落数量比较Tab.4 Number of colonies for artificially contaminated positive standard strain in two media (CFU)
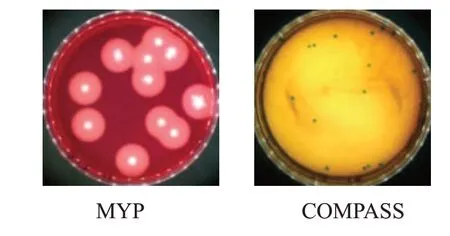
图3 人工污染样品在两种培养基上的菌落形态比较Fig.3 Colony morphologies of artificially contaminated samples in two media
2.4.2 混合菌株人工污染样品
蜡样芽胞杆菌和6株非目标菌株混合污染样品检测结果见表5。t检验结果表明,在同一接种水平下两种培养基间菌落数存在显著差异(P<0.05)。造成差异的原因可能是非目标菌株对培养基检测结果产生影响,特别是短小芽胞杆菌、枯草芽胞杆菌、蕈状芽胞杆菌等非目标芽胞杆菌属菌株均能使MYP培养基中卵黄分解而产生晕环,致使发生接合生长[14],干扰目标菌数量的计数。
2.5 雪茄烟叶实际样品检测分析
2.5.1 两种方法比较
采用ISO 7932和COMPASS两种方法同时检测7份雪茄烟叶中蜡样芽胞杆菌,所得计数结果及其对数值见表6。两个方法检测结果处于同一数量级内,数量基本一致,t检验结果表明COMPASS与ISO 7932方法的实际样品检测结果差异不显著(P>0.05),且COMPASS方法通过直接观察菌落颜色形态就可对蜡样芽胞杆菌进行快速计数,特别是对阴性样品和污染较轻的样品在24 h内可报告结果,缩短了检验时间,提高了检测效率。
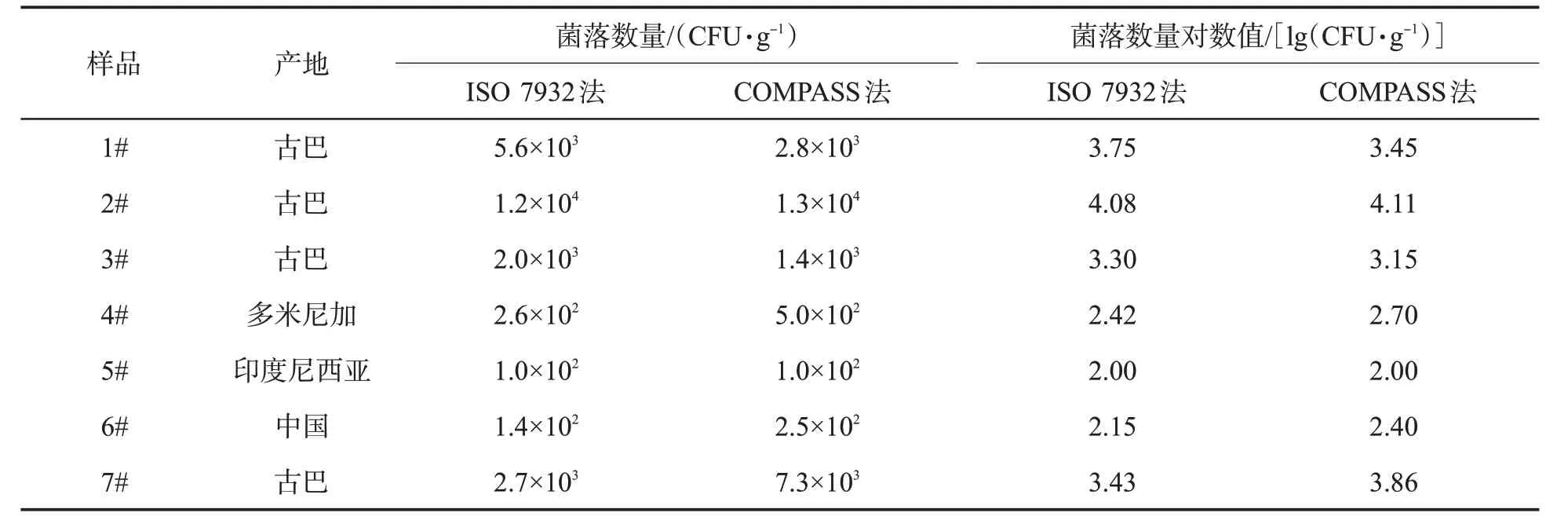
表6 两种检测方法检测结果比较Tab.6 Detection results by two methods
同一样品相同稀释度涂布接种两种平板培养后典型菌落见图4,MYP平板由于杂菌过度生长,使目标菌被遮挡,出现了蔓延情况,且杂菌的颜色和形态会对典型菌落计数造成较大影响,导致判读困难,无法计数。而COMPASS平板上绿色菌落清晰可见,较易判读和计数。COMPASS培养基内含的显色底物被蜡样芽胞杆菌中特征性酶水解,所含的选择性抑菌剂可抑制其他芽胞杆菌(如巨大芽胞杆菌、蕈状芽胞杆菌等)和非芽胞杆菌的生长,从而实现选择性分离的目的,无需进行纯培养、革兰氏染色和生化鉴定等步骤。因此,COMPASS方法替代ISO 7932方法对雪茄烟叶蜡样芽胞杆菌的检测是可行的。
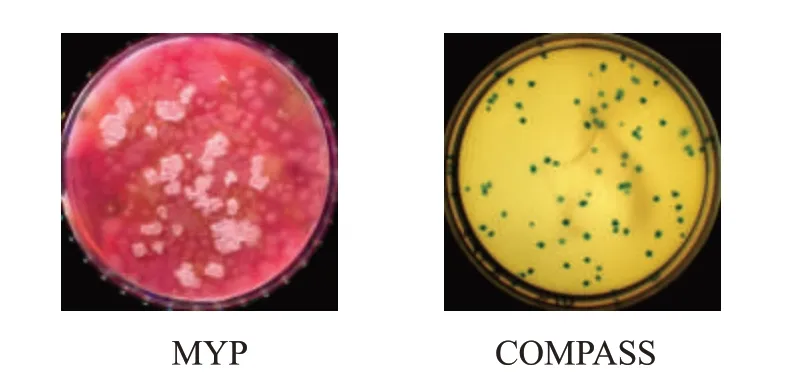
图4 实测样品在两种培养基上的菌落形态比较Fig.4 Colony morphologies of actual samples in two media
2.5.2 鉴定确证
在上述7份雪茄烟叶样品检测过程中,从MYP平板上共挑取92个典型菌落进行生理生化鉴定,确证为阳性的有87个,阳性检出率为94.6%(87/92);从COMPASS平板上共挑取85个典型菌落进行生化鉴定,被确证阳性共82个,阳性检出率为96.4%(82/85)。说明MYP和COMPASS培养基阳性率已达到较高水平,而COMPASS培养基准确性更高,假阳性率更低。从10项鉴定试验结果看,苏云金芽胞杆菌是最难区分的一种假阳性菌,其在MYP和COMPASS培养基皆不能与蜡样芽胞杆菌区分,而蛋白质毒素结晶试验是证实假阳性的最有效手段。
2.5.3 实际样品检测分析
COMPASS法检测实际雪茄烟叶样品的结果见表7。在采集的24份样品中,共检出蜡样芽胞杆菌阳性样品20份,检出率达83.3%,这可能与蜡样芽胞杆菌耐热的生物学特性有关,其游离芽胞能在100℃时耐受30 min,在调制后烟叶中仍能存活。从检出数值来看,检出值范围为1.0×10~1.3×104CFU/g,其中有2个和4个样品菌含量分别达到104和103数量级。从各产地分析,发现古巴的烟叶样品中蜡样芽胞杆菌平均含量最高,其后依次为多米尼加、中国、印度尼西亚和巴西。
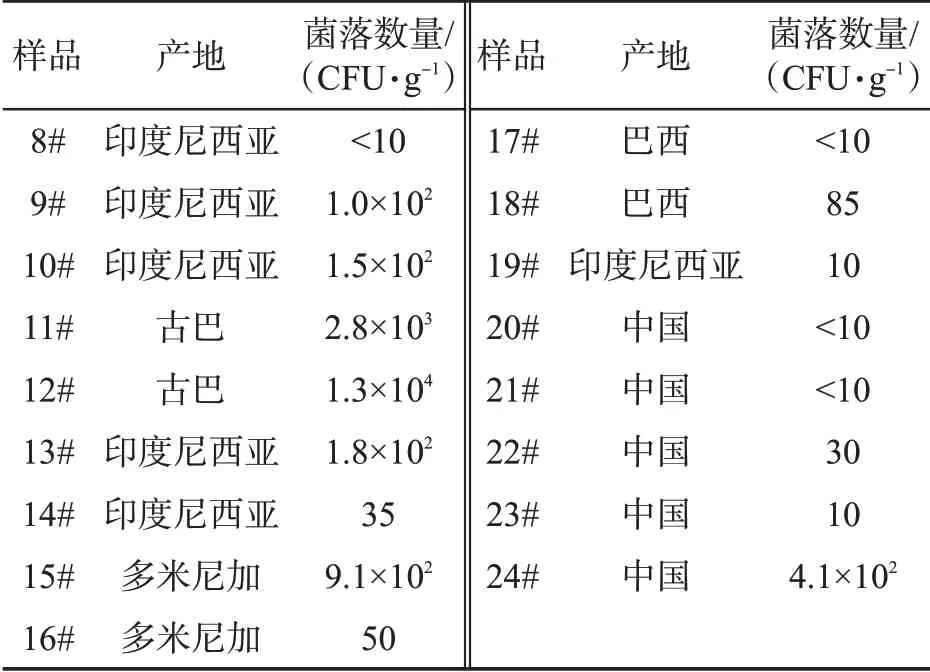
表7 雪茄烟叶样品COMPASS方法的检测结果Tab.7 Detection results of cigar tobacco leaf samples by the COMPASS method
蜡样芽胞杆菌致病风险与其含量密切相关,当食品中蜡样芽胞杆菌大于1×105CFU/g时,该菌能产生大量腹泻型肠毒素和致呕吐型肠毒素,从而引起食物中毒[7,12]。虽然24个雪茄烟叶样品检出值皆低于澳大利亚和新西兰、英国等国对蜡样芽胞杆菌在即食食品中1×105CFU/g的限量规定[20],但雪茄与食品的消费方式不同,其检出率和检出值在一定程度上提示雪茄烟叶中仍存在蜡样芽胞杆菌的潜在风险。
3 结论
通过COMPASS和ISO 7932两种方法检测结果比较发现:①COMPASS培养基在选择性、特异性和灵敏度方面优于ISO 7932使用的MYP培养基;②COMPASS方法较省时且简便;③COMPASS方法与ISO 7932在检测结果上无显著差异。因此,COMPASS方法可作为ISO标准方法的有效替代方法,用于雪茄烟叶样品蜡样芽胞杆菌的快速检测。
