白及基因组DNA分离方法效果比较
2021-10-29张子雄蒋影张家春戚燕强孙超
张子雄 蒋影 张家春 戚燕强 孙超


摘 要:以白及为试验材料,采用优化的CTAB法和试剂盒法提取白及叶片的基因组DNA。结果表明:优化的CTAB法提取出的DNA检测浓度值为252.8~664.8 ng/μL,试剂盒法的检测浓度值为31.7~52.3 ng/μL。证明优化CTAB法和DNA试剂盒法都能获得基因组DNA的良好完整性和高纯度。
关键词:白及;DNA提取;优化的CTAB;试剂盒法
文章编号:1005-2690(2021)17-0022-02 中国图书分类号:R282.71 文献标志码:B
白及(Bletilla striata (Thunb.)H.G.Reichenbach)是兰科白及属的多年生草本植物[1],主要分布于我国贵州、广西、云南、湖南省等多数地区[2-4]。基因组DNA承载着植物的基本遗传物质和遗传信息,要进行其后续的分子层面的生物学试验,提取一定数量、高质量的DNA样品是必不可少的。根据不同植物种的生物特性和基因组DNA的不同,进行提取方法的优化是进行分子标记试验的第一步也是最为关键的一步[5-6]。由于白及的叶片中富含有多糖、多酚等次生代谢产物,不容易去掉杂质,经反复试验,总结出此试验方法步骤。
1 结果与分析
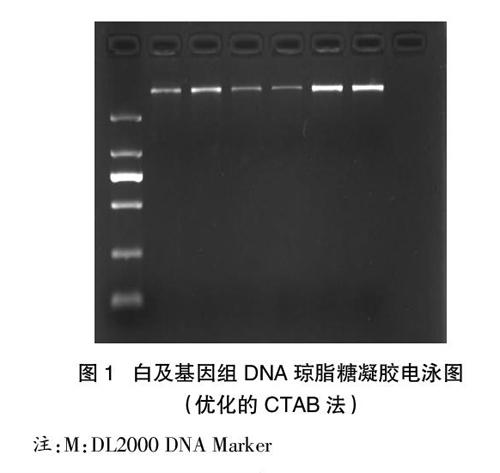
1.1 DNA琼脂糖凝胶电泳检测分析
使用优化的CTAB法提取白及基因组DNA琼脂糖凝胶电泳结果见图1,DNA电泳条带整齐清楚明显,没有拖带,DNA的条带均高于Marker的最高条带。使用DNA提取试剂盒法提取结果如图2,条带也依然清晰明亮。使用传统CTAB法如图3,会发现有些孔中电泳条带有拖带现象,有些孔中提取的DNA电泳条带很弱甚至无条带。
1.2 基因组DNA浓度和纯度检测分析
使用优化的CTAB法提取白及基因组DNA浓度和纯度检测结果见表1。结果中所含有的RNA、蛋白质、酚类物质的杂质、残留的盐或小分子杂质较少。DNA检测浓度值在252.8~664.8,表明与试剂盒法提取相比提取浓度更高。使用DNA提取试剂盒法提取的结果见表2。所提取DNA的结果中所含有的RNA、蛋白质、酚类物质的杂质更少。DNA检测浓度值在31.7~52.3,表明DNA的提取浓度恰好满足后续PCR分子试验的浓度标准要求。
2 试验材料与方法
2.1 材料
以种植于贵州省植物园药用植物试验基地的白及植株的尖端嫩叶为材料。
2.2 方法
2.2.1 优化的CTAB法提取基因组DNA
优化的CTAB法试验步骤如下:①加入液氮,加白及顶端新鲜嫩叶迅速研磨,放入2 mL离心管中,加1.5 mL4 ℃预冷的STE裂解液(NaCl 0.25 mol/L,EDTA(pH值8.0)50 mol/L,Tris-HCl (pH值8.0)0.2 mol/L, β-巯基乙醇1%,2 gpvp)。②离心时间为6 min,转速为8 000 r/min,弃上层清液;加1.5 mL 4 ℃预冷STE裂解液,充分混匀。离心6 min,转速8 000 r/min,棄上层清液。③加65 ℃预热的1 mL的4×CTAB提取缓冲液,65 ℃水浴45 min,其间每隔15 min震荡1次。④4 ℃离心8 min,转速11 000 r/min;取800 μL上清液,加到2 mL的离心管中。再加入与之等体积的平衡酚/氯仿/异戊醇(25∶24∶1)溶液,轻微颠倒混匀3 min。⑤4 ℃中离心8 min,转速11 000 r/min;抽取600 μL的上清液,加到2 mL离心管中,加入等体的氯仿/异戊醇(24∶1)溶液,颠倒混匀3 min。⑥重复⑤。⑦吸取200 μL的上清液,加入1.5 mL的离心管之中,加入等体积的预冷异丙醇,轻微震荡,置于-20 ℃沉淀0.5~1 h。⑧4 ℃离心6 min,转速11 000 r/min,4 ℃预冷70%乙醇清洗两次,加入90 μL TE缓冲液溶解沉淀,加入10 μL RNaseA酶(10 mg/mL),37 ℃水浴锅中水浴30 min;放入-20 ℃保存。
2.2.2 基因组DNA质量的检测
琼脂糖凝胶电泳检测,参照张子雄等(2017)方法。核酸蛋白分析仪检测,参照张子雄等(2017)方法。
3 讨论
刘亭等(2014)是直接进行水浴,但试验在水浴之前加入STE裂解液进行杂质的清洗,可以更好地进行后续步骤;且试验进行了两次氯仿/异戊醇(24∶1)溶液的添加,去除杂质更彻底。周延清等(2005)利用SDS提取液提取的DNA杂质更多,无法去除叶片中的酚类物质氧化成醌类物质和蛋白质结合的产物。在张子雄等(2017)对柱花草DNA提取的基础上改变了裂解液的使用,针对白及能很好地去除杂质。
DNA试剂盒法所提取的DNA结果纯度很高,杂质少。但此方法提取的DNA浓度只是刚好达到后续PCR试验中DNA模板浓度30 ng/μL的最低标准要求,远远低于优化的CTBA法的提取结果。每个处理提取量太少,只适合满足检测小剂量试验使用,不适合大剂量多组次的试验使用。优化的DNA提取分离方法是在之前学者们的方法上经过反复试验,针对贵州道地药材白及这一植物叶片材料加以改进、优化、总结。不仅在很大程度上节省了工作试验时间,而且浓度、纯度均满足后续大剂量多组次的分子试验要求,为后续顺利地开展分子试验研究打下基础。两种方法各有利弊,也各有其用途,DNA试剂盒法适用于少组数的检测试验,优化的CTAB法适用于多组数、大剂量的试验需求[7-8]。
参考文献:
[ 1 ] 李伟平,何良艳,丁志山.白及的应用及资源现状[J].中华中医药学刊,2012,30(1):158.
[ 2 ] 国家药典委员会.中华人民共和国药典(一部)[S].北京:人民卫生出版社,2010.
[ 3 ] 任华忠,何毓敏,杨丽.白及化学成分其药理活性研究进展[J].亚太传统医药,2009,5(2):134
[ 4 ] 俞林花,聂绪强,潘会君,等.白及多糖对糖尿病溃疡创面愈合的作用研究[J].中国中药杂志,2011,36(11):1487.
[ 5 ] 周延清.DNA分子标记技术在植物研究中的应用[M].北京:化学工业出版社,2005.
[ 6 ] 刘亭,雷諝婷,罗阿东,等.白及DNA提取方法研究[J].中国实验方剂学杂志,2014,20(12):119-123.
[ 7 ] Fu L K,Jin J M.China plant red data book:rare and endangered plants (Vol.1)[M].Beijing:Science Press,1992.
[ 8 ] 唐燕琼,吴紫云,郭建春,等.柱花草DNA提取及ISSR反应体系的正交优化[J].热带作物学报,2008(3):352-357.
