散发性前庭神经鞘瘤差异表达基因的鉴定及免疫细胞浸润分析
2021-10-26刘宇超黄巧尹时华
刘宇超 黄巧 尹时华
广西医科大学第二附属医院耳鼻咽喉头颈外科(南宁530000)
前庭神经鞘瘤(vestibular schwannoma,VS),亦称听神经瘤,占颅内良性肿瘤的8-10%,约占桥小脑角肿瘤的80-90%[1]。大多数VS是散发性和单侧的,而双侧肿瘤通常与2型神经纤维瘤病(NF2)相关[2]。其中NF2基因编码的肿瘤抑制蛋白merlin功能丧失是神经鞘瘤发病的重要步骤。而且NF2的双等位体突变也在部分散发性VS中被发现[3,4]。尽管这些肿瘤在组织学上是良性的,但它们会导致耳聋、耳鸣和面瘫,如果发展到很大的规模,会导致脑干受压甚至死亡[5]。目前,手术治疗仍然是较大肿瘤的无可争议的推荐治疗方法,而中小型肿瘤的治疗可以通过反复的MRI观察、手术或放射治疗。另外,靶向药物治疗被认为是既控制肿瘤生长,又可避免手术可能造成的面神经功能损伤等不良预后的治疗手段[6]。然而与神经纤维化2型相关VS已经存在靶向血管内皮生长因子的单抗型血管生成抑制剂不同,散发性VS至今没有合适的药物治疗,这与散发性VS的生长速度和大小上表现出很大的变异性有关[7,8]。
几十年的研究已经在许多方面对VS的生长机制进行了探讨。例如神经鞘瘤发生的“四次打击-三个步骤”的遗传机制,即首先发生一个生殖系基因SMARCB1突变,然后伴随着包含第二个SMARCB1等位基因和一个NF2基因突变的22号染色体的一部分损失,最后剩余的野生型NF2基因也发生突变,从而导致疾病的发生[9,10]。另外,MEK/JUK等基因参与的merlin蛋白磷酸化失活[11]、miR-21/miR-7等microRNA表达模式异常[12,13]等表观遗传的改变也被学者们证明与VS的发生发展相关。除此之外,近年的研究发现免疫细胞的浸润与散发性VS生长和血管生成显著相关[14,15],提示在恶性肿瘤的生长和侵袭中发挥关键作用的浸润免疫细胞[16,17]可能在散发性VS的生长机制中也充当重要角色。然而之前的免疫细胞在VS中的研究存在着相对狭隘的思路及技术缺陷,所以本研究将基于生物信息学方法通过分析Gene Expression Omnibus(GEO)数据库中散发性VS的芯片表达数据,通过鉴定差异表达基因(differentially expressed genes,DEGs)以及利用科学的CIBERSORT方法[18]初步了解样本中浸润免疫细胞的情况,为散发性VS的分子机制研究和药物靶点的筛选提供新思路。
1 材料与方法
1.1 数据下载
从GEO数据库下载散发性VS相关数据集GSE141801、GSE108524和GSE39645,仅筛选出散发性VS及正常的神经组织样本用于后续分析。
1.2 差异表达基因的鉴定
首先对GSE141801芯片数据进行标准化处理,然后使用limma R包筛选DEGs,筛选标准为adj.Pvalue小于0.05及|log2FC|大于1,并绘制火山图和热图。随后用clusterProfiler包对DEGs进行基因本体论(Gene ontology,GO)功能注释和京都百科全书基因与基因组(Kyoto Encyclopedia of Genes and Genomes,KEGG)途径分析,其中GO分析包括生物过程(biological process,BP)、细胞成分(cellular component,CC)和分子功能(molecular function,MF)三个功能组。筛选标准为调整后的P值小于0.05。
1.3 免疫细胞浸润分析
为增加免疫细胞浸润分析可用样本的数量,提高结果的准确性,将GSE141801、GSE108524和GSE39645进行合并,使用limma R包对数据进行批次矫正,并用聚类分析判断矫正效果。随后应用CIBERSORT得到每个样本的22种免疫细胞的含量矩阵,筛选出P值小于0.05的样本。随后用pheatmap包绘制热图;用vioplot包绘制小提琴图;用corrplot包绘制免疫细胞相关性热图;最后进行主成分分析,并用ggplot包可视化。所有分析均在R软件(版本3.6.3)上完成。
2 结果
2.1 样本信息
经过筛选,共得到46例肿瘤组织及19例正常神经组织的样本数据,其中GSE141801贡献36例散发性VS组织和7例正常神经组织,GSE108524贡献10例散发性VS组织和4例正常神经组织,GSE39645贡献8例正常神经组织。
2.2 差异表达基因的筛选与鉴定
经过计算,共找到DEGs 1828个,其中上调基因939个,下调基因889个,火山图见图1A,热图如图1B所示,可以看出DEGs在散发性VS与正常组织间的表达具有显著差异。
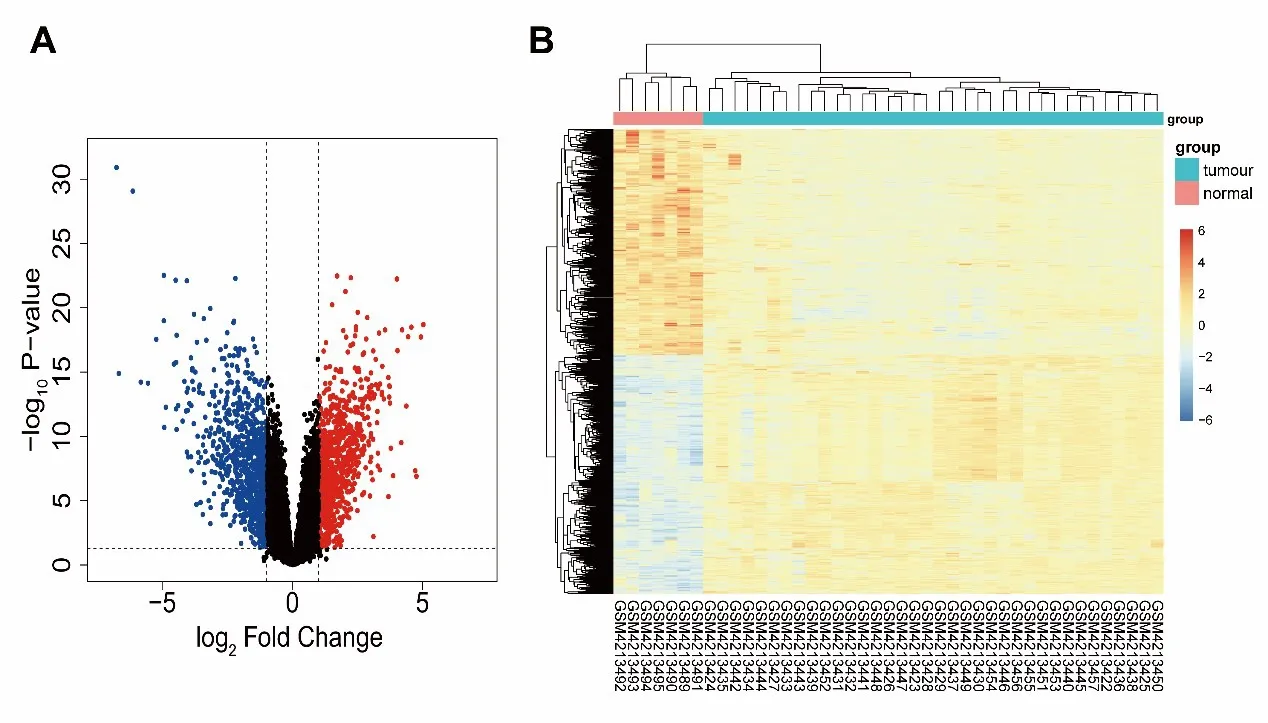
图1 DEGs的火山图和热图A为差异基因的火山图,红色代表上调的基因,蓝色代表下调的基因。B为差异基因的热图,横轴代表每个样本,纵轴代表差异基因,红色代表高表达,蓝色代表低表达。Fig.1 The volcano plot and heat map of DEGs.A is the volcano plot of the DEGs.Red represents up-regulated genes and blue represents down-regulated genes.B is the heat map of DEGs,the horizontal axis represents each sample,the vertical axis represents the differentially expressed genes,the red represents the high expression,and the blue represents the low expression.
GO功能注释结果显示(图2A)DEGs在BP中主要富集于细胞激活、T细胞活化、细胞粘附的正向调节、白血球细胞−细胞粘附以及白细胞、淋巴细胞和单核细胞增生与调控;在CC中主要富集于胶原蛋白−包含细胞外基质、细胞连接和胞质囊腔;在MF中主要富集于受体配体活动、细胞粘附分子结合和细胞因子受体结合。KEGG通路分析结果显示(图2B)DEGs主要富集在细胞因子−细胞因子受体的相互作用、MAPK信号通路、Ras信号通路和细胞粘附分子等通路。


图2 DEGs的GO分析(A)和KEGG通路分析(B)。圆圈大小代表基因富集的数目,圆圈越大表示富集的基因越多;颜色代表富集的程度,颜色越红,代表富集程度越高。Fig.2 GO functional annotation(A)and KEGG pathway analysis(B)of the obtained differential genes.The circle size represents the number of gene enrichment.The larger the circle is,the more genes are enriched.The color represents the degree of enrichment,and the redder the color,the higher the degree of enrichment.
2.3 免疫细胞浸润分析结果
经过计算及筛选,最后得到7例肿瘤组织样本和8例正常神经组织样本的免疫细胞含量矩阵。在随后的分析中,热图(图3)显示M2型巨噬细胞及激活的肥大细胞在样本中含量较高。小提琴图(图4)显示与正常神经组织相比,散发性VS中的M2型巨噬细胞、活化的肥大细胞、未活化的CD4+记忆性T细胞以及嗜酸性粒细胞的比例显著增多(P<0.05);而CD8+T细胞、幼稚CD4+T细胞、调节性T细胞以及中性粒细胞的比例显著减少(P<0.05)。22种免疫细胞的相关性热图(图5)显示构成比相关系数较大的免疫细胞包括嗜酸性粒细胞和活化的肥大细胞(0.76),幼稚CD4+T细胞和中性粒细胞(0.83),活化的CD4+记忆性 T细胞和CD8+T细胞(0.81),中性粒细胞与M2型巨噬细胞(-0.7),调节性T细胞与M2型巨噬细胞(-0.7),未活化的CD4+记忆性T细胞与调节性T细胞(-0.76)。最后二维主成分分析结果显示22种免疫细胞的含量能很好的区分散发性VS和正常神经组织(图6)。

图3 免疫细胞浸润的热图。横轴代表样本,蓝色部分为正常组织,红色部分为肿瘤组织;纵轴代表22个免疫细胞。颜色代表免疫细胞的含量,颜色越红表示该免疫细胞含量越多。Fig.3 Heat map of immune cell infiltration.The horizontal axis represents the sample;The vertical axis represents 22 immune cells.The color represents the amount of immune cells,and the redder the color,the more immune cells there are.

图4 散发性vs及正常组织中免疫细胞占比小提琴图。横轴为22个免疫细胞,蓝色代表正常神经组织,红色代表散发性前庭神经鞘瘤组织,纵轴为细胞占比。Fig.4 The violin plot of the proportion of immune cells in sporadicⅤS and normal tissue.There are 22 immune cells on the horizontal axis,the blue column represents normal nerve tissue,and the red column represents sporadic vestibular schwannoma tissue.The vertical axis is the proportion of cells.

图5 22种免疫细胞浸润的相关性热图。红色表示正相关,蓝色表示负相关,颜色越深,相关性越强;横坐标和纵坐标均表示22种免疫细胞。Fig.5 Heat map of immune cell infiltration.Red means positive correlation,blue means negative correlation,the darker the color,the stronger the correlation;The X-axis and Y-axis represent 22 types of immune cells.

图6 二维主成分分析聚类图。。绿色圆点表示肿瘤样本,红色圆点表示正常样本。Fig.6 Two-dimensional principal component analysis cluster diagram.Green dots represent tumor samples and red dots represent normal samples.
3 讨论
由于散发性VS生长过程中复杂的变异性,让其药物开发充满挑战。虽然近年针对NF2基因和其编码的merlin蛋白等靶标的机制研究有一定进展,但距离精确控制听神经瘤生长仍很遥远。在这项研究中,我们基于GEO数据库的挖掘对DEGs进行鉴定发现散发性VS在T细胞活化、白血球细胞−细胞粘附以及白细胞、淋巴细胞和单核细胞增生与调控等免疫细胞相关功能中显著富集,KEGG分析也显示DEGs在细胞因子和细胞因子受体相关信号通路显著富集。细胞因子往往通过炎症反应、自由基和信号通路直接或间接影响肿瘤细胞,在肿瘤发生和发展的不同免疫阶段、抗原处理和递呈中表现出不同的作用[19],而细胞因子又往往是免疫细胞的产物,因此免疫细胞具有成为散发性VS药物治疗靶点的潜力。
在恶性肿瘤中,肿瘤微环境中的各种免疫细胞的浸润比例与临床结果密切相关并影响肿瘤对治疗的反应已在许多研究中被证实[17,20],尽管VS是良性肿瘤,但近年多项研究证实了炎症反应和免疫细胞的状态与散发性VS的生长及血管生成密切相关[14,15,21,22]。说明控制VS中的免疫细胞状态及炎症或许能成为治疗VS的手段之一。然而这些研究多依赖于流式细胞仪和免疫组化对细胞表面标记物的识别来检测单个免疫细胞,会导致一定程度的细胞丢失和结果偏倚。而基于最先进的去卷积算法的CIBERSORT软件能更精确地解决不同浸润免疫细胞亚群在样本中的浸润情况,在细胞异质性研究中具有显著优势[23,24]。
于是我们利用CIBERSORT方法,比较了散发性VS与正常神经组织间22个免疫细胞亚群的变化,发现两组间的免疫细胞具有显著差异。其中M2型巨噬细胞是浸润最多的免疫细胞。与M1型巨噬细胞通过分泌白介素12,白介素16和干扰素-γ等促炎细胞因子来激活炎症反应,参与宿主固有免疫,抑制肿瘤生长不同[25,26],M2型巨噬细胞主要分泌白介素10和转化生长因子-β等细胞因子来抑制炎症,抑制T细胞增殖和分化,并促进肿瘤细胞增殖和肿瘤基质的血管生成[27,28]。CD163是M2型巨噬细胞的特异性标志物,Vries等人通过免疫荧光染色发现所有VS样本均显示一定程度的CD163免疫阳性并且CD163在快速生长肿瘤中的表达明显高于缓慢生长肿瘤,同时在高表达CD163的肿瘤中,微血管密度的程度显著增高[15]。这些发现都说明M2型巨噬细胞浸润可能是VS的进行性生长的重要因素,可以成为潜在的药物治疗靶点。激活的肥大细胞是另一个显著增加的免疫细胞,一般情况下肿瘤微环境中的肥大细胞具有抗肿瘤的特性。一旦激活和脱颗粒,它们会变得高度促炎,并积极招募先天免疫系统的细胞,以协调抗肿瘤免疫反应[29],同时肥大细胞通过释放血管内皮生长因子等经典促血管生成因子和糜蛋白酶等非经典促血管生成因子,积极参与血管生成[30],所以肥大细胞也可能成为散发性VS的有效治疗靶点。除此之外,未活化的CD4+记忆性T细胞在散发性VS中也显著增多,其作为T细胞的一个亚群,可进一步分化,并能辅助CD8+T细胞发生肿瘤排斥反应,抑制对自身和外来抗原的有害免疫反应,甚至阻断CD8+T细胞的活化和杀伤NK细胞[31,32],我们推测未活化的CD4+记忆性T细胞可能也在散发性VS的发生发展中起着关键作用。
另外值得注意的是,显著减少的免疫细胞主要集中在CD8+T细胞、幼稚CD4+T细胞以及调节性T细胞等T细胞亚型,而近期的研究表明T细胞衰竭与许多慢性疾病的预后不良有关[33],提示T细胞的缺失参与了免疫系统逃避机制,结合我们的研究结果,提示T细胞衰竭或许也参与了散发性VS的肿瘤免疫逃避,从而促进了肿瘤的生长。
此外,我们还发现某些免疫细胞间具有显著相关性,这可能为后续免疫细胞在VS的研究提供思路。更重要的是我们通过主成分分析证明免疫细胞的变化作为散发性VS的一个内在特征可以表现出个体差异,具有重要的临床意义。
总之,我们通过生物信息学的方法,对散发性VS的芯片数据进行了分析,发现差异表达基因主要富集于免疫相关通路及生物学过程,同时我们首次揭示了散发性VS中22种免疫细胞的浸润情况,发现M2型巨噬细胞、肥大细胞、未活化的CD4+记忆性T细胞、CD8+T细胞、幼稚CD4+T细胞和调节性T细胞等免疫细胞可能参与了散发性VS的发生发展,这些发现为免疫细胞在散发性VS的分子机制研究提供了理论依据,也为靶向药物的开发提供了新的视角。
