本源菌降解褐煤的生物学特性及微观结构分析
2021-10-20牛显牛煜索永录
牛显 牛煜 索永录

摘 要:從原位褐煤中筛选本源菌并分析其降解特性是探索原位微生物降解转化煤炭的有效途径。经过原位取样,富集培养,纯化分离得到一株本源真菌,以形态学观测和ITS测序,确定为镰刀菌属(F.spp.NF01)。通过本源菌F.spp.NF01生长曲线、pH-t曲线及褐煤的降(溶)解实验研究了其生理学特性,并利用扫描电子显微镜、傅里叶红外光谱、电子顺磁共振分析了残煤表面形貌、官能团及自由基。结果表明:在MM-SGC培养基中,本源菌F.spp.NF01生长液呈现碱性,菌液含煤时pH值达9.41,0.5 g褐煤可被生长6 d的气生菌丝溶解,且褐煤的降(溶)解率随pH值升高而增大;本源菌F.spp.NF01作用后的残煤,表面离散颗粒更小,粗糙和裂隙度更大,芳环侧链基团、醚键、芳香族CC、脂肪族—CH2—和—CH3—吸收峰强度减弱,自由基浓度Ng、朗德因子g值和线宽ΔH明显增大。说明本源菌F.spp.NF01可以降(溶)解褐煤,使其形貌和结构改变,产生的碱性物质参与了褐煤的降(溶)解。该研究为本源菌降解褐煤的微观结构研究起到积极地促进作用。关键词:褐煤;生物降解;表面形貌;官能团;自由基;本源菌;镰刀菌中图分类号:TD 989
文献标志码:A
文章编号:1672-9315(2021)05-0836-09
DOI:10.13800/j.cnki.xakjdxxb.2021.0510开放科学(资源服务)标识码(OSID):
Research on biological characteristics and microstructure
of lignite degradation by indigenous microorganism
NIU Xian1,2,NIU Yu3,SUO Yonglu1
(1.College of Energy Science and Engineering,Xian University of Science and Technology,Xian 710054,China;
2.School of Mining and Technology,Inner Mongolia University of Technology,Hohhot 010051,China;
3.School of Electric Power,Civil Engineering and Architecture,Shanxi University,Taiyuan 030006,China)
Abstract:Screening indigenous microorganism to explore lignite degrading capacity is an efficient way to examine in-situ biotransformation of lignite.An indigenous fungus was obtained by means of in-situ sampling,enrichment culture,purification and isolation,which was identified as Fusarium(F.spp.NF01)from morphological observation and ITS sequencing.The biological characteristics of indigenous F.spp.NF01 were studied based on strain growth curves,pH-t curves and degradation/dissolution experiment of lignite,and scanning electron microscopy,fourier transform infrared spectroscopy and electron paramagnetic resonance were used to analyze the surface morphology,functional groups and free radicals of the residual coal.The results showed that in MM-SGC medium,the growth solution of indigenous F.spp.NF01 was alkaline,and the pH value was up to 9.41 with the growth liquid containing lignite.0.5 g lignite was dissolved by aerial hyphae grown for 6 days,and the degradation/dissolution rate of lignite promoted with the increase of pH value.With indigenous F.spp.NF01 acted on the pretreatment lignite sample,the surface discrete particles of the residual coal
became smaller,accompanied by greater roughness and crack structures,the intensity of the aromatic ring side chain groups,ether bonds,aromatic CC,aliphatic —CH2— and —CH3— absorption peak was weakened,and the concentration of free radical Ng,Landé g-factor and line width ΔH were significantly increased.This indicates that indigenous F.spp.NF01 can degrade/dissolve the lignite to change its morphology and structure.Alkaline substances secreted by F.spp.NF01 are involved in lignite degradation/dissolution.
The research will provide a guidance for the study of the microstructure of lignite degradation by indigenous microorganism.
Key words:lignite;biodegradation;surface morphology;functional groups;free radicals;indigenous microorganism;Fusarium
0 引 言
褐煤占中国煤炭总储量的13%以上,已探明可采储量约1 300亿t[1]。然而,环境污染大和应用价值低的現状严重制约了褐煤产业的发展[2-3]。褐煤的微生物降解转化技术以其环境友好、反应温和、成本低廉、产物用途广等优势[4],已成为当前研究热点。自20世纪80年代以来,德国FAKOUSSA和美国COHEN分别报道了真菌可以在煤上生长并将其转化为黑色水溶物[5-6]。此后,大量学者集中于煤种、菌种、机理和产物等4个方面的研究。在煤种方面,SCOTT等指出煤种和煤样的氧化预处理会影响真菌类对其的溶解性,氧化程度高的煤易被降解[7];也有学者利用光-氧氧化、过氧化氢、硝酸、氢氧化钠和紫外光照等氧化预处理方法,都不同程度的使煤炭的生物降(溶)解率得到了提高[8-12]。在菌种和机理方面,STRANDBERG等报道了外源放线菌能够产生胞外碱性物质溶解煤炭,生成黑色液体,而且溶解度随pH值的升高而增大[13]。QUIGLEY等评价了9种外源微生物对煤炭的降解情况,并发现胞外碱性产物是煤样降解的原因[14];RALPH等系统的研究了外源真菌黄孢原毛平革菌,证实了其分泌的氧化酶(木质素过氧化酶、锰过氧化酶、漆酶)能够降解煤中部分大分子[15];COHEN等研究外源担子菌云芝的溶煤活性,发现产生草酸能够螯合煤中多价金属离子[16];袁红莉等发现了具有降解褐煤的外源斜卧青霉菌,并证实了分泌的酯酶对褐煤有解聚作用[17-18]。在产物方面,主要研究了产物组成、产物结构、溶解度、分子量、酸沉淀性质、吸光度、蛋白质含量、发热量以及产物应用领域等[19-21]。以上研究中学者们更多地关注于外源菌,忽略了外源菌很难适应原位复杂的煤层环境而存活,其高效的降解性无法实现的问题。以原位褐煤中筛选本源菌为切入点,研究了本源菌F.spp.NF01生长曲线、pH-t曲线和固液态降(溶)解褐煤的生理学特性,表征了菌株降解后残煤的形貌、官能团、自由基,旨在补充原位煤层中本源菌降(溶)解褐煤方面的数据,为推进本源菌对褐煤降解特性研究发展起到积极作用。
1 材料与方法
1.1 煤样筛选本源菌株的褐煤煤样采集于内蒙古自治区赤峰市元宝山煤田的6家煤矿西二采区北三段6-8工作面。先用灭菌取样铲铲去工作面已裸露煤炭,然后利用灭菌取样器(1 000 mm×25 mm)快速插入新揭露的煤壁取样,装入无菌袋密封,4 ℃保温箱运输,如图1所示。其中,取样器常被用做土壤和粮食取样。原煤样采集于地面煤场不同方位的褐煤,用编织袋密封保存。利用颚式破碎机和密封式制样粉碎机逐步粉碎,并用SDNS 200a标准振筛机筛分成粒径200目(0.074 mm)颗粒。预处理煤样是按1 g煤与10 mL 1 mol/L NaOH的比例混合,48 h后抽滤洗涤至中性,烘干,牛皮纸包好备用。
1.2 真菌的分离与鉴定方法
1.2.1 真菌的分离方法基本培养基MM:3 g/L KH2PO4,1.5 g/L MgSO4·7H2O,1 g/L(NH)2SO4,0.1 mg/L FeSO4·7H2O,0.2 mg/L CuSO4·5H2O,0.68 mg/L ZnSO4,pH调至中性,配固体培养基加1.5% Agar。G为10 g/L葡萄糖;M为10 g/L麦芽糖;SGC为10 g/L葡萄糖酸钠。在超净工作台中,将筛选本源菌的褐煤煤样加入灭菌的100 mL MM-GM(基本培养基加入G和M的碳源)培养液中,28 ℃150 rpm,富集培养3 d。将富集菌液1 mL转接到100 mL MM-GM培养液且加有1 g灭菌的原煤样中,筛选7 d,再经多次富集培养和平板分离,得到一株真菌NF01,并用20%甘油-70 ℃保存。
1.2.2 真菌的鉴定方法 真菌NF01通过平板培养和扫描电镜的形态学观测,结合ITS测序,完成菌种的鉴定。其中,扫描电镜样品的制备如下
1)灭菌盖玻片45°插入固体培养基,让菌株爬片生长;
2)取长有菌丝的盖玻片,2.5%戊二醛4 ℃固定48 h;
3)磷酸缓冲液(pBS)漂洗3次,以30%,50%,70%,80%,90%,100%Ⅰ,100%Ⅱ浓度的乙醇梯度脱水,15 min/次;
4)75%叔丁醇,100%叔丁醇各15 min;置冰箱冷冻室固化,抽真空干燥,喷金观察。测序步骤如下1)刮取培养7 d的平板上菌丝50 mg,液氮研磨后转移至EP管中,利用试剂盒SK8259对真菌基因组DNA抽提;2)凝胶电泳检测抽提DNA是否成功;3)采用通用引物ITS1和ITS4对菌株的DNA进行PCR扩增,反应条件为95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,扩增35个循环,最后72 ℃延伸10 min;
4)取PCR扩增产物5 μL用2%琼脂糖凝胶电泳检测,判断扩增是否成功;5)将菌株ITS序列通过NCBI数据库的BLAST进行同源性序列比对,得到相关的同源性菌株信息。
1.3 真菌NF01的特性分析
1.3.1 真菌NF01的生长曲线 在超净工作台中,将1 mL真菌NF01的菌液量分别转接到24瓶装有灭菌的100 mL MM-SGC培养液烧瓶中,28 ℃150 rpm摇床培育8 d。每24 h,取出3个烧瓶,离心,洗涤,收集菌丝,烘干,称取菌丝干重。
1.3.2 真菌NF01生长液的pH值 在超净工作台中,将1 mL真菌NF01的菌液量分别转接到3瓶MM-SGC(100 mL)培养液中,28 ℃150 rpm摇床培养8 d。空白组MM-SGC(100 mL/瓶,共3瓶)为不接真菌。每天分别取3 mL菌液,离心,吸取上清液置于试管,用赛多利斯PB-10检测仪测pH值。
1.3.3 真菌NF01降(溶)解褐煤 在超净工作台中,将真菌NF01接种到MM-SGC固体培养基上,28 ℃恒温避光培养3 d。3 d后,将灭菌的原煤样(0.5±0.000 5 g,200目)和预处理煤样(0.5±0.000 5 g,200目)置于固体培养基菌丝上,观察褐煤的溶解情况。
1.3.4 真菌NF01的褐煤降(溶)解率 配置100 mL MM-SGC培养液18瓶,9瓶/组,共2组。第1组接种1 mL真菌NF01的菌液和添加预处理褐煤,第2组不接种菌液仅添加预处理褐煤,28 ℃150 rpm摇床培育。每组在第3天、第5天、第7天分别取出3瓶,测pH值,离心,多次洗涤,收集褐煤,烘干,称取干重,利用如下公式计算褐煤降(溶)解率。
Lbr=M0-M1M0×100%
式中
Lbr为褐煤生物降(溶)解率,%;M0为降(溶)解前褐煤质量,m;m1为降(溶)解后的褐煤质量,m。
1.4 真菌NF01降解褐煤的表征配置100 mL MM-SGC培养液6瓶,3瓶/组,共2组。第1组中分别接种真菌NF01且加入1.0±0.000 5 g灭菌的预处理褐煤,记“Ⅰ-残煤”代表;第2组中不接种真菌NF01,但分别加入1.0±0.000 5 g灭菌的预处理褐煤,记“Ⅱ-残煤”代表。在28 ℃150 rpm摇床中,培养7 d,离心,洗涤3次,收集残煤,烘干备测。
1.4.1 褐煤的形貌 用扫描电镜JSM-7900F对原煤样、Ⅰ-残煤和Ⅱ-残煤进行测试,分析煤样降解前后形貌变化特征。样品先干燥30 min,然后用导电胶粘附样品在检测台上,喷金10 s,放大10倍-500 000倍,加速电压0.01~30 kV。
1.4.2 褐煤的红外光谱 利用红外光谱Nicolet iS50对原煤样、Ⅰ-残煤和Ⅱ-残煤煤样官能团进行测定分析。先将测试样品和溴化钾真空干燥,分别取煤样各1 mg与100 mg纯KBr研细混合,研磨到粒度小于2 μm,HY-12型粉末压片机压成透明薄片。光谱仪分
辨率4 cm-1,扫描32次,测定范围4 000~400 cm-1。
1.4.3 褐煤的自由基 用电子顺磁共振EMXPLUS10/12对原煤样、Ⅰ-残煤和Ⅱ-残煤煤样进行自由基测定,分析自由基浓度Ng、朗德因子g值和线宽ΔH参数。微波频率分别为9 839,9 837和9 843 MHz,微波功率0.2 mW,中心磁场351 mT,扫描宽度10 mT,调制频率100 kHz,调制振幅0.1 mT,时间常数0.01 ms,扫描60 s。
2 结果与讨论
2.1 真菌鉴定从图2可以看出,真菌NF01培养3 d后,菌落直径2.5~3.1 cm,气生菌丝为白色絮状、无隔透明、质密突起。小型分生孢子为单生,无隔,数量多,形态多为卵形、椭圆形,大小2.67-7.55×0.89-1.83 μm;大型分生孢子散生于气生菌丝上,数量少,无隔,形状多为长筒形,大小8.33-12.5×1.66-2.5 μm;产孢细胞类型为简单瓶梗。
真菌NF01测定的ITS序列519 bq已录入NCBI GenBank数据库,登录号MN822700。通过BLAST进行相似性比对,发现Fusarium proliferatum(MK226301.1,MK226291.1,MK020694.1)、Fusarium sp(MK250069.1,MH050788.1,MH511574.1)、Fusarium fujikuroi(MK166052.1,MH911404.1,MH282573.1)和Fusarium verticillioides(MF882928.1)相似度均为100%,鉴定属于镰刀菌属。
根据菌株形态学特征,检索《真菌鉴定手册》《中国大型真菌》中描述各种真菌的形态,结合测序鉴定结果,菌株NF01属于镰刀菌属(Fusarium spp NF01)。镰刀菌环境适应能力很强,严寒的北极和炎热的沙漠中都有发现,并且据已有研究,其具有降(溶)解褐煤[22]和去除挥发性有机化合物及多环芳烃的能力[23]。在原位煤层中发现镰刀菌,说明其具备适应原位复杂煤层环境的优势,为褐煤的本源菌降解研究起到重要意义。
2.2
F.spp.NF01生长曲线、pH-t曲线及降(溶)解褐煤实验从图3可以看出,在生长曲线中,前3天的真菌F.spp.NF01生长为对数生长期,第3天的菌体干重达到了0.142 g峰值,从第4天开始,菌株生长进入相对平稳期。在pH-t曲线(有菌)中,随着真菌F.spp.NF01生长,pH值逐渐增大,菌液呈现出碱性。第3天菌液pH值相对于最初pH值,增长率达到了25.1%,从第4天开始,pH值增幅相对平缓,最大pH值为第7天的9.28;而pH-t曲线(无菌)的空白组,pH均值为6.92,变化不大,菌液仍显中性。这说明生长于MM-SGC培养液的真菌F.spp.NF01能够分泌碱性物质,使菌液呈现出碱性环境。
从图4可知,煤粉在放置菌丝上培养3 d后,左侧预处理煤粉出现了黑色液滴,0.5 g煤粉完全被降(溶)解,而右側原煤粉没发现黑色液滴,未被降(溶)解。这说明6家煤矿褐煤可以通过预处理实现F.spp.NF01菌丝的降(溶)解,预处理破坏了褐煤结构使菌株更容易降(溶)解褐煤。
從表1可知,第1组中,第3天含煤菌液的pH值7.2增至7.87,褐煤的降(溶)解率是7.46%,第5天,随着pH值逐渐增大,褐煤降(溶)解率也逐渐增大,达到18.14%,第7天,pH值达到9.41,较最初pH值7.2,增幅30.7%,降(溶)解率也增至27.9%。第2组中,pH值没有变化,呈现中性,褐煤只有少量减少。相对于无煤的生长液pH值,有煤菌液前3天pH值增幅不大,但第7天pH值则有较高增幅。说明在菌株生长前期,褐煤的存在对菌液pH值增加有抑制,生长后期,有促进作用。经数据分析发现,真菌F.spp.NF01生长在含褐煤的MM-SGC培养液中能够使菌液呈现碱性环境,伴随着菌液pH值的升高,褐煤降(溶)解率也逐渐增大,褐煤降(溶)解率与菌液pH值存在正
相关性。碱性的生长液使褐煤表面的酸性基团离子化,如褐煤中含有可溶于碱液内的腐殖酸[13-14],从而改变褐煤的亲水性,提高降(溶)解率。因此,菌株产生的碱性物质参与了褐煤的降(溶)解。
2.3 褐煤的表面形貌
从图5(a)和图5(b)可知,原煤样表面形貌相对平整,经无菌培养液摇床7 d后的NaOH预处理煤样(Ⅱ-残煤)表面离散颗粒增多,且变得起伏粗糙。而有菌株作用的煤样(Ⅰ-残煤)表面颗粒变得更小,起伏更大,且出现了较多的裂隙结构,如图5(c)所示。这说明相对于原煤样和无菌株作用的预处理煤样,有菌株作用的预处理煤样表面形貌变化更大,煤样表面形貌的改变与真菌F.spp.NF01的参与有关。
2.4 褐煤的红外光谱从图6可以看出,虚垂线标记的11处原煤样、Ⅰ-残煤和Ⅱ-残煤煤样红外光谱的吸收峰强度和峰形有明显的差异。褐煤官能团的红外吸收峰频率特征,见表2。
其中,波数3 441.4 cm-1是羟基—OH的伸缩振动,相对于原煤样,Ⅰ-残煤和Ⅱ-残煤煤样吸收峰强度要更大,这可能与NaOH预处理后,缔合的羟基(醇羟基和酚羟基)增多有关。波数2 922.7,2 851.7 cm-1为脂肪族—CH2—,—CH3,伸缩振动,相比于原煤样和Ⅱ-残煤,Ⅰ-残煤吸收峰强度更弱,这说明是菌株作用褐煤过程中,使其亚甲基和甲基官能团减少。波数1 620.9,1 447.3,1 109.3 cm-1分别是芳香族CC骨架振动、苯环骨架的振动和醚、酯、醇键的伸缩振动,相比于其它,Ⅰ-残煤特征峰峰距更小,强度更低。振动的减弱说明菌株F.spp.NF01作用于褐煤解聚,使波数处的官能团减少。相比其它煤样,Ⅰ-残煤791.6,702 cm-1波数处的芳环C—C和C—H键面外伸缩振动强度明显减弱,说明Ⅰ-残煤煤样中芳环侧链基团减少,该菌株作用使芳环的侧链断裂,生成了简单的芳香族化合物。还有Ⅰ-残煤540,473 cm-1处波数的减弱,说明该菌株作用于褐煤过程中,解聚了高岭石、蒙脱石、伊利石等官能团。
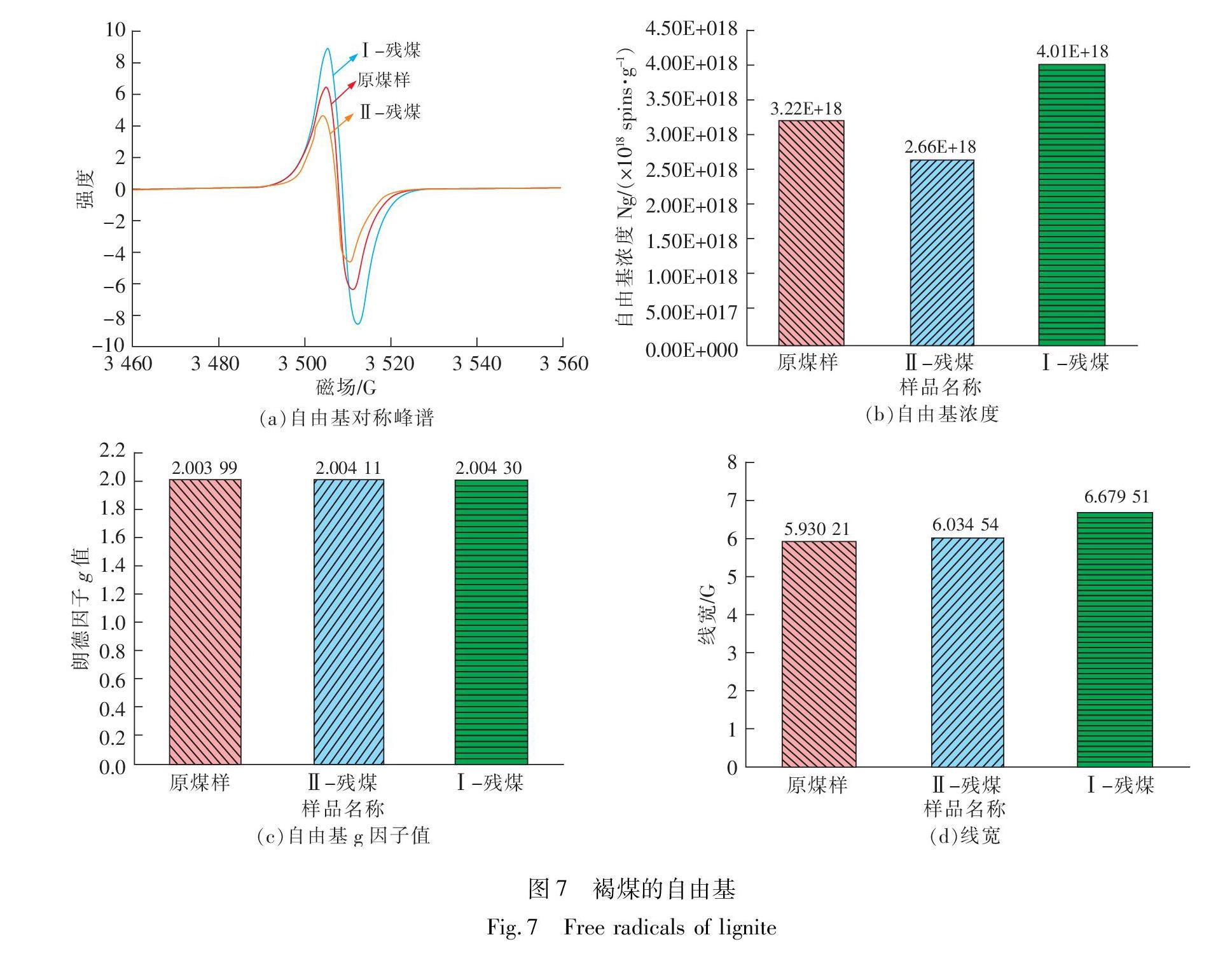
2.5 褐煤的自由基从图7(a)和图7(b)所知,Ⅱ-残煤、原煤样和Ⅰ-残煤的EPR波谱对称性峰和自由基浓度依次增大。相比于原煤样,Ⅱ-残煤自由基浓度减少,说明预处理过程中自由基活性位点逐渐减少。在红外光谱中,Ⅱ-残煤羟基官能团的增多,可能与自由基位点被含氧官能团消耗有关。而对于原煤样和Ⅱ-残煤,菌株作用后的Ⅰ-残煤,自由基浓度增大,说明菌株作用过程中发生了褐煤结构的改变,使其结构中的弱键断裂并张开,以及芳香族结构单元间桥键和侧链的断裂,使小分子自由基含量逐渐增加,自由基浓度升高。从图7(c)可以看出,相比于原煤样,Ⅱ-残煤朗德因子g值增大可能与煤中含有的自由基种类、杂原子等有关。而对于原煤样和Ⅱ-残煤,Ⅰ-残煤自由基g值的增大可能是产生较多小分子自由基中的杂质成分有关,如氮、硫和一些金属自由基。因为g值是表征分子内部结构特征的量,代表着不同的自由基种类。已有研究可知,碳原子为中心的自由基g值较小,过氧化、含硫类及金属离子络合物自由基g值偏大[30-31]。PETRAKIS研究了自由基g值,并总结出含氮自由基g为2.003 1,含硫自由基g为
2.008 0~2.008 1,这些杂原子自由基对g值有影响[32]。这与高阶煤(无烟煤)含杂原子少,g值偏小的结果相一致。从图7(d)可知,Ⅰ-残煤煤样谱线宽明显偏大,相对于Ⅱ-残煤和原煤样。这说明该菌株作用褐煤过程中,形成了大量小分子自由基,电子自旋减弱,弛豫时间缩短,导致谱线宽度逐渐增大。
3 结 论
1)原位煤层中分离得到一株真菌,通过形态学特征和ITS测序鉴定,菌株为镰刀菌属。菌株F.spp.NF01分离与鉴定进一步丰富了降解褐煤的本源菌库,为褐煤的生物降解研究提供了有价值的菌属信息。2)F.spp.NF01生长于MM-SGC培养液中呈现碱性,pH值最高达9.41,生长6 d的菌丝可完全降(溶)解0.5 g预处理褐煤,且预处理褐煤的降(溶)解率,随着含煤菌液pH值的升高而增大。菌株产生的碱性物质参与了褐煤的降(溶)解。分析得到的生物学特征结果是剖析碱作用机理的重要数据,将为揭示碱作用机理研究起到积极作用。
3)褐煤的表征说明了F.spp.NF01可以降解预处理褐煤,使其表面形貌、官能团和自由基发生改变。在形貌上,表面变得更加粗糙,结构增多。在官能团上,芳环侧链基团、醚键、碳碳双键、脂肪族甲基和亚甲基等官能团吸收峰强度减弱。在自由基上,自由基浓度、朗德因子g值和线宽ΔH增大。残煤微观结构表征丰富了褐煤生物降解产物的研究,推进了降解产物的增值研究工作。
参考文献(References):
[1] JIANG F,LI Z H,LV Z W,et al.The biosolubilization of lignite by bacillus sp y7 and characterization of the soluble products[J].Fuel,2013,103:639-645.
[2]FENG X,CHENG Z,PENG T,et al.Experimental study of the physicochemical structure and moisture readsorption characteristics of zhaotong lignite after hydrothermal and thermal upgrading[J].Fuel,2016,185:112-121.
[3]TAHMASEBI A,YU J,HAN Y,et al.A kinetic study of microwave and fluidized-bed drying of a chinese lignite[J].Chemical Engineering Research & Design,2014,92(1):54-65.
[4]谢和平,王金华,王国法,等.煤炭革命新理念与煤炭科技发展构想[J].煤炭学报,2018,43(5):1187-1197.
XIE Heping,WANG Jinhua,WANG Guofa,et al.New ideas of coal revolution and layout of coal science and technology development[J].Journal of China Coal Society,2018,43(5):1187-1197.
[5]FAKOUSSA R M.Coal as a substrate for microorganisms:Investigation with microbial conversion of national coals
[D].Bonn:Friedrich Wilhelms University,1981.
[6]COHEN M S,GABRIELE P D.Degradation of coal by the fungi polyporus versicolor and poria monticola[J].Applied & Environmental Microbiology,1982,44(1):23-27.
[7]SCOTT C D,STRANDBERG G W,LEWIS S N.Microbial solubilization of coal[J].Biotechnology Progress,1986,2(3):131-139.
[8]李建濤,刘向荣,皮淑颖,等.煤的微生物转化研究进展[J].西安科技大学学报,2017,37(1):106-120.
LI Jiantao,LIU Xiangrong,PI Shuying,et al.Research and development of coal bioconversion[J].Journal of Xian University of Science and Technology,2017,37(1):106-120.
[9]HLKER U,FAKOUSSA R M,HFER M.Growth substrates control the ability of fusarium oxysporumto solubilize low-rank coal[J].Applied Microbiology & Biotechnology,1995,44(3):351-355.
[10]MACHNIKOWSKA H,PAWELEC K,PODGRSKA A.Microbial degradation of low rank coals[J].Fuel Processing Technology,2002,77-78:17-23.
[11]ACHI O K,EMERUWA A C.Influence of cultural conditions on coal solubilization by penicillium-simplicissimum[J].Journal of Chemical Technology and Biotechnology,1993,57(2):121-125.
[12]徐敬尧.煤炭生物降解转化新菌种基因工程的构建研究[D].合肥:安徽理工大学,2009.XU Jingyao.Study on modified new culture genetic engineering in biotransformation of the coal[D].Hefei:Anhui University of Science and Technology,2009.
[13]STRANDBERG G W,LEWIS S N.Solubilization of coal by an extracellular product from streptomyces setonii 75vi2[J].Journal of Industrial Microbiology,1987,1(6):371-375.
[14]QUIGLEY D R,WARD B,CRAWFORD D L,et al.Evidence that microbially produced alkaline materials are involved in coal biosolubilization[J].Applied Biochemistry & Biotechnology,1989,20-21(1):753-763.
[15]RALPH J P,CATCHESIDE D E A.Depolymerisation of macromolecules from morwell brown coal by mesophilic and thermotolerant aerobic microorganisms[J].Fuel Processing Technology,1994,40(2):193-203.
[16]COHEN M S,FELDMAN K A,BROWN C S,et al.Isolation and identification of the coal-solubilizing agent produced by trametes versicolor[J].Applied & Environmental Microbiology,1990,56(11):3285-3291.
[17]YUAN H,YANG J,CHEN W.Production of alkaline materials,surfactants and enzymes by penicillium decumbens strain p6 in association with lignite degradation/solubilization[J].Fuel,2006,85(10):1378-1382.
[18]YANG Y,YANG J,LI B,et al.An esterase from penicillium decumbens p6 involved in lignite depolymerization[J].Fuel,2018,214:416-422.
[19]岳子林,劉向荣,赵顺省,等.微生物溶解内蒙古褐煤影响因素及产物分析[J].西安科技大学学报,2017,37(2):251-259.
YUE Zilin,LIU Xiangrong,ZHAO Shunsheng,et.al.Influential factors and products of biosolubilization of Inner Mongolia lignite[J].Journal of Xian University of Science and Technology,2017,37(2):251-259.
[20]石开仪.白腐真菌Hypocrea lixii AH对抚顺长焰煤及其模型化合物生物液化机理研究
[D].北京:中国矿业大学,2011.
SHI Kaiyi.Research on mechanisms of bio-liquefaction of fushun long flame coal and its model compounds by white rot fungi Hypocrea lixii AH
[D].Beijing:China University of Mining and Technology,2011.
[21]XIAO L,LI Y Y,LIAO Y S,et al.Bioconversion of lignite humic acid by white-rot fungi and characterization of products[J].3 Biotech,2018,8(5):1-6.
[22]KWIATOS N,JEDRZEJCZAK-KRZEPKOWSKA M,ST-RZELECKI B,et al.Improvement of efficiency of brown coal biosolubilization by novel recombinant fusarium oxysporum laccase[J].Amb Express,2018,8:1-9.
[23]VERGARA-FERNANDE A,YANEZ D,MORALES P,et al.Biofiltration of benzo alpha pyrene,toluene and formaldehyde in air by a consortium of rhodococcus erythropolis and fusarium solani:Effect of inlet loads,gas flow and temperature[J].Chemical Engineering Journal,2018,332:702-710.
[24]ALVAREZ R,CLEMENTE C,GOMEZ-LIMON D.The influence of nitric acid oxidation of low rank coal and its impact on coal structure[J].Fuel,2003,82(15-17):2007-2015.
[25]HE X Q,LIU X F,NIE B S,et al.Ftir and raman spectroscopy characterization of functional groups in various rank coals[J].Fuel,2017,206:555-563.
[26]WANG S Q,TANG Y G,SCHOBERT H H,et al.Ftir and c-13 nmr investigation of coal component of late permian coals from southern China[J].Energy & Fuels,2011,25(12):5672-5677.
[27]BASARAN Y,DENIZLI A,SAKINTUNA B,et al.Bio-liquefaction/solubilization of low-rank turkish lignites and characterization of the products[J].Energy & Fuels,2003,17(4):1068-1074.
[28]刘洁.褐煤中易分离/热解组分的解析及褐煤大分子结构模型的构建
[D].徐州:中國矿业大学,2019.
LIU Jie.Analysis of easy separation/pyrolysis components in lignite and construction of lignite macromolecular structure model
[D].Xuzhou:China University of Mining and Technology,2019.
[29]LIU Z Q,WEI X Y,LIU F J,et al.Temperature-controlled hydrogenation of anthracene over nickel nanoparticles supported on attapulgite powder[J].Fuel,2018,223:222-229.
[30]位爱竹.煤炭自燃自由基反应机理的实验研究
[D].徐州:中国矿业大学,2008.
WEI Aizhu.Experimental study on free radical reaction mechanism of coal spontaneous combustion
[D].Xuzhou:China University of Mining and Technology,2008.
[31]LI Y H,ZHAO H Y,SONG Q,et al.Influence of critical moisture content in lignite dried by two methods on its physicochemical properties during oxidation at low temperature[J].Fuel,2018,211:27-37.
[32]PILAWA B,WIECKOWSKI A B,LEWANDOWSKI M,et al.Epr studies of interactions between paramagnetic centres of exinite,vitrinite and inertinite during thermal decomposition[J].Fuel,1997,76(1):79-83.
