酶法辅助聚乙二醇-200 提取野菊花中绿原酸的工艺及数学模型分析
2021-10-14方小军彭敏娟
刘 霞,方小军,彭敏娟
(赣南医学院 药学院,江西 赣州 341000)
野菊花(Chrysanthemumindicum)为多年生草本植物,多在秋冬时节初开,体轻,气芳香[1]。具有降压、保护心血管系统、抗消化性溃疡、抗病毒等药理作用[2-4]。
目前关于野菊花中绿原酸的提取研究多集中于不同提取工艺的优化,主要为超声法[5]、水浴提取法[6]及超声-微波协同萃取法[7]等。但这些方法不仅成本高、耗时长、溶剂耗量大且提取率低。聚乙二醇(PEG)是一种成本较低、非挥发性且性质比较稳定的环境友好型溶剂[8-9]。纤维素酶能温和有效地降解植物细胞壁,加速活性成分溶出,从而提高提取效果[10]。采用酶法辅助PEG-200 提取野菊花中绿原酸,并对其绿原酸提取过程进行数学模型的研究尚未见报道。本试验以野菊花为原材料,采用酶法辅助PEG-200 超声提取法,用Box- Benhnken 中心组合设计优化提取工艺,并建立了不同液固比下绿原酸提取的数学模型,从而为野菊花资源的进一步开发利用提供技术依据。
1 材料与方法
1.1 试验材料
野菊花药材:市售;纤维素酶(5×104u/g):江苏锐阳生物科技有限公司;绿原酸对照品:天津一方科技有限公司;其他试剂均为分析纯。
SPECORD 50 PLUS 型紫外分光光谱仪:德国耶拿分析仪器股份公司;KQ-500DB 数控超声波清洗器:昆山市超声仪器有限公司;Hei-VAP Value Digital G3 旋转蒸发仪:德祥Tengent;SHA-C 数显水浴恒温振荡器:金坛市白塔新宝仪器厂;PB-10 酸度计:赛多利斯科学仪器有限公司。
1.2 试验方法
1.2.1 标准曲线的绘制
参照文献[11]绿原酸标准曲线测定方法,精密称取10.16 mg 绿原酸标准品于100 mL 容量瓶中,并用体积分数为30% PEG-200 溶解稀释至刻度,即得101.6 μg/mL 的绿原酸标准溶液。分别准确吸取0、0.3、0.6、0.9、1.2 和1.5 mL 上述标准液,用体积分数为30% PEG-200 稀释并定容至10 mL,即得0、3.12、6.23、9.35、12.47 和15.59 μg/mL系列工作液。在最大吸收波长329 nm 处测定吸光度。以吸光度A329为纵坐标、绿原酸质量浓度C为横坐标,绘制标准曲线,得到标准曲线方程A=0.051C+0.003 9(R2=0.999 8)。
1.2.2 野菊花绿原酸的提取
野菊花→烘干→粉碎→过筛→溶解(体积分数为30%的PEG-200)→调节pH→酶解→超声提取→趁热过滤→滤液减压浓缩→定容
1.2.3 绿原酸提取率测定
将上述提取液按一定比例稀释后,以 30%PEG-200 为参比,按照1.2.1 的方法测定A 值,并计算绿原酸提取率。
1.2.4 绿原酸提取工艺优化设计
通过单因素试验考察酶用量、超声温度、液固比、酶解温度及酶解时间对野菊花绿原酸提取率的影响。其中超声温度对绿原酸提取率影响不大,拟固定超声温度为 50 ℃。利用 Design Expert8.0.6 软件进行响应面优化试验方案设计,各因素水平见表1。
1.3 数据分析
响应面优化设计采用Design Expert8.0.6 软件进行了试验设计与数据分析,数学模型拟合采用Origin Pro 8.0 数据处理软件。
2 结果与分析
2.1 单因素试验
2.1.1 酶用量对绿原酸提取率的影响
由图1 可知,在酶用量0%~1.2%时,绿原酸提取率急剧上升;在酶用量为1.2%时绿原酸提取率达到最大值,随后提取率开始缓缓下降。这是因为随着酶用量的增加,酶与底物接触机会增大,酶解反应速率加快;后续增加酶用量,会导致反应系统中底物浓度相对不够,酶促反应速率下降,因而绿原酸浸出率降低[12]。因此最佳实验条件选择纤维素酶用量比例为1.2%。
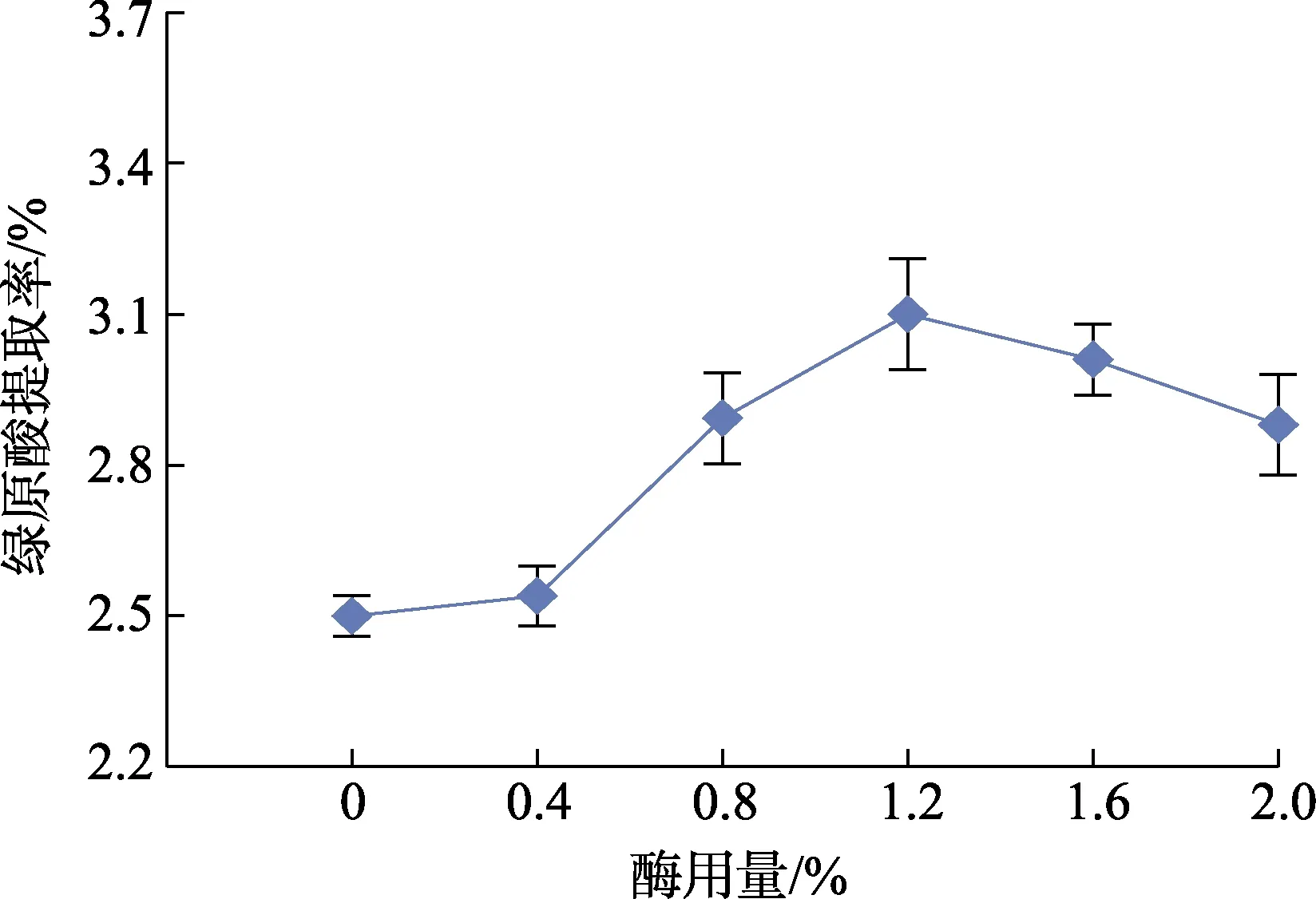
图1 酶用量对绿原酸提取率的影响Fig.1 Effect of enzyme dosage on extraction rate of chlorogenic acid
2.1.2 超声温度对野菊花绿原酸提取率的影响
由图2 得知,超声温度对野菊花绿原酸提取率的影响是一个先逐步上升后缓慢下降的过程,在超声温度为50 ℃时,绿原酸提取率达到最大值3.34%。温度超过50 ℃后,绿原酸因其结构中的不稳定因素而容易被破坏,如酚羟基易被氧化变成醌,酯键容易水解生成羧酸和醇等,致使提取率下降[13]。因此选择50 ℃为最佳超声温度。
2.1.3 液固比对野菊花绿原酸提取率的影响
由图3 可知,液固比从10∶1 增加15∶1 时,绿原酸提取率增加幅度较明显。当液固比超过15∶1 时,绿原酸提取率开始逐步下降。这是因为PEG-200 作为非离子型表面活性剂,可明显降低界面张力,增加细胞膜的渗透性;此外PEG 与水混合后形成胶束,绿原酸的非极性基团可进入胶束内核被增溶,使绿原酸更易溶于水中。而当液固比超过其最佳比后,其他物质也会相应进入胶束内核,占据一定的体积后被增溶[14],使绿原酸的溶出减少,因此,本试验的液固比定为15∶1 为宜。
2.1.4 酶解温度对野菊花绿原酸提取率的影响
由图4 可知,酶解温度对野菊花绿原酸提取率的影响是一个呈先上升后下降的趋势,在酶解温度为50 ℃时,绿原酸提取率达到最大值。这是因为酶的活力在最适温度时水解效率最高,低于该温度,酶活力不足,高于该温度,酶易变性失活。故本试验选择50 ℃为最佳酶解温度。
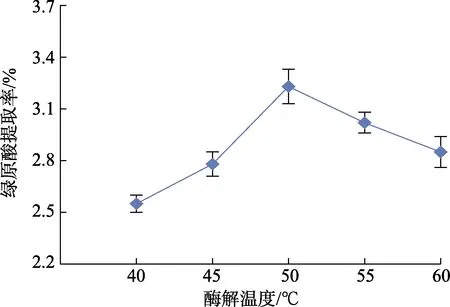
图4 酶解温度对绿原酸提取率的影响Fig.4 Effect of enzymolysis temperature on extraction rate of extraction rate of chlorogenic acid
2.1.5 酶解时间对野菊花绿原酸提取率的影响
由图5 可知,酶解时间在0.5~2 h 之间时,酶解作用时间越长,绿原酸提取率越高,超过2 h后,绿原酸提取率呈下降趋势。这是因为绿原酸结构具有不稳定性,长时间加热会导致部分绿原酸水解或者结构异变[15],因而提取率下降。故本试验最优酶解时间定为2 h。

图5 酶解时间对绿原酸提取率的影响Fig.5 Effect of enzymolysis time on extraction rate of chlorogenic acid
2.2 响应面试验结果
2.2.1 响应面试验结果及方差分析响应面试验设计方案及结果见表 2。利用Design-Expert 8.0.6 软件对表2 中的数据进行回归拟合,得出方差分析表,见表3。

表2 Box-behnken 中心组合试验结果Table 2 Test results of Box-behnken center combination
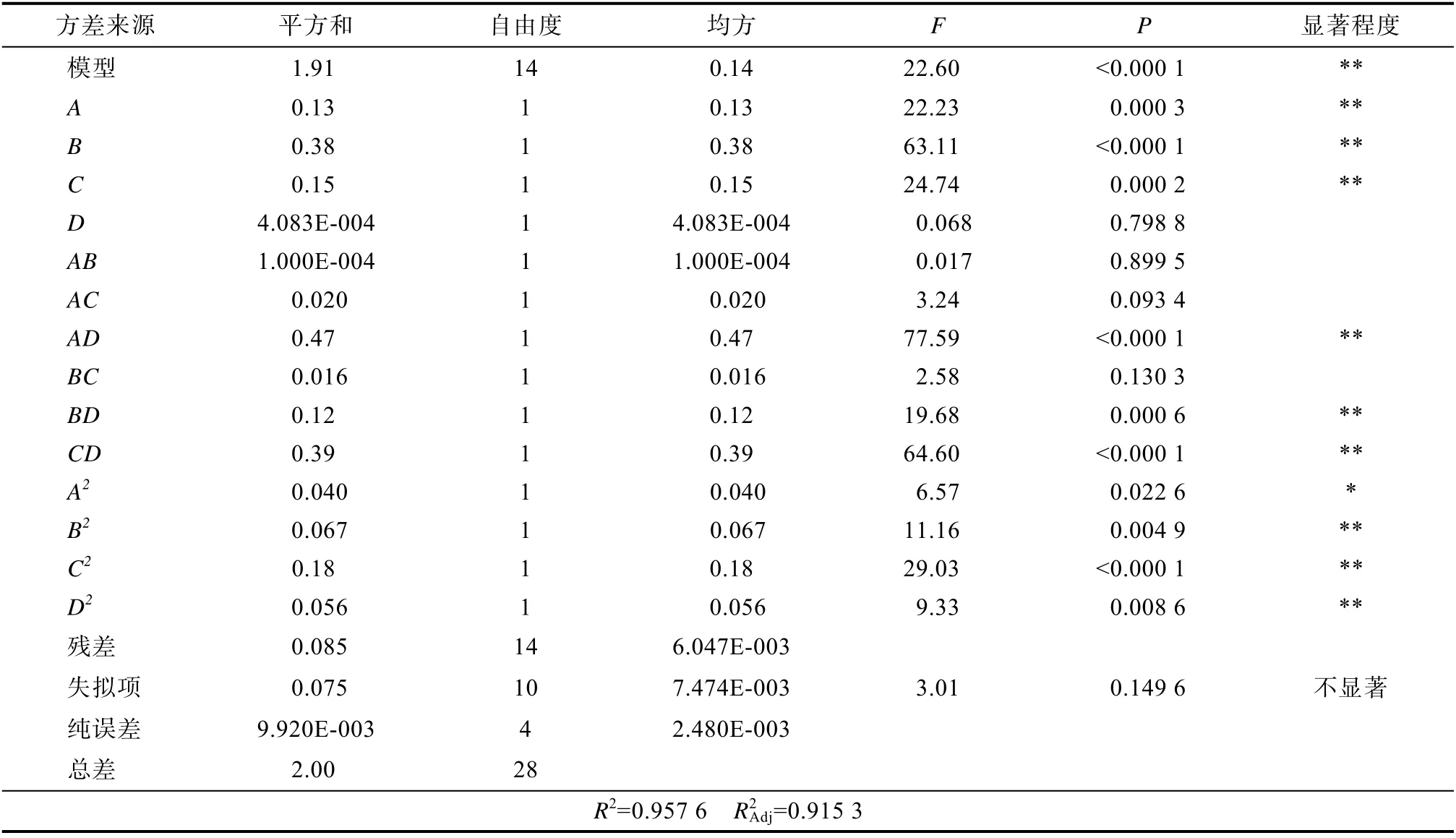
表3 响应面方差分析结果Table 3 Variance analysis results of response surface
得到野菊花中绿原酸提取率(Y)对响应值变量A、B、C和D的回归方程为:
Y=–11.662 8+6.650 8×A+0.148 1×B+0.509 8×C–3.726 3×D–(2.500 0E–003)×A×B–0.035 0×A×C–1.712 5×A×D–(2.500 0E–003)×B×C+0.069 0×B×D+0.125 0×C×D–0.489 1×A2–(4.080 0E–003)×B2–(6.580 0E–003)×C2–0.373 0×D2
由表3 可知,模型的相关系数R2=0.957 6,P<0.01,表明该模型极显著。模型校正系数R2Adj=0.915 3,表明方程对实验拟合良好,可用此数学模型解释91.53%的野菊花中绿原酸提取率的变异性。一次项A、B、C,交互项AD、BD、CD,二次项A2、B2、C2、D2对试验结果影响显著(P<0.05),表明酶用量、液固比和酶解温度对野菊花中绿原酸提取率影响显著,且影响顺序(主→次)为液固比>酶解温度>酶用量。
2.2.2 响应面交互作用分析及最佳提取工艺研究
根据表3 可知,交互项AD、BD、CD的P值均小于0.01,表明酶用量与酶解时间、液固比与酶解时间、酶解温度与酶解时间的交互作用对野菊花中绿原酸提取率的影响达到了极显著的水平。利用回归模型作各试验因素间响应面图如图6 所示。
由Design-Expert 8.0.6 软件进行分析计算得到野菊花绿原酸提取的最佳工艺为:纤维素酶用量0.8%,液固比20∶1(mL∶g),酶解温度55 ℃,酶解时间2.5 h,此时野菊花绿原酸提取率的预测值为4.05%。在此工艺条件下进行3 次验证试验,实际提取率为3.92%,相对误差为3.21%,表明该模型合理可靠,具有有效性。
2.3 野菊花中绿原酸提取的数学分析
2.3.1 野菊花中绿原酸提取数学模型的建立
由图6 可知,液固比对野菊花中绿原酸的提取率有着极其显著的影响,本试验固定酶用量为0.8%和酶解温度为55 ℃,考察不同液固比下绿原酸提取率随酶解时间的变化规律(图7)。

图6 各两因素交互作用对野菊花绿原酸提取率影响的响应面图Fig.6 Response surface diagrams of two factors’ interaction influence on extraction rate of chlorogenic acid from Chrysanthemum indicum
从图7 中可以看出,液固比过大或过小均不利于绿原酸的提取。液固比过大会导致细胞中其他物质与绿原酸竞争其在胶束中的位置,而液固比过小会导致绿原酸尚未完全溶出就已经饱和,因而影响提取率。

图7 液固比、酶解时间与绿原酸提取率的关系Fig.7 The relationship between liquid-solid ratio,enzymolysis time and extraction rate of chlorogenic acid
利用OriginPro 8.0 软件对图7 的实验数据进行模型拟合,结果见表4。表4 中的数据表明:除Logostic 模型外,其余三个模型Sgompertz、Asymptotic1 和Slogistic1均能较好的拟合绿原酸提取过程。其中在液固比为10∶1 时,Asymptotic1 模型的Adj-R2为0.951 67,优于其他三个模型;在液固比为15∶1 和20∶1 时,Slogistic1 模型的拟合参数最佳,为最优拟合模型。Slogistic1 模型在液固比10∶1 条件下提取绿原酸的数学模型数据与Asymptotic1 模型相比差别不大。综合以上数据分析可知Slogistic1 模型更能反映野菊花中绿原酸提取过程的数学规律。
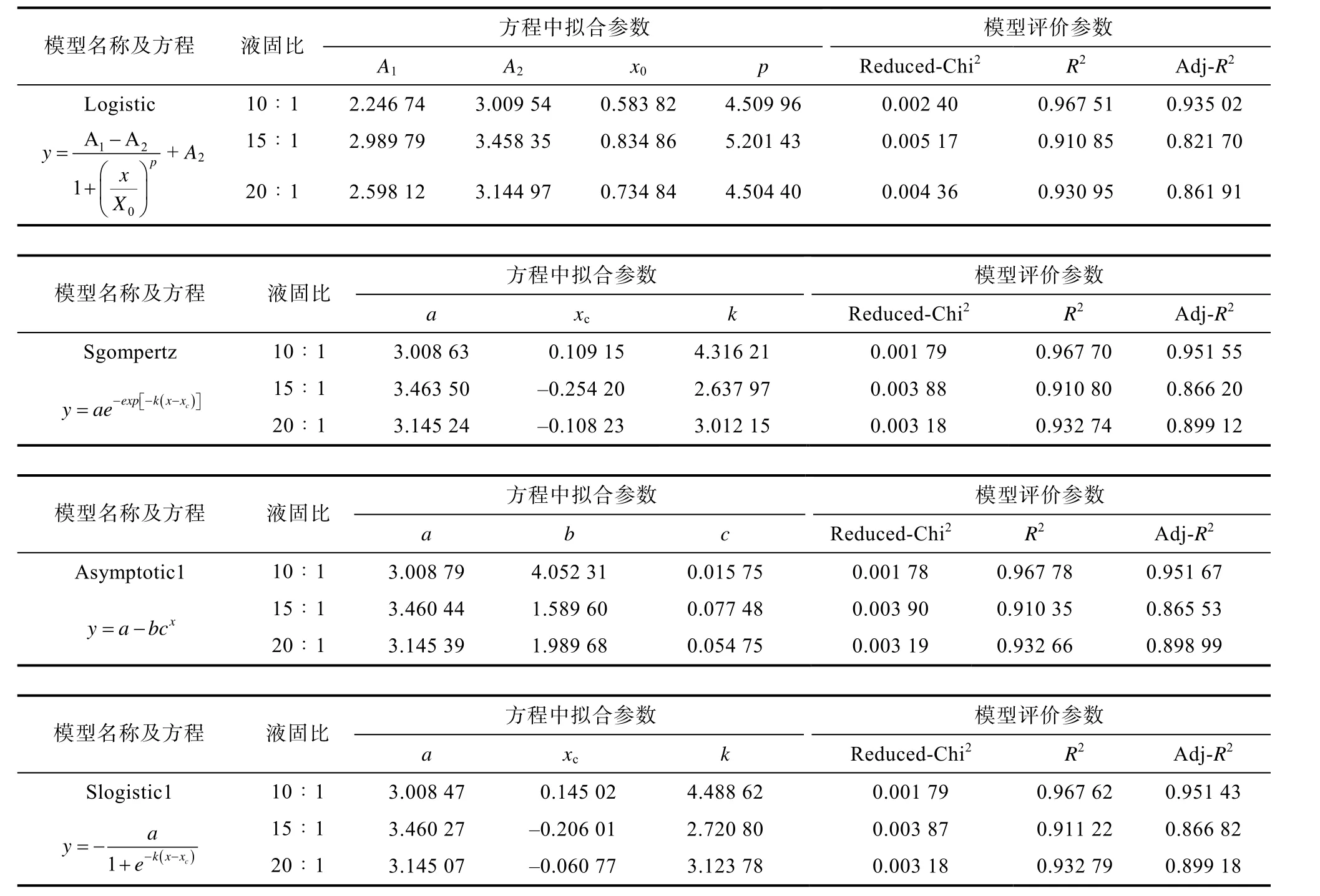
表4 不同液固比下提取模型拟合参数Table 4 Fitting parameters of the extraction model under different liquid-solid ratios
2.3.2 数学模型的验证
为了验证模型的正确性,分别在不同液固比条件下选定两个酶解时间。将实际得到的提取率与预测值进行比较,结果见表5。由表5 可知,实测值与预测值拟合程度高,说明Slogistic1 模型是描述野菊花中绿原酸提取过程的最佳数学模型。
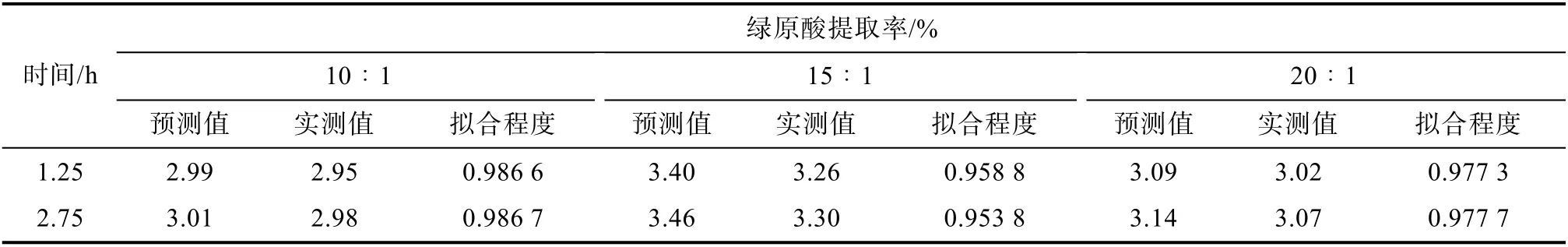
表5 野菊花中绿原酸提取数学模型验证Table 5 Validation of mathematical model for chlorogenic acid extraction from Chrysanthemum indicum
3 结论
通过响应面分析方法的优化,采用酶法辅助PEG-200 提取野菊花中绿原酸的最佳工艺条件为纤维素酶用量0.8%,液固比20∶1(mL∶g),酶解温度55 ℃,酶解时间2.5 h,此时实际提取率为3.92%。对不同液固比下绿原酸提取率随酶解时间的变化规律采用了4 种数学模型进行拟合,结果显示:Slogistic1 模型得到最优拟合,是描述野菊花中绿原酸提取过程的最佳数学模型。
