用于1型糖尿病细胞治疗的胰岛低温保存进展
2021-10-12韩恒鑫占太杰崔梦冬杨加敏
韩恒鑫 占太杰 崔梦冬 杨加敏 陈 亮 胥 义
(上海理工大学医疗器械与食品学院 上海 200093)
1型糖尿病(type 1 diabetes mellitus,T1DM)是一种自身免疫疾病,免疫系统会攻击胰腺中产生胰岛素的β细胞,β细胞大量死亡导致胰岛素分泌不足,从而造成患者血糖调控能力丧失[1]。据国际糖尿病联盟数据,2019年超过110万儿童和青少年患有1型糖尿病[2]。目前,T1DM治疗的主要方法是监测血糖水平,在水平过高时进行胰岛素注射。频繁的胰岛素注射费时费力,且可能会导致严重的并发症,如血管疾病[3]和无意识性低血糖[4]等。
对于T1DM,胰岛移植是十分具有潜力的治疗方法,该方法可以恢复患者的血糖调控能力,避免定期的胰岛素注射,很大程度上提高患者的生活质量。但由于供体短缺以及供体与受体之间时间的不匹配,限制了胰岛移植的广泛应用。目前已经探索了胰岛供体的其他来源[5],例如猪胰岛[6-8]和干细胞衍生的胰岛类器官[9-11]。有望解决胰岛移植供体短缺的问题,也对高质量的胰岛低温保存提出了更为迫切的需求。
低温保存是高质量保存生物样本的重要方法,液氮下的低温可以使细胞代谢完全停滞,是长期保存胰岛的理想条件[12-15]。现用胰岛低温保存方案存在许多问题,例如回收率较低且功能较差,添加的有毒CPA需要复杂的洗脱步骤,此外还缺乏高质量的、自动化的和高通量的胰岛低温保存技术。近年来,由于材料科学、低温生物学和跨学科研究的发展,出现了一些新的低温保存方法,如开发出了天然来源的新型保护剂[16-18]、非渗透性保护剂胞内递送方法[19-22]和快速复温方式[22-28]等。这些新技术方法提升了胰岛的低温保存质量,在一定程度上降低了低温保存过程中引起的胰岛损伤。本文综述了近年来胰岛低温保存领域出现的新材料新方法,这些新的低温保存方法有助于建立随用随取的高质量胰岛库,为后续T1DM的细胞治疗提供可靠的胰岛来源。
1 低温保存机理
目前胰岛的低温保存方法主要有两类:一类是慢速冷冻保存,另一类是玻璃化保存。
1)慢速冷冻保存,是通过添加低浓度(本文涉及的“浓度”如无特殊说明均为摩尔浓度)的冷冻保护剂(cryoprotective agents,CPA)结合两步法降温使胰岛处于胞外结冰胞内玻璃化的状态。图1(a)所示为在慢速降温过程中降温速率对于胰岛低温保存的影响,在该慢速降温过程中,需要摸索适合胰岛的最佳降温速率[29-30]。若降温速率过快,会在胰岛细胞内部产生冰晶,这些胞内冰在复温过程中会产生再结晶而使细胞受损;若降温速率过慢,则胰岛细胞收缩过度,加重溶质损伤。最佳降温速率下,胰岛的整体损伤最小。
2)玻璃化保存,是通过添加高浓度CPA结合小样本快速的降温速率,使体系达到整体的玻璃化状态。玻璃化是指液体转变为非晶态(玻璃态)的固化过程。实现玻璃化有两种途径,一是极大的提高冷却速率,二是增加溶液浓度。玻璃化状态是胰岛保存的理想状态,细胞内外完全避免了结晶,但要达到完全的玻璃化,需要很高的CPA浓度,也会对胰岛细胞产生毒性损伤,此外复温过程中的反玻璃化现象也会对细胞产生损伤,如图1(b)所示。

图1 低温保存原理Fig.1 Principle of cryopreservation
2 胰岛低温保存中损伤因素的抑制
胰岛结构较为复杂,单个胰岛约含1 000~10 000个细胞[31-32],平均直径为150 μm,由多种细胞构成。这种复杂结构增加了胰岛高质量低温保存的难度,首先热传递限制导致了降温和复温过程中冰晶更加难以控制[29,33]。其次CPA渗透更加困难,较长的平衡时间加重了其对胰岛的毒性损伤[31]。此外在胰岛分离和体外培养过程中,其血管系统被破坏[34-35],氧气的输送效率大大降低,复温时氧气供应不足将导致胰岛内部细胞死亡。
造成胰岛低温保存过程中损伤的因素主要有冰晶损伤、保护剂损伤及缺氧损伤。近些年来出现了新的低温保存方法,如天然无毒的新型保护剂、非渗透性保护剂的胞内递送和快速复温方式等,从不同方面抑制了低温保存过程中胰岛的损伤,提高了胰岛低温保存效果。
2.1 冰晶损伤的抑制
胰岛低温保存过程中,冰晶的生成会产生机械应力[29],对细胞膜[30]和胰岛结构造成破坏。由于过冷度、冷却速率、溶质性质和保护剂浓度的不同,冰晶的生长速率和形态也不同,冰晶可能呈现针状、羽状、不规则枝状以及多种过渡形式的结构,不同结构的冰晶对胰岛形态结构的损伤也不同。S.Matsumoto等[17]将不同浓度的合成抗冻蛋白类似物(sy AFGP)添加到保护剂中,研究其对低温保存中胰岛形态结构的保护作用。低温显微结果显示,当sy AFGP质量浓度为500 μg/mL时,冰晶形态从锋利的刀片状变为一系列羽状分支结构,羽状结构中晶体间未冻结区域更大,胰岛处于冰晶间隙中,形态结构保存较为完整;当sy AFGP质量浓度进一步增加,达到1 000 μg/mL以上时,会促使冰晶大量生长且晶体形态从树枝状转变为针尖状,对胰岛结构造成了严重损伤。所以在胰岛低温保存过程中,控制冰晶生长是十分必要的,可以通过优化降温程序、微囊化包封及玻璃化保存等方法来减轻低温保存过程中冰晶对于胰岛的损伤。
2.1.1 降温程序的优化
冰核的产生和冰晶的生长过程与降温速率有关,较慢的降温速率形成少而大的冰晶;较快的降温速率形成多而小的冰晶。图2所示为慢速低温保存中出现的过冷度示意图,在实际降温操作中,样品体系可能会出现较大的过冷度,在释放潜热后出现很高的冷却速率(图2 e-f段),导致胞内冰的生成,对胰岛造成损伤。
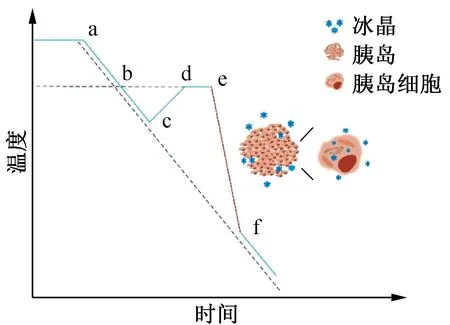
图2 高过冷度导致胞内冰的生成Fig.2 High degree of under cooling leads to the formation of intracellular ice
研究表明[36-37],胰岛最适降温速率约为0.25~1.00 ℃/min。为了减轻体系在较大过冷度下释放潜热后出现的快速降温阶段的影响,通常采用“置核”来控制晶核的生成。目前主要的置核方法有两种,一是通过冷媒在体系局部形成较大的过冷度来实现[38],二是通过调节降温程序来实现[39]。
2.1.2 微囊化胰岛
微囊化胰岛是将胰岛包封在具有选择透过性的微囊中,最早由F.Lim等[40]提出。微囊在胰岛外部形成一层保护屏障,既可以最小化免疫反应,又可以显著减轻冰晶形成对胰岛造成的机械损伤。
液滴生成器是最常用的液滴生成方式。常规液滴生成器(图3(a))生成的液滴范围通常为100~1 000 μm,液滴中通常包含不同数量的胰岛且微囊的大小不一难以控制。同轴气流液滴发生器(图3(b))可以获得尺寸较均匀的微囊,S.Schneide等[41]利用同轴气流液滴发生器获得的微囊直径约为700~800 μm。静电液滴发生器(图3(c))在喷嘴和胶凝溶液之间施加静电势有助于制造更小的微囊[42-44]。近年来,微流体设备也已用于胰岛封装[22,43-45]。使用微流体包囊胰岛可更好的控制胶囊大小,且可以利用多种包封材料形成核壳结构的多层微囊,同时避免了胰岛可能出现在微囊外部的问题(图3(d))。J.D.Weaver等[43],使用微流控技术将小鼠胰岛封装在300 μm PEG胶囊中,对照组使用静电液滴发生器产生的最小胶囊为500 μm。此外,A.A.Tomei等[46]开发了基于流动聚焦的保型封装方法(图3(e)),可以贴合胰岛形状形成更薄、更稳定且厚度均匀的微囊,大幅减小了微囊的体积,改善了氧气及养分的获取[47-48]。构成微囊的材料通常有藻酸盐水凝胶、壳聚糖、葡聚糖、超分子或其它合成聚合物[49-50]。这些材料的3D网络结构可以限制冰晶生长[51],并在复温中抑制冰重结晶,最大限度地减少冰晶对细胞的物理损害[52]。A.A.Haridkar等[53]使用壳聚糖-海藻酸盐水凝胶包封小鼠胰岛,封装组存活率为95.4%,而未包封组为69.4%。侯军等[54-55]也得到类似的结论,侯军等[54]的研究中,CPA为含有2 mol/L二甲基亚砜(dimethyl sulfoxide,DMSO)的RPMI 1640溶液,降温过程首先将样本快速降温至-7.4 ℃,然后以0.25 ℃/min降至-40 ℃,随后投入液氮中保存。1个月后将样本利用37 ℃水浴复温,使用0.75 mol/L的蔗糖溶液洗脱DMSO,双硫腙染色结果显示,微囊化组的胰岛回收率可以达到94.7%±1.4%,显著高于裸露组(68.6%±2.9%)。K.D.Inaba等[55]优化了降温程序,将样本以-0.2 ℃/min的降温速率从4 ℃冷却至-45 ℃,并在-7.5 ℃处置核,然后将样品置于液氮中保存。保护剂均为含有2 mol/L DMSO的RPMI 1640溶液。结果显示微囊化组胰岛(97.2%±1.3%)的回收率显著高于裸露组(79.5%±9.8%),通过降温程序的优化,微囊化胰岛的回收率得到进一步的改善。此外,S.Schneide等[41]优化了微囊化胰岛低温保存所需的DMSO浓度及降复温程序,结果显示在DMSO终浓度为2.0 mol/L时,在0 ℃下平衡15 min,37 ℃水浴并通过梯度蔗糖溶液逐步洗脱去除DMSO,结果最优,这些条件与之前针对非微囊化大鼠胰岛优化的最优低温保存条件相当[56]。
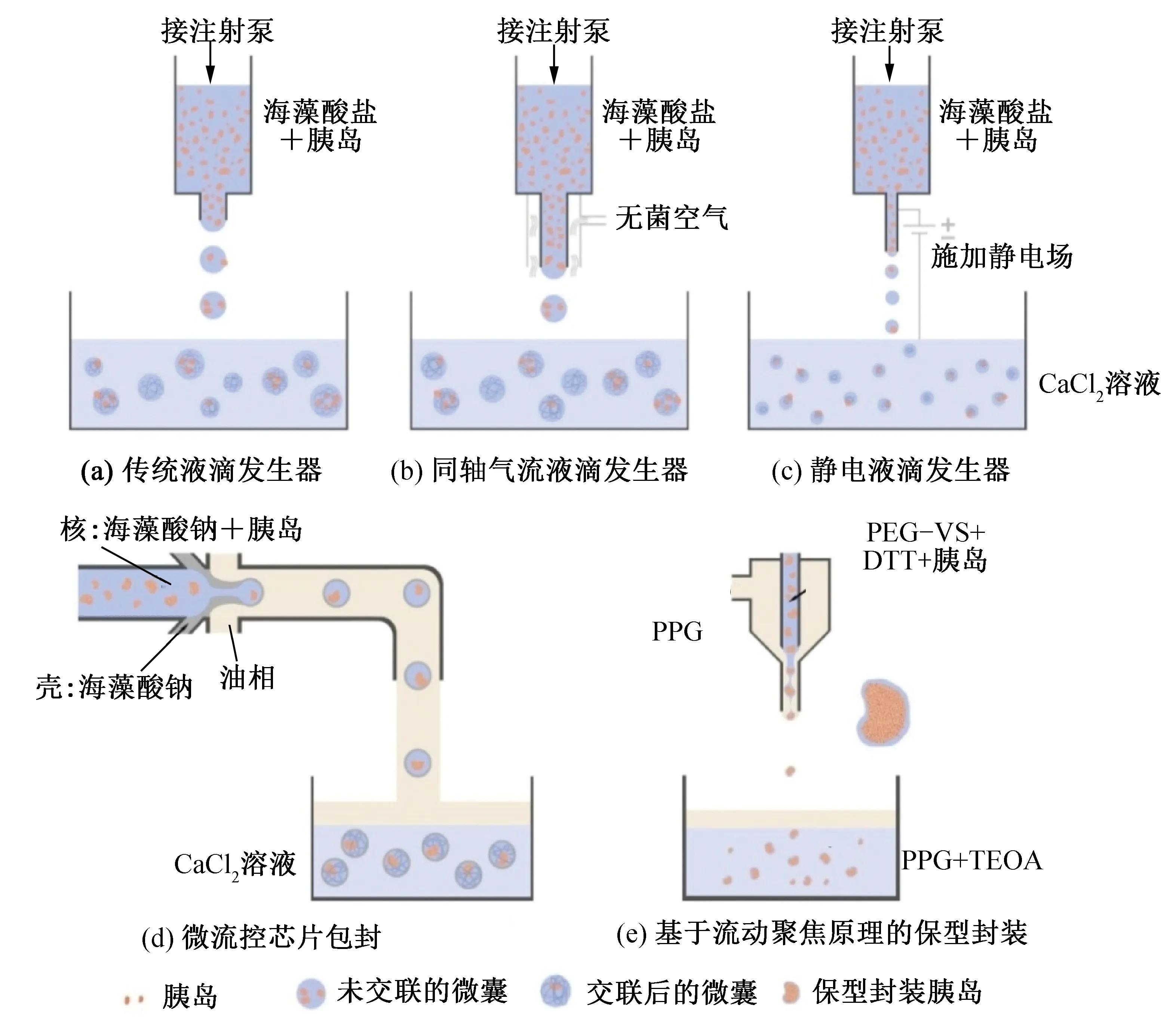
图3 微囊化包封方法Fig.3 Microencapsulation encapsulation method
图4所示为微囊化降低冰晶对胰岛损伤的示意图,微囊化可以显著减轻胰岛在低温保存过程中受到的冰晶损伤,保护胰岛形态,提高胰岛低温保存后的回收率,改善胰岛细胞低温保存后的功能,并在后续移植过程中避免免疫反应。但微囊也增加了氧气及养分的运输距离[57-59],限制了移植后的再血管化,加剧了胰岛内部细胞的缺氧死亡[60-61],不利于胰岛在体内长期发挥功能。此外,微囊包封也显著增加了胰岛的体积,限制了移植的部位。保型封装在一定程度上改善了氧气及养分的输送且减小了移植物的体积,但仍对再血管化存在限制,且其在冷冻过程中对于胰岛的保护作用还需要进一步研究。

图4 微囊对冰晶损伤的抑制原理Fig.4 Inhibition principle of ice crystal damage by microcapsules
2.1.3 玻璃化保存胰岛
玻璃化保存是克服低温保存过程中冰晶损伤的有效方法,近年来,一些新的玻璃化装置应用于胰岛低温保存领域,显著提高了降温速率,降低了对于高浓度CPA的依赖,改善了玻璃化保存胰岛的功能性。
冷表面玻璃化是将包含样本的小液滴直接滴在冷表面实现玻璃化。H.Sasamoto等[36]将100个胰岛悬浮于40 μL的保护剂溶液中,然后立即滴至液氮预冷的铝皿上实现玻璃化。复温后胰岛达到92.4%的高存活率。
麦管加热后拉伸得到拉伸麦管(open pulled straw,OPS),外径约为0.27~0.40 mm,管壁约为0.05 mm。拉伸麦管降温速率可达11 400~18 400 ℃/min,复温速率为12 200~32 300 ℃/min[62]。与普通麦管相比,使用拉伸麦管的降温速率和复温速率都快了约4倍,但拉伸麦管的容积也大幅减小,有效容积从普通麦管的约150 μL降至约10 μL,只能保存少量的胰岛。
冷冻载杆(cryotop)由附着在耐液氮的塑料手柄上的细透明薄膜条及外套管组成,可以提供23 000 ℃/min的降温速率和42 000 ℃/min的升温速率,可以减轻对于高浓度CPA的依赖,提高玻璃化保存效果。但在降温过程中样本需要直接与液氮接触,可能造成污染[63]。目前利用cryotop设备已经成功保存了卵母细胞[64-66]以及胚胎[67-68]等生物样本。近年来,cryotop也被用于胰岛玻璃化保存[18,37]。
中空纤维(hollow fiber,HF)是一种由三乙酸纤维素材料制成的中空管,管壁约为15 μm;近些年来有研究者将中空纤维玻璃化应用于胰岛保存领域。M.Nagaya等[69]对比了冷表面、OPS和HF玻璃化对于胰岛功能的影响,结果显示HF组胰岛功能最优。
目前的玻璃化设备为了达到足够快的降温速率,一般容积都很小,单次保存的胰岛量对于临床应用远远不够,所以需要开发高通量的胰岛玻璃化方法,冷表面玻璃化显示出了高通量保存胰岛的潜力,后续可以通过高精度的3D打印喷射成液滴矩阵来进一步降低液滴大小,提高保存效果,实现高通量的玻璃化保存。
2.2 保护剂损伤的抑制
冷冻保护剂损伤包括细胞膜损伤[70],增殖和分化能力减弱[71-74],线粒体功能降低[75-77],DNA、蛋白质或其他大分子受损等[78-82]。这些损伤可能是CPA本身的毒性以及CPA引起的渗透压冲击所造成的。通过复配使用多种CPA,无毒低毒保护剂结合胞内递送等方法可以减轻这些损伤。
2.2.1 保护剂的复配使用
不同CPA具有不同的膜渗透能力[83]、玻璃化能力以及细胞毒性。通过不同CPA的复配使用可以降低CPA的整体浓度,在抑制冰晶的同时降低CPA对于细胞的毒性损伤以及渗透冲击。G.Kojayan等[38]的研究结果显示与目前的标准2 mol/L DMSO相比,复配使用CPA(1 mol/L DMSO + 0.5 mol/L EG)可获得更高的存活率和细胞活力。此外,大鼠体内实验显示,复配组可以更快的使血糖恢复正常。
了解CPA损伤机理和CPA功能特性是寻找更优CPA配方的基础。不同细胞对于CPA的渗透性差异很大,为了开发出更适合胰岛的CPA配方,各种CPA对于胰岛的损伤机理以及胰岛与不同CPA的相互作用还需要进一步研究。
2.2.2 非渗透冷冻保护剂胞内递送
目前用于胞内递送的非渗透CPA主要是天然糖类如海藻糖、蔗糖和棉子糖[84]。应用最多的是海藻糖,海藻糖首先在极端耐寒和干燥的生物中发现[85-86],它可以与生物大分子形成氢键促进生物大分子的水合作用,充当水以使细胞成分构象保持稳定;还可通过大幅降低分子流动性促进玻璃态的形成来暂停代谢活动[87-88]。
通常海藻糖无法透过哺乳动物的细胞膜,且仅胞外的海藻糖不能起到良好的保存效果[89]。研究者探索了将海藻糖递送至胞内的方法,例如诱导磷脂相变[20]、电穿孔、超声、显微注射和纳米粒子递送[21,90]等。G.M.Beattie等[91]利用胰岛细胞膜的脂质相变将海藻糖递送至胞内,结果表明冷冻保存后的胰岛在复温后显示出良好的活力和功能,移植到糖尿病大鼠模型中的效果与移植新鲜胰岛无显著差异。V.Mutsenko等[84]利用电穿孔将海藻糖、蔗糖和棉子糖分别递送进细胞内,对比了3种糖在细胞冷冻保存中的效果,结果表明蔗糖和棉子糖与海藻糖一样有效。
Cheng Yue等[22]利用冷响应纳米胶囊(CR-NCs)递送海藻糖,CR-NCs具有冷响应特性,在温度低于10 ℃时,CR-NCs会裂解释放海藻糖,可使胞内海藻糖浓度达到0.4 mol/L。该项研究还将胰岛包封在海藻酸盐水凝胶中,并通过磁热复温提高了复温速率,进一步降低对胰岛的损伤。结果显示,仅0.4 mol/L的游离海藻糖,冷冻保存后的细胞活力仅为30%,通过CR-NCs将海藻糖运送至细胞内后,细胞活力达到60%以上。再加上海藻酸盐封装后,冷冻保存后细胞活力增至75%,最后引入磁热复温后,细胞活力进一步提高至85%。海藻糖胞内递送,微囊封装以及磁热复温的综合使用,减少了对有毒CPA的需求,仅使用0.4 mol/L的海藻糖即可达到80%以上的细胞活力。该项工作体现了综合利用多种工程方法保存胰岛细胞的巨大潜力。
2.2.3 低毒性的冷冻保护剂
近年来,一些无毒或低毒的CPA应用于胰岛低温保存领域,例如不同来源的抗冻蛋白以及聚两性电解质等。这些CPA具有较低的生物毒性且可以提高胰岛低温保存后的存活率和功能性,展现出了替代传统有毒保护剂的潜力[92]。
抗冻蛋白是一种天然来源的保护剂,其保护机理可能为通过疏水相互作用与膜磷脂缔合,起到稳定细胞膜的作用[93],减少了胞外冰对膜造成的损伤。目前抗冻蛋白也已应用于胰岛低温保存领域,并取得了良好的保存效果[17,93-95]。聚两性电解质也称两性聚电解质,已成功实现了胰岛[18]、红细胞[96]、人肺腺癌细胞[97]、小鼠成纤维细胞[98]、小鼠胚胎[99]等样本的冷冻保存。聚两性电解质具有较强的冰重结晶抑制作用[98,100-101],可以减少胰岛低温保存过程中冰晶形成对于胰岛的损伤;CPA配方中引入聚两性电解质可以降低保护剂的渗透压[102],从而减轻渗透冲击对于胰岛的损伤;且聚两性电解质具有较低的细胞毒性,可以降低有毒CPA的用量,减轻其对于胰岛的毒性损伤;此外有观点认为聚两性电解质可以在胞外形成无冰的缓冲区域[103],减轻冰晶对胰岛的机械损伤。
2.3 缺氧损伤的抑制
胰岛的血管网络在分离过程会被破坏,被动扩散成为分离的胰岛获取氧气的主要方式[34-35,104]。氧气输送受限导致胰岛功能下降,内部细胞缺氧死亡,最终导致整个胰岛死亡。
在复温过程中,细胞恢复代谢需要消耗大量能量,ATP耗尽导致细胞功能不足也会导致胰岛的损伤[105-106]。H.Komatsu等[107]研究发现在高氧(50% 体积浓度的O2)下解冻可以降低胰岛炎症相关基因的表达,更好的保存胰岛功能。减轻炎症细胞因子对于胰岛细胞活力和功能的不利影响[108-109],可能是提高胰岛存活率和功能性的关键。
ROS(reactive oxygen species,ROS)是冷冻保存过程中细胞损伤的另一个重要因素[110-114]。通过添加姜黄素和牛磺酸等抗氧化物质可以降低ROS水平,减轻细胞损伤。姜黄素是一种多酚化合物[115],具有细胞保护和抗凋亡特性[116-117]。K.Meghana等[116]观察到低温保存胰岛ROS水平是新鲜胰岛的5倍,且加入姜黄素后低温保存胰岛的ROS水平降至与新鲜胰岛ROS水平相当。姜黄素增强了胰岛中血红素加氧酶-1(HO-1)和热休克蛋白70(Hsp 70)基因的表达,这两种蛋白在低温保存中对细胞具有保护作用[118]。A.A.Hardikar等[119]研究了在低温保存之前添加牛磺酸对胰岛的保护作用,结果表明,在低温保存之前添加0.3 mmol/L和3.0 mmol/L牛磺酸可提高胰岛的存活率(0.3 mmol/L为91.9%±2.3%,3.0 mmol/L为94.6%±1.58%)。
天然胰岛复杂结构给低温保存带来了诸多限制[120-123]。胰岛的大小是影响低温保存后胰岛质量的一个重要因素,在M.A.Mach等[56]将胰岛根据直径分为Small(<200 μm)、Medium(200~400 μm)和Large(>400 μm)3组,研究不同DMSO浓度和不同加载、去除方式对于胰岛活力的影响,结果显示,在中等DMSO浓度(1.4 mol/L,2 mol/L)下,胰岛活力整体与胰岛大小呈负相关。且经过不同加载、洗脱方式处理后,不同大小的胰岛对于处理方式改变的响应程度也不同。经过不同加载方式(45 min,4 ℃;15 min,4 ℃;45 min,22 ℃)处理的胰岛低温保存再复温后,与22 ℃加载组(r=-0.79)相比,4 ℃加载组(45 min,r=-0.84;15 min,r=-0.84)的负相关性更强。该研究表明胰岛大小对胰岛低温保存后的质量影响显著,对以后胰岛低温保存方案的优化,特别是干细胞分化来源的胰岛的低温保存具有借鉴意义。
将胰岛分解为单细胞可以显著降低低温保存中的缺氧损伤。但胰岛功能实现高度依赖于细胞间通讯以及不同细胞类型间的旁分泌相互作用[124-126]。针对这些特点,研究者们研究了将胰岛分解成单细胞进行低温保存,复温后再将其聚合成胰岛的保存方法。S.Rawal等[83]对比了将胰岛分解为单细胞保存与整体保存后的胰岛存活率与功能,结果表明胰岛直接低温保存和胰岛单细胞保存的最终存活率均稳定在约80%,但单细胞保存后再聚集的胰岛比直接保存的完整胰岛具有更高的代谢活性。A.A.Stock等[46]发现在胰岛分解成单细胞再聚集的过程中会损失掉一部分细胞,有报道[127]称该种细胞丢失可以消除与胰岛素分泌无关的细胞类型,从而增加细胞群中胰岛素分泌细胞的比例,起到纯化的作用。
虽然将胰岛分解为单细胞保存可以提高胰岛细胞整体的功能性,但酶解成单细胞也破坏了胰岛原本的细胞构成与结构,这些破坏对于胰岛整体功能以及后续存活的影响还不清楚,有待进一步研究。
3 总结与展望
近年来,由于材料科学、低温生物学和跨学科研究的发展,诸多新材料新方法应用于胰岛低温保存领域,胰岛低温保存技术得到进一步发展。但现有方案与临床细胞治疗的需求还有一定差距。首先是仍然缺乏高通量玻璃化保存胰岛的方法,一些技术方法如冷表面玻璃化展现出了高通量保存胰岛的潜力,但仍需要进一步研究。其次对于胰岛低温保存过程中损伤的机理的研究尚不够深入,了解损伤机理对于后续低温保存程序的设计具有一定的指导意义。
胰岛低温保存是一个系统性工程,高质量保存需要综合考虑保存过程中的各个方面。胰岛低温保存过程存在诸多损伤因素,最终胰岛的损伤是这些损伤因素相互作用的共同结果。这些损伤的抑制方法很多,如保护剂的多步加载、降温过程的控制、非渗透性保护剂胞内递送以及快速复温等。胰岛低温保存要通过多种技术的协同作用,将强烈的损伤尽可能分化成为处于胰岛耐受范围内的轻微损伤,避免引入单一强烈的处理方式。
在后续研究中,开发新材料新技术以及对于损伤机理的深入研究均具有重要意义。在利用现有的保护剂以及技术方法来设计胰岛低温保存方案时,需要综合考虑保存过程中的各种损伤,各种保护方法带来的不利影响以及其协同作用。
