靶向金纳米棒联合纳秒脉冲电场对体外A375黑色素瘤2D模拟组织的消融效果研究
2021-10-11代璐健唐均英
米 彦 代璐健 刘 权 张 倩 唐均英
(1. 输配电装备及系统安全与新技术国家重点实验室(重庆大学) 重庆 400030 2. 重庆医科大学附属第一医院 重庆 400016)
0 引言
纳秒脉冲电场(nanosecond Pulsed Electric Fields, nsPEF)是一种在不使用有毒化疗药物的情况下实现肿瘤有效治疗的新型物理疗法[1]。由于其脉冲宽度窄,nsPEF可以诱导细胞产生内电效应,发生程序性死亡,即凋亡,而且该方法在治疗期间温升较低,从而不存在热安全性风险[2]。但是,由于过窄的脉冲宽度,在nsPEF治疗期间需要高电场强度才能有效杀死肿瘤细胞。但过高的电场强度可能会导致肿瘤组织表面意外放电[3],并发生局部灼伤,这给nsPEF治疗带来了一定的安全性问题。
近年来,金纳米棒作为一种高电导率的纳米材料已经被发现具有增强脉冲电场生物电效应的功 能[4-8],这为改善传统nsPEF治疗肿瘤的电气安全性问题提供了新的可能性。许多学者首先研究了金纳米棒在体内的生物安全性问题,大量研究表明,安全浓度范围内的金纳米棒在体内没有明显的毒副作 用[9-10],并且在一定时间后能够通过身体的新陈代谢排出体外[11-12]。在以上研究的基础上,国内外大量学者基于金纳米棒的导电特性进行了相关仿真与实验研究。Huang Shuyan等研究证明,金纳米粒子能够使局部电场强度发生畸变,从而增大电场强度,但是由于纳米粒子尺寸过小,导致加入金纳米粒子对整体细胞溶液的电场分布影响不大[13]。通过有限元仿真,Qiu Hao等发现高电导率金纳米粒子可以增强脉冲电场的作用,并明显提高了细胞膜的跨膜电位和穿孔密度[4]。A. Rolong等也通过有限元仿真研究了导电纳米粒子和微秒脉冲电场联合对组织消融的影响。研究结果表明,导电纳米粒子的加入能够扩大组织的消融面积,降低消融组织所需的最低阈值电场强度[5]。A. Ghorbel等通过实验和仿真共同研究了导电纳米粒子和非导电纳米粒子对细胞电穿孔效应的影响,结果表明,导电纳米粒子比非导电纳米粒子具有更强的增强效果。除此之外,当纳米粒子更多地聚集在细胞膜周围时,增强效果更加明显[6]。类似的一些实验研究同样也验证了金纳米粒子的确能够明显地增强电穿孔效应[7-8],但是这些实验和仿真研究更多的是集中于电转染领域,鲜有关于金纳米粒子与nsPEF联合的研究。
在现有研究的指导下,高电导率且具有靶向结合功能的纳米粒子是首选。叶酸(Folic Aicd, FA)受体广泛地表达于各种肿瘤细胞表面[14]。在光热疗法的研究中,FA修饰后的金纳米棒由于能够靶向结合肿瘤细胞,因此,比未修饰的金纳米棒具有更强的抗肿瘤功效[15]。Chen Zhongjian等开发了一种叶酸修饰的阳离子脂质体,用于靶向A375黑色素瘤细胞来实现低氧诱导因子HIF-1α 传递[16]。叶酸修饰后的脂质体由于能够主动与A375细胞结合,具有更高的传递效率,从而实现更好的肿瘤抑制效果。因此,本文也选用叶酸这一常用的靶向配体来修饰金纳米棒,从而实现金纳米棒在细胞周围的有效聚集,提高细胞的电穿孔效应。
基于本课题组的前期研究[17-18],叶酸靶向金纳米棒可以在较低的电场强度下实现更高的肿瘤杀伤效果。为了进一步验证并探讨该方法的实验效果,本文从实际情况出发,讨论了该方法的可行性。本文将高生物相容性的GNR-PEG表面进行FA修饰(Folic Acid-polyethylene Glycol-gold Nanorods, GNR-PEG-FA),使其能够有效地与A375黑色素瘤细胞结合[19-20],并通过暗场显微镜对细胞和金纳米棒的结合进行观察。本文在确定其靶向结合作用后,通过使用calcein-AM试剂染色和荧光显微镜观察,研究了不同脉冲参数(电压、脉冲宽度和脉冲个数)作用下对2D模拟组织消融面积的影响。通过将Comsol有限元仿真得到的电场强度分布图与消融图进行拟合,从而直观地展现实现肿瘤细胞有效杀伤的阈值电场强度大小。最后,本文分析和对比了不同脉冲参数下消融面积和阈值电场强度的变化规律,并分析了GNR-PEG-FA增强细胞电穿孔的机制,为nsPEF治疗肿瘤提供一种新的思路和方法。
1 材料与方法
1.1 体外2D模拟组织培养
人黑色素瘤A375细胞系获自第三军医大学基础医学研究院。细胞在含有10%的血清和1%抗生素的青霉素-链霉素的高糖DMEM(dulbecco's modified eagle medium)培养瓶中培养,并在5%的CO2和37℃湿润环境中孵育。
实验前,将A375细胞从培养瓶中消化,以800r/min的速度离心5min,然后以1.5×106个细胞/mL的浓度接种到35mm培养皿中24h。当细胞汇合度接近100%时,即形成了致密的2D体外细胞模拟组织,随后将被用于nsPEF实验。
1.2 靶向金纳米棒的表征与暗场成像
GNR-PEG-FA购于西安瑞禧生物科技有限公司,通过TECNAI G2 F20 S-TWIN透射电镜(FEI, USA)和Cary60紫外-可见光分光光度计(Agilent, USA)分别对GNR-PEG-FA进行透射电镜观察和吸收光谱的测定。
暗场成像之前,将在24mm盖玻片上预先孵育生长了24h的A375细胞从孵箱中取出,用磷酸缓冲液轻轻清洗盖玻片表面两次,然后将0.1mg/mL的GNR-PEG-FA溶液(基于本课题组的前期研究[21],0.1mg/ml是材料的安全浓度)加入到培养基中与细胞共同孵育15min。随后,用磷酸缓冲液轻轻冲洗3次以去除未与细胞结合的金纳米棒,之后使用多聚甲醛固定,甘油包被,并用另一个盖玻片进行密封。最后,通过配备有暗视场聚光镜(U-DCW,1.2-1.4)的BX51光学显微镜(日本奥林巴斯,日本)观察GNR-PEG-FA和A375黑素瘤细胞溶液。
1.3 nsPEF实验方案
实验系统的实验波形和装置示意图分别如图1和图2所示。图1中,nsPEF单独作用及和GNR- PEG-FA曲线均为电流曲线。纳秒脉冲发生器的输出连接到两个直径为1mm的铜针电极,电极中心之间的距离为3mm。在nsPEF处理之前,将具有A375黑色素瘤2D模拟组织的不同培养皿分为单独nsPEF组(不含GNR-PEG-FA)和GNR-PEG-FA组(含GNR-PEG-FA)两组。在实验过程中,将针状电极插入到培养皿中,并施加相应的纳秒脉冲进行处理。
本研究使用了自制的模块化高压纳秒脉冲发生 器[21]。纳秒脉冲电场参数见表1。表中,U为脉冲电压,τ为脉冲宽度,N为脉冲个数,每个参数均 设有5个水平值,当变化其中一个脉冲参数时,另外两个脉冲参数均固定为中间值,脉冲重复频率均为1Hz。例如,当变化不同脉冲电压时,脉冲个数固定为100个,脉冲宽度固定为300ns,其余参数设置以此类推。
综上所述,打孔注药防治黄斑星天牛不但防治效果好,不污染环境,不杀伤天敌,且用药量少,成本低,在通常情况下建议使用氧化乐果,既节约又有效,可大面积推广使用,对受害严重的也可以进行3次注药防治。
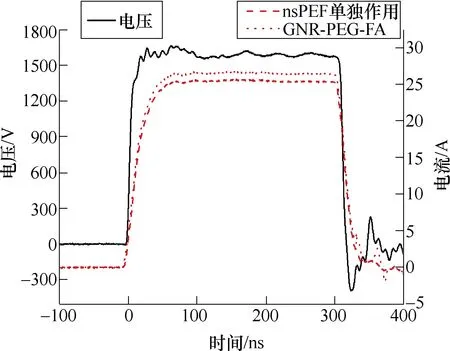
图1 实验波形 Fig.1 Experimental waveforms
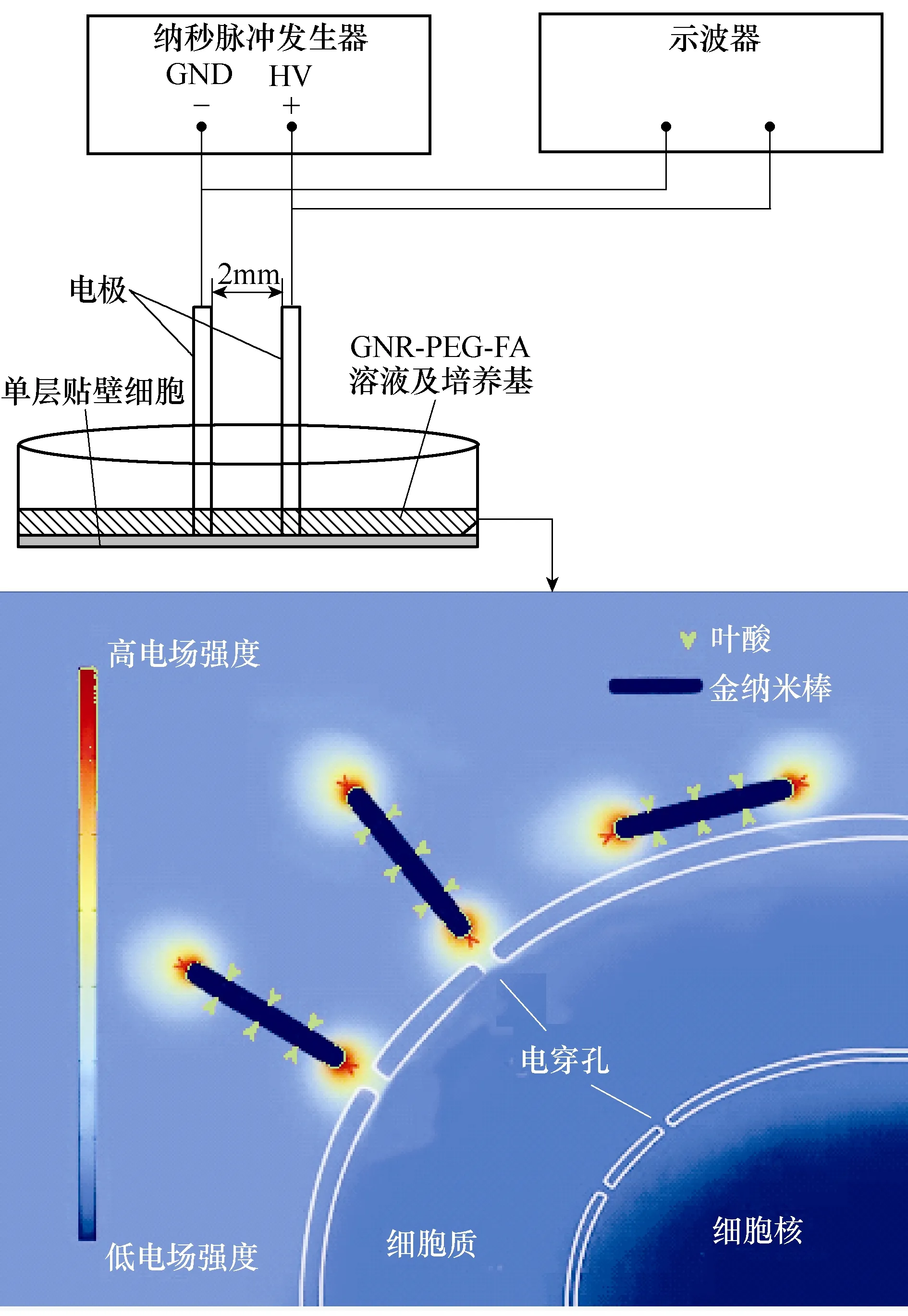
图2 实验装置示意图 Fig.2 Schematic of experimental setup
1.4 Calcein-AM染色检测消融面积
在GNR-PEG-FA联合nsPEF处理完A375细胞后,从培养皿中吸出培养基,并将1mL新鲜培养基添加到培养皿中,然后放置在37℃的孵箱下孵育3h。 3h后,除去培养皿中的培养基,并用PBS(phosphate buffer saline)轻轻洗涤细胞3次。随后,将1mL于避光环境下配制而成的钙黄绿素溶液PBS与钙黄绿素-AM的体积稀释比为250∶1(Dojindo, 日本)添加到培养皿中,于孵箱中继续培养30min。30min后,吸出培养皿中的钙黄绿素溶液,将细胞用PBS轻轻洗涤两次,然后加入1mL制备的PI(propidium iodide)溶液(PBS与PI的稀释比为100∶1)(Dojindo, 日本),放入孵箱中孵育5min。5min后,将培养皿用PBS轻轻洗涤一次,然后再加入1mL新鲜培养基,最后在避光条件下用荧光显微镜(DMi8,Leica,德国)观察细胞。Leica LAS AF Lite软件将Calcein-AM和PI染色的最终成像结果合并。

表1 纳秒脉冲电场参数 Tab.1 Parameters of nsPEF
1.5 空间电场分布仿真
COMSOL Multiphysics 5.4a是一种基于有限元分析法进行多物理场仿真模拟的常用软件。本文使用该软件进行仿真,并用于分析电极周围的电场强度分布。电场分布的仿真模型和空间分布的结果分别如图3和图4所示。如图3所示,模型的求解域是直径为35mm的圆形区域(对应于实验中使用的培养皿),中间为两个中心间距为3mm、直径为1mm的圆形针电极(对应于实际实验中使用的电极针)。 含与不含GNR-PEG-FA细胞溶液的电导率通过计算后分别设定为1S/m和1.047S/m,电极材料选用软件中预设的铜材料。

图3 空间电场分布仿真的网格模型 Fig.3 Meshing model of simulation of space electric field strength

图4 电场强度分布结果 Fig.4 Distribution of electric field strength
1.6 数据的统计学分析
采用OriginPro软件对数据进行绘图和统计学分析,数据结果均用x(均值)±s(标准差)表示,利用单因素方差分析方法评估实验数据的显著性差异,其中,*p<0.05和**p<0.01分别表示实验数据之间具有显著性差异和极显著性差异。本文采用单因素方差分析方法比较处理组之间实验结果的不同。
2 结果
2.1 GNR-PEG-FA的表征与暗场成像
GNR-PEG-FA的表征与A375细胞的暗场成像如图5所示。如图5a所示,本文所使用的GNR- PEG-FA外径约为15nm,长度约为60nm,纵横比约为4。金纳米棒作为一种金属纳米材料,由于独特的棒状结构以及具有的局部表面等离子体共振的特性,使得其在暗场成像中具有很大的优势[22-23]。金纳米棒的局部表面等离子体共振分为横向表面等离子体共振(Transverse Surface Plasmon Resonance, TSPR)和纵向表面等离子体共振(Longitudinal Surface Plasmon Resonance, LSPR)两种模式,反映在GNR-PEG-FA紫外-可见光吸收光谱上是两个吸收峰。其中,强度较小的吸收峰(520nm)对应TSPR,强度较大的吸收峰(830nm)对应LSPR。在暗场显微镜中,一束倾斜入射的狭窄的白光射向金纳米棒,由于白光的波长覆盖了可见光波长的范围,因此,当金纳米棒发生表面等离子体共振对应的波长如果在可见光范围内,则会被白光激发产生局部等离子体共振,从而发生光的强烈的散射或吸收。从紫外可见吸收光谱(见图5b)可以看出,最强LSPR吸收峰最强的位置位于波长为830nm处,已经超出了可见光波长(380~780nm)的范围,因此,无法通过暗场显微镜观察到GNR-PEG-FA最强烈的散射光。但是,在LSPR峰的上升沿前部有一段处于可见光的红光范围内,而且该范围内的强度与TSPR峰(520nm,绿光)的强度十分接近,因此,在暗场显微观察中将会收集到强度接近的红光和绿光。通常来说,红光与绿光混合进入人眼时,眼睛会将其识别为黄色,这解释了图5c中金纳米棒显示为黄色的原因。
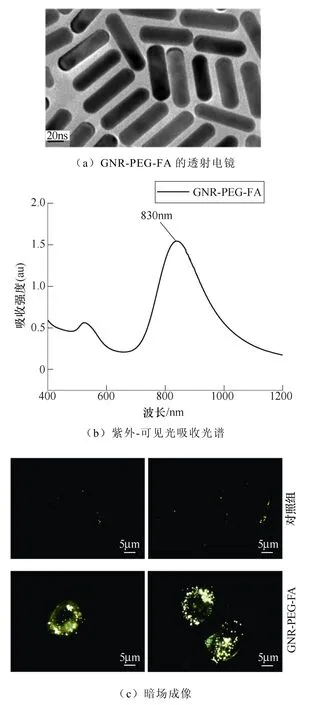
图5 GNR-PEG-FA的表征与A375细胞的暗场成像 Fig.5 Characterization of GNR-PEG-FA and dark field imaging of A375 cells
由于叶酸受体是A375细胞的一种良好的靶向识别物[24-26],因此本文也选用了叶酸作为金纳米棒的靶向修饰物。图5c的暗场成像结果表明,大量的GNR-PEG-FA聚集在A375细胞周围,进一步证明了GNR-PEG-FA与A375细胞确实存在靶向结合的效果。除此之外,由于叶酸受体介导的内吞作用[25-27],一部分GNR-PEG-FA也进入到了细胞内部,而不是仅仅分布在细胞膜周围。总之,无论是金纳米棒位于细胞膜表面还是细胞内部,均为增强nsPEF对A375细胞电穿孔效应提供了帮助。
2.2 GNR-PEG-FA联合nsPEF对消融面积的影响

图6 不同脉冲电压下nsPEF联合或者不联合GNR-PEG-FA对消融面积的影响 (比例尺=0.5μm,*p<0.05,**p<0.01) Fig.6 Ablation area under different applied voltages after nsPEF treatment with or without GNR-PEG-FA (scale bar=0.5μm, *p<0.05, **p<0.01)
在nsPEF处理后3h,通过荧光显微镜观察消融区域。如图6~图8所示,分别为不同脉冲电压、 脉冲宽度和脉冲个数作用下的消融结果,其中,活细胞将会被钙黄绿素染色,在荧光显微镜下呈现绿色,而图中黑色的部分代表此处的肿瘤细胞已经被消融,即消融区域(电极划痕部分没有被计算入消融面积中)。如图6所示为不同脉冲电压对消融面积的影响,随着脉冲电压的上升,消融面积呈现出明显的上升趋势。当nsPEF单独作用时,消融面积从1 000V时的0.387mm2增加到2 000V时的7.704mm2,而GNR-PEG-FA组的消融面积从约0.677mm2增加到8.627mm2。相同脉冲电压作用下,含有纳米粒子的实验组与仅有脉冲电压作用的实验组相比,消融面积增幅比例范围为12%~75%。在所有的实验电压下,GNR-PEG-FA组的消融面积均比nsPEF单独作用组的消融面积大,且具有显著性差异(*p<0.05或**p<0.01),显著性差异指实验组之间消融面积的统计分析。
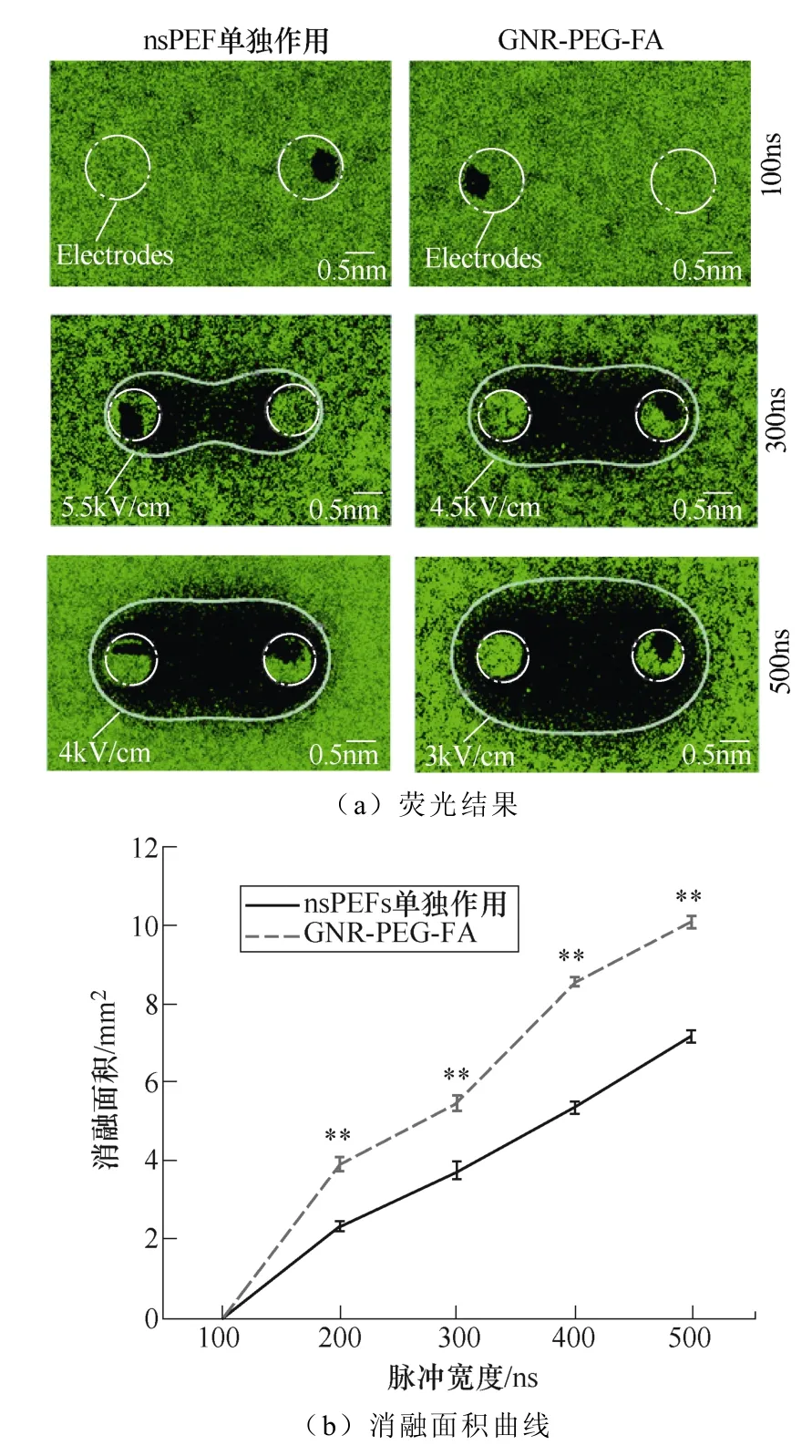
图7 不同脉冲宽度下nsPEF联合或者不联合GNR-PEG-FA对消融面积的影响 (比例尺=0.5μm,*p<0.05,**p<0.01) Fig.7 Ablation area under different pulse widths after nsPEF treatment with or without GNR-PEG-FA (scale bar =0.5μm, *p<0.05, **p<0.01)

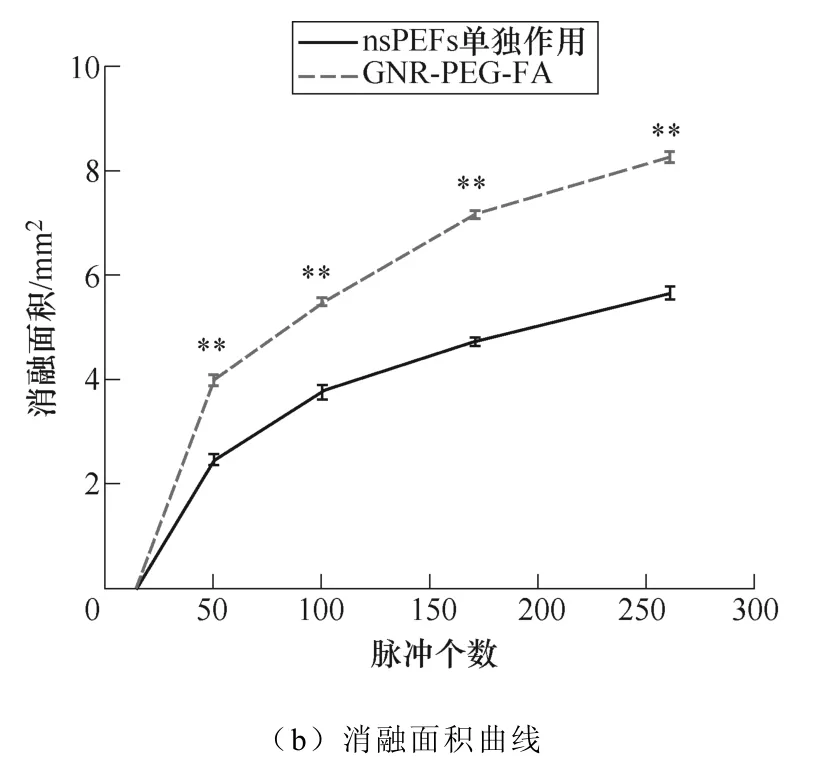
图8 不同脉冲个数下nsPEF联合或者不联合GNR-PEG-FA对消融面积的影响 (比例尺=0.5μm,*p<0.05,**p<0.01) Fig.8 Ablation area under different pulse numbers after nsPEF treatment with or without GNR-PEG-FA (scale bar =0.5μm, *p<0.05, **p<0.01)
类似地,当改变脉冲宽度(见图7)或脉冲个 数(见图8)时,也呈现出这样的规律,在脉冲宽度为100ns或脉冲数为15的情况下,在nsPEF单独作用组和GNR-PEG-FA组中均未观察到明显的消融区域(黑色区域是被电极刮除)。当脉冲宽度增加到300ns和500ns时,GNR-PEG-FA组的消融面积上升到了300ns时的5.477mm2和500ns时的10.066mm2,明显高于nsPEFs单独作用组300ns时的3.751mm2和500ns时的7.159mm2(消融面积增幅比例达到31.6%~88.2%)。当脉冲个数增加到100和260时,GNR-PEG-FA的消融面积上升到了100时的5.477mm2和260时的8.237mm2,明显高于nsPEFs单独作用组100时的3.751mm2和260时的7.074mm2(消融面积增幅比例达到45.8%~62.6%)。 由此可见,GNR-PEG-FA的加入能够有效提高nsPEF消融肿瘤的效果。
3 讨论
3.1 GNR-PEG-FA联合nsPEF增强对肿瘤细胞消融面积的电学机制
具有高电导率的金纳米棒具有独特的棒状结构。当将金纳米棒置于均匀电场中时,由于“避雷针效应”[27],可以增强金纳米棒尖端局部的电场强度,其增强作用可以描述为
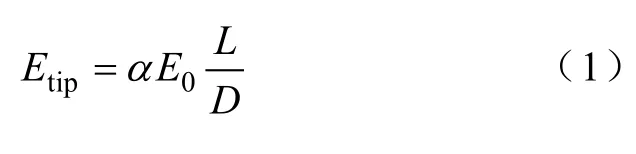
式中,Etip、E0分别为尖端电场强度和外加均匀电场强度;L和D分别为金纳米棒的长度和外径;α为常数。
由于细胞膜在受到电场作用时,可将其假设为一个阻容模型,因此,当对细胞施加电场时,会导致其跨膜电压增加。当跨膜电压增加到临界阈 值[28-30]时,细胞膜两端会由于无法继续承受更高的电压,发生穿孔,即电穿孔。而可以引起电穿孔的电场强度描述[31]为

式中,ϕΔ为发生电穿孔所需的跨膜电压阈值,通常为1V;d为球型细胞的直径;θ为细胞膜某一位置与细胞中心法向方向与该位置受到电场E的方向之间的夹角。
式(2)表明,影响细胞膜某一点上跨膜电位的主要因素是电场强度的大小。由于避雷针效应(见式(1)),GNR-PEG-FA可以局部地增强细胞周围的电场强度,从而增强nsPEF对细胞的电穿孔作用。但是,由于金纳米棒尺寸较小,其电场增强的范围有限,所以为了更有效地利用金纳米棒的避雷针效应,本研究用FA修饰了金纳米棒以靶向A375黑色素瘤细胞,以使更多的金纳米棒聚集在细胞周围,细胞承受的电场增强效果也越强,电穿孔效应也越明显,nsPEF的消融效果也得到增强。类似地,避雷针效应还用于其他一些增强的电穿孔应用中[32-35],显示出与本研究相似的结果。
3.2 GNR-PEG-FA联合nsPEF对阈值电场强度的影响
电场强度的分布在图4中示出,离电极越远,电场强度越小。由于难以确定脉冲处理过程中金纳米棒的分布和数量,因此,如果想要通过仿真完全模拟存在GNR-PEG-FA时的空间电场分布是非常不准确的。因此,本文以未加入GNR-PEG-FA时的空间电场分布为基准,以此来判定加入或不加入GNR-PEG-FA时各个脉冲参数下对应的阈值电场强度,这样也更方便后续治疗方法的确定。图6b~图8b均给出了将消融区域与电场合并的模拟结果。图9给出了在不同脉冲参数下的电场强度阈值的差异(显著性差异指两实验组之间电场强度阈值的统计分析)。
当施加的脉冲电压为变量时,在任一脉冲电压下,各组的阈值电场强度分别保持不变,而GNR- PEG-FA组的4.5kV/cm比nsPEF单独作用组的5.5kV/cm降低了约18.2%。
当脉冲个数为变量时,nsPEF单独作用组的平均电场强度阈值从100时的5.5kV/cm降低到了260时的4.5kV/cm,而GNR-PEG-FA组的平均电场强度阈值从100时的4.5kV/cm降低到260时的3.5kV/cm。 与nsPEF单独作用组相比,GNR-PEG-FA组阈值电场强度的降低幅度为100时的18.2%和260时的22.2%。
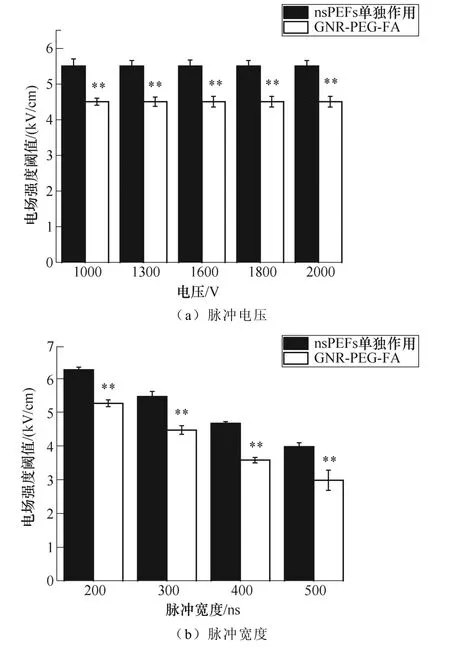
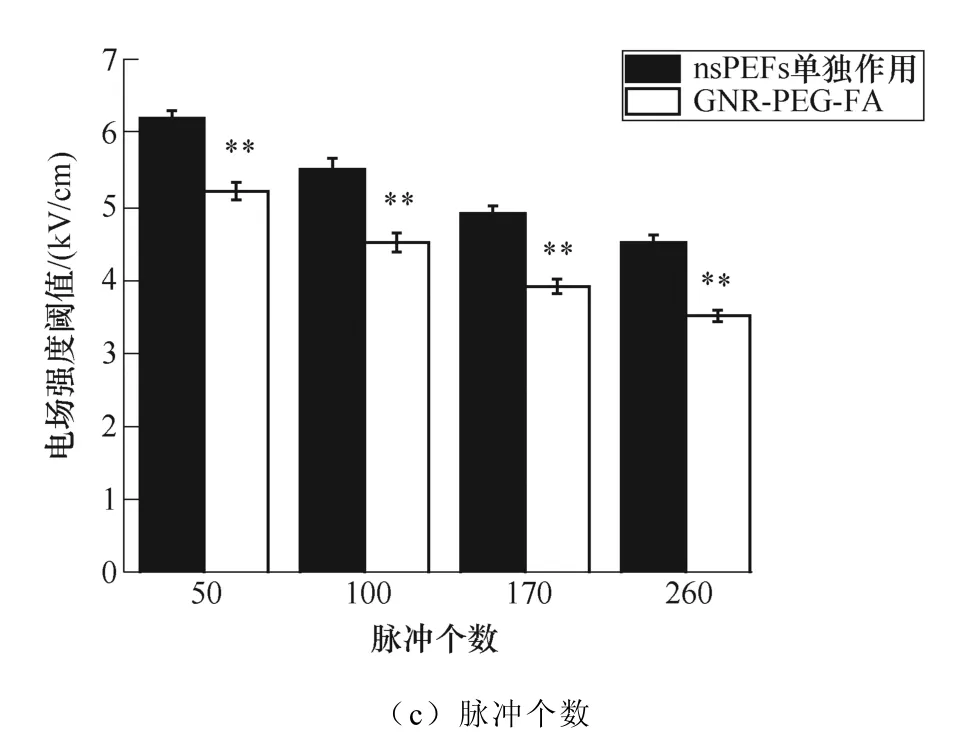
图9 不同脉冲参数下的电场强度阈值 (*p<0.05, **p<0.01) Fig.9 Electric field threshold under different pause parameter (*p<0.05, **p<0.01)
当脉冲宽度为变量时,nsPEF单独作用组的平均电场强度阈值从300ns时的5.5kV/cm降低到500ns时的4kV/cm,而GNR-PEG-FA组的平均电场强度阈值从300ns时的4.5kV/cm降低到500ns时的3kV/cm。与nsPEF单独作用组相比,GNR-PEG-FA组阈值电场强度的降低幅度为300ns时的18.2%和500ns时的25%。
总之,脉冲电压的变化不会影响最终阈值电场强度的变化,但是由于脉冲电压的提高,使得阈值电场强度的分布范围扩大了,从而实现了消融面积的增加。当脉冲宽度和脉冲个数增加时,阈值电场强度呈现出明显的降低趋势。K. H. Schoenbach等研究了不同电场强度、脉冲个数和脉冲宽度下纳秒脉冲电场对细胞膜通透性的影响定律,文中将可观察到的生物电效应强度与脉冲参数之间的关系描 述[36]为

式中,S为可观察到的生物电效应的强度;E为电场强度;τ为脉冲宽度;N为脉冲数。
假定实现A375肿瘤细胞消融的强度S是恒定的。如式(3)所示,当τ或N增加时,只需要较低的电场强度E就可以达到相同的S。这意味着在研究中,消融A375细胞的视野阈值降低了。然而,较高的施加电压只能扩大电场强度阈值的空间分布面积,这会增加消融面积,但不能影响电场强度阈值,所以导致电场强度阈值在不同电压下应相同,这与本文的实验结果也十分吻合。这项研究的结果可以为未来的体内研究或临床应用提供参考。通过合理选择纳秒脉冲参数,并联合GNR-PEG-FA,可以有效地降低阈值电场强度,为黑素瘤治疗提供一种更加安全有效的物理疗法。
4 结论
本文首先通过暗场显微镜证明了叶酸修饰的金纳米棒可以有效结合A375黑色素瘤细胞。在确定了靶向效果的前提下,首次研究了GNR-PEG-FA联合nsPEF对A375黑色素瘤2D体外模拟组织消融情况的影响。实验发现,当脉冲参数强度(电压、脉冲数和宽度)增加时,细胞的消融面积呈现明显的上升趋势。但是,阈值电场强度不受脉冲电压变化的影响,而与脉冲宽度和脉冲个数呈负相关。更重要的是,与单独使用nsPEF相比,添加GNR-PEG- FA可以显著增加消融面积并有效降低电场强度阈值。因此,在合适的脉冲参数指导下,nsPEF联合GNR-PEG-FA有望成为一种安全有效的物理治疗 方法。
