黑果腺肋花楸果中总花色苷含量测定方法的比较
2021-09-28李涵涵朴昌善杨长青
赵 婧,李涵涵,千 文,朴昌善,杨长青,*
(1.中国药科大学基础医学与临床药学学院,江苏 南京 211198;2.南京珼瑞斯生物医药科技有限公司,江苏 南京 211100;3.延边日鑫生物科技有限公司,吉林 延吉 133000)
黑果腺肋花楸(Aornia melanocarpa)为蔷薇科腺肋花楸属植物。果实富含多酚、有机酸、蛋白质等多种营养物质[1],并且多酚类物质的含量在已知浆果中居于榜首[2]。花青素作为黑果腺肋花楸果的主要多酚类物质,在自然状态下通常以不稳定的花青素结构单元和糖类结合形成稳定的糖配体,即花色苷形式存在[3]。花色苷具有抗炎、抗氧化、改善视力、消除自由基、预防心脑血管疾病等多种生物活性[4-5],因此黑果腺肋花楸果具有药用开发潜力。
目前,花色苷含量的测定方法主要有pH示差法、高效液相色谱(high performance liquid chromatography,HPLC)法和高效液相色谱-质谱联用法[1]。其中,pH示差法主要采用花色苷在不同pH值的分子结构变化,进而改变颜色以定量测定[6],其测定结果通常受外界条件及辅色素转化等因素影响[7],若测定以黑果腺肋花楸果中含量最低[1,8]的矢车菊素-3-O-葡萄糖苷为标准[9-10]进行计算可能引起误差[7,11]。自然界中花色苷形式众多,标准品昂贵且不易获取,因此HPLC法大多采用1~2 种对照品为标准,通过相对分子质量校正以定量计算总花色苷含量[12-15],或采用盐酸水解糖苷的方法,通过测定花青素单体的含量间接表示花色苷含量[16],但花色苷分子质量的差异、水解后苷元稳定性降低等问题均可能会对结果造成偏差[17-18]。高效液相色谱-质谱联用法分辨率高、灵敏度高,可用于含量低、结构复杂的花色苷含量测定,也可鉴别未知结构[1,19-20],但此方法价格昂贵,不利于测定方法的普及。目前,国内鲜见采用混合标样HPLC法和以矢车菊素-3-O-半乳糖苷摩尔吸光系数为标准的pH示差法测定黑果腺肋花楸果中总花色苷含量的报道。因此,本研究运用优化前后的pH示差法和HPLC法测定延边地区4 个种植基地黑果腺肋花楸果实中总花色苷,通过比较不同方法测定结果的准确性,进而优选黑果腺肋花楸果实中总花色苷含量的最佳测定方法,以期为黑果腺肋花楸果花色苷质量标准的建立及开发提供理论依据。
1 材料与方法
1.1 材料与试剂
黑果腺肋花楸果实1~4号均由延边日鑫生物科技有限公司提供,经采摘挑选后冷冻干燥,用粉碎机粉碎,过40 目筛,于4 ℃避光密封保存。
矢车菊素-3-O-葡萄糖苷(批号DST180622-019、含量98%) 成都德思特生物技术有限公司;矢车菊素-3-O-木糖苷(批号AR9781W1,纯度98%) 宝鸡辰光生物科技有限公司;矢车菊素-3-O-半乳糖苷(批号20190612,纯度98%)、矢车菊素-3-O-阿拉伯糖苷(批号20190612,纯度98%) 南京珼瑞斯生物医药科技有限公司;乙醇(分析纯) 美国Merck Drugs &Biotechnology公司;甲醇(色谱纯) 美国TEDIA公司;磷酸溶液(分析纯) 上海凌峰化学试剂有限公司;纯化水 杭州娃哈哈集团有限公司。
1.2 仪器与设备
LC-2010AHT高效液相系统(配备四元高压泵、紫外检测器) 日本Shimadzu公司;Galaksil®EF C18色谱柱(250 mm×4.6 mm,5 μm) 无锡加莱克色谱科技有限公司;冷冻干燥机 上海比朗仪器制造有限公司;KH-250DB型数控超声波清洗器 昆山禾创超声仪器有限公司。
1.3 方法
1.3.1 花色苷的提取
取黑果腺肋花楸果粉(冷冻干燥品)0.2 g于具塞试管中,加入5 mL体积分数60%乙醇溶液(含0.096 mol/L盐酸),40 ℃超声30 min,于室温、2 500 r/min离心5 min,果渣再重复提取2 次,收集所有离心后上清液用60%乙醇溶液(含0.096 mol/L盐酸)定容至25 mL,室温保存。
1.3.2 标准溶液的配制
取矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-阿拉伯糖苷、矢车菊素-3-O-木糖苷适量,分别用盐酸-甲醇(2∶98,V/V)配制,得1 mg/mL对照品储备液;取各对照品储备液适量,用盐酸-甲醇(2∶98,V/V)制得含有矢车菊素-3-O-半乳糖苷225 μg/mL、矢车菊素-3-O-葡萄糖苷7.2 μg/mL、矢车菊素-3-O-阿拉伯糖苷72 μg/mL、矢车菊素-3-O-木糖苷30 μg/mL的混合对照品溶液,均置于4 ℃中保存备用。
1.3.3 HPLC条件
色谱柱:Galaksil®EF-C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇(A)、体积分数8.5%甲酸溶液(B),按以下条件匀速梯度洗脱:0~5 min,90%~78% A、10%~22% B;5~7.5 min,78% A、22% B;7.5~11.5 min,78%~92% A、22%~8% B;11.5~14.5 min,92%~60% A、8%~40% B;14.5~18.5 min,60% A、40% B;18.5~20 min,60%~90% A、40%~10% B;20~23 min,90% A、10% B。流速1.0 mL/min;检测波长525 nm;柱温30 ℃;进样量10 μL。
1.3.4 花色苷含量的计算
1.3.4.1 单标样HPLC法
根据SW/T 2—2013《越橘提取物国际商务标准》[21],按式(1)计算花色苷含量:

式中:i为黑果腺肋花楸果中相应花色苷组分(对照品色谱峰1~4);Ci为经标准曲线计算所得花色苷组分质量浓度/(μg/mL);V为花色苷提取液定容体积/mL;m为黑果腺肋花楸果实称样质量/g;F为稀释倍数(5);Mi为黑果腺肋花楸果中相应花色苷组分的相对分子质量;Mstda为对照品花色苷相对分子质量。
1.3.4.2 pH示差法
参照孙婧超[22]和杨萍[23]等的方法并优化。取2 份0.5 mL花色苷提取液分别加入KCl-HCl(25∶67,V/V)缓冲液(pH 1.0)、NaAc-HCl(1∶1,V/V)的缓冲液(pH 4.5)4.5 mL,避光、40 ℃恒温水浴30 min,以提取溶剂为空白对照,在515、700 nm波长处测定溶液吸光度,按式(4)、(5)分别以矢车菊素-3-O-半乳糖苷摩尔吸光系数、矢车菊素-3-O-葡萄糖苷摩尔吸光系数计算黑果腺肋花楸果中总花色苷的含量。
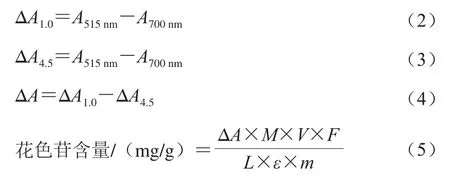
式中:ε为对照品摩尔吸光系数/(L/(mol·cm)),其中ε矢车菊素-3-O-半乳糖苷、ε矢车菊素-3-O-葡萄糖苷分别为23 505、26 900 L/(mol·cm)[9];M为对照品相对分子质量;V为最后定容的体积/mL;F为稀释倍数(10);m为黑果腺肋花楸果实称样量/g;L为比色皿的宽度(1 cm);A515nm、A700nm分别为提取液在515、700 nm波长下的吸光度;ΔA1.0、ΔA4.5为pH 1.0、4.5条件下提取液的不同波长吸光度差值;ΔA为ΔA1.0、ΔA4.5差值。
1.4 数据处理
2 结果与分析
2.1 HPLC法
2.1.1 线性范围
2.1.1.1 单标样HPLC法的标准曲线
取1.3.2节质量浓度均1 mg/mL矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷对照品储备液,分别逐级稀释得质量浓度0.5、1.0、5.0、25.0、50.0、100.0、200.0 μg/mL的系列对照品溶液,再经1.463 mol/L磷酸溶液稀释5 倍后制得0.1、0.2、1.0、5.0、10.0、20.0、40.0 μg/mL对照品溶液,进样检测[17],HPLC分析结果如图1所示。

图1 花色苷HPLC色谱图Fig.1 HPLC chromatograms of anthocyanin standards
2.1.1.2 混合标样HPLC法的标准曲线
取1.3.2节的混合对照品储备液,逐级稀释分别制得矢车菊素-3-O-半乳糖苷质量浓度24.0、48.0、96.0、120.0、150.0、180.0、225.0 μg/mL;矢车菊素-3-O-葡萄糖苷质量浓度0.8、1.5、3.1、3.8、4.8、5.8、7.2 μg/mL;矢车菊素-3-O-阿拉伯糖苷质量浓度7.9、15.4、30.7、38.4、48.0、57.6、72.0 μg/mL;矢车菊素-3-O-木糖苷质量浓度3.2、6.4、12.8、16.0、20.0、24.0、30.0 μg/mL的系列对照品混合溶液,再经1.463 mol/L磷酸溶液稀释5 倍后分别制得矢车菊素-3-O-半乳糖苷质量浓度4.8、9.6、19.2、24、30、36.4、45 μg/mL;矢车菊素-3-O-葡萄糖苷质量浓度0.2、0.3、0.6、0.8、1.0、1.1、1.4 μg/mL;矢车菊素-3-O-阿拉伯糖苷质量浓度1.5、3.1、6.1、7.7、9.6、11.5、14.4 μg/mL;矢车菊素-3-O-木糖苷质量浓度0.6、1.3、2.6、3.2、4.0、4.8、6.0 μg/mL的对照品混合溶液,进样检测[17],HPLC结果如图1C所示。花色苷溶液标准曲线结果见表1。

表1 花色苷的线性回归方程Table 1 inear regression equations for anthocyanins
2.1.2 精密度、稳定性、重复性及加样回收率
取混合对照品溶液连续进样6 次,记录各对照品色谱峰面积,计算相对标准偏差(relative standard deviation,RSD)。样品中矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-阿拉伯糖苷、矢车菊素-3-O-木糖苷峰面积的RSD(n=6)分别为0.06%、0.66%、0.18%、0.32%。表明方法的精密度良好。
取黑果腺肋花楸果粉4号样品,按1.3.1节的方法制备供试液1 份,分别于0、2、4、6、8、10、12、24 h进样分析,记录峰面积,计算RSD。样品中矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-阿拉伯糖苷、矢车菊素-3-O-木糖苷峰面积的RSD(n=8)分别为0.44%、0.69%、1.31%、2.69%。表明花色苷提取液在24 h内稳定。
取黑果腺肋花楸果粉4号样品,按1.3.1节的方法制备供试液6 份,进样后按照标准曲线法计算各成分含量。样品中矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-阿拉伯糖苷、矢车菊素-3-O-木糖苷含量分别为(15.985±0.113)、(0.219±0.003)、(5.491±0.034)、(1.467±0.013)mg/g,RSD(n=6)分别为0.71%、1.28%、0.62%、0.91%,表明方法的重复性良好。
取黑果腺肋花楸果粉4号样品0.1 g,共6 份,分别精密加入对照品溶液,按1.3.1节的方法制备供试溶液,进样分析,计算加样回收率。样品中矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-阿拉伯糖苷、矢车菊素-3-O-木糖苷回收率分别为95.03%、99.17%、95.93%、99.10%,RSD(n=6)分别为3.14%、2.54%、3.54%、3.83%,表明方法的准确度良好。
2.1.3 样品测定
取黑果腺肋花楸果粉样品1~4号,一式三份,按1.3.1节的方法制备花色苷提取液,再经1.463 mol/L磷酸溶液配制,将其稀释5 倍后进样检测[17],带入单标和混标的标准曲线,分别计算各组分花色苷单体含量及花色苷的总含量。花色苷总量数据之间采用单因素方差分析显著差异。结果如表2所示。
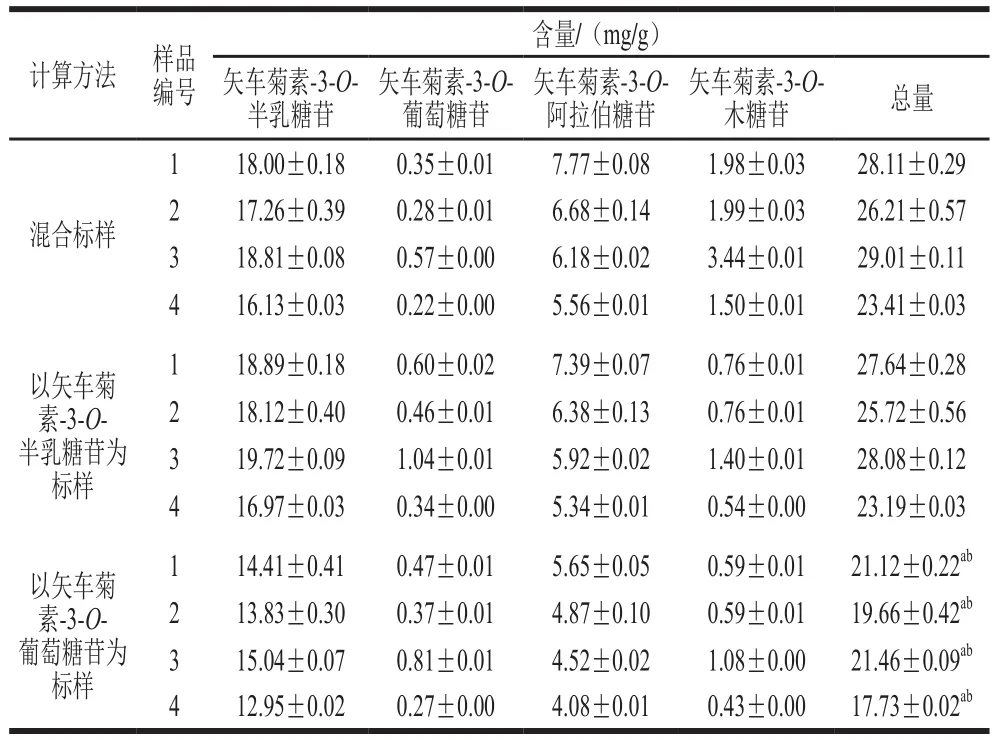
表2 HPLC法测定黑果腺肋花楸果中花色苷的含量(n=3)Table 2 Anthocyanin contents in black chokeberry determined by HPLC with different reference standards (n = 3)
以矢车菊素-3-O-葡萄糖苷为标样计算的花色苷总量均与其他2 种方法的结果比较具有显著差异(P<0.05),其原因可能与矢车菊素-3-O-葡萄糖苷在黑果腺肋花楸果中花色苷含量占比最低有关。黑果腺肋花楸果中矢车菊素-3-O-半乳糖苷约占总花色苷的65.6%,而矢车菊素-3-O-葡萄糖苷仅占2.5%[24],因此用非主要花色苷单体作为标样计算黑果腺肋花楸果中花色苷含量明显偏离真实结果。以矢车菊素-3-O-半乳糖苷为标样计算的花色苷总量与混合标样结果无显著差异(P>0.05),因此采用混合标样HPLC法计算结果最准确,但以矢车菊素-3-O-半乳糖苷为单标样的HPLC法结果可靠,且方法经济、简便,同样适用于黑果腺肋花楸果中花色苷的含量测定。
2.2 pH示差法
2.2.1 摩尔吸光系数
配制质量浓度分别为0.020、0.025、0.050、0.075、0.100、0.150、0.20 mg/mL的矢车菊素-3-O-半乳糖苷系列对照品溶液,按1.3.4.2节的方法得到对照品溶液吸光度,以对照品质量浓度为横坐标,吸光度为纵坐标,制作标准曲线,结果表明:矢车菊素-3-O-半乳糖苷在0.02~0.20 mg/mL范围内线性关系良好,得线性回归方程Y=48.481X+0.011 1(r=0.999 9),经计算矢车菊素-3-O-半乳糖苷在515 nm波长处、60%乙醇(含0.096 mol/L盐酸)溶液中摩尔吸光系数为23 505 L/(mol·cm)。采用位路路等[9]矢车菊素-3-O-葡萄糖苷吸光系数26 900 L/(mol·cm)。
2.2.2 样品测定
取黑果腺肋花楸果样品1~4号,一式三份,按1.3.1、1.3.4.2节的方法分别制备供试溶液、计算花色苷总含量。各组数据之间采用t检验比较显著性差异,结果见图2。以矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷共2 种花色苷各自摩尔吸光系数计算的结果之间存在显著差异(P<0.05)。样品1~4号中花色苷含量以矢车菊素-3-O-半乳糖苷摩尔吸光系数计算结果分别为(26.67±0.50)、(25.61±0.38)、(25.61±0.29)、(22.68±0.38)mg/g;以矢车菊素-3-O-葡萄糖苷摩尔吸光系数计算结果分别为(23.30±0.44)、(22.38±0.33)、(22.38±0.25)、(19.82±0.33)mg/g。不同溶剂、波长检测物质的摩尔吸光系数存在差异[22],因此计算过程需要考虑实际的检测波长及溶剂情况。黑果腺肋花楸果中花色苷主要以矢车菊素-3-O-半乳糖苷为主,因此以矢车菊素-3-O-葡萄糖苷摩尔吸光系数计算的结果必然会有误差[25]。结合以矢车菊素-3-O-半乳糖苷为标准的单标样HPLC法测定结果可知,使用pH示差法时以矢车菊素-3-O-半乳糖苷摩尔吸光系数计算的结果更加准确。
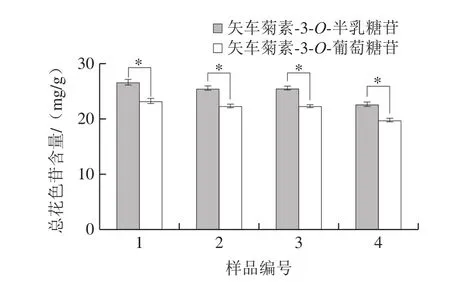
图2 基于pH示差法以矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷的摩尔吸光系数计算黑果腺肋花楸果中花色苷的含量(n=3)Fig.2 Anthocyanin contents in black chokeberry determined by pH differential method based on the molar extinction coefficients of cyanidin 3-O-galactopyranoside and cyanidin 3-O-glucoside (n = 3)
2.3 混合标样HPLC法和pH示差法的比较
黑果腺肋花楸果样品经过2.1、2.2节方法计算后,采用t检验比较混合标样HPLC法测定结果和pH示差法测定结果间显著差异的结果如图3所示。1、3号样品pH示差法测定结果与HPLC法测定结果之间存在显著差异(P<0.05),2、4号样品的2 种方法结果间无显著差异(P>0.05)。周丹蓉等[26]报道果实中花色苷含量越高,pH示差法与HPLC法所测花色苷的结果差异越大,而本实验1号和3号花色苷总含量经HPLC法测定均高于2号和4号,因此与周丹蓉等[26]的结论相符。另外4 个样品HPLC法测定的花色苷总量均高于pH示差法,这也刘玉芹[27]和Wu Xianli[28]等报道的结论一致。导致以上结果的可能原因为花色苷通常与辅色素结合,以共呈色的形式存在[29],因此花色苷含量越高,这种作用越强。这种现象往往会导致偏离朗格比尔定律[30]的现象出现,从而影响pH示差法对花色苷的含量测定。其次,pH示差法仅针对游离状态的花色苷分子,而聚合形式的花色苷在pH值分别为1.0、4.5时均有吸收[31],因此在pH值为1.0时,辅色素不完全转化导致游离态花色苷分子较少[32],可能为pH示差法结果偏低的另一个原因。此外,pH示差法还比较容易受仪器、温度、溶液pH值及操作的影响[17]。因此混合标样HPLC法测定结果比pH示差法更加准确。
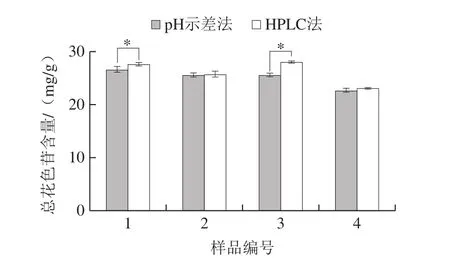
图3 pH示差法和HPLC法对花色苷总含量测定的比较(n=3)Fig.3 Comparison of total anthocyanin contents in black chokeberry determined by optimized pH differential method and HPLC (n = 3)
3 结 论
本实验对黑果腺肋花楸果中总花色苷含量测定方法进行优化和比较,结果表明:混合标样HPLC法为黑果腺肋花楸果果实总花色苷含量测定的最准确的方法,但成本较高;以矢车菊素-3-O-半乳糖苷作单标样的HPLC法操作简单、结果准确、经济成本适宜,同样适用于黑果腺肋花楸果实总花色苷的测定。本研究为黑果腺肋花楸果实及其相关产品质量标准的建立及开发提供理论依据。
