罗非鱼鱼糜自然发酵过程中微生物群落结构对其品质形成的影响
2021-09-28李春生王悦齐陈胜军李来好
赵 跃,李春生*,王悦齐,陈胜军,李来好*,黄 卉
(1.上海海洋大学食品学院,上海 201306;2.中国水产科学研究院南海水产研究所,农业农村部水产品加工重点实验室,广东 广州 510300)
罗非鱼(Tilapia)是我国南方最主要的淡水养殖品种之一,凭借生长速度快、繁殖量大、容易养殖、产量高等特点,逐渐成为全球关注的淡水养殖鱼类[1]。2019年我国罗非鱼的总产量达到164.2万 t,较2018年产量提高了1.05%[2]。近几年,我国罗非鱼养殖产量占全球罗非鱼总产量的近50%[3]。目前,罗非鱼加工产品形式单一,大部分加工成鱼片出口,精深加工产品少,产品附加值低[4]。因此,合理利用罗非鱼资源,开发切实有效的加工技术,已成为我国罗非鱼产业持续健康发展的当务之急。鱼糜加工是目前国内外发展较快的鱼制品加工方式。鱼糜制品具有高蛋白、低脂肪、口感嫩爽、食用方便等特点,并且产量逐年增加。由于海水鱼鱼糜具有良好的凝胶特性,市场上鱼糜制品的生产原料多采用海水鱼[5]。研究发现,罗非鱼鱼肉中盐溶性蛋白含量低,应用传统鱼糜加工方式加工形成的鱼糜制品凝胶强度差,极大地限制了罗非鱼鱼糜加工的应用[4]。因此提高罗非鱼鱼糜凝胶强度,开发高品质罗非鱼鱼糜制品,已成为罗非鱼鱼糜加工亟待解决的关键问题。
利用微生物发酵技术提高淡水鱼鱼糜品质是目前研究的热点。发酵鱼糜一般使用乳酸菌作为发酵剂,依靠快速降低的pH值促进鱼肉凝胶化,抑制有害微生物的生长[6-7]。同时,乳酸菌发酵作用使鱼糜的蛋白质、脂肪或碳水化合物发生不同变化,形成其特有的风味与口感[8]。国内外对发酵鱼糜的研究主要集中于利用市售的乳酸菌等微生物菌种作为发酵剂,分析加菌发酵对鱼糜品质和风味等相关理化指标的影响。杨方[9]利用Lactobacillus plantarum发酵鲢鱼鱼糜,建立发酵鱼糜体系和酸性模拟体系,探讨鱼肉内源酶对发酵鱼糜凝胶特性的影响。Liu Zhongyi等[6]利用L.casei、Streptococcuslactis、Saccharomyces cerevisiae和Monascus anka混合发酵鳙鱼鱼糜,结果发现加菌发酵后的鱼糜在味道和外观上都优于未加菌的对照组。王洋等[7]利用L.pentosus、L.plantarum、Staphylococcus sciuri、Staphylococcus xylosus等复合发酵剂发酵鲟鱼鱼糜,其产品具有优良的感官品质和理化特性。然而,目前发酵鱼糜研究主要集中鲢鱼、鳙鱼、草鱼、鲟鱼等淡水鱼,对罗非鱼鱼糜发酵过程品质变化的研究鲜见相关报道。
发酵鱼糜一般采用添加单菌或复合菌剂的方式进行发酵生产,然而由于鱼糜原料中微生物菌群比较复杂,实际的鱼糜品质形成过程是由复杂的微生物菌群代谢活动引起。明确发酵鱼糜复杂微生物群落的结构及其功能调控是实现发酵鱼糜产业升级的重要环节。然而,目前绝大部分研究并未考虑微生物群落结构及其代谢活动对发酵鱼糜品质的影响。而且,由于不同淡水鱼鱼糜中蛋白质、脂质等营养物质差异较大,盲目使用微生物发酵剂不仅不会改善鱼糜品质,而且会与原料自身优势菌群发生竞争性抑制,大大降低发酵鱼糜的品质。因此,如何筛选适用于特定淡水鱼鱼糜的功能微生物是发酵鱼糜研究的难点。目前,基于16S/18S/ITS的二代高通量测序技术已较为普遍地应用于传统发酵食品微生物菌群多样性研究。朱雯娟等[10]利用16S rRNA高通量测序技术对梅香鱼样品的微生物菌群进行分析,发现Lactobacillus、Staphylococcus和Tetragenococcus是参与梅香鱼发酵过程的优势菌属。Wang Zongmin等[11-12]通过16S rRNA和ITS高通量测序技术,明确了Acetobacter、Lactobacillus、Enhydrobacter、Lactococcus、Gluconacetobacer、Bacillus、Staphylococcus7 个微生物菌属是镇江香醋中产生独特风味的核心微生物菌群。利用16S rRNA高通量测序技术能够解析罗非鱼发酵鱼糜中的微生物菌群,进一步利用Pearson、主成分分析(principal component analysis,PCA)等统计学分析方法能够揭示微生物菌群对发酵鱼糜品质形成的影响规律,有利于定向筛选适用于特定淡水鱼鱼糜的功能微生物,避免所用微生物发酵剂不合适或效果差,降低了发酵剂选择盲目性,节省了发酵鱼糜生产成本。
因此,本研究以罗非鱼鱼糜为研究对象,利用16S rRNA高通量测序技术揭示罗非鱼鱼糜自然发酵过程中微生物菌群变化情况,结合罗非鱼鱼糜发酵过程中质构、凝胶强度、色度等品质变化结果,借助Pearson、PCA等统计学分析方法揭示微生物菌群对发酵鱼糜品质形成的影响规律,为定向分离筛选适用于罗非鱼发酵鱼糜的功能微生物、靶向改善罗非鱼发酵鱼糜品质提供一定理论依据。
1 材料与方法
1.1 材料与试剂
罗非鱼、食盐、蔗糖和葡萄糖(食品级) 广东广州市海珠区客村华润万家超市。
PCA培养基 广东环凯微生物科技有限公司;FastDNA®Spin Kit for Soil DNA抽提试剂盒 美国MP Biomedicals公司;NEXTFLEX®Rapid DNA-Seq Kit建库试剂盒 美国Bioo Scientific公司;MiSeq Reagent Kit v3测序试剂盒 美国Illumina公司;Biowest Agarose琼脂糖西班牙Biowest公司;FastPfu Polymerase聚合酶 中国TransGen公司。
1.2 仪器与设备
IKA-T25组织匀浆机 德国IKA公司;CT3质构仪美国Brookfield公司;3K30台式高速冷冻离心机 德国Sigma公司;SZ-22绞肉机 湖南省长沙固利食品机械有限公司;CR-410全自动色差仪 日本柯尼卡美能达光学影像公司;QuantusTMFluorometer微型荧光剂 美国Promega公司;Illumina MiSeq测序仪 美国Illumina公司;ABI GeneAmp®9700型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司。
1.3 方法
1.3.1 罗非鱼发酵鱼糜制备
在市场购买鲜活罗非鱼(500~750 g/条)后,立刻运往实验室,去头、去鳞、去内脏,取背部鱼肉并用冷水冲洗,然后用绞肉机绞碎成鱼糜。在低温环境下(4 ℃),将鱼糜与0.5%葡萄糖、2%食盐、0.5%蔗糖等辅料斩拌均匀。使用手动灌肠机灌入直径30 mm的塑料肠衣中,每根长约15 cm,然后置于30 ℃恒温恒湿培养箱中发酵30 h,分别在第0、18、24、30小时取样分析(标记为C0、C18、C24、C30)。
1.3.2 16 S rRNA高通量测序
将3.0 g发酵香肠充分搅碎后,置于27 mL生理盐水中充分混匀,取含菌的生理盐水在12 000 r/min、4 ℃离心10 min,获得菌体沉淀。16S rRNA高通量测序参照文献[8]方法。采用FastDNA®Spin Kit for Soil试剂盒说明书进行微生物群落总DNA抽提,利用NanoDrop2000检测DNA纯度和浓度。采用上游引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和下游引物806R(5’-GGACTACHVGGGTWTCTAAT-3’)对16S rRNA基因V3-V4可变区进行PCR扩增,扩增程序如下:95 ℃预变性3 min;95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸45 s,27 个循环;然后72 ℃稳定延伸10 min,最后在10 ℃进行保存。PCR产物经2%琼脂糖凝胶电泳鉴定后,使用AxyPrep DNA Gel Extraction Kit纯化,用QuantusTMFluorometer进行检测定量,使用NEXTFLEX®Rapid DNA-Seq Kit进行建库,利用Illumina MiSeq PE300进行双末端测序。
1.3.3 质构分析
将发酵香肠切成高25 mm且切面平整的圆柱体,采用质构仪测定发酵鱼糜的硬度、弹性、黏性、内聚力、咀嚼性等质构特性。选用4 mm TA44平底圆柱形探头,TA-RT-KIT夹具,测试速率1 mm/s,距离目标值15 mm,每个样品进行轴向压缩2 次,2 次下压间隔时间1 s,触发点负载5 g。每次实验做5 次平行,取平均值。
1.3.4 凝胶强度分析
将发酵香肠切成高25 mm且切面平整的圆柱体,采用质构仪分析鱼糜凝胶的凝胶强度。选用压缩模式测定香肠凝胶的破断强度(g)和凹陷深度(cm),选用直径5 mm球形探头压缩样品,下压位移设置为15 mm,触发点负载5 g,测试速率1 mm/s。每次实验做5 个平行,取平均值。凝胶强度按式(1)计算:

1.3.5 色差分析
将发酵香肠切成25 mm且切面平整的圆柱体,采用全自动色彩色差仪在457 nm波长处用标准白板对仪器进行校对,然后测定鱼糜凝胶的亮度(L*)值、红/绿(a*)值、黄/蓝(b*)值,按式(2)计算白度值(W):
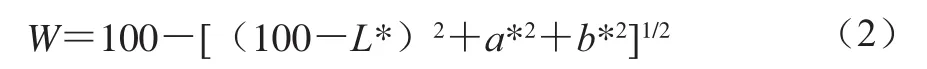
1.3.6 pH值测定
将5.0 g发酵香肠置于45 mL超纯水中匀浆,10 000 r/min离心10 min取上清液,用酸度计测定pH值。
1.3.7 菌落总数测定
将3.0 g发酵香肠充分搅碎后,置于27 mL生理盐水中充分混匀,梯度稀释后,涂布于PCA培养基上,将平板倒置于37 ℃培养箱内培养24 h后计数。
1.4 数据分析
1.4.1 微生物菌群结构分析
采用Fastp(v0.19.6)软件对16S rRNA高通量测序原始序列进行质控,利用Flash(v1.2.11)软件将双末端测序得到的成对reads进行组装拼接。使用UPARSE(v7.0.1090)软件在97%相似度条件下进行操作分类单元(operational taxonomic units,OTU)聚类并剔除嵌合体,利用RDP classifer(v2.11)软件比对Silva 16S rRNA数据库(v138)进行物种分类注释。分别采用Mothur(v1.30.2)和QIIME(v1.9.1)软件计算样品的α多样性值和β多样性值。
1.4.2 统计学分析
采用单因素方差分析中的Tukey-Kramer检验方法,“*”表示不同微生物菌群在不同发酵时间下菌群差异显著(P<0.05),利用Pearson、PCA等统计学方法分析微生物菌群与发酵鱼糜品质变化的相关性。
2 结果与分析
2.1 16S rRNA高通量测序数据统计
利用Illumina MiSeq测序技术研究罗非鱼发酵鱼糜微生物群落结构和多样性变化,如表1所示。8 个样品共得到368 664 条序列,平均每个样品46 083 条序列,平均长度约为428 bp。序列经过优化后,在97%相似度下将其聚类为用于物种分类的OTU。8 个样品共获得246 种OTU,其中发酵24 h的OTU种类最多,平均值达到117 种。
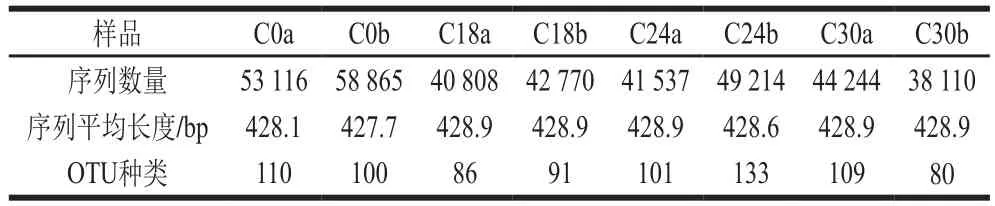
表1 罗非鱼鱼糜自然发酵过程中微生物16S rRNA高通量测序数据统计Table 1 Statistics of bacterial 16S rRNA gene sequencing data for tilapia surimi during natural fermentation
2.2 罗非鱼鱼糜发酵过程中微生物多样性变化
2.2.1α多样性分析
α多样性是对单个样品中物种多样性进行分析,Sobs指数、Chao指数和ACE指数反映样品中群落的丰富度,不考虑群落中每个物种的丰度情况,而Shannon指数和Simpson指数则同时考虑群落中物种丰富度和物种均匀度的影响。覆盖率反映各样本文库的覆盖程度,即样本中序列被测出的概率。如表2所示,Sobs指数、Chao指数和ACE指数结果显示,发酵到第24小时,样品中的微生物丰富度最高;Shannon指数和Simpson指数结果显示,未发酵时物种的均匀度最高,自然发酵能降低物种的均匀度,发酵后期(24~30 h)物种的均匀度最小;所有发酵时间样品的序列被捕获概率均大于0.999,表明测序结果的完整度较高。

表2 不同发酵时间罗非鱼鱼糜微生物α多样性分析Table 2 α-Diversity analysis of microbial community in tilapia surimi at different fermentation stages
2.2.2 独有和特有的OTU组成分析
如图1所示,4 个发酵时间点共有的微生物种类为54 种;发酵后期即发酵24 h和30 h共有微生物种类最多,达到105 种;发酵24 h时,独有的微生物种类最多,达到47 种。
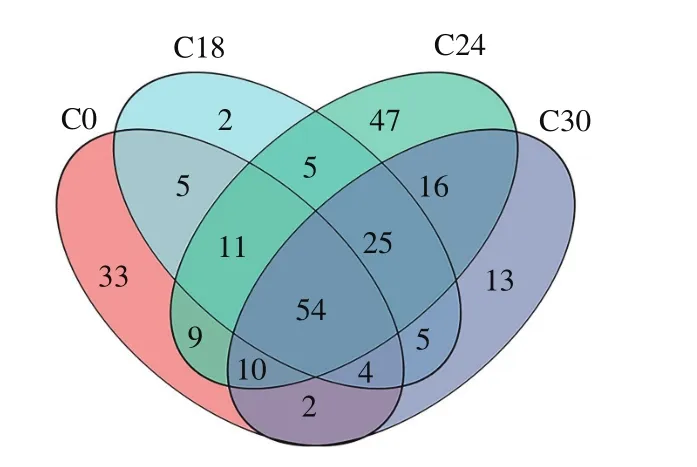
图1 不同发酵时间罗非鱼鱼糜微生物群落Venn图Fig.1 Venn diagram analysis of microbial community in tilapia surimi at different fermentation stages
2.2.3β多样性分析
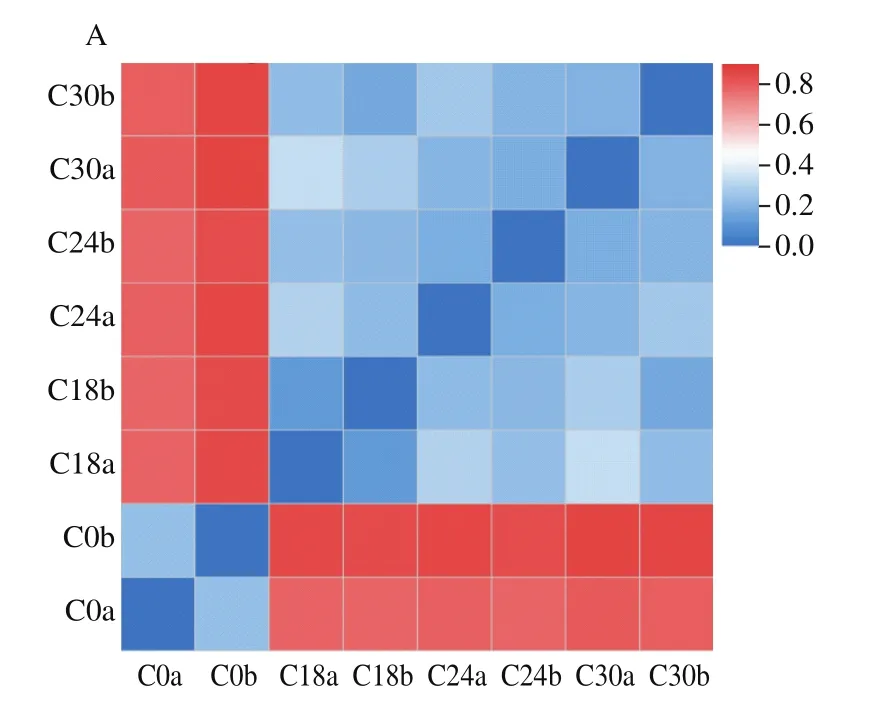
在OTU分类水平上采用Bray-Curtis、unweighted UniFrac和weighted UniFrac距离算法比较不同发酵时间罗非鱼鱼糜β多样性,结果如图2所示。Bray-Curtis的计算只考虑样品中物种的存在情况,而不考虑序列间的进化距离。结果显示,平行样品间微生物菌群差异较小,发酵18、24 h和30 h样品的微生物菌群差异较小,而与未发酵鱼糜中微生物菌群的差异较大(图2A)。UniFrac是利用系统进化的信息比较不同样品间物种群落差异,其中unweighted UniFrac不考虑物种丰度,而weighted UniFrac考虑物种丰度。在不考虑物种丰度(图2B)和考虑物种丰度(图2C)的情况下,其分析结果均与Bray-Curtis结果相似,平行样品间微生物菌群差异最小,罗非鱼鱼糜自然发酵后(18~30 h)与未发酵鱼糜的菌群差异较大。
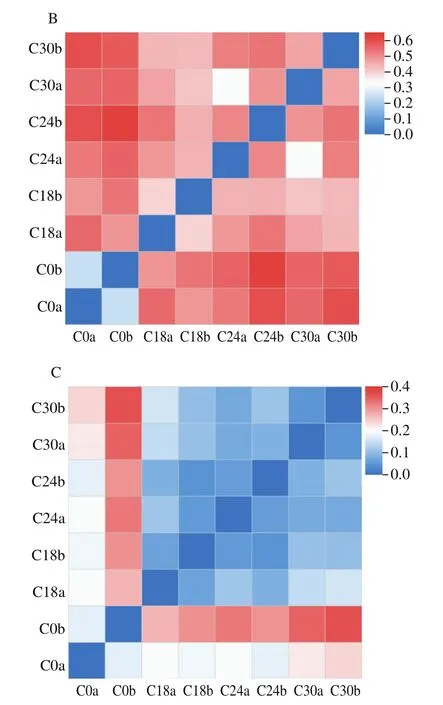
图2 不同发酵时间罗非鱼鱼糜微生物菌群β多样性热图Fig.2 Heatmap for β-diversity of microbial community in tilapia surimi at different fermentation stages
2.3 罗非鱼鱼糜发酵过程中微生物群落结构变化
罗非鱼鱼糜在自然发酵条件下微生物菌群变化较为明显(图3)。在门水平上(图3A),Firmicutes和Proteobacteria为整个发酵过程主要微生物菌门,随着发酵时间的延长,Firmicutes中的微生物相对含量逐渐增加,而Proteobacteria相对含量逐渐下降。这与传统猪肉干制香肠[13]和自然发酵鱼露[14]发酵过程门水平上微生物菌群变化结果相似。自然发酵30 h后,Firmicutes成为最主要微生物菌群,相对含量接近90%。

图3 不同发酵时间罗非鱼鱼糜微生物菌群在门(A)和属(B)水平的相对丰度Fig.3 Relative abundance of microbial community in tilapia surimi at different fermentation stages at phylum (A) and genus (B) levels
在属水平上(图3B),Lactococcus、Macrococcus、Enterobacter、Citrobacter、Enterococcus等微生物菌属在整个发酵过程中的变化具有显著差异(P<0.05)。未发酵前罗非鱼鱼糜原料中Macrococcus(29.0%)、Acinetobacter(22.2%)、Lactococcus(12.6%)、Floricoccus(11.5%)、Streptococcus(6.9%)为主要微生物菌群。Lactococcus在自然发酵18 h内的相对丰度显著增长到64.9%,并在随后的发酵过程中(18~30 h)相对丰度保持稳定,因而是罗非鱼发酵鱼糜中主要的微生物菌属。Lactococcus在鱼茶[15]、豆腐乳[16]等其他发酵食品中也是主要的发酵菌属。值得注意的是,Pediococcus在罗非鱼鱼糜原料中的相对丰度较低(0.02%),随着发酵时间的延长而增长迅速,发酵30 h的相对含量仅次于Lactococcus,达到13.2%。此外,Enterococcus和Lactobacillus等微生物菌属的相对丰度也随着发酵时间的延长呈增长趋势。由此可见,Lactococcus、Pediococcus、Enterococcus、Lactobacillus等微生物菌属均可适应罗非鱼鱼糜发酵环境,这些微生物的代谢作用可能对发酵鱼糜品质的形成有很大的影响。
随着发酵时间的延长,Macrococcus、Acinetobacter、Streptococcus、Floricoccus、Rothia、Enhydrobacter、Psychrobacter、Pseudomonas、Chryseobacterium等微生物菌属的相对含量呈降低趋势,同时,Enterobacter、Citrobacter、Photobacterium、Aeromonas、Plesiomonas、Vagococcus、Vibrio在发酵18 h时呈显著增长趋势,但发酵后期(24~30 h)含量又逐渐下降。由此可见,这些微生物菌属可能不适应罗非鱼鱼糜的弱酸性厌氧发酵环境。Yin等[17]相关研究报道表明添加乳酸菌能显著抑制发酵鲭鱼糜中Pseudomonas、Staphylococcus和Enterobacteriaceae的生长,并在发酵12 h后即成为优势菌种。因此,发酵后期罗非鱼发酵鱼糜中有害微生物丰度的显著降低可能与Lactococcus、Pediococcus、Enterococcus、Lactobacillus等乳酸菌的大量繁殖有关。
2.4 罗非鱼鱼糜发酵过程中品质特征变化
如图4所示,凝胶强度是衡量鱼糜凝胶制品品质最基本的指标之一。一般来说,具有令人愉悦的弹性口感的凝胶强度在300 g·cm以上[18],而使用加热法生产的罗非鱼鱼糜的凝胶强度只有200 g·cm左右[4]。本研究发现,自然发酵能够显著提高罗非鱼鱼糜的凝胶强度,发酵18 h罗非鱼鱼糜的凝胶强度超过450 g·cm,发酵30 h超过670 g·cm。而且,利用发酵方法得到的罗非鱼鱼糜的凝胶强度也优于加热法生产的混合海水鱼(马鲛鱼、海鲈鱼、金鲳鱼等)的罗非鱼鱼糜[19]。白度也是评价鱼糜凝胶制品的标准之一,它直接影响消费者对商品的可接受程度,对于鱼糜制品而言,白度越高产品越受消费者喜爱[20]。结果发现,自然发酵能显著提高鱼糜的白度,且发酵时间(18~30 h)对鱼糜白度的影响无显著性差异。发酵后罗非鱼鱼糜的白度值明显优于加热法生产的罗非鱼鱼糜,且优于海鲈鱼、黄花鱼、金鲳鱼、红三鱼、马鲛鱼等海水鱼鱼糜[4]。罗非鱼鱼糜发酵过程中菌落总数呈逐渐上升趋势,可能与Lactococcus、Pediococcus、Enterococcus、Lactobacillus等乳酸菌的大量繁殖有关。同时,罗非鱼鱼糜的pH值在18 h内迅速下降,发酵后期(24~30 h)则降速减缓。菌落总数和pH值变化结果与自然发酵鲢鱼鱼糜的结果一致[21]。pH值是影响鱼糜凝胶形成的重要因素,研究表明,由于pH值的变化可以改变氨基酸残基侧链的电荷分布,蛋白质分子在等电点处所带的静电荷为0,蛋白质分子间就失去了静电斥力作用,使蛋白分子相互迅速聚集,使产品产生较佳的硬度与弹性[22]。本研究中,罗非鱼鱼糜发酵过程中pH值的下降对其凝胶强度的改善起着重要作用。
质构特性是影响发酵香肠品质的重要因素,优良发酵香肠的组织结构应该是紧密且切片富有弹力,其中,硬度、弹性和黏性能比较好反映鱼糜制品的感官适口性,是表征香肠质地特征的重要力学参数[23]。如图4所示,罗非鱼鱼糜发酵前的黏性较高,而随着发酵的进行,鱼糜由溶胶状态变为胶状组织,使其黏性逐渐下降。硬度是指第1次压缩样品时的压力峰值,可衡量其熟化程度,通常是由鱼肉蛋白的变性和凝胶化以及水分的损失引起。罗非鱼发酵鱼糜的硬度在发酵过程中始终保持增长趋势,并在第30小时达到最大。弹性反映的是试样在第1次压缩形变后能够再复原的程度;内聚性反映形成食品形态所需内部结合力的大小[24];咀嚼性反映了鱼糜制品从咀嚼的状态到可吞咽状态所需要的能量,咀嚼性越高“咬感”就越好[25]。罗非鱼发酵鱼糜的弹性、内聚性和咀嚼性在发酵过程中的变化趋势相同,表现为在发酵前18 h明显下降并在24 h达到最大值。发酵24 h时,罗非鱼发酵鱼糜具有更佳的硬度与弹性,此特性有助于发酵鱼肉香肠被切成薄片。
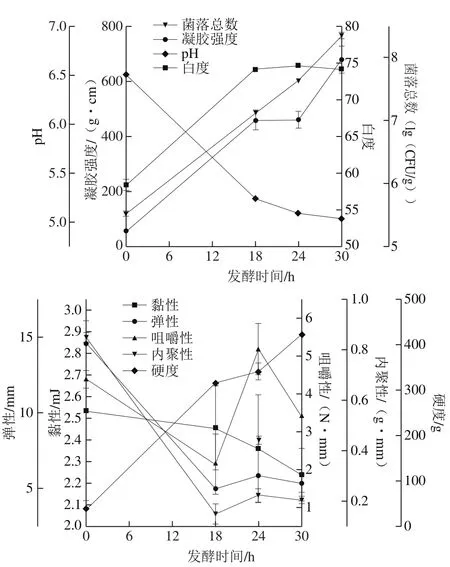
图4 不同发酵时间罗非鱼鱼糜的品质特征变化Fig.4 Changes in quality characteristic of tilapia surimi at different fermentation stages
2.5 微生物群落结构对罗非鱼发酵鱼糜品质特性变化的影响规律
为研究微生物群落结构对罗非鱼发酵鱼糜品质特性变化的影响规律,筛选相对丰度前10的菌属(Lactococcus、Macrococcus、Acinetobacter、Enterobacter、Pediococcus、Citrobacter、Floricoccus、Streptococcus、Enterococcus、Rothia),结合发酵鱼糜品质指标(凝胶强度、白度、菌落总数、pH值、黏性、弹性、咀嚼性、内聚性、硬度),利用Pearson和PCA等统计学分析方法研究微生物群落结构与鱼糜品质的相关性。
如图5A所示,凝胶强度、白度、硬度等关键鱼糜品质指标之间具有显著正相关(P<0.05),同时与菌落总数、Pediococcus、Enterobacter、Citrobacter、Enterococcus、Lactococcus表现出正相关,特别是与Lactococcus的正相关最为显著(P<0.05),相关系数分别达到0.907、0.980、0.957;与内聚性、弹性和pH值以及Acinetobacter、Rothia、Floricoccus、Streptococcus、Macrococcus等菌属具有显著负相关(P<0.05),而与咀嚼性和黏性均无显著相关。PCA作为一种多变量的相关性分析方法,已被应用于分析中国米酒[26]和韩国Saeu-jeot[27]等发酵食品中主要的菌群与化学物质之间的关系。本研究中,利用PCA方法比较微生物菌群与鱼糜品质的相关性,如图5B所示。结果显示,PCl的方差贡献率为77.7%,PC2的方差贡献率为9.6%,这2 个PC可以反映全部信息的87.3%,提取较为完全,说明这2 个PC能够替代原始19 个成分反映样品信息。结果显示,就不同发酵阶段而言,罗非鱼鱼糜发酵后(18、24、30 h)的样本与鱼糜原料(0 h)的差异性较大。PCA相关性分析结果与Pearson聚类结果类似,19 个成分明显分为两大类,一类为凝胶强度、白度、菌落总数、硬度、Lactococcus、Enterobacter、Pediococcus、Citrobacter、Enterococcus,另一类为pH值、黏性、弹性、咀嚼性、内聚性、Macrococcus、Acinetobacter、Floricoccus、Streptococcus、Rothia,每个类别内的成分之间呈正相关,2 个类别间的成分呈负相关,其中发酵过程中Lactococcus相对丰度的增加与凝胶强度、白度、硬度的提高以及鱼糜pH值的下降相关性最为显著(P<0.05)。Pearson相关性分析和PCA结果表明,罗非鱼发酵鱼糜中Lactococcus、Pediococcus、Enterobacter、Citrobacter、Enterococcus等产酸菌的代谢作用导致发酵鱼糜的pH值逐渐下降,从而促进了凝胶强度、白度、硬度等关键鱼糜品质指标的改善。

图5 利用Pearson(A)和PCA(B)方法分析微生物群落结构与罗非鱼发酵鱼糜品质的相关性Fig.5 Correlation analysis of microbial community with quality indexes in fermented tilapia surimi using Pearson correlation analysis (A) and PCA (B)
Lactobacillus、Pediococcus等乳酸菌属经常被用作商业发酵剂用于淡水鱼鱼糜发酵,有助于发酵鱼糜形成良好的品质[21,28-29]。而本研究中相对丰度最高的Lactococcus在淡水鱼发酵鱼糜的应用较少。尽管Enterococcus并未列入欧盟安全合理推定和美国公认安全认证的安全性菌属名单,但有研究报道发现,Enterococcus是奶酪和香肠发酵过程中常见的微生物菌属,对其品质和风味形成起着重要的作用[28,30]。本研究表明,Lactococcus、Pediococcus、Enterococcus等乳酸菌属,特别是Lactococcus和Pediococcus与罗非鱼发酵鱼糜品质形成密切相关。
3 结 论
采用16S rRNA高通量测序技术研究罗非鱼鱼糜自然发酵过程中微生物群落结构以及多样性变化。罗非鱼鱼糜发酵过程中微生物多样性较为丰富,并在发酵第24小时的OTU总数和独有的种类最多,发酵18、24和30 h样品的微生物菌群差异较小,而与发酵初期(0 h)菌群差异较大。Firmicutes和Proteobacteria为整个发酵过程主要微生物菌门,随着发酵时间的延长,Firmicutes中的微生物相对含量逐渐增加,而Proteobacteria相对含量逐渐下降。Lactococcus、Pediococcus、Enterococcus、Lactobacillus等微生物菌属均可适应罗非鱼鱼糜发酵环境,随着发酵时间的延长而迅速增长。Lactococcus是罗非鱼发酵鱼糜中主要的微生物菌属,在自然发酵18 h内的相对丰度从12.6%显著增长到64.9%,并在随后的发酵过程中保持稳定,其次是Pediococcus,发酵第30小时的相对含量达到13.2%。随着发酵时间的延长,凝胶强度、白度、硬度、菌落总数等品质指标逐渐增加,pH值、黏性、弹性、咀嚼性、内聚性等品质指标与发酵前相比有所下降。Pearson相关性分析和PCA发现,罗非鱼发酵鱼糜中Lactococcus、Pediococcus、Enterococcus、Enterobacter、Citrobacter等产酸菌属与凝胶强度、白度、硬度等关键鱼糜品质指标呈正相关而与pH值呈负相关,这些菌的代谢作用(特别是产酸特性)对于发酵鱼糜品质的形成发挥着重要作用。基于本实验结果,后续可以从Lactococcus、Pediococcus等乳酸菌中定向分离筛选菌株,开发适用于罗非鱼鱼糜的发酵剂,用于靶向改善罗非鱼发酵鱼糜品质,本研究结果也为其他淡水鱼鱼糜发酵菌株的定向筛选提供了重要技术参考。
