草铵膦和草甘膦在水环境中的行为和毒性效应研究进展
2021-09-22孟秀柔宋青梅王飞唐守英张钰萍
孟秀柔,宋青梅,王飞,唐守英,张钰萍
贵州大学精细化工研究开发中心,绿色农药与农业生物工程国家重点实验室,教育部绿色农药与生物工程重点实验室,贵阳 550025
我国是农业大国,每年用于农业生产的农药数量和种类很多。近年来,我国每年使用农药制剂约100万t,防治面积达3亿hm2以上,且这个数据还在逐年上升[1]。农田化学除草剂的使用,是农业增产、农民增收的重要保障,在除草剂种类不断增加、作物面积不断扩大、除草剂用量不断增加的同时,除草剂使用带来的一系列环境问题逐渐引起重视[2]。农药在农业生产使用的过程中,可以通过地表径流、雨水冲刷以及地下水渗透等过程进入水体中[3]。残留于水体中的农药成分对于水中的植物、动物等会产生一定的影响,藻类、鱼类作为水中的生产者和消费者,对水环境的变化会产生各种生理响应。
草铵膦和草甘膦作为最常用的有机磷类除草剂,在使用过程中的环境问题一直是研究热点之一。草铵膦和草甘膦均为灭生性广谱除草剂,具有高效、低毒等特性,常用于防治禾本科杂草和阔叶杂草。草铵膦和草甘膦由于结构比较相似(图1),都易溶于水,在水溶液中较稳定,环境残留分析方法也相似[4-6]。

图1 草铵膦和草甘膦的结构式Fig. 1 Structural formulas for glufosinate and glyphosate
尽管目前在世界范围内的不同的水环境中都发现这2种农药残留[7]。但对2种农药在水环境中的行为以及对水生生物的毒性效应的研究尚不够全面,因此,展开2种除草剂在水环境的行为研究及其在水环境中毒性效应的研究具有重要意义和价值。本文在简介2种除草剂的特性及使用的基础上,重点总结了2种农药在水体中的环境行为和对水生生态环境的影响,以期为2种农药的研究和合理使用提供有益借鉴。
1 概述(Summary)
1.1 草铵膦概述
草铵膦,别名草胺膦、保仕达、草铵膦铵盐、双丙氨磷,是由赫斯特公司研发的一类触杀型除草剂。原药为白色结晶,有轻微气味,熔点210 ℃,在水中溶解度为1 370 g·L-1(22 ℃),在一般有机溶剂中溶解度较低,对光稳定。主要剂型为水剂。草铵膦是L-和D-对映异构体的外消旋物,其中L-对映异构体是潜在的谷氨酰胺合成酶抑制剂,是主要的杀草活性成分,而D-对映异构体则无杀草活性[8]。
由于草铵膦与谷氨酸有相似的结构,其除草机制是通过不可逆地抑制杂草中的谷氨酰胺合成酶(植物氨解毒所必需的),阻碍谷氨酰胺的合成,导致短时间内植物体内氨的过度积累,造成铵代谢紊乱,破坏细胞膜,抑制植物光合作用从而导致植物死亡[9]。目前主要用于防治果园、葡萄园、马铃薯田和非耕地等一年生和多年生的双子叶禾本科杂草[10]。近年来,随着抗草铵膦转基因作物种类逐渐增多,推广范围不断扩大,草铵膦的使用量正在逐年上升,草铵膦成为了世界上仅次于草甘膦的第二大转基因作物耐受除草剂。据中国农药信息网的农药注册数据显示,2019年在我国注册使用的草铵膦产品达400余种。
与目前国际上使用量最大的草甘膦除草剂相比,草铵膦生产工艺复杂,成本较高,制约了草铵膦的推广与使用。但草铵膦除具有除草活性外,还具有杀虫杀菌活性,可以与杀虫剂等混配,达到虫草同时防治的效果。且草铵膦杀草速度快,一般在施药后的1 d内即可使杂草停止生长,2~3 d内即出现失绿、黄化现象,1~2周内可使杂草死亡,一个月内不长出新根。施药后在土壤中即可被微生物分解,且分解速度快,不易伤及农作物根系。草铵膦在防治果园和非耕地杂草上有着用量少、效果好、除草迅速等优点,且对于对常规除草剂产生抗性的杂草也有良好的防治效果[11]。
1.2 草甘膦概述
草甘膦,又称镇草宁、农达、草干膦,是孟山都公司生产的内吸型除草剂,是目前国际上使用量最大的除草剂。目前市场上使用的草甘膦制剂有水剂和粉剂2种,其中水剂由于使用方便等因素,占大多数。纯品为非挥发性白色无味固体,难溶于无水乙醇、乙醚和苯等有机溶剂。25 ℃时在水中(pH 7)的溶解度为15.7 g·L-1,其异丙铵盐在水中的溶解度较大,pH 7时溶解度为900 g·L-1[12]。对40多科的植物有防除作用,包括单子叶和双子叶、一年生和多年生、草木和灌木等植物。
草甘膦的除草机制主要通过抑制植物体内的烯醇丙酮基莽草素磷酸合成酶,从而抑制莽草素向苯丙氨酸、酪氨酸及色氨酸的转化,使蛋白质合成受到干扰,导致植物体死亡。对多年生深根杂草的地下组织破坏力很强,适用于甘蔗、茶、桑、麻、剑麻、橡胶、林木和果树等种植地进行灭生性除草。随着抗草甘膦转基因作物在世界各地的推广,草甘膦的使用量与日俱增。
2 2种除草剂在水体中的环境行为(Environmental behavior of two herbicides in water)
2.1 草铵膦在水环境中的行为研究
施用于土壤环境中的草铵膦由于其很强的水溶性,很容易转移到水环境中,造成水环境的污染[13]。草铵膦在加拿大环境中推测的环境期望浓度(EEC)值为1 mg·L-1[14]。在中国海南省的香蕉园附近水样的检测中,检测出草铵膦的质量浓度为0.63 μg·L-1[15]。关于草铵膦在水生环境中生物体的富集研究,目前相关文献较少。
2.1.1 草铵膦在水环境中的迁移
农药在水体中的迁移转化主要包括光解和挥发、水解、吸附和解吸附等途径[16]。使用摇瓶法测定草铵膦的正辛醇-水分配系数时,在3种不同体积比(12∶1、6∶1、3∶1)的正辛醇-水条件下测得的平均分配系数为-3.49[17]。由于草铵膦的正辛醇-水分配系数较小,因此可推测草铵膦在水生生物群体中有较小的生物富集因子。且有文献报道,草铵膦及其代谢物由于水溶性高,在水环境中不易转移到其他生物体中,也不易在鱼类或其他动物的脂肪组织中积累[18]。
2.1.2 草铵膦在水体中的降解
草铵膦在水中的降解速率受pH、温度和光照强度等的影响。有研究表明,草铵膦在不同pH(5.0、6.9、9.3)缓冲溶液中的半衰期分别为433、693和533 d,可稳定存在于弱酸和弱碱条件下;温度对草铵膦的水解影响显著,随着温度的升高,草铵膦的水解速率加快;草铵膦在4 500 lx和8 300 lx氙灯下的半衰期分别为1 155 h和866 h;在360 nm和254 nm波长紫外光光照处理下的半衰期分别为462 h和40 h,不同光强和波长对草铵膦在水中的光解速率有显著影响[19]。在对映体水平上开展的试验结果表明,D,L-草铵膦对映体在pH值为5、7、9的无菌缓冲溶液中的半衰期可达400 d以上。在自然来源的池塘水中,L-草铵膦的降解速度略快于D-草铵膦,100 d时L-草铵膦的降解率为21.4%,D-草铵膦的降解率为15%[20]。草铵膦在自然水环境(pH值为5~9)中稳定,不易被水解和光解。将溶解在砾石坑地表水中的草铵膦置于25 ℃的紫外线照射下118 h(相当于33 d的阳光照射),草铵膦在该条件下几乎没有降解,3%~5%转化为3-甲基膦酸丙酸(MPP),其结构如图2所示,另有0.2%矿化。可见在地表水中草铵膦的光降解作用较弱[21]。
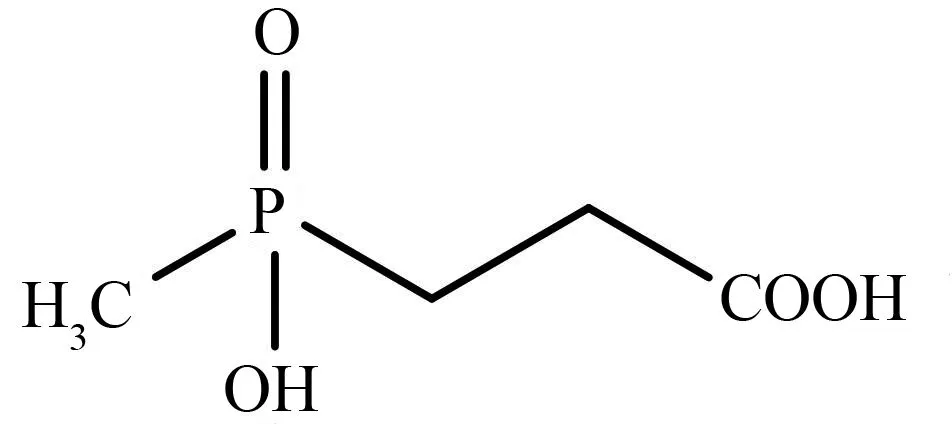
图2 草铵膦在水中降解产物3-甲基膦 酸丙酸(MPP)的结构式Fig. 2 Structural formula of 3-methylphosphonic acid (MPP), a degradation product of glufosinate in water
2.2 草甘膦在水环境中的行为研究
大多数草甘膦类除草剂仅限用于陆生环境中的除草,不被批准用于水生环境;然而,由于不可控因素,在很多非目标湿地生态系统中也经常检测到草甘膦[22]。在地表水中检测到大量的农药活性成分和表面活性剂,这些农药残留有可能使水生生物的生理机能发生改变[23]。草甘膦可以通过地表径流、雨水冲刷、不规范的清洗喷洒用具等方式进入水生生态系统中[24]。有研究发现,使用草甘膦等除草剂的农业行为会影响非目标生物和水体,从而改变淡水生态系统的结构和功能[25]。
近年来,草甘膦也用于我国南方水域防治空心莲子草、水葫芦等恶性杂草,具有良好的防治效果[26]。与土壤中的施药效果不同,防治水草时药剂直接施于水体中,这就很大程度上造成水体污染,进一步会伤害水生生物和水生生态系统,使生态系统失去平衡。现有研究表明,在世界多地的表层水体中均检测出草甘膦的存在。如在美国的河流中草甘膦的质量浓度达到了2.2 μg·L-1[27]。中国浙江省多地的饮用水源中检测出了草甘膦,检出率为27.6%,检出质量浓度为0.065~5.930 μg·L-1[28]。阿根廷北部转基因大豆种植区的田间水体中检出的草甘膦质量浓度为0.10~0.70 mg·L-1[29]。草甘膦在渥太华河中检出的浓度约为100 ng·L-1,在圣劳伦斯河中检出的草甘膦浓度为2~202 ng·L-1,检出率为84%[30]。
2.2.1 草甘膦在水环境中的迁移与分布
应用14C核素研究草甘膦在水域生态系统中的迁移时发现,在由鱼-金鱼藻-麦穗鱼-底泥组成的模拟水生态系统中,草甘膦在进入水中后,迅速向生态系统各组分中转移,为金鱼藻和麦穗鱼吸收,并在底泥上沉积、吸附。随着时间的推移,水相中14C-草甘膦继续向金鱼藻、麦穗鱼和底泥中迁移,其在水相中的活度呈不断下降之势。同时,14C-草甘膦在底泥、金鱼藻和麦穗鱼中的活度则增加较多。而在鱼塘和河道施药后,鱼塘水样中检出的草甘膦残留量在1 d后迅速下降,第6天时已<0.01 mg·L-1,但在河道系统中仅5 d后即<0.01 mg·L-1[31]。
在80 d实验周期的沉积物-水系统中,生物系统中实验结束时有55.7%草甘膦转化为了二氧化碳,而在非生物系统中则只有18.6%矿化,推测在该过程中,生物过程起着主导作用。但是在水系统中,草甘膦的矿化度却很低,实验结束时只有2.4%的草甘膦转化成了二氧化碳。通过比较水系统和沉积物-水系统中草甘膦的矿化度可知,沉积物在草甘膦的矿化过程中起着主导作用,推测可能是因为沉积物中含有较多的微生物种群。且在同样的实验条件下,低浓度(3 mg·L-1)的草甘膦矿化度高于高浓度(50 mg·L-1)的草甘膦,由于草甘膦浓度为50 mg·L-1时微生物需要更长的驯化时间,进一步证实了草甘膦的矿化度与微生物种群有关[32]。
2.2.2 草甘膦在水环境中的富集
草甘膦的辛醇/水分配系数为-3.2(20 ℃时)[33],因此推测草甘膦在水生生物群中有较低的生物富集因子(BCF),然而富集研究显示的结果并非如此。水生植物黄花水龙(Ludwigiapeploides)对水中的草甘膦的BCF为88.10 L·kg-1,沉积物中的草甘膦的生物-沉积物累积因子(BSAF)为7.61[22]。杂色蚓(Lumbriculvsvariegatus)在不同浓度的草甘膦中的BCF的变化范围在1.4~5.9 L·kg-1fw之间,高于辛醇/水分配系数(logPow)的估计值[27]。在模拟水生态系统中,金藻鱼和麦穗鱼对14C-草甘膦的20 d的BCF分别为27.96 L·kg-1和45.79 L·kg-1,结果显示14C-草甘膦在金藻鱼和麦穗鱼中有较强的生物富集作用[31]。
2.2.3 草甘膦在水体中的降解
草甘膦在水体中主要受到光降解作用。将1 mg·L-1的草甘膦去离子水溶液分别暴露于不同的光(钠光、汞光和紫外光)下一周发现,长波长光对草甘膦没有光降解作用,而紫外线光对草甘膦的光降解有显著影响,半衰期为4 d。将2 000 mg·L-1的草甘膦去离子水溶液分别暴露于黑暗和紫外光下发现,在黑暗条件中草甘膦几乎未降解,而暴露于紫外光下的草甘膦半衰期为3~4周。草甘膦在水中的降解产物主要是氨甲基磷酸(AMPA),其结构如图3所示,且AMPA对光降解的稳定性远高于母体化合物,对生物降解也有相当的持久性[34]。

图3 草甘膦在水中主要降解产物氨 甲基磷酸(AMPA)的结构式Fig. 3 The structural formula of aminomethylphosphoric acid (AMPA), the main degradation product of glyphosate in water
草甘膦可在地表水中存在长达60 d,对很多水生生物都能产生一定的影响[35]。以高于推荐用药量3~4倍的剂量将草甘膦施于鱼塘,当日水中残留量为6.286 mg·L-1,1 d后下降90%左右,第6天降至0.003 mg·L-1,半衰期为0.61 d。草甘膦在自然鱼塘的水环境中消失十分迅速;而在鱼塘沉积物中,施药后第1天的残留量为水中浓度的5倍以上,其在水体中的半衰期约为1 d,表明草甘膦可迅速被池塘沉积物(底泥)吸附[36]。草甘膦除草剂在水体中的半衰期与水体中的植物体有关,有水葫芦的水塘中草甘膦的半衰期比无水葫芦的水塘中的半衰期短[37]。
3 2种除草剂对水生生态系统的毒性效应(Toxic effects of two herbicides on aquatic ecosystems)
3.1 草铵膦对水生生态系统的毒性效应
3.1.1 草铵膦对浮游植物的毒性效应
藻类广泛存在于各种天然水体中,以种类繁多、个体小、繁殖迅速、对毒物毒性敏感等特点成为了水生毒理学研究的试验对象。藻类是水体中的初级生产者之一,其毒性效应可以影响鱼类等水生生物[38]。
据文献报道,草铵膦对一些藻类的毒性效应存在“低促高抑”现象。在研究草铵膦对铜绿假单胞菌的影响时发现,草铵膦对铜绿假单胞菌生长的影响具有剂量依赖性,低浓度的草铵膦(0.5 mg·L-1和1 mg·L-1)可以促进铜绿假单胞菌的生长,而在高浓度(5 mg·L-1和10 mg·L-1)时,草铵膦可以通过诱导铜绿假单胞菌的丙二醛(MDA)含量,抑制其生长[14]。在研究草铵膦对铜绿微囊藻的影响机制时发现,低浓度的草铵膦(0.5 mg·L-1和1 mg·L-1)暴露对铜绿微囊藻的生长有促进作用,且可显著提高藻胆蛋白和类胡萝卜素含量;而高浓度的草铵膦(5 mg·L-1和10 mg·L-1)暴露对铜绿微囊藻的生长有抑制作用,使藻MDA和电解质泄露率(EL)显著提高,破坏细胞膜完整性[39]。在研究草铵膦暴露对水生单细胞小球藻的毒性实验中,与对照组相比,草铵膦暴露使小球藻产生了一定的氧化损伤,小球藻体内的MDA含量、超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性均显著增强,这些氧化酶的升高可能有助于减轻氧化损伤。通过电镜可观察到有大部分叶绿体异常;在草铵膦暴露12 h后,小球藻中与光合作用有关的psaB、psbC和rbcL这3种光合基因的转录丰度降低[40]。
3.1.2 草铵膦对浮游动物的毒性效应
在研究95%草铵膦原药对大型溞的48 h急性毒性试验中,草铵膦浓度范围为0.1~102.4 mg·L-1,接触药液后0~8 h内,大型溞无特别症状;8~24 h内有部分大型溞出现刺激反应迟钝、游动缓慢等中毒症状;而24~48 h内,高浓度中毒的大型溞对刺激反应迟钝。当草铵膦浓度为6.4 mg·L-1和102.4 mg·L-1时,48 h时均只有一只大型溞死亡,由此可知,95%草铵膦原药对大型溞的致死中浓度(LC50)均>102.4 mg·L-1,根据农药毒性等级划分体系可知,95%草铵膦原药对大型溞毒性为低毒[19]。
3.1.3 草铵膦对鱼类的毒性效应
斑马鱼属热带鱼类,由于其产卵量大、胚胎具有光学透明性、与人类基因组具有87%的相似性、在解剖学与分子水平上已证明与哺乳动物相似等特点,已成为研究水生生物毒性效应的常用试验对象,且斑马鱼的毒性试验结果大部分适用于人类[41],因此研究草铵膦对斑马鱼的毒性效应十分必要。
在草铵膦对斑马鱼胚胎的免疫毒性的研究中发现,草铵膦在降低斑马鱼胚胎存活率的同时,还可引起胚胎的一系列形态畸形。当草铵膦浓度为2 μg·L-1和4 μg·L-1时,在受精后48 h(48 hpf)与对照组相比,斑马鱼的胚胎存活率显著低于对照组。当草铵膦浓度升高至10 μg·L-1时,在72 hpf时胚胎存活率迅速降至60%。且草铵膦暴露可引起斑马鱼胚胎的一系列畸形,当暴露于10 μg·L-1草铵膦中,在48 hpf时观察到最突出的畸形是卵黄囊水肿,在4~10 μg·L-1草铵膦暴露下72 hpf时观察到脊柱畸形[42]。在研究不同剂量的草铵膦对斑马鱼胚胎的毒性时发现,1.6 μg·L-1的草铵膦对斑马鱼胚胎有显著致死作用、1.3 μg·L-1的草铵膦有显著致畸作用,其中畸形表现为尾部弯曲和阻碍黑色素沉着[43]。胚胎致死可能与生殖细胞的相关基因有关,vasa基因和gcl基因是与生殖细胞发生有关的基因,是动物生殖细胞形成所必需的[44]。将斑马鱼暴露于1.3 mg·L-1的草铵膦中,处理组的vasa基因表达量明显减少(仅为对照组的30%)[45]。
将海洋青鳉(Oryziasdancena)分别暴露于不同浓度的草铵膦农药Basta中28 d和42 d,观察到鱼体内出现了多种病理变化,且严重程度随药物浓度和时间的增加而增加。暴露于Basta中28 d后,在2 mg·L-1处理组的个体中,可观察到肝脏血窦扩张,有部分白细胞浸润;4 mg·L-1处理组个体在此基础上还出现了干细胞固缩现象;8 mg·L-1处理组个体,除以上改变更严重、更频繁外,严重的脂质变性、水肿变性和坏死也存在。暴露于Basta中42 d的鱼肝脏中,2 mg·L-1处理组的个体出现了水样变性和肝细胞固缩,并伴有严重的白细胞浸润和纤维化;4 mg·L-1处理组中鱼的肝脏除表现出上述所有变化外,还有脂肪变性;8 mg·L-1处理组个体,除上述变化更严重外还观察到坏死[46]。
在研究草铵膦对中华鳑鲏鱼的急性毒性时发现,草铵膦浓度为35~43 mg·L-1时,前0~6 h在低浓度下中华鳑鲏鱼运动情况与对照组相比无差异;但在较高浓度下,中华鳑鲏鱼与对照组相比,显得躁动不安,上下游动。随着实验时间的延长,中华鳑鲏鱼大多在底层活动,活力逐渐减弱,游速变得缓慢甚至停止运动;时而侧游,对外界刺激反应很迟钝,最后死亡。由此可知,随时间和浓度的增加,草铵膦对鱼体的毒性增大[47]。
3.1.4 草铵膦对其他水生生物的毒性效应
据文献报道,蝌蚪长期暴露于15 mg·L-1的草铵膦环境中,乙酰胆碱酯酶和丁酰胆碱酯酶受到抑制,蝌蚪的游泳能力受到影响[48]。对血液中微核红细胞(ME)的评估是一种广泛使用的检测染色体损害的方法。将普通蟾蜍(Rhinellaarenarum)蝌蚪分别暴露于不同浓度(3.75、7.5和15 mg·L-1)的以草铵膦为活性成分的农药中,观察微核红细胞的频率和其他红细胞核的异常情况,与阳性对照组(40 mg·L-1环磷酰胺)和阴性对照组(去氯自来水)进行评估和比较。结果显示,所有实验组和阳性对照组的48 h红细胞核异常频率均显著高于阴性对照组,而仅阳性对照组和7.5 mg·L-1草铵膦的96 h红细胞核异常频率高于阴性对照组。实验结果表明,暴露于以草铵膦为活性成分的农药中会使普通蟾蜍蝌蚪的微核红细胞异常频率增加[49]。
3.2 草甘膦对水生生态系统的毒性效应
3.2.1 草甘膦对浮游植物的毒性效应
草甘膦中的有机磷对光营养体是有毒的,但对抗草甘膦的浮游植物(如藻类)是有效的,且一定剂量浓度范围的草甘膦有助于藻类的生长[50]。有研究发现,草甘膦对一些藻类的毒性效应有“低促高抑”现象。在研究草甘膦对铜绿微囊藻和绿色微囊藻的毒性时发现,草甘膦可诱导铜绿微囊藻细胞的凋亡,并促进铜绿微囊藻的毒素释放;而草甘膦对绿色微囊藻的毒性效应却表现出明显的剂量关系,高浓度(2、5和10 mg·L-1)时抑制绿色微囊藻的生长,低浓度(0.2 mg·L-1)时反而能刺激绿色微囊藻的生长[51]。在研究草甘膦异丙胺盐对球形棕囊藻的刺激效应时发现,高浓度(1~10 mg·L-1)的草甘膦异丙胺盐可抑制球形棕囊藻细胞生长,而低浓度(0.001~1 mg·L-1)范围内的草甘膦异丙胺盐可增加球形棕囊藻的细胞相对增长率,使藻体生长加快[52]。草甘膦异丙胺盐对赤潮异弯藻具有明显的毒性效应,高浓度(10 mg·L-1)处理下可引起赤潮异弯藻细胞大量死亡,藻细胞密度以及叶绿素a和可溶性蛋白的含量显著降低;而低浓度(0.001~1 mg·L-1)处理时,在培养的第3天就能够显著增加赤潮异弯藻的细胞密度,叶绿素a含量也明显高于对照组,表现出毒物刺激效应[53]。
3.2.2 草甘膦对浮游动物的毒性效应
溞科生物是水生生物链中的关键成员,其繁殖周期短、易培养、对水中的有害物质敏感,是一类较为理想的毒性试验研究材料。研究草甘膦对大型溞和福寿螺的毒性时发现,草甘膦对大型溞的24 h和48 h的LC50分别为54.12 mg·L-1和51.12 mg·L-1,均属于低毒;草甘膦对福寿螺的影响具有剂量关系,高浓度可抑制其生长,但相对低浓度(2 mg·L-1,即环境中的浓度)可促进生长,且相对低浓度(10 mg·L-1)的草甘膦能促进福寿螺卵提前孵化,降低福寿螺卵期受到其他伤害的风险[54]。在研究95%草甘膦原药对大型溞的急性毒性和21 d慢性毒性效应时发现,其对大型溞的48 h半最大效应浓度(EC50)为151.057 mg·L-1,毒性为低毒;慢性毒性试验发现,草甘膦对大型溞的初次产幼溞的时间、数量、胎数及存活个体的平均体长都有显著影响,其中3.125 mg·L-1的暴露浓度可显著减少大型溞产幼溞数量和胎数,而暴露浓度为25 mg·L-1时可显著延长大型溞初次产卵的时间[55]。
3.2.3 草甘膦对鱼类的毒性效应
斑马鱼现已成为毒理学研究的新型评价模型,草甘膦对斑马鱼的毒性效应主要表现在生殖毒性和发育毒性中。
3.2.3.1 草甘膦暴露对斑马鱼的生殖毒性
精子和卵细胞的发育和质量是评估生物生殖能力的重要评价标准。将斑马鱼分别暴露于不同质量浓度的草甘膦(5 mg·L-1和10 mg·L-1)中24 h和96 h后,切除睾丸,分析精子质量,与对照组相比,暴露损害了斑马鱼精子DNA的完整性,破坏了线粒体膜的完整性及其功能,降低了精子活力,从而大大降低了斑马鱼的生殖能力[56]。精子质量的变化与基因表达密切相关。将斑马鱼暴露于草甘膦(0.01、0.5和10 mg·L-1)中21 d后,在10 mg·L-1时检测到睾丸中hsd3b2、cat和sod1基因表达上调;草甘膦暴露影响了睾丸的类固醇激素合成,使得部分基因表达上调,从而对雄性斑马鱼的生殖功能产生了不利影响[57]。
雌性斑马鱼卵母细胞和相关基因表达的异常也是毒性效应的表现。将斑马鱼卵巢体外暴露于草甘膦(65 μg·L-1)中15 d后,形态学研究与对照相比无明显变化;但其卵母细胞直径增加,可能与类固醇生成因子-1(SF-1)的表达有关;同时,卵巢超微结构出现异常,发现有同心膜和髓磷脂样结构,草甘膦对卵母细胞产生的这些不利影响直接影响到其繁殖功能[58]。将斑马鱼暴露于草甘膦中,发现其卵巢中cyp19a1与ers1基因表达显著上调。cyp19a1上调的可能原因是草甘膦暴露引起类固醇激素的机制反馈,抑制了芳香化酶的转录反应,增加了芳香酶以维持类固醇激素的比率;ers1上调是卵巢为维持雌激素通路产生的一种代偿机制的结果;基因表达上调间接影响卵巢的功能,减少了产卵量[57]。
3.2.3.2 草甘膦暴露对斑马鱼的发育毒性
斑马鱼暴露于草甘膦(32.5、65和130 μg·L-1)中可引起斑马鱼的细胞毒性,直接影响到细胞膜的完整性,抑制线粒体的活动,使斑马鱼呼吸活动减少[59]。将4 hpf的斑马鱼暴露于1、5、10和100 mg·L-1质量浓度的草甘膦中96 h后,观察到高浓度暴露下斑马鱼的鳃部位活性氧簇(ROS)增加,而低浓度暴露下斑马鱼的ROS减少或无明显改变。大量的ROS可诱发斑马鱼的细胞凋亡,导致斑马鱼出现心包水肿、脊柱弯曲等器官畸形[60]。
草甘膦对水生生物存在潜在毒性,其对斑马鱼的生育毒性主要发生在早期[35]。将斑马鱼幼苗暴露于0、0.01、0.065和0.5 mg·L-1质量浓度的草甘膦中96 h后,受精后7 d(7 dpf)时可观察到其体长明显缩短,且暴露于高浓度的草甘膦中还可观察到眼距也明显缩短[61]。将4 dpf的斑马鱼暴露于0~400 mg·L-1的草甘膦中,可观察到体长缩短、眼睛变小、头部缩小等形态损伤,且浓度越高,形态损伤越明显;而当草甘膦浓度达到600 mg·L-1时,斑马鱼胚胎将无法存活[62]。将斑马鱼胚胎暴露于草甘膦中,观察24、48、72和96 h的发育毒性,发现暴露时间越长,其胚胎和幼苗的存活率越低,胚胎孵化率也随时间增长而降低[63]。
心脏是生物体中最重要的器官之一,较大剂量有机磷农药会造成心脏的损害。将5 hpf的斑马鱼暴露于50 μg·L-1的草甘膦中培养至48 hpf,结果发现草甘膦可损害斑马鱼心脏发育,导致心房心室结构异常、心脏循环无规律、内脏逆位和心率失常[64]。
草甘膦对草鱼、鲢鱼和鲫鱼的96 h-LC50分别为0.2518、0.2588和0.2599 mg·L-1,按现行农药对鱼类毒性的分级标准,草甘膦属于高毒性,且随着时间的延长,草甘膦对这3种鱼的急性毒性逐渐增高[65]。在不同类型的水体中,草甘膦对水生生物的毒性效应也不一样,有研究显示,草甘膦对硬水中小鲑鱼的毒性小于对软水中小鲑鱼的毒性[66]。
3.2.4 草甘膦对其他水生生物的毒性效应
0.82~1.23 mL·L-1的41%草甘膦异丙胺盐(水剂)可使黑斑蛙的肝脏、皮肤和肾脏中的SOD和CAT活性在30 d内均有升高趋势;而1.64~2.87 mL·L-1范围内0~20 d内SOD和CAT的活性均有增强,而20~30 d内活性降低,表现出剂量效应和时间效应[67]。
4 结论与展望(Conclusion and prospect)
(1)草铵膦和草甘膦均为灭生性广谱除草剂,也是目前世界上使用最多的2种有机磷类除草剂,它们在水中的溶解度大,通过它们在水环境中降解行为的研究,发现2个农药在水环境中黑暗条件下降解都非常缓慢,自然光条件下降解也非常慢,在多地自然水体中均有检测到草铵膦和草甘膦的残留。2种农药在水环境中会对水生生物产生影响并通过生物累积和食物链传递给人类,给环境和人类健康带来潜在威胁,因此研究2种农药在水环境中的污染状况及其迁移转化规律非常重要。草铵膦和草甘膦在水环境中的降解规律虽有相关报道,但它们在水环境中迁移转化规律研究尚非常缺乏,尤其是在生物体中富集研究应受到重视。
(2)关于2种除草剂对水生生态系统的毒性影响研究中,草甘膦的研究报道较草铵膦的略多,研究结果显示,2种农药均对水环境中藻、鱼和溞等典型生物的生长和发育具有一定毒性。2种农药的毒性研究中大多集中于较高浓度引起的急性毒性,对接近环境中污染物浓度的低剂量暴露情况研究较少,因此,开展环境浓度水平的低剂量暴露毒性研究是今后研究的重点。值得注意的是,2种农药在使用时,有时为了达到更好的防治效果,常与其他农药助剂或其他药效的农药一起使用,因此,应多关注农药在联合用药时的综合影响。
(3)现代毒理学研究认为,污染物与生物体之间的相互作用都始于分子水平,且在分子水平上生物体之间的共性最大,因此在分子水平上开展草铵膦和草甘膦污染环境的早期诊断和生态风险评价会成为其毒理学研究的热点之一。
(4)草铵膦是一种手性农药,L-草铵膦是活性体,D-草铵膦是无效体,由于对映异构体间的生物学性质迥异,为了对手性除草剂草铵膦对人类健康和生态系统的风险作出准确评价,有必要在手性层面上深入研究草铵膦的环境行为和毒性效应。
(5)希望更加重视农药对水环境及其生物的毒害效应,在达到理想除草效果的前提下,可以考虑减小农药残留和对水生生态系统的影响。
