基于适配体传感器快速检测发酵豆粕中的β-伴大豆球蛋白β亚基
2021-09-17卫亚峰毛银李国辉邓禹
卫亚峰,毛银,李国辉,邓禹*
1(粮食发酵工艺与技术国家工程实验室(江南大学),江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
大豆及其衍生物因富含蛋白质、油脂、维生素和其他营养元素,被广泛用于人类食品和动物饲料的生产[1],然而,大豆也是公认的8大食物过敏原之一[2],严重影响了大豆食品的开发与应用。β-伴大豆球蛋白是由α′(72 kDa),α(68 kDa)和β(52 kDa)亚基通过疏水相互作用组成的三聚体蛋白[3-4],占大豆7S球蛋白的85%,已被确认为是最易致敏的大豆蛋白之一[5-6]。其中,β亚基含有相对较高的疏水性氨基酸[7],也是大豆蛋白的主要营养抑制剂之一[8]。另外,相对于α′和α亚基,β亚基具有更好的耐受性,在后处理过程中难以完全去除[9]。因此,基于β亚基的有效检测可用于评估大豆中抗原蛋白的含量。
由于核酸适配体可折叠形成对靶分子具有高亲和力和特异性的复杂空间结构[10],研究筛选获得了针对β-伴大豆球蛋白β亚基的高特异性核酸适配体,并在此基础上构建了高精确度的适配体传感器,实现了对分离纯化后获得的β-伴大豆球蛋白β亚基的专一性检测。然而实际的豆粕发酵样品成分复杂[11],可能会影响适配体传感器的检测。而分离纯化β-伴大豆球蛋白β亚基需要经过7S球蛋白纯化、β-伴大豆球蛋白分离纯化、透析除盐等步骤,严重限制了适配体传感器的开发与应用。
本研究基于β-伴大豆球蛋白β亚基的高特异性适配体生物传感器,首先用碱性蛋白酶酶解模拟豆粕发酵,通过对比十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)验证了该传感器检测实际样品的可行性,在此基础上对关键影响因素进行分析,最后成功将该传感器应用于菌酶协同发酵豆粕中β-伴大豆球蛋白β亚基的检测。
1 材料与方法
1.1 仪器与试剂
SynergyH1多功能检测仪,美国BioTek有限公司;ST 16R高速冷冻离心机,美国赛默飞世尔科技公司;Master-S15实验室纯水系统,上海和泰仪器有限公司;ChemiDoc XRS+多功能凝胶成像系统、LF-Mini4小型垂直电泳槽,美国Bio-Rad公司。
市售豆粕;牛血清白蛋白(bovine serum albumin,BSA)、溶菌酶、胰蛋白酶,生工生物工程(上海)股份有限公司;凝血酶、Tris、十二烷基磺酸钠(sodium dodecyl sulfate,SDS),索莱宝生物科技有限公司;氯金酸、考马斯亮蓝R250、NaCl、甲醇、脲、盐酸,国药化学试剂有限公司;碱性蛋白酶(200 000 U/g),锡贝特生物科技有限公司;其他试剂均为分析纯;适配体序列5′-AACACGACCACGCTGTGACGGACACAGGTTGGCA-GCGTCGTG-3′,金唯智生物科技(苏州)有限公司;实验操作过程中所用溶液均为超纯水(电阻率≥18.2 MΩ·cm)配制;通过苯基疏水柱子和凝胶层析柱(Superdex 200 column)分离纯化得到纯β-伴大豆球蛋白β亚基。
1.2 实验方法
1.2.1 纳米金颗粒的制备
参考刘颖沙等[12]的柠檬酸三钠还原法制备纳米金(gold nanoperticles,AuNPs)。该方法制备的AuNPs颗粒最大吸收峰在520 nm处。
1.2.2 碱性蛋白酶水解豆粕
按1∶15的质量比取粉碎豆粕和碱性蛋白酶溶液并充分混匀,使碱性蛋白酶的质量分数为0.2%。置于摇床37 ℃振荡30 min使其充分混匀。沸水浴10 min使碱性蛋白酶失去活性,12 000 r/min低温离心10 min,取上清液备用。
6.逃避退缩的勉强适应期。政策不断调整,待遇逐渐改善,协解人员推翻协解事实的幻想因无望而基本放弃。他们的工作环境、生活水平的提升需求也一步步得到满足,大部分协解人员决定勉强接纳现状,自觉寻求心理平衡,尽量维持适应目前生活。
1.2.3 碱性蛋白酶固态发酵豆粕
按2∶1的质量比将粉碎豆粕和碱性蛋白酶溶液充分混匀,使碱性蛋白酶的质量分数分别为0%、0.1%、0.2%、0.3%、0.5%、1%。置于37 ℃培养箱中发酵24 h,烘干,粉碎。将粉碎好的不同酶浓度固态发酵豆粕1 g分别溶于15 mL超纯水中,置于摇床37 ℃振荡30 min使其充分混匀,12 000 r/min低温离心10 min,取上清液备用。
1.2.4 菌酶协同发酵豆粕
取粉碎好的豆粕20 g,1 mL对数生长期的乳酸菌DY6,超纯水10 mL,碱性蛋白酶0.1 g于无菌自封袋中混合均匀,置于37 ℃培养箱中发酵24 h,烘干,粉碎。将粉碎好的菌酶协同发酵豆粕1 g溶于15 mL超纯水中,置于摇床37 ℃振荡30 min使其充分混匀,12 000 r/min低温离心10 min取上清液备用。
1.2.5 传感器检测实际样品
参照付田等[13]的参数优化方法对本实验中NaCl和适配体浓度进行优化。检测条件:100 μL AuNPs和20 μL 0.5 μmol/L的适配体溶液于96孔板中室温避光反应1 h,使适配体吸附在AuNPs颗粒上以保证其在低盐环境中不聚集变色[14],随后加入20 μL 0.3 mol/L的NaCl溶液,并立即加入20 μL β-伴大豆球蛋白β亚基于室温孵育30 min,使其特异性结合适配体。用酶标仪扫描450~650 nm的吸光值,记录520和600 nm处的吸光值,根据吸光值A600/A520的变化对β亚基进行定量分析。本研究对实际样品进行检测时,用豆粕上清提取液取代方法中的β-伴大豆球蛋白β亚基。
为验证适配体比色法检测β-伴大豆球蛋白β亚基的特异性,按照1.2.5中方法分别用20 μL 0.3 μmol/L的牛血清蛋白、胃蛋白酶、溶菌酶、胰蛋白酶、凝血酶以及上述5种干扰蛋白的混合物代替β-伴大豆球蛋白β亚基。用酶标仪检测600和520 nm处吸光值,按照公式(1)计算干扰蛋白对传感器的干扰率:

(1)
菌酶发酵豆粕蛋白的提取常引入蛋白提取液,但蛋白提取液成分复杂,有些成分还可能影响检测结果,因此采用控制变量法对常用蛋白提取液成分进行分析,排除影响适配体传感器检测结果的成分。排除方法如表1所示。
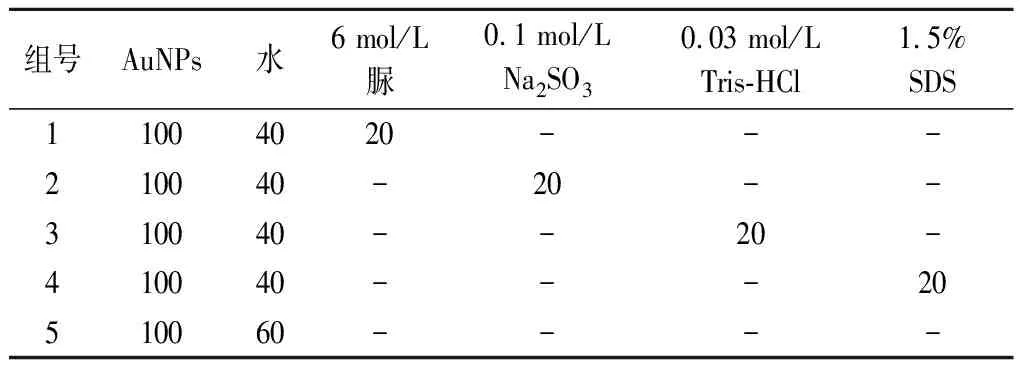
表1 蛋白提取液不同成分对传感器检测的影响 单位:μL
2 结果与讨论
2.1 传感器检测实际样品可行性分析
本研究首先以碱性蛋白酶溶液水解豆粕来模拟更为复杂的豆粕发酵过程,以验证适配体比色传感器检测实际发酵豆粕样品的可行性。豆粕经过酶解前后样品的吸收光谱图如图1所示,酶溶液处理后的豆粕最大吸收峰在530 nm左右,说明经过酶溶液处理后的豆粕中β-伴大豆球蛋白β亚基含量很少,大部分核酸适配体依然吸附在AuNPs颗粒上防止其在特定盐浓度条件下发生聚集,从而使AuNPs溶液呈红色(样品a);用水处理的对照组豆粕曲线最大吸收峰在600 nm左右,说明豆粕中的β-伴大豆球蛋白β亚基没有被降解。当该豆粕提取液加入到AuNPs体系中,由于β亚基与其适配体的特异性结合力远大于适配体和AuNPs之间的电荷吸附力[15],使AuNPs失去核酸适配体的保护,体系中的NaCl就会破坏AuNPs之间的静电斥力导致其发生聚集变色。以上结果表明,所构建的适配体传感器可以应用于碱性蛋白酶水解豆粕样品的检测。
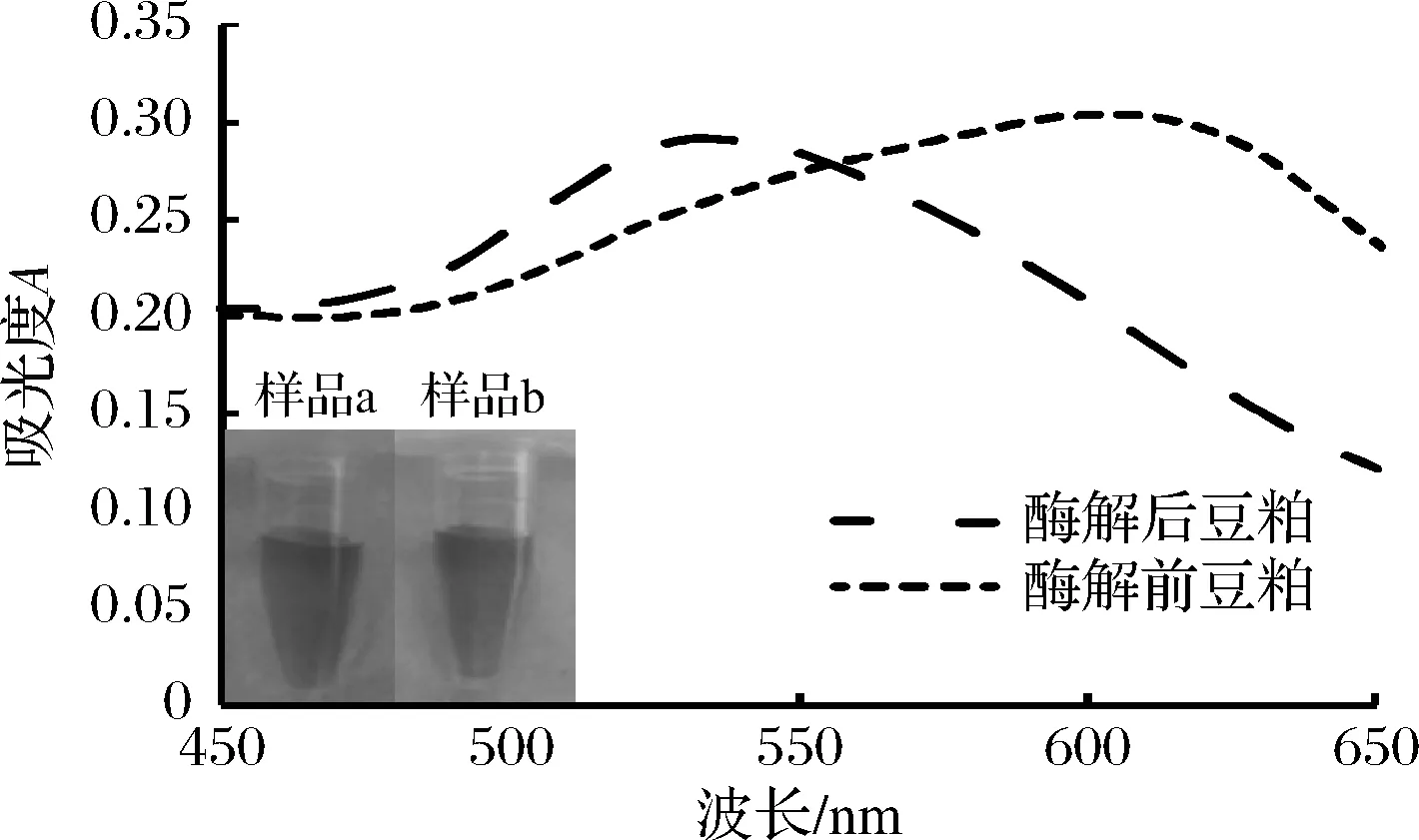
a-酶解后豆粕;b-酶解前豆粕图1 豆粕酶解前后样品溶液及其吸收光谱图Fig.1 Solution and absorption spectrum of soybean meal sample before and after enzymolysis
2.2 实际样品检测的最佳浓度探究
参考AuNPs适配体传感器的相关研究[13],将纯化后的β-伴大豆球蛋白β亚基应用于适配体传感器,获得A600/A520和β-伴大豆球蛋白β亚基浓度的标准曲线为y=0.016 6x+0.297 5,检测范围为7~58 nmol/L。考虑到豆粕中β-伴大豆球蛋白含量丰富且β亚基占据β-伴大豆球蛋白的20%左右[16],过高的β亚基浓度势必会影响检测结果的准确性,因此确定实际豆粕样品检测时的最佳浓度十分重要。对2.1中样品b用超纯水进行不同倍数稀释后进行检测,结果如图2-a所示,随着稀释倍数的增大,样品中β亚基浓度逐渐变小,最大吸收峰接近520 nm。图2-b表示稀释后上清提取液中β-伴大豆球蛋白β亚基浓度和A600/A520的关系图。
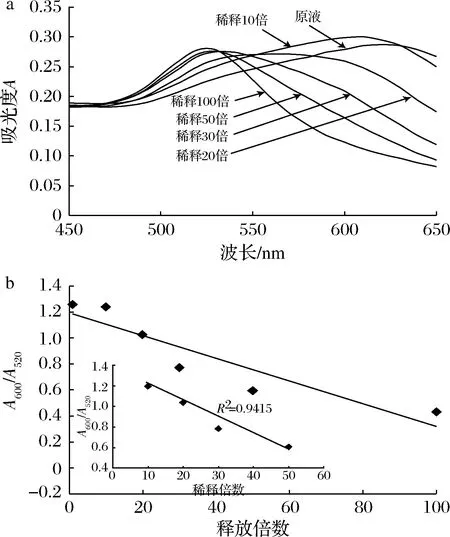
a-吸收光谱图;b-校准曲线图2 稀释不同倍数豆粕提取上清液的吸收光谱图和校准曲线Fig.2 The absorption spectra and calibration curve of the extracted supernatants of soybean meal with different dilutions
当稀释倍数小于10时,A600/A520数值最高,表明该样品不稀释时上清液中的β亚基含量超出传感器所检测的范围。而在稀释倍数为10~50倍时稀释倍数和A600/A520相关性良好,R2=0.94。所以,此品种豆粕在以下的实验中均选用20倍稀释。
2.3 酶固态发酵验证
用碱性蛋白酶溶液处理豆粕,可使豆粕在短时间内和碱性蛋白酶充分接触,极大提高实验效率。但是一方面不符合传统发酵豆粕的工艺路线,另一方面可能会由于反应太快,很难掌握豆粕发酵过程中抗原蛋白的真实变化情况。因此以不同浓度的碱性蛋白酶固态发酵豆粕,探究酶浓度对抗原蛋白β亚基降解率的影响。如图3-a所示,用质量分数为0%、0.1%、0.2%、0.3%、0.5%、1%的碱性蛋白酶分别发酵豆粕样品(编号1~6)。总的来看,在酶固态水解过程中,β-伴大豆球蛋白的α′和α亚基首先被降解,β亚基因酶耐受力较强而最后被降解。
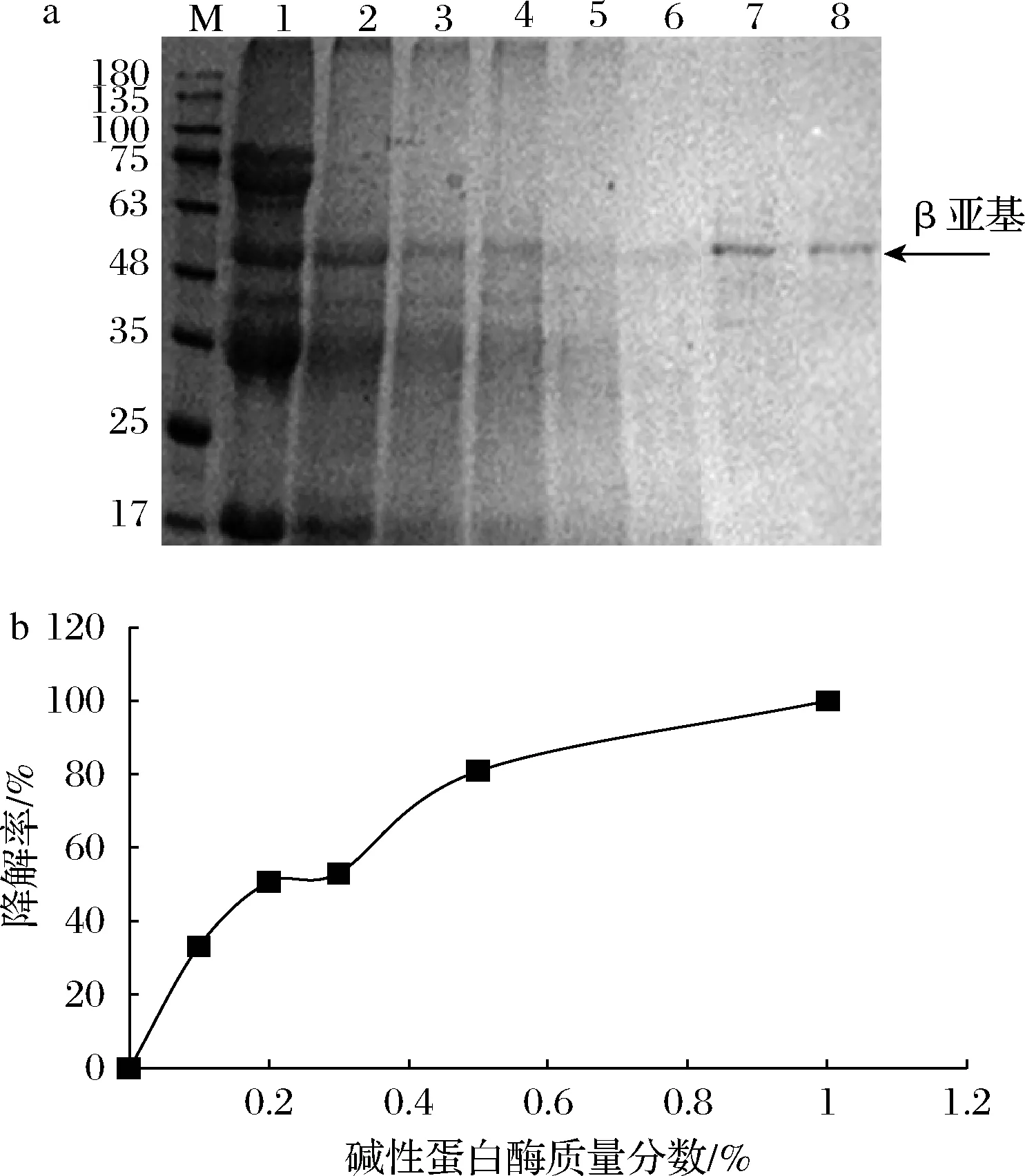
M-蛋白Marker;泳道1-6分别代表样品1-6; 泳道7,8代表纯化的β亚基; a-SDS-PAGE分析;b-β亚基降解率关系图图3 碱性蛋白酶酶解β伴大豆球蛋白β亚基Fig.3 Hydrolysis of β-conglycinin β subunit with alkaline protease
当碱性蛋白酶质量分数增加到0.2%时,α′和α亚基基本被降解完全,而β亚基在碱性蛋白酶质量分数为0.5%时才基本被完全降解,这与ZHAO等[9]的研究结果相似。同样将1.2.3中上清液通过适配体传感器进行检测,经过计算得到关于碱性蛋白酶浓度和β-伴大豆球蛋白β亚基降解率的关系见图3-b。随着碱性蛋白酶浓度增加,β亚基降解率也随之增加,当碱性蛋白酶质量分数在1%左右时,β亚基降解率为100%,与SDS-PAGE结果相符合。此外,图3-a泳道5基本检测不到β亚基,但AuNPs传感器依然检测到20%左右的β亚基存留量,证明了AuNPs-适配体传感器高灵敏度的特点[17]。
2.4 传感器的特异性验证
在对实际发酵豆粕进行检测时,豆粕上清提取液中复杂的环境对生物传感器的特异性要求很高,良好的特异性可以有效避免“假阳性”,提高实验的准确度。本实验分别对浓度过量(0.3 μmol/L)的BSA、胃蛋白酶、胰蛋白酶、溶菌酶、凝血酶、β-伴大豆球蛋白β亚基,以及以上6种蛋白的混合物进行检测。经计算,BSA、胃蛋白酶、溶菌酶、胰蛋白酶、凝血酶、混合物对传感器的干扰率分别为4.82%、2.33%、5.87%、5.14%、6.12%、109.45%(图4)。这表明干扰蛋白不会和β-伴大豆球蛋白β亚基的适配体特异性结合,因此加入干扰蛋白的体系中,适配体可以有效保护AuNPs在低盐环境中不聚集,这与之前的报道[18]相一致。以上结果表明,构建的AuNPs-适配体传感器可直接应用于豆粕样品的检测。
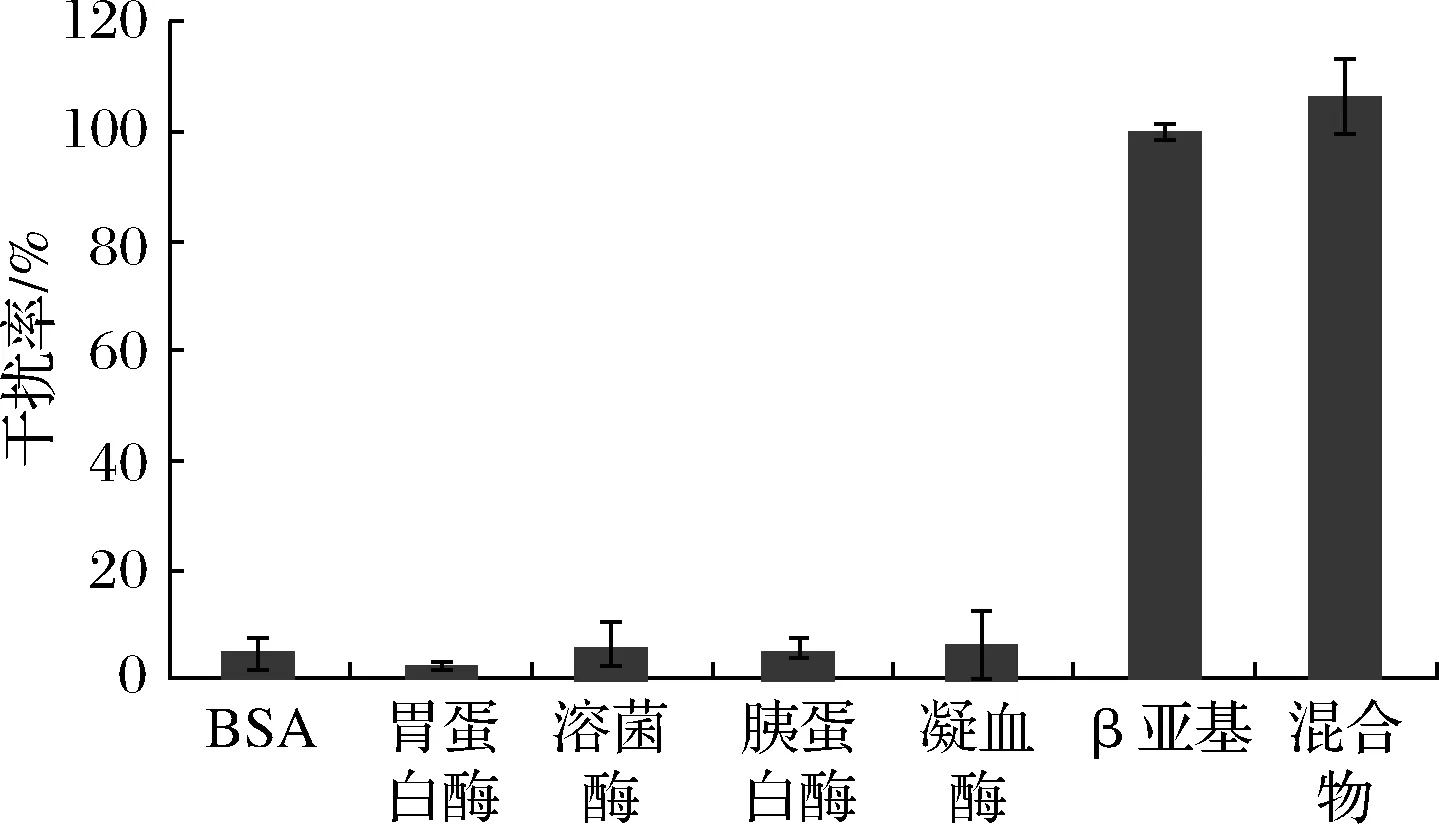
图4 AuNPs-适配体传感器检测β伴大豆球蛋白 β亚基的特异性分析Fig.4 Specificity analysis of β-conglycinin β subunit detected by AuNPs aptamer sensor
2.5 干扰性物质排除
豆粕菌酶协同发酵过程常添加微生物、蛋白酶、糖蜜等物质,实际发酵过程中有机酸、小肽、蛋白大分子的含量会发生变化[19]。在不妨碍检测结果的前提下,为使待检测蛋白从固体发酵豆粕中更好地溶出以提高检测效率,常常需要用蛋白提取液来推进此过程。常用的蛋白提取液包含脲、Na2SO3、Tris-HCl和SDS。AuNPs适配体传感器对检测环境要求较高,在特定情况下微量盐离子就可以使AuNPs聚集变色,影响实验结果。采用表1控制变量方法对蛋白提取液常用成分进行分析,结果如图5所示,只有脲对检测体系中的AuNPs几乎无影响,其他3种成分皆对传感器产生较大干扰。其中,Na2SO3溶液使AuNPs聚集变色、Tris-HCl溶液可使AuNPs最大吸收峰值变大且峰形产生明显变化、SDS溶液使AuNPs最大吸收峰值显著变小。故在后续蛋白提取的过程中应避免使用以上3种成分。
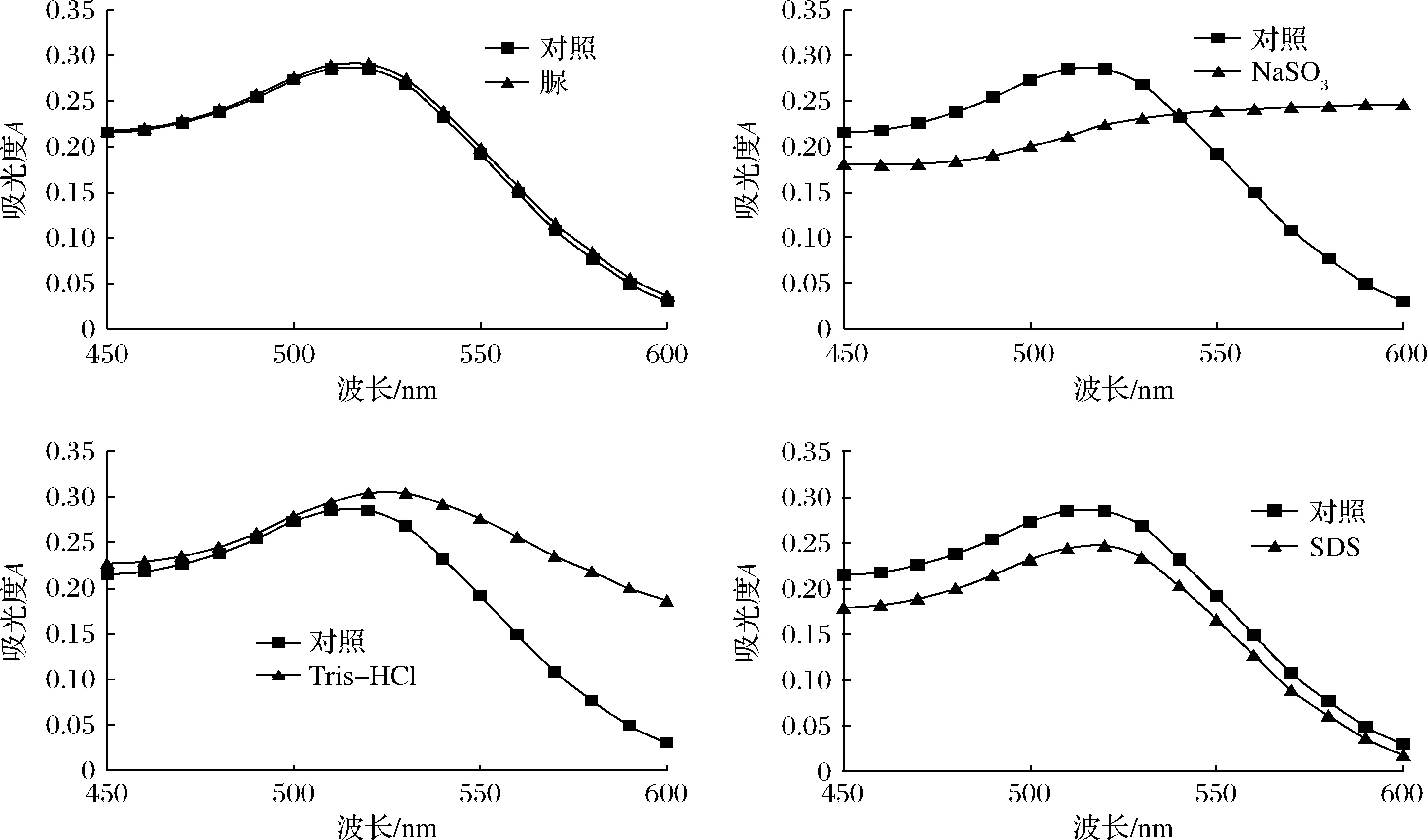
图5 蛋白提取液成分干扰分析Fig.5 Analysis of interference of protein extracting solution
2.6 菌酶协同发酵验证
近年来,菌酶协同发酵豆粕因其对豆粕价值的显著提升受到广泛关注[20-21]。本研究参考毛银等[19]菌酶协同方法发酵豆粕,结合AuNPs-适配体生物传感器检测豆粕发酵后β-伴大豆球蛋白β亚基的降解情况,从而评估菌酶协同发酵的效果。发酵前后豆粕各项指标见表2,豆粕经过菌酶协同发酵后粗蛋白含量、肽含量、总酸含量、β-伴大豆球蛋白β亚基降解率均有所提高。其中,菌酶协同方法发酵24 h豆粕样品β亚基降解率为87.81%,较2.3中相同浓度碱性蛋白酶单独发酵β亚基降解率提高了6.91%,且加入植物乳杆菌DY6还可以提高豆粕饲料的适口性和抑菌性,说明菌酶协同发酵优于蛋白酶单独发酵。综上所述,AuNPs适配体传感器同样适用于菌酶协同发酵豆粕中β-伴大豆球蛋白β亚基的快速检测。
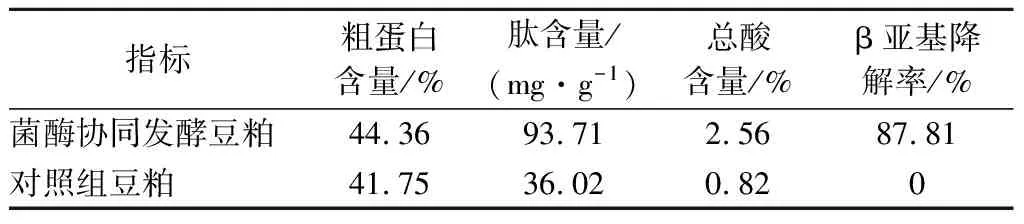
表2 发酵前后豆粕各项指标Table 2 Indexes of soybean meal before and after fermentation
3 结论
本研究将适配体传感器应用于发酵豆粕中β-伴大豆球蛋白β亚基的检测,大大提高了检测效率。相对于传统的大豆抗原蛋白检测方法,本方法操作简单、灵敏度高、结果可靠且不需要昂贵的仪器设备。然而,大豆产品多种多样,在今后的研究中,可以构建诸如荧光传感器、电化学传感器、表面等离子共振传感器等方法,进一步拓宽适配体生物传感器的应用范围,实现所有大豆产品中β-伴大豆球蛋白β亚基的有效检测。
