舒筋活络方对骨关节炎患者滑膜成纤维细胞增殖、迁移和侵袭的影响
2021-09-15王欢丁海涛舒骏王瑞茵齐蕊涵史榕荇杨帆唐学章
王欢 丁海涛 舒骏 王瑞茵 齐蕊涵 史榕荇 杨帆 唐学章


摘要 目的:測定舒筋活络方(SHC)对骨关节炎(OA)患者滑膜成纤维细胞(FLS)增殖、迁移、侵袭的影响,明确其作用机制。方法:对胶原酶法分离培养的FLS进行形态学观察,通过MTT比色法、划痕实验、Transwell实验、ELISA法等技术测定SHC对FLS增殖、迁移、侵袭等的影响。结果:体外分离的FLS生长状态良好,具备成纤维细胞形态特性;所选药物浓度范围对FLS增殖影响较小,与空白组比较,较高浓度和低浓度的SHC对FLS增殖的影响差异均有统计学意义(P<0.05),FLS的增殖与SHC呈浓度依赖性;镜下观察到OA-FLS的迁移现象,其中,模型组48 h、72 h的迁移率与0 h时比较,差异有统计学意义(P<0.05),SHC组72 h的迁移率与0 h时比较差异有统计学意义(P<0.05),与模型组比较,48 h、72 h时,SHC组FLS迁移能力比较,差异有统计学意义(P<0.05);SHC组FLS侵袭穿过小室膜的细胞个数较空白组明显减少(P<0.05);SHC各浓度组均对MMP3的释放有不同程度的抑制作用(P<0.05)。结论:SHC调节FLS增殖、抑制FLS的迁移和侵袭,维护和修复OA患者关节内组织完整性,为OA的关节保护提供新的预防和治疗策略。
关键词 舒筋活络方;中药复方制剂;增殖;迁移;侵袭;滑膜成纤维细胞;骨关节炎;滑膜
Effects of Shujin Huoluo Formula on the Proliferation,Migration and Invasion
of Fibroblast-like Synovicytes in Osteoarthritis
WANG Huan1,DING Haitao1,SHU Jun1,WANG Ruiyin2,QI Ruihan2,SHI Rongxing1,YANG Fan1,TANG Xuezhang1
(1 China-Japan Friendship Hospital,Beijing 100029,China; 2 Beijing University of Chinese Medicine,Beijing 100029,China)
Abstract Objective:To determine the effects of Shujin Huoluo Formula(SHC) on the proliferation,migration and invasion of fibroblast-like synovicytes(FLSs) in patients with osteoarthritis(OA),and to further clarify the mechanism of its action in the treatment of OA.Methods:the FLSs isolated and cultured by collagenase were observed morphologically,and the effects of SHC on FLSs proliferation,migration and invasion were determined by MTT colorimetry,scratch assay,Transwell assay and ELISA assay.Results:The FLS isolated in vitro has a good growth status and possesses the morphological characteristics of fibroblasts; the selected drug concentration range had little effect on the proliferation of FLS.Compared with the blank group,higher and lower concentrations of SHC have statistical effects on the proliferation of FLS of higher and lower concentration(P<0.05).The proliferation of FLS was concentration-dependent with SHC; the migration of OA-FLS can be observed under the microscope,and its migration speed was slower.The migration rate of 48 h and 72 h in the control group was statistically significant compared with 0 h(P<0.05),the 72 h migration rate of the SHC group was statistically significant compared with 0 h(P<0.05).Compared with the control group,the difference in FLS migration ability of the SHC group at 48 h and 72 h was statistically significant(P<0.05); The number of cells that FLS invaded and penetrated the compartment membrane in the SHC group was significantly less than that in the blank group(P<0.05); each concentration group of SHC inhibited the release of MMP3 to varying degrees(P<0.05).Conclusion:SHC regulates FLS proliferation,inhibits the migration and invasion of FLS,maintains and repairs the integrity of the tissue in the OA joint,and provides new prevention and treatment strategies for the joint protection of OA.
Keywords Shujin Huoluo Formula; Chinese medicine compound preparation; Proliferation; Migration; Invasion; Fibroblast-like synovicytes; Osteoarthritis; Synovial
中图分类号:R289.5;R684文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.15.017
骨关节炎(Osteoarthritis,OA)是一种与关节破坏相关的慢性退行性疾病[1],滑膜组织病变是导致关节软骨降解和关节破坏的中心环节[2]。滑膜成纤维细胞(Fibroblast-like Synovicyte,FLS)参与着关节内免疫反应和炎症反应的生理和病理过程[3]。FLS的活化特征主要表现为异常增殖[4],然而,炎性的FLS类似于癌症细胞的迁移性和侵袭性,作为另一典型特征也可能导致滑膜组织的增生,加速OA进程[4-5]。以往对FLS增殖的研究多集中在以滑膜炎症为主要病理改变的类风湿关节炎(Rheumatoid Arthritis,RA)中[6-8],忽略了OA中FLS不平衡的增殖和凋亡,以及向附近软骨迁移和侵袭导致的软骨侵蚀和关节破坏。对FLS增殖、迁移和侵袭的评估无疑是有意义的。目前,大多数临床治疗未针对FLS的此种特性在OA发病机制中的作用展开,未来更多的保护疗法将应用于抑制FLS的增殖和向未受影响的组织迁移和侵袭。
舒筋活络方(Shujin Huoluo Compound,SHC)是中华中医药学会疼痛分会主任委员唐学章教授临床治疗OA的经验效方,前期研究证明,SHC可参与机体的固有免疫反应,有效地抑制炎症介质释放,并在诱导FLS凋亡和异常增殖中有确切作用[9]。我们将对SHC对OA的FLS增殖、迁移、侵袭的影响进行测定,进一步明确其治疗OA的作用机制,为OA患者的关节保护提供新的预防和治疗策略。
1 材料与方法
1.1 材料
1.1.1 细胞 供FLS细胞分离的滑膜组织采集于中日友好医院骨关节中心确诊为OA的志愿者,诊断符合2018年中华医学会骨科分会修订的OA诊断标准,在膝关节置换手术过程中,将膝关节腔内增生的滑膜组织剔除,收集于装有预冷储存液的容器中低温条件下运送至实验室。
在超净台内将取回的新鲜滑膜组织反复冲洗,用眼科剪剔净脂肪后剪成小块,胶原酶消化后筛网过滤,所得滑膜细胞连续培养3~4代后备用[10]。
1.1.2 药物 SHC中药材由中日友好医院中药房提供,质检合格,水煎全方后经过滤、旋蒸水提、超低温冻干等技术制备成储备颗粒供试。
1.1.3 试剂与仪器 Methyl thiazolyl tetrazolium(MTT)(Sigma,美国,货号:88417-250MG)、dimethyl sulfoxide(DMSO)(Sigma,美国,货号:D8418-100ML)、结晶紫溶液(Sigma,美国,货号:62105-50ML),基质金属蛋白酶3(Matrixmetalloproteinase3,MMP3)酶联免疫吸附试验(Enzyme-linked Immunoabsorbent Assay,ELISA)试剂盒(Abcam,美国,货号:ab189572-1 x 96 tests)、96孔细胞培养板(Corning,美国,货号:3599),Transwell细胞培养板(Corning,美国,货号:3470)。
1.2 方法
1.2.1 檢测指标与方法
1.2.1.1 MTT比色法测定SHC对FLS增殖的影响 在提前1 d接种好FLS的96孔板中以800 μg/mL为初始浓度,1:3配制成6个浓度的稀释液,分别标记为浓度1至浓度6,与作为对照的含完全培养基的空白组一起加入细胞培养板孔内,37 ℃恒温5%CO2培养箱中干预24 h,以磷酸盐缓冲液(PBS)清洗各孔中残留药液,加入5%MTT溶液继续温育4 h,将各孔中液体吸弃,倒扣培养板用滤纸小心吸去残留液体,加入DMSO摇床震荡,待甲瓒结晶充分溶解后,酶联免疫检测仪492 nm波长下测定各孔吸光值(OD值)。计算FLS的生长抑制率(Inhibition Rate,IR)和成活分数(Survival Fraction,SF)以反映各供试浓度的SHC对FLS增殖情况的影响,具体公式为:IR(%)=(OD空白-ODSHC)/OD空白×100;SF(%)=ODSHC/OD空白×100。
1.2.1.2 划痕实验测定SHC对FLS迁移的影响 将FLS接种于画好平行线的6孔板内,密度约为80%,饥饿(无血清培养基培养)24 h后,用20 μL的灭菌枪头沿之前画好的平行线制造划痕,用PBS溶液清洗3次,吸弃脱落细胞,加入无血清培养基配制的SHC稀释液(浓度为800 μg/mL),另设空白组加入无血清培养基与之对照,每组分别设3个复孔。分别在倒置显微镜下观察0、24、48、72 h划痕区FLS迁移情况,采用Image J软件对每个镜下视野的FLS迁移后的划痕宽度和划痕面积,迁移率以迁移后划痕面积占初始划痕面积的百分比进行计算。
1.2.1.3 Transwell实验测定SHC对FLS侵袭的影响 将饥饿培养后的FLS接种子包好Matrigel(5 mg/mL)的Transwell小室的上室,观察组以无血清培养基配制的SHC稀释液(浓度为800 μg/mL)培养,下室加入含同浓度SHC稀释液的完全培养基,空白组为不含SHC药液的Transwell小室,同时针对观察组和空白组,分别设置上下室均不含血清的模型组。将上下室装好,置于37 ℃恒温5%CO2培养箱中共同培养24 h,吸弃小室中液体,以PBS溶液清洗小室中残留药液,棉签擦掉上室中未穿过聚碳酯膜的细胞,甲醇固定30 min后,将小室倒扣风干,0.1%结晶紫染色20 min,选于倒置显微镜下观察和细胞计数。
1.2.1.4 ELISA法测定MMP3含量 根据实验1.2.1.1中MTT比色法检测结果,设置观察组为:SHC高浓度组(LPS 1 μg/mL+800 μg/mL)、SHC中浓度组(LPS 1 μg/mL+400 μg/mL)、SHC低浓度组(LPS 1 μg/mL+200 μg/mL),另外,设置模型组(LPS 1 μg/mL)和空白组(完全培养基),各组药液均以完全培养基配制。温育24 h后取各组的上清液,离心沉淀细胞碎片,收集各组EP管中的上清液,按ELISA试剂盒的操作说明书检测各样本中MMP3的含量。
1.3 统计学方法 采用SPSS 20.0统计软件对其进行数据分析,上述实验中所得数据均以均数±标准差(±s)表示,以P<0.05为差异有统计学意义。
2 结果
2.1 FLS形态学观察 体外分离所得的滑膜细胞约在10 h后完成贴壁,3~4代后,A型细胞即滑膜巨噬细胞的数量逐渐减少,由此获得了纯度较高的滑膜细胞的主要效应细胞B型细胞,即FLS。前期研究鉴定此方法分离培养的FLS纯度>95%,可用于后续实验研究。在×100倒置显微镜视野下,可见FLS遍布视野,增殖分裂旺盛,呈极向旋涡状分布,有簇状聚集的细胞集落。见图1。×400倒置显微镜视野下,可观察到FLS贴壁良好,具备成纤维细胞形态特性,细胞体积均较大,具有生长突,呈长梭形、纺錘形,偶见星形、多角形,包质丰富,折光性好,胞核呈卵圆形,位于细胞中央。见图1。
2.2 SHC对FLS增殖的影响 在前期研究中,我们对2 mg至1 μg浓度范围的SHC对FLS细胞活性的影响做了大区间的整体筛选。为了有利于后续试验,本研究选取了对FLS生长影响较小的浓度范围进行进一步的测定。在所选的SHC浓度区间中,随SHC浓度逐渐降低,IR逐渐升高,SF逐渐降低,FLS增殖由促进逐渐转向抑制,呈规律的浓度依赖性;与空白组比较,当SHC浓度为800~50和0.781 μg/mL时,实验结果差异有统计学意义(P<0.05);但从各组均值来看,各浓度对FLS的增殖影响程度均较轻,IR在-27.034%~11.549%范围内,SF在127.034%~88.451%范围内,IR和SF均未大幅度偏离空白组,变化趋势较平缓,结合之前对差异浓度SHC影响FLS炎症介质释放等实验结果,我们在此浓度区间选取后续实验的药物干预浓度。见图2~3、表1。
2.3 SHC对FLS迁移的影响 在倒置显微镜下,模型组和SHC组0 h时与同组的其他时间点比较,划痕宽度最大,划痕带较均匀,带内无细胞分布,边缘细胞排列均较紧密,划痕边界较清晰;随着时间的推移,有FLS迁移入原划痕内,划痕逐渐变窄,粗细不均,边界逐渐模糊,划痕面积逐渐缩小。模型组48 h、72 h的迁移率与0 h时比较,差异有统计意义(P<0.05),SHC组72 h的迁移率与0 h比较差异有统计学意义(P<0.05);与模型组比较,SHC组迁移能力较弱,48、72 h时差异有统计学意义(P<0.05),说明SHC在一定程度上抑制了FLS的迁移。结果见图4~6、表2。
2.4 SHC对FLS侵袭的影响 与只含培养基的空白组(图7Aa)比较,SHC干预下的观察组(图7Ba)FLS穿过小室膜的细胞个数明显减少,FLS的透膜侵袭能力被SHC明显抑制(P<0.05);而下室不含血清的培养基对FLS的侵袭基本无诱导力,空白组的模型组(图7Ab)和观察组的模型组(图7Bb)均基本观察不到完整的细胞穿过小室膜。见图7。
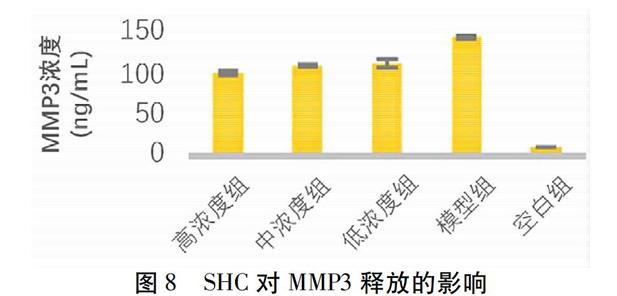
2.5 SHC对MMP3释放的影响 在用ELISA法对受试各组细胞培养上清液中的MMP3测定结果可见,由LPS诱导的模型组的MMP3释放量比较空白组显著升高(P<0.05),FLS活化成功;与模型组比较,SHC各浓度组均对MMP3的释放有不同程度的抑制作用(P<0.05),随SHC浓度升高,抑制作用逐渐增强,其中,SHC高浓度组对MMP3释放的抑制作用最强。见表3、图8。
3 讨论
OA是一种以慢性的炎症反应和进展性的关节受损为主要病理特征的退行性骨关节病,主要累及以膝关节为主的负重关节,随着病程进展,可由单一关节发展至多关节[11-13]。在多种致病途径中,滑膜组织中以B细胞、T细胞、巨噬细胞和FLS等不同细胞群诱导关节产生的异常免疫、慢性炎症和滑膜增生现象是OA进展和持续不愈的主要因素[14-15],其中,以占滑膜细胞总数最多的FLS作为滑膜生理、病理变化的主要效应细胞,附着、侵袭和降解关节软骨和骨骼[16]。FLS活化的特征主要见于关节滑膜组织在本病中具有的多层性和增生性,不仅反映了不平衡细胞的增殖和凋亡,还包括向衬里层直接接触的关节软骨组织和较远处暴露的软骨和骨骼的迁移和侵袭[17]。这种侵袭性的行为类似于淋巴细胞和肿瘤细胞的远处转移。现已被证实,这种特征性的细胞——FLS在RA患者的关节内通过循环体液或细胞因子等招募更多的RA-FLS到新的软骨侵蚀部位,导致疾病的不断进展[18-19]。OA滑膜的炎症反应和增殖程度较均低于RA[20],在以往的研究中,滑膜组织对OA进展的重要性易被忽视,也无关于FLS侵袭关节软骨的系统性报道,但不可否认,激活的OA-FLS同样具有上述特性,在OA患者慢性、渐进性的损伤关节中起着重要作用。
细胞迁移是包括伤口愈合在内的生理和病理过程的核心,伤口治疗、免疫防御,以及基质重塑和器官稳态均需要数种细胞的迁移以维持体内平衡[21]。这些细胞具有迁移潜能,能从组织局部迁移到受损组织的固定部位,参与免疫反应以及细胞所在区域的伤口愈合和组织修复。成纤维细胞是伤口愈合的主要细胞类型,其存在于身体大部分的器官与组织内[22],在OA中,FLS是构成患者关节滑膜组织的主要细胞,影响着软骨降解和关节内稳态。对此类细胞进行去除以达到关节保护的治疗策略显然是不可行的,基于这一问题,我们提出对FLS在OA中的增殖、迁移、侵袭等属性进行系统评估,并针对上述各个病理过程予以合理的干预治疗。
SHC是一种专利保护下的中药复方制剂(专利号:202010700833.4),由唐学章教授及其团队结合中药方剂的现代配伍与制剂工艺研发而成,配伍精良、疗效显著,临证时发现其有舒筋活血、活络止痛的功效,在本研究中,以FLS侵袭为主要方向,对其治疗OA的机制做了新的拓展。结果显示,在MTT实验中,FLS增殖与SHC呈浓度依赖性,在本实验所选浓度区间中,SHC对FLS生长IR和SF影响趋势平缓,在此浓度范围选取的药物干预浓度有利于后续实验的顺利进行;在划痕实验中,OA-FLS需要比文献记载中RA-FLS更长的迁移时间,在各观察时间点中,SHC均不同程度抑制FLS迁移;在Transwell实验中,OA-FLS能穿透transwell胶质室膜侵袭入下室,而SHC可显著降低FLS的侵袭能力;在ELISA实验中进一步证实了上述实验结果,FLS可在侵袭位点分泌大量与软骨细胞外基质降解相关的MMPs,MMP3为其中一类特异性MMP,与细胞的迁移和侵袭密切相关,本研究各浓度的SHC均能控制被LPS激活的OA滑膜炎症反应产生的MMP3释放,从而减轻关节破坏。
综上所述,SHC能通过调节FLS增殖,抑制FLS病理性迁移、侵袭等,起到维护和修复OA关节内组织完整性的作用,为OA患者的关节保护提供新的途径,也为深入研究中药复方制剂的作用机制提供了数据支撑。但本实验着重研究了SHC對FLS在关节腔内局部、短距离迁移的作用,未来的研究可对其在体内长距离的迁移途径、间质结构的改变等潜力给予更深入的探究,并注意FLS可能存在的类肿瘤细胞的免疫逃逸机制。
参考文献
[1]Desai M,Bentley A,Keck WA,et al.Cooled radiofrequency ablation of the genicular nerves for chronic pain due to osteoarthritis of the knee:a cost-effectiveness analysis based on trial data[J].BMC Musculoskelet Disord,2019,20(1):302.
[2]Sun M,Rethi B,Krishnamurthy A,et al.Anticitrullinated protein antibodies facilitate migration of synovial tissue-derived fibroblasts[J].Ann Rheum Dis,2019,78(12):1621-1631.
[3]Puetzer JL,Ma T,Sallent I,et al.Driving Hierarchical Collagen Fiber Formation for Functional Tendon,Ligament,and Meniscus Replacement[J].Biomaterials,2021,269:120527.
[4]Heldin CH,Lennartsson J,Westermark B.Involvement of platelet-derived growth factor ligands and receptors in tumorigenesis[J].J Intern Med,2018,283(1):16-44.
[5]Karonitsch T,Kandasamy RK,Kartnig F,et al.mTOR Senses Environmental Cues to Shape the Fibroblast-like Synoviocyte Response to Inflammation[J].Cell Rep,2018,23(7):2157-2167.
[6]Kracke V,Intemann J,Fennen M,et al.P073 Regulation of joint destruction by activin a in rheumatoid arthritis[J].Ann Rheum Dis,2018,77(Suppl 1):A43.
[7]Ozeki N,Koga H,Sekiya I.Homeostasis and Disorder of Musculoskeletal System.Transplantation of synovial mesenchymal stem cells for cartilage and meniscus regeneration[J].Clin Calcium,2018,28(3):319-327.
[8]Corsiero E,Jagemann L,Perretti M,et al.Characterization of a Synovial B Cell-Derived Recombinant Monoclonal Antibody Targeting Stromal Calreticulin in the Rheumatoid Joints[J].J Immunol,2018,201(5):1373-1381.
[9]王欢,丁海涛,舒骏,等.舒筋活络方对骨关节炎滑膜细胞生长特性调控的研究[J].中华中医药杂志,2021,36(4):1930-1933.
[10]王欢,王庆甫,杨黎黎,等.基于体外细胞模型的建立探讨通络止痛方对滑膜炎症反应的影响[J].长春中医药大学学报,2016,32(4):684-687.
[11]Glyn-Jones S,Palmer AJ,Agricola R,et al.Osteoarthritis[J].Lancet,2015,386(9991):376-387.
[12]Budd E,Nalesso G,Mobasheri A.Extracellular genomic biomarkers of osteoarthritis[J].Expert Rev Mol Diagn,2018,18(1):55-74.
[13]Vilar JM,Manera ME,Santana A,et al.Effect of leukocyte-reduced platelet-rich plasma on osteoarthritis caused by cranial cruciate ligament rupture:A canine gait analysis model[J].PLoS One,2018,13(3):e0194752.
[14]Ingale D R,Kulkarni P G,Koppikar S J,et al.Reduced synovial inflammation and inhibition of matrix metalloproteinases explicates anti-osteoarthritis activity of polyherbal formulations[J].Indian J Pharmacol,2018,50(1):22-29.
[15]Sakurai Y,Fujita M,Kawasaki S,et al.Contribution of synovial macrophages to rat advanced osteoarthritis pain resistant to cyclooxygenase inhibitors[J].Pain,2019,160(4):895-907.
[16]Hemshekhar M,Thushara RM,Kumar S,et al.Bone Degeneration,Inflammation and Secondary Complications of Arthritis:Potential Targets and their Natural Inhibitors[J].Mini Rev Med Chem,2018,18(3):244-275.
[17]Ruscitto A,Morel MM,Shawber CJ,et al.Evidence of vasculature and chondrocyte to osteoblast transdifferentiation in craniofacial synovial joints:Implications for osteoarthritis diagnosis and therapy[J].FASEB J,2020,34(3):4445-4461.
[18]Chijimatsu R,Kobayashi M,Ebina K,et al.Impact of dexamethasone concentration on cartilage tissue formation from human synovial derived stem cells in vitro[J].Cytotechnology,2018,70(2):819-829.
[19]Nobuo Sakai,Seido Yarimitsu,Y Sawae,et al.Biomimetic artificial cartilage:fibre-reinforcement of PVA hydrogel to promote biphasic lubrication mechanism[J].Biosurface & Biotribology,2019,5(1):13-19.
[20]Gotoh H,Hagihara M,Nagatsu T,et al.Activities of dipeptidyl peptidase Ⅱ and dipeptidyl peptidase Ⅳ in synovial fluid from patients with rheumatoid arthritis and osteoarthritis[J].Clin Chem,1989,35(6):1016-1018.
[21]López JF,Sarkanen JR,Huttala O,et al.Adipose tissue extract shows potential for wound healing:in vitro proliferation and migration of cell types contributing to wound healing in the presence of adipose tissue preparation and platelet rich plasma[J].Cytotechnology,2018,70(4):1193-1204.
[22]Pakshir P,Noskovicova N,Lodyga M,et al.The myofibroblast at a glance[J].J Cell Sci,2020,133(13):227900.
(2020-03-26收稿 責任编辑:芮莉莉)
基金项目:国家自然科学基金青年项目(81804214);北京市优秀人才培养资助项目(2018000052580G469)
作者简介:王欢(1986.04—),女,博士,住院医师,研究方向:中医药防治退行性骨关节病,E-mail:pulongqi@126.com
通信作者:唐学章(1963.02—),男,主任医师,推拿科主任,研究方向:推拿手法治疗脊柱相关疾病,E-mail:tangxuezhang@126.com
