醉蝶花茎叶粉碎物对葡萄灰霉病的抑制作用
2021-09-14赵星
赵星

摘 要:灰霉病是葡萄的主要病害之一,目前喷施化学农药的防治方法虽然简便快速,但会造成严重的环境污染问题,且容易在土壤中残留,长期使用会使灰霉菌产生抗药性。通过查阅大量资料及前期试验发现,醉蝶花的存在可抑制多种土传病害,本次试验发现其对葡萄灰霉病也有较好的防治效果,并利用菌丝生长速率法确定了醉蝶花茎叶粉碎物抑制灰葡萄孢的最佳剂量,以此找到了环保有效、可替代化学药剂的生物熏蒸剂,可在未来实现工厂化生产并加以推广应用。
关键词:葡萄灰霉病;醉蝶花;土传病害;菌丝生长速率法;生物熏蒸剂
文章编号: 1005-2690(2021)14-0025-02 中国图书分类号: S436.631.1 文献标志码: B
葡萄灰霉病(Grapegraymold)是由灰葡萄孢菌引起,在相对湿度75%~100%时可快速生长,在2~31 ℃下均能对葡萄新梢、叶片、果梗、花序和果实产生危害,是一种极具威胁性的真菌性病害[1]。该病为土传病害,以菌丝体、菌核和分生孢子在病残组织上越冬,是世界上对葡萄果实造成严重影响的病害之一。植株染病后,新梢和叶片会出现褐色病斑或灰色霉层,花序萎缩,幼果脱落,成果有凹陷病斑,前期在枝梗上出现淡褐色水浸状病斑,中后期病部腐软、病斑颜色加深。环境湿度大时,病斑上产生灰色霉状物,反之则使花序和幼果逐渐失水萎缩、干枯脱落。在葡萄开花期至幼果期发病,果实转色期至成熟期危害最重,该时期主要为害葡萄果穗部分,使果穗软腐,遇阴雨会长出一层灰白色霉层,造成果实腐烂脱落。该病每年有3次发病高峰期[2],农户在种植时管理不细致、氮肥使用量大、气候潮湿等情况都有利于葡萄灰霉病的发生,严重影响品质和卖相,使农户损失惨重。
生物熏蒸技术是指通过分解植物代谢物产生的挥发性气体来达到抑菌效果。这种方法在中医上较为常见,艾蒿“烟熏”、得克斯消毒剂“烟熏”都是利用类似原理达到除菌效果。但在目前的农业生产中,熏蒸技术的应用较为空白。前期资料显示该项技术除了能够有效减少部分土传病原菌的传播、降低对作物的危害、提高作物产量,还可以减少土壤有机质的流失、改善土壤的结构,增加有益微生物的种群数量含量,保证现代农业的可持续发展。此技术源于利用含有硫代葡萄糖苷(Gl-
ucosinolates,GSLs)的植物抑制土传病虫害[3],研究表明十字花科蔬菜液泡中含有黑芥子酶[4],可分解GSLs产生大量的异硫酸氰酯类物质[5],具有广泛的杀菌除螨、防虫防病、分泌植保素等功效[6]。资料显示,十字花科的多种植物中含有GSLs结构,具有很大的生物防治潜能,醉蝶花就是其中一种[7-8]。
因此,应进一步研究其对灰霉的抑制作用并明确最佳用量,以求将其制成固定药剂防止生长期及储藏期的葡萄发生灰霉病,以此来帮助农户减少经济损失,同时此方法对于减少化学农药造成的土壤残留问题及病原菌的抗性问题也具有重大意义[9]。
1 供试材料与方法
1.1 供试材料
灰葡萄孢(Botrytis cinerea)属于半知菌类(Fungi imperfecti)、絲孢纲(Hyphomycetes)、丝孢目(Moniliales)、淡色孢科(Moniliaceae)、葡萄孢属(Botrytis)[10],由东北农业大学植物病理研究室提供,经过活化和形态学鉴定后用于本试验。
醉蝶花茎叶粉碎物,保存于-80 ℃冰箱中,由东北农业大学病理研究室提供。
1.2 PDA培养基的制作
制作1 L PDA培养基,需要称取去皮马铃薯200 g,切成1 cm3的小正方体后放于锅中,加入1 L蒸馏水,熬煮约10 min后停火过滤,定容到1 L后倒入锅中继续熬煮,同时缓慢加入20 g葡萄糖、20 g琼脂,待其全部溶解后倒出、分装灭菌。
1.3 灰霉菌的活化与形态学鉴定
将灭菌锥形瓶中的PDA加热融化,稍冷却后加入2~3滴青霉素以抑制细菌生长。在超净工作台中将其趁热倒入5个灭菌的平板中备用。
取出实验室冰箱中保存的灰霉菌进行活化。在超净台中打开皿盖,用直径为0.90 cm的打孔器在菌落边缘同一圈上打孔,用移菌勾挑取菌饼,倒置接种在已倒好的凝固的培养基上,贴上封口膜后倒置培养5 d。
选择灰霉菌长势较好且无杂菌生长的培养皿,挑取其中的菌落进行形态鉴定。在载玻片上滴一滴水,用移菌勾挑取少量菌丝后在水中涂抹,盖上盖玻片后在显微镜下观察。
视野中的菌分生孢子梗丛生,顶端膨大或是尖削,在其上有小的突起;分生孢子单生于小突起之上;分生孢子亚球形或卵形[11]。经过鉴定该菌确为灰葡萄孢后将其保存好备用。
2 试验方法
2.1 供试真菌接种
采用菌丝生长速率法测定醉蝶花对葡萄灰霉病菌丝的抑制效果。取出-80 ℃冷冻保存的醉蝶花粉碎叶片备用,将在PDA培养基上培养7 d的葡萄灰霉病病菌,用直径为0.9 cm的打孔器在同一半径的菌落边缘打孔并挑取菌饼,用移菌钩将菌饼接种于倒有PDA的9.0 cm培养皿中央备用[12]。
2.2 茎叶粉碎物对灰霉抑菌活性的测定
分别称量醉蝶花茎叶粉碎物0.2 g、0.4 g、0.6 g、0.8 g、1.0 g各3份,分别快速倒入接好菌的培养皿皿盖上,用封口膜封好后在20 ℃恒温箱中培养,每天观察菌落生长情况,并记录数据[13]。
2.3 结果调查与统计分析
每处理3次重复,对每个培养皿中的菌落用十字交叉法垂直测量直径,取其平均值。根据测得的结果,计算醉蝶花提取液对葡萄灰霉病菌的菌丝生长抑制率。
3 结论与分析
3.1 试验结论
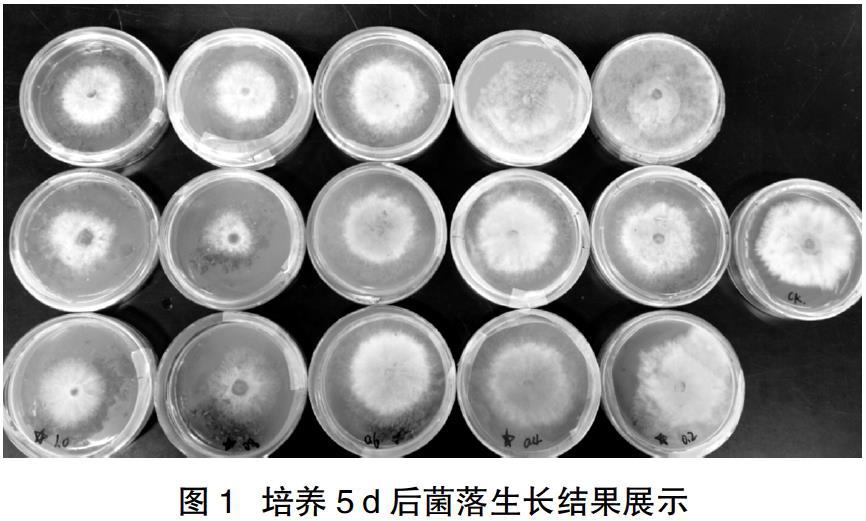
本试验首次发现了醉蝶花茎叶粉碎物对葡萄灰霉病病菌的抑制作用,并通过试验确定了粉碎物发挥抑菌作用的最适剂量。结果表明,0.2 g/皿、0.4 g/皿 0.6 g/皿、0.8 g/皿、1.0 g/皿都有一定的抑菌效果,其中1.0 g/皿和0.8 g/皿的效果较好,0.8 g/皿左右的浓度抑菌效果最好。试验培养情况及统计结果见图1、表1。
3.2 讨论
回顾整个试验过程,本试验设计存在以下一些问题,需要进一步改进。
(1)醉蝶花茎叶粉碎物这一材料是取自-80 ℃的冰箱中,取出时粉碎物上含有细小冰晶且无法分离,故称量时的质量包含一定冰的质量,而不是粉碎物的净重,造成所称量的粉碎物偏少,小于应该称量的理论值。
(2)在称量过程中,粉碎物表面的冰会融化成水,使粉碎物粘连在称量纸上,导致向培养基中倒入粉碎物这一过程速度减缓,且无法一次性快速全部倒出。这就导致了两个问题,一个是会损失一部分粉碎物,使实际上发挥熏蒸作用的量比所需的理论值小;另一方面就是打开皿盖较长时间会导致杂菌进入,造成污染。
另外,下一阶段本试验还需要从以下几方面继续深入探究。
(1)在试验后期发现,醉蝶花茎叶粉碎物发黄变质,这证明茎叶粉碎物常温下无法保存太久,无法持续发挥药效,因此需要提取有效物质用于生产实践,而不是直接使用茎叶粉碎物。
(2)虽然确定了醉蝶花本身具有抑菌作用,但究竟是哪些物质起到了抑菌作用目前尚不明确。因此需要进一步分析其有效成分,并探究各有效成分的最适浓度。希望在明确有效成分后直接人工合成该物质,制成药剂在实践中防治葡萄灰霉病。
4 结束语
葡萄灰霉病作为影响葡萄产量和品相的重要病害,目前的防治方法除了化学药剂防治外还有选用抗病品种、加强栽培管理措施、施用化学药剂以及物理防治方法,但这些方法都有各自的缺点:选用抗病品种,不同的葡萄品种间对灰霉病的抗性差异显著,病害可能发生突变,对原来具有抗性的植株不敏感,可以继续危害,导致抗病品种的抗性消失;通过加强水肥管理在整枝定穗初期进行防治,通过间种、套作、轮作等方式,减少病原寄主,效果良好,持续时间长,但工作繁重冗杂,处理起来较为困难;大棚等种植场所、修剪种植工具应及时消毒,减少菌源,通过高温闷棚为苗床消毒,但此方法只能作为辅助,并不能真的防治病害。
随着人们环保意识的增强,社会对于更加绿色安全的生物防治关注度也越来越高。化学农药虽然见效快,但其造成的环境污染也日渐显现。病原菌开始出现抗病性,这使得农民们不得不加大剂量或者不断更换药剂,造成更进一步的污染和抗性增加,甚至出现交互抗性。因此生物农药的发明推广迫在眉睫,而熏蒸技术作为更加高效的防治方法,发展前景广阔[14]。用醉蝶花挥发物质防治土传病害,这一研究领域目前仍为空白,在发现其抑菌效果后,会以此为切入点,深入研究其对其他土传病害的防治作用[15]。
参考文献:
[ 1 ] 李廷刚,陈广霞,张倩倩,等.葡萄灰葡萄孢生长及产孢条件研究[J].中外葡萄与葡萄酒,2021(2):6-11.
[ 2 ] 祝婉莹,孙影.浅析葡萄灰霉病的发病规律及绿色防治措施[J].南方農机,2020,51(9):83.
[ 3 ] 张大琪,颜冬冬,方文生,等.生物熏蒸——环境友好型土壤熏蒸技术[J].农药学学报,2020,22(1):11-18.
[ 4 ] 宋曙辉,薛颖.几种十字花科蔬菜抑菌作用的初步研究[J].蔬菜,1997(4):24-25.
[ 5 ] 李玉群,范成明.生物熏蒸法控制芸苔属植物土传病害[J].农业与技术,2006(2):57-60.
[ 6 ] Yedidia I,Benhamou N,Chet I. Induction of defense responses in cucumber plants(Cucumis sativus L.)by the biocontrol agent Trichoderma harzianum[J].Applied and Environmental Microbiology,1999,65(3):1061-1070.
[ 7 ] 张迪,王晓东.葡萄灰霉病生物防治研究进展[J].中国植保导刊,2017,37(7):24-28.
[ 8 ] 曲田丽,罗小勇,金玉兰,等.大花金鸡菊花提取物对几种植物病原真菌的抑制活性[J].中国植保导刊,2013,33(5):57-58.
[ 9 ] Sudhakar, M., Rao, C. V., Rao, P. M., et al, D. B.Evaluation of antimicrobial activity of Cleome viscosa and Gmelina asiatica[J].Fitoterap,2006(7):47-49. doi: 10.1016/j.fitote.2005.8.003.
[ 10 ] 张中义.中国真菌志 (第二十六卷)[M].北京:科学出版社,2006:57-73.
[ 11 ] 黄灵旺,徐丹丹,习平根,等.黄腐酸在防治葡萄果实采后灰霉病中的应用[J].腐植酸,2020(6):70-72.
[ 12 ] 郭书普.新版果树病虫害防治彩色图鉴[M].北京:中国农业大学出版社,2010:95-96.
[ 13 ] 方献平,查倩,奚晓军,等.葡萄灰霉病抗性快速鉴定技术与应用[J].中外葡萄与葡萄酒,2019(2):42-45.
[ 14 ] 王红丽,善文辉,胡海瑶,等.生防菌混合接种对葡萄灰霉病菌的防治效果[J].中国生物防治学报,2020,36(2):265-271.
[ 15 ] 魏新燕,黄媛媛,黄亚丽,等.甲基营养型芽孢杆菌BH21对葡萄灰霉病菌的拮抗作用[J].中国农业科学,2018,51(5):883-892.
