2个葡萄品种越冬抗寒性比较及其生理响应分析*
2021-09-12杨义明张宝香李昌禹王衍莉路文鹏
赵 滢,杨义明,张宝香,李昌禹,王衍莉,路文鹏
(中国农业科学院特产研究所,吉林长春 130112)
低温在很大程度上决定了不同葡萄种类和品种的分布范围与生产性能[1-2]。山葡萄作为东北地区的酿酒葡萄,能够在-30 ℃的严寒条件下露地安全越冬,而葡萄砧木品种‘贝达’枝条则需埋土防寒越冬[3-4],可见不同葡萄品种越冬抗寒能力存在差异。
有研究表明,木本植物抗寒性可通过连续的低温锻炼过程形成,是一个动态、复杂的生理响应过程[5-6]。在低温锻炼过程中植物会诱导一系列信号传导反应,并通过内源激素、渗透调节物质、次生代谢物质等生理生化变化来适应低温环境[7-10]。多数葡萄品种在气温低于-15~-10 ℃时枝条即需埋土防寒,导致葡萄植株自然越冬过程中相关抗寒机制研究进展缓慢,所以山葡萄也就成为低温锻炼过程中研究越冬抗寒力形成的有力材料。而目前有关研究多集中于对葡萄属某些种质或品种开展的实验室抗寒性鉴定与比较[11-12],或者仅测定某一时期低温处理下的抗寒指标[13],不能够完全真实地反映其在田间的实际抗寒能力,相关抗寒机制仍不明晰。
本研究以山葡萄品种‘左山一’和葡萄砧木品种‘贝达’叶片和当年生枝条为试材,比较其露地自然越冬后枝条萌芽率来反映其越冬实际抗寒能力,同时测定在田间自然低温条件下叶片和枝条中内源激素含量、渗透调节物质含量、总酚含量及多酚氧化酶活性,在叶片与枝条之间信号及物质转化基础上,深入比较分析两者抗寒性差异的生理基础,对抗寒葡萄品种选育及区域性栽培具有重要的指导意义。
1 材料与方法
1.1 试验材料与抗寒性鉴定
试验于2018年8月至2019 年1月在中国农业科学院特产研究所国家果树种质山葡萄圃(左家)中进行。该圃位于北纬44°04′,东经126°05′,海拔190 m,年平均气温3.6 ℃,绝对低温-39.8℃。圃内设有HOBO小型气象监测系统,可监测并自动记录资源圃内的气象数据。
本试验材料为山葡萄品种‘左山一’(Vitis amurensis‘Zuoshanyi’)和葡萄砧木品种‘贝达’(V.riparia×V.labrusca‘Beta’)叶片及当年生枝条。叶片在休眠落叶前进行3 次取样,分别为2018年8月23日、9 月26日和10 月8日;枝条进行6次取样,分别为2018年8月23日、9 月26日、10月8日、11月9日、12 月20日和2019年1月11日,其中‘贝达’的枝条均为冬季存活枝条。每次取样后立即放入液氮壶中速冻,然后带回实验室-80℃超低温冰箱中保存,以用于生理指标的测定。
抗寒性鉴定采用田间鉴定法,通过调查自然越冬后2 个葡萄品种枝条的萌芽率来进行鉴定。田间萌芽率调查参照刘崇怀等[14]的方法,2019年5月初调查2 个品种枝条在资源圃中经自然越冬后的萌芽情况,统计萌芽率。

1.2 测定项目与方法
脱落酸(ABA)提取参照Dobrev和Kamínek[15]的方法。称取0.5 g 样品,加入5 mL 内含1 mmol/L二叔丁基对甲苯酚(BHT)和1%PVPP预冷的80%甲醇溶液,弱光下冰浴研磨匀浆,4℃下过夜提取,然后4℃下12 000×g转速离心15 min获取上清液,并记录体积。上清液经氮气吹干,加入50%甲醇洗涤后过C18胶柱,再用氮气吹干残余甲醇,得到纯化的ABA;再加入0.5 mL 内含0.1%吐温-20和0.1%白明胶的0.01 mmol/L 磷酸缓冲液(pH值7.5)定容。ABA含量测定采用中国农业大学研发的酶联免疫试剂盒。
叶片和枝条中可溶性糖含量测定采用蒽酮比色法[16];淀粉含量采用爱尔兰Megazyme 公司生产的K-TSTA试剂盒进行测定;脯氨酸含量测定采用酸性茚三酮法[17];总酚含量测定采用福林酚比色法[18];多酚氧化酶(PPO)活性测定采用紫外分光光度法,测定波长420 nm 下吸光值的变化[19]。
1.3 数据统计分析
采用SAS 9.0软件对数据进行单因素方差分析和差异显著性检验(LSD法,P<0.05)。作图采用SigmaPlot 10.0 软件,每个样品3次生物学重复。
2 结果与分析
2.1 自然越冬后2个葡萄品种抗寒性鉴定
2018年8月至2019年1月整个取样期间的气温逐渐降低,2018年8月上旬的最低气温在14~21℃范围内,9月中旬时最低气温已降至10℃,9月25日第1次早霜过后最低气温降至0℃,10月上中旬的最低气温已降至0℃以下,到2019年1月中旬的最低气温为-20 ℃左右,1月25日的最低气温达到-32℃(图1-A)。
而2 个葡萄品种经自然越冬后,‘左山一’枝条的田间萌芽率为80.81%,显著高于‘贝达’的30.12%(图1-B)。说明‘左山一’的抗寒性明显强于‘贝达’。同时,低温驯化初期,‘左山一’叶片变红时,‘贝达’叶片仍为绿色;前者叶片脱落时间也早于后者。

图1 2018年8月至2019年1月资源圃气温变化及2个葡萄品种抗寒性田间鉴定
2.2 自然低温下2个葡萄品种ABA 含量的变化
从8月23日的第1次取样到早霜过后9月26日的第2 次取样,‘左山一’叶片中的ABA含量大幅度升高,到10 月8日的第3次取样,‘左山一’叶片中的ABA含量已迅速下降。但整个取样期间,‘贝达’叶片中的ABA含量始终呈上升趋势,到10月上旬‘贝达’叶片中的ABA含量已显著高于‘左山一’(图2-A)。
2 个品种枝条中的ABA 含量变化基本表现出相反的趋势,且二者之间的差异始终达显著水平,10月后‘贝达’枝条中的ABA 含量一直显著高于‘左山一’(图2-B)。
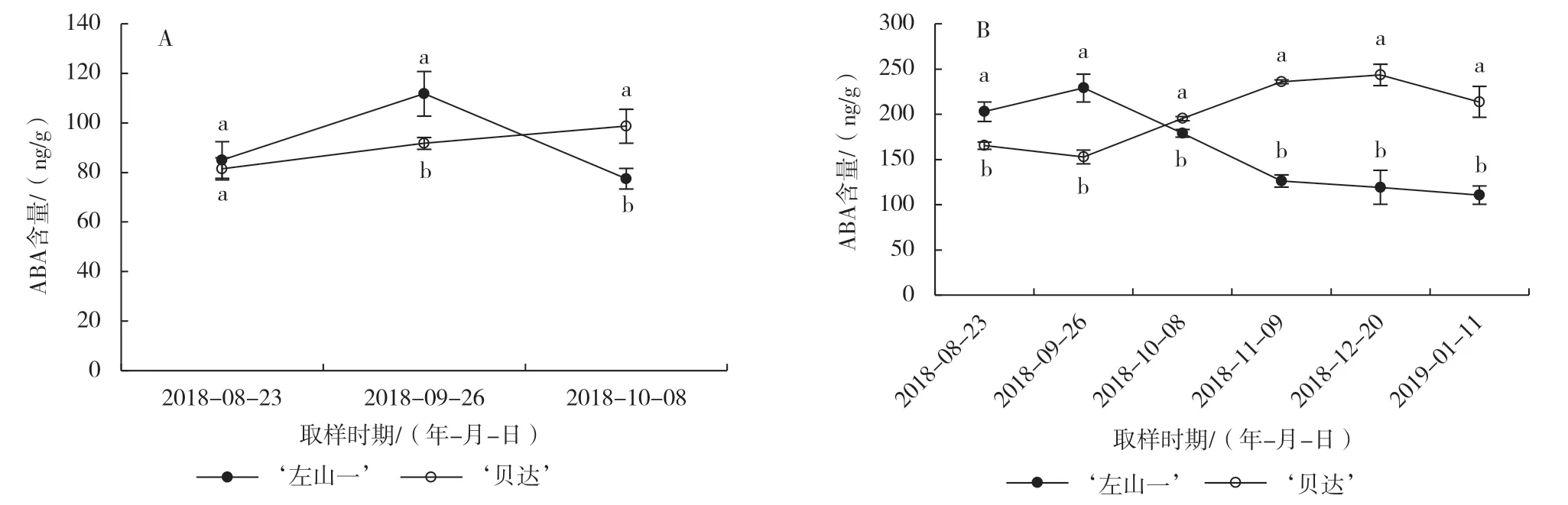
图2 自然低温下2个葡萄品种叶片(A)和枝条(B)中ABA 含量的变化
2.3 自然低温下2个葡萄品种渗透调节物质含量的变化
8月下旬‘左山一’和‘贝达’叶片中可溶性糖含量接近;9月底时随着气温的下降,‘左山一’叶片中可溶性糖含量迅速上升,且显著高于‘贝达’;10月上旬叶片脱落前,‘左山一’可溶性糖含量大幅度下降,但仍显著高于‘贝达’(图3-A)。2个品种枝条中的可溶性糖含量则随气温降低基本呈上升趋势,并且从10 月开始‘左山一’枝条中的可溶性糖含量始终显著高于‘贝达’(图3-B)。
整个取样期间,2个葡萄品种叶片和枝条中的淀粉含量均呈下降趋势。除10月‘贝达’叶片中的淀粉含量略高于‘左山一’外,其余2 次取样均是‘左山一’高于‘贝达’,且在9月底时二者差异达显著水平(图3-C)。而‘左山一’枝条中的淀粉含量仅在8—10月显著高于‘贝达’,其含量下降幅度也明显大于‘贝达’(图3-D)。
2 个葡萄品种叶片和枝条中的脯氨酸含量随气温降低基本呈上升趋势。从9月底低温驯化开始,‘贝达’叶片中的脯氨酸含量高于‘左山一’,10月上旬含量差异达显著水平(图3-E)。低温驯化前期,2 个品种枝条中的脯氨酸含量差异不明显,从11月开始‘贝达’枝条中的脯氨酸含量显著高于‘左山一’(图3-F)。
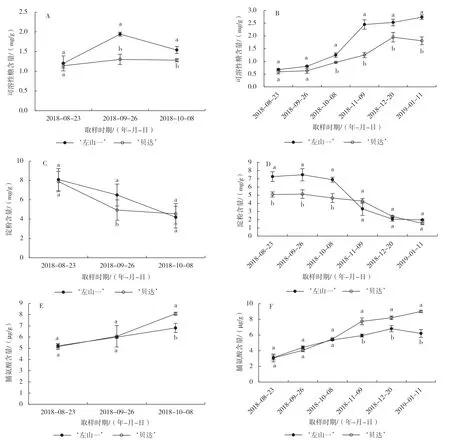
图3 自然低温下2个葡萄品种叶片(A、C、E)和枝条(B、D、F)中可溶性糖、淀粉和脯氨酸含量的变化
2.4 自然低温下2 个葡萄品种总酚含量和PPO 活性的变化
在整个取样期间,‘左山一’叶片中的总酚含量先迅速上升而后略有下降,‘贝达’则基本呈平稳上升趋势,且‘左山一’的总酚含量始终显著高于‘贝达’(图4-A)。而‘左山一’枝条中的总酚含量除8月显著低于‘贝达’外,其余取样时间基本显著高于‘贝达’(图4-B)。
在整个取样期间,‘贝达’叶片和枝条中的PPO活性始终显著高于‘左山一’。‘贝达’叶片中的PPO活性呈先上升后下降的趋势,‘左山一’表现为逐渐上升的趋势(图4-C)。‘贝达’枝条中的PPO活性也是先升高后大幅下降,‘左山一’枝条中的PPO 活性从10月开始逐渐下降(图4-D)。

图4 自然低温下2个葡萄品种叶片(A、C)和枝条(B、D)中总酚含量和PPO活性的变化
3 讨论与结论
本研究对露地自然越冬、未埋土防寒的2个葡萄品种枝条萌芽率调查结果表明,‘左山一’枝条田间萌芽率为80.81%,显著高于‘贝达’的30.12%,说明2 个葡萄品种抗寒性差异明显。这与我们前期采用TTC染色图像可视化评估法鉴定了葡萄种质抗寒性的研究结果相一致,‘左山一’枝条低温半致死温度(LT50)为-38.53℃,‘贝达’LT50为-28.53℃[20]。
有研究表明,ABA作为逆境响应的信号分子,在低温下促进叶片脱落的同时也启动了促休眠调控机制以适应自然低温[21-23]。本研究2个品种间比较发现,抗寒性强的品种‘左山一’叶片ABA含量在9月26日早霜过后大幅升高,10 月上旬其叶片变红脱落前急剧下降,而此时‘贝达’叶片仍为绿色;并且‘左山一’叶片和枝条中的ABA含量达到峰值时间均明显早于抗寒性弱的品种‘贝达’。而ABA含量的升高能够促进和调节蔗糖在植物体内的运输[24-25]。由此推测,‘左山一’叶片在脱落前可溶性糖大幅积累和外运可能与ABA含量升高有关,随之其枝条中可溶性糖含量升高明显。可溶性糖作为渗透调节物质可增强植物抗寒性[26-27],本研究中抗寒性强的山葡萄品种‘左山一’叶片和枝条中的可溶性糖含量始终高于抗寒性弱的葡萄砧木品种‘贝达’。
除可溶性糖外,木本植物抗寒性提高也与淀粉水解含量下降密切相关[28],本研究结果也支持了这一结论。2个葡萄品种叶片和枝条中淀粉含量随气温降低下降明显,特别是越冬期间‘左山一’枝条淀粉含量急速下降。贮藏淀粉水解其含量下降后可转化为可溶性糖,以帮助植物抵御冬季严寒[27-28]。但对于抗寒性弱的‘贝达’而言,其叶片在脱落前脯氨酸含量大幅上升,同时其枝条中脯氨酸含量在越冬过程中显著高于抗寒性强的‘左山一’,推测‘贝达’可能更多地利用脯氨酸作为渗透调节物质来抵御自然低温,这在火龙果[29]、落叶松[9]、蔷薇[30]等研究中得到证实。可见,2 个葡萄品种在越冬过程中抵御冷冻低温的渗透调节机制上存在明显的种间差异。
另外,低温胁迫会诱导植物体内酚类物质的产生[31-32]。相比于‘贝达’,抗寒性强的品种‘左山一’叶片和枝条中的总酚含量在低温驯化初期大幅升高,此时较高的总酚含量有利于有机物质积累[33]。随着冬季严寒的到来,11 月时‘左山一’枝条中的总酚含量又一次明显升高,而此时较高的总酚含量有利于清除低温诱导产生的活性氧,从而减轻活性氧造成的低温伤害,保护其枝条在露地条件下安全越冬[34]。此外,2 个品种多酚氧化酶(PPO)活性也存在明显的种间差异。与总酚含量不同,‘左山一’叶片和枝条中的PPO 活性始终低于‘贝达’。正常细胞中PPO与膜结合呈潜伏状态,当受到逆境胁迫后,膜结构瓦解,PPO被激活,与酚类物质接触,催化醌类物质形成[35]。所以抗寒性弱的品种‘贝达’较高的PPO活性可能与其受到的低温伤害活性被激活有关。除氧化作用外,有学者认为PPO还具有抗氧化保护作用,这在橄榄树低温胁迫响应机制研究中得到证明[36]。所以一方面由于‘贝达’受到的低温伤害使其PPO 活性显著高于‘左山一’,另一方面‘贝达’也可能利用PPO作为保护酶来抵御自然低温。
综上所述,ABA作为逆境响应信号分子,调控了抗寒性强的山葡萄品种‘左山一’叶片和枝条中可溶性糖的积累与运输,并以淀粉形式贮藏;随着冬季严寒的到来,淀粉发生水解转化为可溶性糖,提高了‘左山一’应对低温的渗透调节能力;而枝条中总酚含量的升高有利于有机物积累的同时又可清除低温诱发产生的活性氧,进一步增强了抗寒性强的山葡萄品种‘左山一’植株在露地条件下抵御冬季严寒的能力。而葡萄砧木品种‘贝达’虽然在低温驯化后其叶片和枝条中的脯氨酸含量开始显著高于‘左山一’,同时PPO活性也始终处于较高水平,但仍不足以支撑其枝条的露地安全越冬,所以‘贝达’露地自然越冬后其枝条发生大量死亡。
